このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
植物プロトプラストの蛍光活性化細胞選別
要約
植物材料から、特定の種類の細胞を単離する方法が示されている。この手法は、特定の細胞型、細胞の解離と蛍光活性化細胞選別に蛍光タンパク質を発現するトランスジェニックマーカーラインを採用しています。さらに、成長のセットアップがの治療を容易にするここで確立されているシロイヌナズナ苗。
要約
遺伝子発現の高解像度、細胞型特異的な分析は非常に発達規制とあらゆる多細胞生物の環境刺激に対する反応の理解を深める。situハイブリダイゼーションおよびレポーター遺伝子の可視化でできる限られた範囲で、この目的のために使用されるが、高分解能の定量のためにすることにRT - PCRまたはハイスループットトランスクリプトーム全体の分析、特定の細胞型からのRNAの分離は必須です。特定の細胞型とそれに続く蛍光活性化細胞選別(FACS)で蛍光タンパク質マーカーを発現する組織の細胞の解離により、RNA抽出、cDNA合成/増幅とマイクロアレイ解析のために材料の十分な量を収集することができます。
細胞タイプ特異的蛍光レポーターラインの拡張セットは、植物の研究コミュニティに利用可能です。このケースでは、 シロイヌナズナの根の2つのマーカ線が使用されています:P SCR::GFP(内皮および静止センター)とP WOX5::GFP(静止センター)。苗の大量(数千)は水耕や寒天プレート上で成長し、さらなる分析のために十分なルートの材料を得るために収穫されます。植物素材の細胞の解離は、細胞壁の酵素消化によって実現されます。この手順では、高浸透圧誘導性の原形質分離と溶液中にプロトプラストを解放するために市販のセルラーゼ、ペクチナーゼ及びヘミセルラーゼを使用しています。
GFP陽性細胞のFACSは、488 nmレーザーで励起されたプロトプラストの赤色発光スペクトル対緑の可視化を利用しています。 GFP陽性のプロトプラストは、赤色発光の緑色のそれらの比の上昇によって区別することができます。プロトプラストは、通常のRNA抽出緩衝液に直接ソートされ、後での処理のために保存されています。
この手法は単純で実用的であることが明らかになりました。さらに、それはそれであっても非常に希少な種類の細胞( 例えば、静止中心の細胞)のために、トランスクリプトーム解析のために細胞の十分な数字を分離するために困難なく使用できることが示されている。最後に、シロイヌナズナ実生の成長のセットアップは、セルソーティング(細胞の種類に固有の生物的または非生物的ストレス応答の解析のためなど )する前に、植物の合併症の治療を可能にすることが示されている。植物プロトプラストのFACSのための潜在的な補足の使い方が説明されています。
プロトコル
1)植物材料の調製
- プロトプラストを酵素消化、細胞壁の適切な組み合わせが1を使用していることを提供する多くの異なった植物種や組織から得ることができます。本格的な実験が行われる前に、材料の小規模な消化は、組織のprotoplasting効率、酵素、などを評価し、細胞選別のためにパーセント陽性細胞を推定するためにお勧めです。ここでは、細胞のタイプは、特に緑色蛍光タンパク質(GFP)を発現していることをシロイヌナズナ実生の根から得られたプロトプラストを用いています。内皮と静止中心がP SCRでマークされています::GFPとP WOX5で静止センター::GFP 2,3(図1)。
- 根が(0.22%w / vのムラシゲ及びスクーグ基礎培地[シグマ]、1%成長培地中にを通じて成長できるよう、ナイロンフィルター(NITEX250μmのメッシュ)で、苗が(図2aシグマ)phytatraysで水耕栽培されていますw / vのスクロース、0.05%(w / v)のMES [2 - (N -モルホリノ)エタンスルホン酸]、KOHでpH 5.7)。また、植物が垂直に配置さ1%寒天プレート(図2b)のナイロンフィルター(100μmのメッシュ)の上に成長させることができる。
- 必要に応じて根の収穫のない唯一のエイズ上記フィルターの使用は、それはまた、苗木の容易な追加治療を容易にします。フィルタは、苗が関心の触媒を添加した新しいphytatraysまたは寒天プレートに一括して転送することができます。例えば、設定phytatrayは、細胞型特異的シロイヌナズナ実生4の窒素の治療への転写反応の解析に使用されています。
- あなたの蛍光マーカーが正しく(自分自身が治療によって影響される可能性が細胞型特異的マーカーとして、治療のオプションを使用する場合は特に)発現していることを顕微鏡で確認してください。このケースでは、苗は蛍光顕微鏡(;図1ニコン)の下に検査されます。細胞タイプ特異的蛍光マーカーのラインが正確にどの種類の細胞がマークされているかを判断し、発現の変動を決定するために共焦点顕微鏡下で最初に特徴付けされるべきであることに注意してください。
protoplasting溶液2)の調製
- 1.25パーセントw / vのセルラーゼ(ヤクルト)、0.3%w / vのMacerozyme(ヤクルト)、0.4 M、D -マンニトール、20mMのMESと脱イオン水に20mMのKClを(1Mストックから)に溶かし、5.7にpHを調整する1 Mトリス/ HCl pH7.5で。このソリューションは、僅かに濁ったようになります。
- 55に解決策を加熱℃で10分間(溶液は透明になります)と0.1%を追加する前に、それが室温に冷却させますw / vのBSA(ウシ血清アルブミン)、10mMのCaCl 2を 、および5mMβ-メルカプトエタノール。
3)植物材料の収穫とprotoplasting
- ルーツは、メスとナイロンメッシュを離れてそれらをこすることによって収穫し、protoplasting溶液を含むフラスコに堆積される。一般的に、protoplasting溶液10mlを1500苗の根ごとに使用されます。
- 1時間室温で静かにフラスコ(75 rpm)を振る。より長いインキュベーション時間は、プロトプラストの収量を増加させることができるだけでなく、遺伝子発現に自分自身をprotoplastingの効果に追加されます。
- 40μmのセルストレーナー(BDファルコン)とのプロトプラスト溶液を濾過し、円錐形の15 mlチューブ(BDファルコン)を介してソリューションを分割する。
- この遠心分離の速度が使用されてプロトプラストの種類、それらの脆弱性および酵素処理中に生成細胞残渣の量に依存すること500 G.の注で10分間、スイングバケット遠心機でチューブをスピン。
- 上清のほとんどを除去、残りの溶液中でプロトプラストを懸濁しますと(図3)顕微鏡でそれらを検査。
- プロトプラストの数と密度を推定するために血球計を利用してください。細胞密度は、試料注入速度、FACSで細胞を選別するために必要な秒あたりのイベント、したがって、合計時間を(また、4.3節を参照)が決定されます。
- 3.7)FACSに直接進むか、なしなどW5などのインキュベーション溶液、(154 mMのNaCl、125 mMの塩化カルシウム、5mMのKClを、5mMのMES、KOHで5.7にpHを調整)のプロトプラストまたはprotoplastingソリューションを洗浄し、再懸濁のどちらか酵素を追加しました。転写の変化を見ていたとき、それはそのようなバッファを変更するなど、遺伝子発現に影響を与える可能性の条件へのサンプルの曝露を最小限にするために重要であるプロトプラストは、それがゆえprotoplasting溶液中でプロトプラストを維持し、続行するために推奨されてインチに保たれているできるだけ早くFACSへ。
プロトプラストの4)蛍光活性化細胞選別
- 電源をオンにして、セルソーターを準備する。ここで、FACSAria(BD)が使用されます。
- 100&mでの流れのストリームを設定するU、m個のノズルと20 psiのシース圧。
- 細胞密度および試料注入速度は、最高の歩留まりや、もっとも早く達成可能な速度が必要かどうかに基づいて、特定の実験に調整することができます。我々は、10,000,000個/ mlまでの濃度で正常にソートされている。
- プロトプラストの沈降を防ぐために、FACSのサンプル攪拌オプションを使用します。 1:FACSの目詰まりが問題になる場合は、3つの可能なトラブルシューティング手順があります。サンプルラインのフラッシュを実行します。 2。密度を減らすために、プロトプラスト懸濁液を希釈する。 3。遠心分離と再懸濁後ろ過工程(3.3)を繰り返すことにより、プロトプラスト溶液をクリーンアップします。
- 488 nmのレーザーで励起後の赤いスペクトル自己蛍光(RSA)のためのGFPと20分の610 nmの30分の530 nmでの前方散乱光(FSC)、側方散乱(SSC)とエミッションを測定する装置を準備します。これらは本質的にGFP陽性プロトプラストを単離するために使用される唯一のパラメータです。ここで、電圧の設定は以下の通りであった:FSC - 60V、SSC 250V、GFP 350VとRSA 335V。最適な電圧設定がすべてのFACSに異なるとなるとさらにセルソーターの存続期間全体を通じて調整が必要になることに注意してください。
- 前方散乱対側方散乱のためのドットプロットを設定することで起動します。測定イベントはプロットの中心にされるように電圧設定を適用します。
- 次に、緑と赤の蛍光シグナルのドットプロットを作成します。野生型(非GFP)をプロトプラスト懸濁液を見たときに測定されたイベントがプロットの中心角の人口が得られるように電圧設定を適用します。 GFPマーカーのラインから派生したプロトプラスト懸濁液は、野生型のサンプルでは見たことのない緑色蛍光イベントの明確な母集団を生成します。
- GFPとRSAとの間のスペクトルの重なりを調整するために補償の制約を設定します。適切な補償の制約の設定は、非GFPのプロトプラストと破片からGFP陽性プロトプラストの分離も可能になります。 RSA、マイナス17.91パーセントのGFP:ここで使用される制約は次のとおりです。
- GFP陽性のイベントを識別するためにゲートを設定し、非GFPのプロトプラストの負の制御は、ゲートの境界(図4)の定義を支援するために使用する必要があります。
- 分析のうち、小さな破片を残すために前方散乱の遮断を実装します。 GFP陽性のカットの配置を決定するためのFSC対SSCプロット内のイベントを可視化する。ここでは、カットオフは5,000に設定した。 FACSは、残骸の高レベルのソートイベントとサンプルとして残骸をカウントすることに注意しては予想と異なるパーセントのGFPポジティブイベントがあるかもしれません。これは問題であるとは限りません。しかし、サンプルのより多くの破片は、長いソートがかかります。
- 実験と分析される細胞の種類の豊富さに応じて、ソートされた細胞の最適な歩留まりや最適な純度のためにどちらかのFACSの精度モードを設定します。
- RNAの抽出には、RNAの抽出緩衝液の適切な量のコレクションチューブ(1.5ミリリットルマイクロチューブ)を用意。このセットアップでは、20,000ソートイベントは、抽出緩衝液350μlの(したRNeasyマイクロキット、QIAGEN)にソートされた約100μlの総容量が得られます。ソートの完了後に細胞懸濁液は、上部にプールできるようにサンプルを混ぜる。
- サンプルを保管または抽出をRNAに直接進みます。成功したマイクロアレイ解析は、わずか500ソートのイベントから抽出したRNAを用いて予備成形されています。ここで、我々はしたRNeasyマイクロ抽出キット(QIAGEN)、WT - OvationエキスパートのピコRNA増幅システムとFL -オベーションcDNAのビオチンモジュールV2(NuGEN)を使用。
代表的な結果
:約1,500一週齢のP SCRの一つphytatray:GFPの苗木は60,000プロトプラスト(のような血球計で測定される)について得られた。 65000 FACS -処理されたイベントの2.6%がGFP陽性であると定義され、(図4b)ソートされた。
約1,500四日齢P WOX5の八プレート::GFPの苗は、それぞれ(12,000合計)は3000万プロトプラスト(のような血球計で測定される)について得られた。 1600万FACS -処理されたイベントの0.063パーセントは、GFP陽性であると定義され、(図4c)ソートされた。
万ソートのイベントは通常、RNA抽出に使用され、20〜140 ngのトータルRNA(図5)にもたらすことができる。
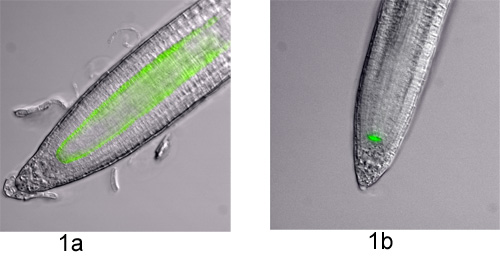
図1。 シロイヌナズナの根における細胞型特異的GFPマーカーライン。蛍光顕微鏡画像は、微分干渉コントラスト(DIC)とMetamorphソフトウェア(Molecular Devices社)上で実行しているEclipse 90i顕微鏡(ニコン)でGFPフィルターで撮影された。 DICとGFPの画像は、可視化の目的のために重ねていた。この視覚的な実験で使用される2つのマーカーの行が表示されます。A)P SCR::GFPとb)P WOX5::GFP。

図2。植物の成長条件。苗木を水耕phytatrays()または垂直に配置寒天プレート(B)上の環境のコントローラで増殖させた。
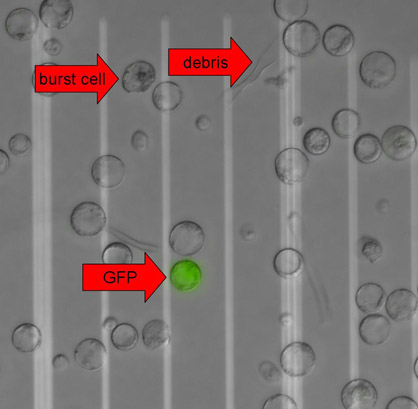
図3。 GFPの蛍光顕微鏡画像を発現する植物のプロトプラストは、微分干渉コントラスト(DIC)とMetamorphソフトウェア(Molecular Devices社)上で実行しているEclipse 90i顕微鏡(ニコン)でGFPのフィルターで撮影された。 DICとGFPの画像は、可視化の目的のために重ねていた。矢印は、バーストセル、細胞残渣およびGFP陽性プロトプラストを示している。つの白い線の間の距離は50μmである。
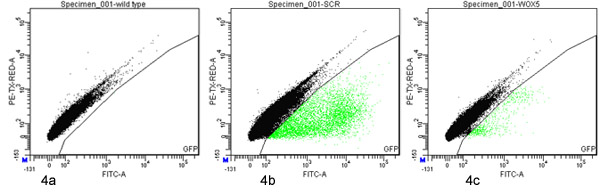
図4。 GFP陽性のプロトプラストの蛍光活性化細胞選別野生型()P SCRから派生したプロトプラストは:。:GFP(B)またはP WOX5::GFP(C)マーカーの線がFACSAria(BD)で分析し、ソートされた定義されたゲートを使用して対赤(20分の610 nmの、y軸)蛍光、緑(x軸30分の530 nm)のドットプロット上に。 100,000イベントは、各プロットに示されている。 GFPのソーティングゲート内のイベントは緑色で強調表示されています。
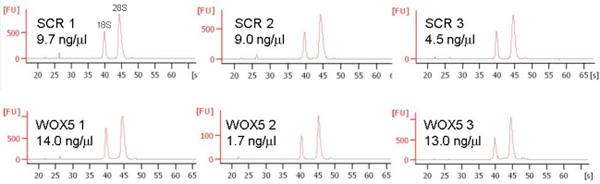
図5。 10.000ソートされた細胞からの代表的なRNA抽出。細胞がRNA抽出バッファー(QIAGEN)に直接ソートされたが、RNAを精製し、2100バイオアナライザ(アジレント)の濃度、純度および整合性がチェックされました。三つは、両方のマーカーの線が表示されているために複製します。
ディスカッション
プロトプラストは、原則として、植物組織の様々な由来することが、有利な条件の最適化は大幅にRNAの質と量を強化することができます。 protoplastingソリューションと使用される選択科目インキュベーションバッファーの両方が、この側面に影響を与えます。
多くの異なる蛍光タンパク質は、YFP、CFPまたはそれらの多くの変種および誘導体、 例えば、GFP、RFP、使?...
謝辞
この作品は、国立科学財団(助成金なし。DBI 0519984)と国立衛生研究所(助成金なし。5R01GM078279)によってサポートされていました..
資料
| Name | Company | Catalog Number | Comments |
| 250 μm nylon mesh | Sefar Filtration | NITEX 03-250/50 | |
| 100 μm nylon mesh | Sefar Filtration | NITEX 03-100/47 | |
| Square petri dishes | Fisher Scientific | 08-757-10k | |
| Phytatrays | Sigma-Aldrich | P1552 | |
| Murashige and Skoog Basal Medium (MS) | Sigma-Aldrich | M5519 | |
| sucrose | Fisher Scientific | S5-3 | |
| MES | Sigma-Aldrich | M2933 | |
| KOH | Sigma-Aldrich | P1767 | 10 M stock |
| Eclipse 90i microscope | Nikon Instruments | ||
| Cellulase R-10 | Yakult Pharmaceutical | ||
| Macerozyme R-10 | Yakult Pharmaceutical | ||
| D-mannitol | Sigma-Aldrich | M9546 | |
| KCl | Sigma-Aldrich | P8041 | 1 M stock |
| BSA | Sigma-Aldrich | A3912 | |
| β-mercapt–thanol | Calbiochem | 444203 | |
| CaCl2 | Sigma-Aldrich | C2536 | 1 M stock |
| orbital shaker | Labline Instruments | ||
| 40 μm cell strainer | BD Biosciences | 352340 | |
| conical 15 ml tubes | BD Biosciences | 352196 | |
| table centrifuge | Sorvall, Thermo Scientific | Legend RT | |
| NaCl | Sigma-Aldrich | S3014 | |
| FACSAria | BD Biosciences | ||
| 1.5 ml microfuge tubes | VWR international | 20170-38 | |
| RNeasy micro kit | Qiagen | 74004 | |
| WT-Ovation Pico RNA Amplification System | NuGEN | 3300_12 | |
| FL-Ovation cDNA Biotin Module V2 | NuGEN | 4200_12 |
参考文献
- Sheen, J. Signal transduction in maize and Arabidopsis mesophyll protoplasts. Plant Physiol. 127, 1466-1475 (2001).
- Wysocka-Diller, J. W., Helariutta, Y., Fukaki, H., Malamy, J. E., Benfey, P. N. Molecular analysis of SCARECROW function reveals a radial patterning mechanism common to root and shoot. Development. 127, 595-603 (2000).
- Blilou, I., Xu, J., Wildwater, M., Willemsen, V., Paponov, I., Friml, J., Heidstra, R., Aida, M., Palme, K., Scheres, B. The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots. Nature. 433, 39-44 (2005).
- Gifford, M. L., Dean, A., Gutierrez, R. A., Coruzzi, G. M., Birnbaum, K. D. Cell-specific nitrogen responses mediate developmental plasticity. Proc Natl Acad Sci U S A. 105, 803-808 (2008).
- Bargmann, B. O. R., Birnbaum, K. D. Positive fluorescent selection permits precise, rapid, and in-depth overexpression analysis in plant protoplasts. Plant Physiol. 149, 1231-1239 (2009).
- Petersson, S. V., Johansson, A. I., Kowalczyk, M., Makoveychuk, A., Wang, J. Y., Moritz, T., Grebe, M., Benfey, P. N., Sandberg, G., Ljung, K. An Auxin Gradient and Maximum in the Arabidopsis Root Apex Shown by High-Resolution Cell-Specific Analysis of IAA Distribution and Synthesis. Plant Cell. 21, 1659-1668 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved