このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
気道抵抗測定とマウスにおける気管支肺胞洗浄液のサンプリングのためのリバーシブル、非侵襲的方法
要約
げっ歯類の呼吸の生理学と気道炎症細胞のサンプリングの繰り返し測定が望ましいですが、一般的には不可能。ここでは、気道過敏性と気道炎症細胞のサンプリングの繰り返し測定を可能に経口挿管マウスの反復可能な方法を説明します。
要約
気道過敏性(AHR)の測定と気管支肺胞洗浄(BAL)液のサンプリングは、実験的喘息モデルには不可欠ですが、同じ動物でそのような測定値を得るための手順を繰り返して、一般的には不可能です。ここで、我々は、マウスからAHRおよび気管支肺胞洗浄液のサンプルの繰り返し測定を得るためのプロトコルを示す。マウスは、治療を受けた強力なアレルゲンまたは偽で14日間鼻腔内に七回チャレンジした。最初の挑戦に先立ち、および各鼻腔内チャレンジ後24時間以内に、同じ動物では経口挿管と人工呼吸器、麻酔をかけた。偽とアレルゲン不自由な動物の間にアセチルコリン(ACH)塩化物の静脈内投与量を増やすことによって誘発される呼吸器系の抵抗(RR)の用量反応曲線を比較することによって評価AHRは、決定した。気道細胞の差列挙を行うことができるように、その後、同じ挿管を経由して、左肺はlavagedした。これらの研究は、AHRとBAL液中のコレクションの繰り返し測定は、同じ動物から可能であることを明らかにし、その最大の気道過敏性と気道好酸球増加は、アレルゲンのチャレンジを開始の7〜10日以内に達成されています。この小説の技法が大幅に長手方向の実験に必要なマウスの数を削減し、多様なげっ歯類、疾患モデルと気道生理学機器に適用可能である。
プロトコル
アレルゲンの課題:
- C57BL / 6マウス、生後4-8週間では、深い全身麻酔を達成するために10分間酸素の蒸気混合物の3.2%イソフルランでパージ気密プレキシガラス室で麻酔する。
- 鼻腔内アレルゲンの課題(45μLOVA(22.5μg)を、PBS中7μL麹菌(7μg)を、)7つの連続するアプリケーションの合計のため、木曜日、日曜日、毎週火曜日に、投与されています。
麻酔:
- 前の各アレルゲンのチャレンジに、そして第7の課題を次のように、マウスは前の軽を除くレセプタクルの位置に、48 mg / kgのエトミデート(2 mg / mlの)の腹腔内注射を投与されています。
- 観察可能な神経学的応答の欠如が後肢(5-10分)に圧力を加える際に検出されるまで被験者は、容器内に残ります。
挿管:
- 〜37 ° Cボディのコア温度は、低体温症を防ぐため作業中は被写体に集中するべきであるの維持を確保するための距離に維持放射熱ランプ、。直腸温度計は関係なく使用される熱源のeuthermiaを確認するには、少なくとも最初に使用する必要があります。
重要なステップは、実験動物で受信された全ての液体と楽器は無菌でなければならない。手続きは、厳格な無菌条件下で実行する必要があります。麻酔下でしばらく長引く低体温症は異常なデータおよび/または動物の死につながる。すべての侵襲的手技を持つ能力は、生きた動物での作業を試みる前に、死体、動物を使用して開発されるべきである。眼科用潤滑剤は、全身麻酔下で動物の角膜擦過傷を防止するために使用する必要があります。 - 麻酔したマウスは、レセプタクルから削除し、臥位(上腹側)に配置され、プレチスモグラフのテーブルの上に、45 °の角度に調整。
- テーブルを囲むゴムバンドは、所定の位置に被験者を確保するため、切歯の一番上の行の後ろに挿入されます。右手、グリップのピンセットで、延長、そして左手に圧子金属との場所に固定する前に口から舌を持ち上げ、従って挿管用妨げられることなく気道を可能にします。
- 光源に接続さ0.8mmの直径の光ファイバーのスレッドが、、血管カテーテルを通して挿入し、先端を超え10mmを拡張されています。圧子が左手でsteadiedれているように声帯が可視化されるまで、光ファイバースレッドの照らされた最後は右手で口腔と咽頭を介して導かれる。スレッドは、コードを最大限に開いているときに発生するタイミング、動きの声帯を通して気管への直接可視化の下に渡されます。
- カテーテルの先端が気管の半ば部分内にあるまで、血管カテーテルは、気管内に光ファイバースレッドを介して渡されます。 17〜22グラムのマウスの場合、これは、コネクタと被験者の下顎の頭蓋の極端の間に目に見える、残りの10 mmのカテーテルのセグメントに対応しています。カテーテルが渡される実際の量は、関連の大きさと遺伝的背景の2-3カテーテルを挿入したマウスの気管の直接の検査によって決定されるべきである。
- すぐに親指とコネクタの以下の閉塞を終了する定期的な深い呼吸(胸部と腹部のリズミカルな小旅行)を観察することにより、光ファイバーのスレッドは削除され、成功した挿管が確認された。窒息応答は、関係なく親指閉塞の、不規則な呼吸、または呼吸困難の他の徴候はmalpositioning血管カテーテルを示しており、通常は食道挿管を示している。
すぐに食道挿管を逆にする重要なステップの失敗は致命的になることができます。食道挿管が疑われる場合、動物が正常な呼吸パターンを再開した後に、カテーテルを素早く除去し、再挿入する必要があります。エトミデートが使用可能なすべての齧歯類の麻酔薬の、などの選択の麻酔薬である、このエージェントは、少なくとも心血管毒性(低血圧、不整脈、心停止)を引き起こす。 - 作業台と平行になるまでプレチスモグラフのテーブルより低いと空気の人工呼吸器のポート側を手前にまで対象を180 °回します。人工呼吸器に接続する前に、その側に動物をオンにします。
- 気密接続を確保し、人工呼吸器を(150回/分、9ミリリットル/ gの一回換気量、酸素100%で機能して)アクティブにしたあと、胸エクスカーションが人工呼吸器とのペースに見たときに、成功した挿管がさらに確認されている。
静脈ライン:
- 10ミリメートル、27ga針は無料、それを溶融の方法によって、そのシリンジコネクタから削除し、ベベルは角度に向くように、滅菌ピンセットと止血剤を使用して中間点で針90 °に曲げています。非面取り端は、IV注入ポートにつながるPE10チューブに接続されています。
- 潜在的に防ぐために致命的な空気塞栓、チューブと針を37でパージされています° C、1 mlの注射器を経由して塩化ナトリウム0.9%。注入ポートは、15ミリリットルの遠心チューブのキャップに開けた穴を通してプッシュ27ga針、から構成されています。キャップは、このように空気を針に混入して静脈内に注射される可能性を減らすこと、針の端が常に水没していること生理食塩水などで満たされている。
- 熱ランプの下で、残りのマウスを使って、針が横静脈へと上に尾の並列の尾極端に整列されます。針は、静脈の長さに沿って頭側で指示しながら、皮膚の下にわずかに実行し、曲げに皮下プッシュされます。成功したIVの配置は、シリンジのプランジャーのわずかな引っ張りとIVチューブに血液の逆流を観察することによって確認されている。さらに、尾静脈に50〜100μlの生理食塩水の注入時にIVラインを通して流れをそこに妨げられることがあります。時折尾静脈を安定的にカニューレを挿入することができます。これらのインスタンスでは、マウスは他の側面とIVは通常困難なしにアクセス他のテールに180度回転することができます。
- セットアップからの熱のランプを取り外した後、被験者は、その後4クランプのアプリケーションとの気密として確保、プレチスモグラフで囲まれています。
ヒートランプが点灯したままできるようにする重要なステップは、プレチスモグラフチャンバー内の空気を加熱し、潜在的に維持されなければならない静脈針とソリューションのR RSの無菌性のその後の測定値が変更されます。針の滅菌を浸漬し、洗浄とIVの挿入の前に滅菌生理食塩水で洗浄、続い70%エタノールで洗浄することによって達成される。また、尾は70%エタノールまたはIVの挿入前イソプロピルアルコールで洗浄してください。
気道抵抗の測定:
- ピークの抵抗は等しい肺気量のポイント(70%一回換気量)での商DPT / V(DPTは気管圧の変化であり、Vは空気の流れです)の連続定量により決定されます。 DPTは、気管血管カテーテルに接続されている圧力トランスデューサを使用して決定されます。 Vを決定するために、プレチスモグラフの圧力変動を検討生理的範囲で音量の変化に校正されています。プリアンプモジュールによって計算された時間をかけてプレチスモグラフのボリュームの差は、、V.、安定したベースラインR RS(3分以上<5%の変動)、増加の5つの連続する投与量(体積= 2μL/ g体重)を確立した後です。塩化アセチルコリン(0.058、0.18、0.59、1.58、5.8ミリグラム/体重kg、pH7.4の0.9%食塩水で、氷と前に、各注射に手温めた上に維持)の濃度は、静脈を経由して1秒間に注入され(約12cm H 2 O X ml -1の X秒、すなわち、約4 cmの典型的なベースライン上気道抵抗で200%増加ベースライン抵抗の3倍までは、ベースラインにR RSの復帰時に投与した後続の各用量でH 2 O X ml -1の X秒)が達成されます。ベースライン値からR RSで200%増加を(PC 200と呼ばれる)原因となる体重のmg / gのAchの刺激的な濃度は、、、ACH - R RS用量反応曲線の数学的補間によって計算されます。
- 一度PC 200の値は、リリースのファスナーに達し、プレチスモグラフを解体している。 Achの5増加する用量の最大値が与えられます。上記のAchの濃度範囲は、最も単純なマウス系統のためにPC 200の値を達成するために適しています。
重要なステップは約4 cmの基線H 2 O X ml -1の X秒、30秒間抵抗のモニター上で確立されると、生理食塩水60μLのは、麻酔の適切な面が確立されていることを確認するために静脈注射することができます。完全な麻酔で、抵抗には有意な変化はありません。四肢や尾の抵抗や運動の増加は、物理的な苦痛の兆候を表し、追加の麻酔薬の必要性を示している。 - 尾静脈からIVを削除して代わりに気管カニューレを保つことによって気道を維持し、人工呼吸器から動物を外してください。時々動物はすぐに自発呼吸を再開するが失敗。これらのインスタンスでは、呼吸を静かに胸部をマッサージすることにより奨励することができます。
重要なステップ自発呼吸が回復室に転送する前に確立する必要があり、そうでない場合の死亡が発生します。 - 自発呼吸の再開時には、マウスを、37で100%O 2および維持でパージ室に、代わりに気管カニューレを使用して転送されます° Cの熱ランプを使用。 15〜20分内で、マウスは、強く呼吸とその気管カテーテルを除去することができる、その時点で四肢、そして動物のを移動し始めているafely、通常のケージに転送されます。
重要なステップは、気道が容易にアセチルコリン誘発ハイパー流涎による無意識のマウスで妨げと気道の生理学的測定は、以下の麻酔したマウスで窒息による死亡の主な理由です。このような理由から、気管カニューレは、彼らがarousableであり、ハイパーsalivatonが中止されるまでは除去されるべきではないまでも、気管支肺胞洗浄を受けていないマウスでは、保存しておく必要があります。
気管支肺胞洗浄:
- マウスが十分に彼らのギャグ反射を(回復室での留置後〜20分)を回収するときに気管支肺胞洗浄液のコレクションが安全です。咽頭反射が優しく血管カテーテルを内側と外側にスライドすることによって評価され、明らかな咳や苦労は、咽頭反射が戻ってきたことを示している。
あまりにも延長回復時間を許可する重要なステップは非常に個々のマウスからBALのリターンの効率が低下します。従って、咽頭反射が示唆20分休息期間の後、数分ごとに監視する必要があります。マウスは、部分的な覚醒のために洗浄手順を許容できない場合は、3.2%イソフルラン蒸気の麻酔を使用することができます。 - 肺の左葉に向け〜30℃の連続的な屈曲を持つ金属製の挿管のガイドワイヤー(0.5ミリメートルOD)は、、血管カテーテルに挿入されます。ガイドワイヤーと血管カテーテルは、カテーテルが(ハブを除く)のみ1mmずつ前歯を超えるようなことが、肺の左葉に一緒に進めています。
動物の死亡の可能性を向上させながら、左肺を分離するために重要なステップの失敗は大きく、収量が減少します。ケアは、ガイドワイヤの先端が血管カテーテルの開放端を通過しないように注意する必要があります。突き出した金属製のチップでangiocathetherを進めることは気管破裂による気管裂傷と死の可能性があります。 - 場所で血管カテーテルを維持する、ガイドワイヤーが削除され、PBS(pH7.4の、滅菌)300μLのを1mlの注射器を介して左肺にフラッシュされます。すぐに負圧を作成するには、シリンジのプランジャーを描きながら、後に激しく肺をマッサージしながら、血管カテーテルをゆっくり(3秒)が削除されます。 100〜200μLのBALリターンが期待されている。
- すぐに37にlavagedマウスを返す° C、100%O 2室連続して胸部をマッサージしながら。完全に回復するまで、その左側の上に置いてマウス(〜20分)。動物はその後、自分のケージに戻って配置されます。
タイミング:
マウスごとに、全体の手順は、達成するために1時間以上も時間がかかるはずです:3-4、5〜10分のステップ、ステップ5から21まで、10分、ステップ22、20〜30分、ステップ23から24、。。。 10分。増加能力を持つとプロトコルの驚異的な主題によって、最大3匹/時間処理することができる。
代表的な結果:
としてPC 200の値の措置によって決定されるマウスの気道過敏性は、T細胞とサイトカインのIL - 135 - 7の分泌の肺への活性化と募集の結果です。したがって、気道過敏性は、アレルゲンと気道の挑戦の必然的な帰結ではなく、無傷のT細胞免疫コンパートメントと繰り返しアレルゲン曝露の設定で開発するためにT細胞の応答に要する時間によって異なります。図に示す。 2A、気道過敏性は、第六の挑戦の後にはさらに大幅に増加、5アレルゲンチャレンジ後に開発されたベースライン値に比べてPCのように大幅に下げるとき、200の値を定義する。完全には理解されていない理由から、気道の反応性は、まずアレルゲンチャレンジ(図2a)の後に(PC 200の値が増加)減少した。同じような傾向は、同じマウス(図2b)のためAchの用量応答曲線を比較することによって明らかである。しかし、それは完全な気道過敏性が急激に第五アレルゲンチャレンジ後に開発した、ここで明らかなように、そのようなそのマウスは、30倍以上になって4番目と6番目の課題の間にACHに敏感。一緒に、これらの知見は、AHRの最も信頼性の高い測定が6アレルゲンチャレンジ(12日)後に得られることを示しているが、それ以前の時点においてでの測定は非常に可変データを生成する可能性があります。繰り返し車両鼻腔内(生理食塩水)でチャレンジしたマウスは、気道過敏症を発症しない、と、所定のAchのすべての用量で、R RSの測定が著しく(図3、データは示されていない)のベースライン値から変化しない。
堅牢なAHRの出現に先立って、アレルゲンによって誘発される気道の支配的な細胞のタイプは、好中球(図4)であった。 AHRのための傾向と同様に、しかし、好酸球増加が徐々に繰り返されるアレルゲンの挑戦と好酸球で強化BAL液a〜fの数値主要な細胞型になったneutrophis数の著しい減少(図4)と一致してTER第六課題、。マクロファージは、当初は最初の数アレルゲンの課題に数が増加し、その後豊富で推移。リンパ球豊富が大幅にかかわらず、アレルゲンの課題の数の変更と、逆説的にモデルにそれらの主要な重要性を与えていない、典型的にはBAL液中の少なくとも多数のセルです。
アレルゲンのチャレンジもBALサンプリングのどちらを投与したマウスにおける気道抵抗測定は、実験の17日間にわたって変化しなかった。気道生理学の測定またはアレルゲンのチャレンジの不在の反復BAL液のサンプリングも行われ、5日間(データは示さず)を超えて存続していない気道にのみ強化された好中球とマクロファージの動員を示した。これらの知見は、アレルゲンチャレンジマウスで観察された顕著な好中球増加は主として手続きとしない抗原の結果であることを示している。
制御では、マウスにPBS -挑戦、気道抵抗の測定は、時間の経過とともに大きく変化しなかった。 BAL液に強化されたマクロファージや好中球ではなく好酸球、募集はまた、これらのマウスでのみ繰り返さBAL液のサンプリング(図4b、d)を投与したマウスで観察される変化に類似が見られた。一緒に、これらのデータは、アレルギー(好酸球性)気道の炎症およびAHRの両方の誘導に、気道の異なる操作をアレルゲンの重要性を強調し、ではない。
同様の結果が我々がここで使われているプロテアーゼに類似鼻腔アレルゲンを使用して期待できる。しかし、多くの研究者は、アレルギー性肺疾患を誘発するために卵白アルブミンを使用してください。オボアルブミンと皮内や腹腔内プライミング(1-2週間)の適切な期間は、気道過敏症を含むアルミニウム塩、堅牢な喘息の表現型、中に析出した後、水溶性卵白アルブミンを持つ単一の鼻腔内チャレンジ後24時間以内に期待することができます。
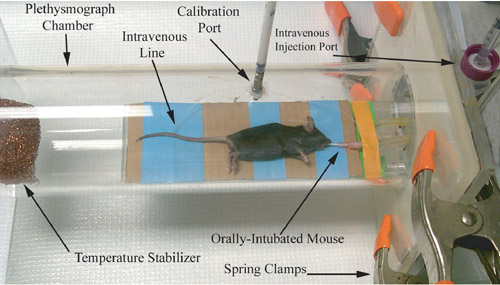
図1。げっ歯類のプレチスモグラフの写真表現、気道生理学の測定記録の直前に。

図2。気道抵抗測定。 A)統計目的のために、逆対数PC 200の値が報告されています。さらなる挑戦に続く最初の課題とその後の減少後の逆対数PC 200の大幅な増加に注意してください。 B)呼吸器系の抵抗(RRS)は:6番目と7番目の挑戦の後にACH - RRS用量応答曲線の傾斜に注意してください。エラーバーはSEMを示す。
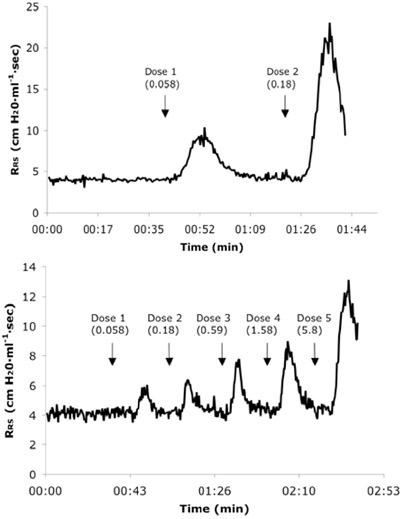
図3。代表リアルタイム呼吸器系の抵抗(R、RS)Achの連続するIVを投与したマウスに挑戦ナイーブ(A)と6Xアレルゲン(B)からトレーシング。線量値はmg / kgの単位で表示されます。

図4 7の連続した鼻の課題を投与したマウスの左肺 から派生した気管支肺胞洗浄液の検体での差免疫細胞数。パーセント(%)アレルゲン()またはPBS(B)で処置したマウスにおける免疫細胞の豊富さ。アレルゲン(C)またはPBS(D)で処置されたマウスから免疫細胞の合計数。 sem - この値は+ /を意味として表現。
ディスカッション
喘息、その他様々な気道閉塞性疾患の研究は、生物医学研究の積極的で拡大しつつある分野を構成している。喘息関連の実験的研究の重要なコンポーネントは、様々な条件の下気道の大きさの変化を測定する能力です。挑発的なチャレンジへの応答の過度の気道狭窄、喘息と関連肺疾患と気道と呼ばれる気道過敏性のプロパティの標準的な機能は、呼吸や死を含む他の症状は、息切れにつな?...
謝辞
我々は、光ファイバー経口気管内挿管を行うために提案のために博士W. Mintzerに感謝。国立衛生研究所からの補助金U19AI070973、R01AI057696、K02HL75243、およびR01HL082487によってサポートされています。
資料
気道生理計測ソフトウェア(Rescompは)(; 415-519-4371ミレニアムプレミアグループ)カスタム調製した。
データは、Pentium III CPU(インテル社サンタクララ、カリフォルニア州)とデジタル信号の変換器(ナショナルインスツルメンツ、#PC - LPM16)〜17ピンアナログを搭載したWindows XPを実行しているPCのワークステーションを用いて解析した。
小動物の気道生理学のワークステーションは、市販の圧力トランスデューサ(部分#TRD5700とTRD4510)、プリアンプのモジュール(部品#MAX2270)、シャーシ(パート#MAX1320を使用して(ミレニアムプレミアグループ)組み立てカスタムでした。Buxco、(株)ウィルミントン、NCからのすべての)とカスタマイズされた小動物のプレチスモグラフ。
光源(コールパーマーイルミネーター、41722シリーズ)に接続さ0.5ミリメートル、外径の光ファイバのスレッド、
人工呼吸器(ハーバード装置マウス人工呼吸器、#687)
10ミリメートル、27ga針(BD Biosciences社、カタログ番号309602)
熱ランプ
1mlのシリンジ(BD Biosciences社、カタログ番号305109)
4クランプ(ポニー3200スプリングクランプ)
挿管のガイドは0.5mm単位の外部ワイヤ
血球計
Superfrost /プラス顕微鏡スライド(Fisherの猫。無し。12-550-15)
シャンドンフィルタカード(サーモカタログ番号5991022)
染色差の細胞のスライド(フィッシャーカタログ番号122911)
光学顕微鏡(ライカ)
サイトスピン3(シャンドン)
20 GA、1.25インチProtectIV静脈カテーテル(スミスメディカル)
0.5ミリメートルポリマー光ファイバ(エドモンドオプティクス#NT02 - 532)。
参考文献
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved