Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine reversible, nicht-invasive Methode für Airway Resistance-Messungen und bronchoalveolären Lavage Sampling in Mäuse
In diesem Artikel
Zusammenfassung
Wiederholte Messungen von Nagetier Atemfunktion und Probenahme von Atemwegs Entzündungszellen sind wünschenswert, aber in der Regel nicht möglich. Hier beschreiben wir eine wiederholbare Methode für oral Intubation Mäuse, wiederholte Messungen der Atemwege Hyperreaktivität und die Entnahme von Atemwegs-inflammatorischen Zellen ermöglicht.
Zusammenfassung
Airway Hyperreaktivität (AHR) Messungen und Lavage (BAL) Flüssigkeit Probenahme sind unerlässlich, um experimentelle Asthma-Modellen, sondern wiederholte Verfahren auf diese Messungen in der gleichen Tier zu erhalten sind in der Regel nicht möglich. Hier zeigen wir, Protokolle für die Gewinnung von Mäusen wiederholten Messungen von AHR und Bronchalveolarlavages flüssigen Proben. Die Mäuse wurden intranasal sieben Mal mehr als 14 Tage in Frage gestellt mit einem potenten Allergen oder Schein behandelt. Vor der ersten Herausforderung, und innerhalb von 24 Stunden nach jeder intranasalen Challenge wurden die gleichen Tiere narkotisiert, intubiert und mündlich mechanisch belüftet. AHR, durch den Vergleich Dosis-Wirkungs-Kurven der Atemwege Widerstand (RRS) durch Erhöhung intravenösen Dosen von Acetylcholin (Ach)-Chlorid zwischen Schein und Allergen-induzierte herausgefordert Tiere beurteilt, bestimmt. Danach, und über die gleiche Intubation wurde die linke Lunge gespült, so dass Differential Aufzählung der Atemwege Zellen durchgeführt werden konnte. Diese Studien zeigen, dass wiederholte Messungen der AHR und BAL-Flüssigkeit Abholmöglichkeit sind aus dem gleichen Tiere und die maximale Atemwegshyperreaktivität und Atemwege Eosinophilie sind innerhalb von 7-10 Tagen nach Beginn Allergen-Provokation erreicht. Diese neue Technik reduziert die Anzahl der Mäuse für die Längs-Experimente benötigt und ist für diverse Nagetierarten, Krankheitsmodelle und Atemwege Physiologie Instrumente.
Protokoll
Allergen Herausforderung:
- C57BL / 6 Mäuse, 4-8 Wochen alt, werden in einem luftdichten Plexiglas Kammer mit einer 3,2% Isofluran in Sauerstoff Dampf-Gemisch für 10 Minuten auf tiefe allgemeine Betäubung zu erreichen gespült betäubt.
- Intranasale Allergen Herausforderungen (45μL OVA (22,5 ug) und 7μL A. oryzae (7 ug), in PBS) verabreicht werden, jeden Dienstag, Donnerstag und Sonntag, für eine Gesamtmenge von sieben aufeinander folgenden Anwendungen.
Anästhesie:
- Vor jedem Allergen-Provokation und nach dem 7. Herausforderung, sind Mäuse eine intraperitoneale Injektion von 48 mg / kg Etomidat (2 mg / ml) verabreicht werden, bevor sie in ein Licht-ohne Steckdose.
- Subject bleibt in der Aufnahme bis zum fehlenden beobachtbaren neurologische Reaktion auf Anwendung von Druck auf den Hinterpfoten (5-10 min) erkannt wird.
Intubation:
- Ein strahlender Wärme-Lampe, in einem Abstand gehalten, um Wartung von ~ 37 ° C Körperkerntemperatur, sollte sich auf das Thema während des gesamten Verfahrens, um eine Unterkühlung zu verhindern konzentrieren zu gewährleisten. Eine rektale Thermometer sollte zumindest anfänglich zur euthermia unabhängig von der Wärmequelle genutzt bestätigen.
Kritischen Schritte aller Flüssigkeiten und Instrumente, die von Versuchstieren erhalten sollten steril; Verfahren sollten unter strengen aseptischen Bedingungen durchgeführt werden. Längerer Hypothermie während der Narkose wird aberrante Daten und / oder zum Tod der Tiere führen. Competence mit allen invasiven Verfahren zu entwickeln mit Leichen Tiere, bevor Arbeiten an lebenden Tieren werden. Ophthalmic Schmiermittel sollte verwendet werden, um Hornhautverletzungen von Tieren unter Narkose zu verhindern. - Narkotisierten Mäusen aus Behälter entfernt und in der Rückenlage (Bauchseite nach oben), auf Plethysmographen Tisch, zu einem Winkel von 45 ° eingestellt.
- Ein Gummiband Einkreisung der Tabelle befindet sich hinter der oberen Reihe der Schneidezähne so eingesetzt, um das Thema in Platz zu sichern. Mit einer Pinzette in der rechten Hand Grip, zu erweitern, und heben Sie die Zunge aus dem Mund, bevor die Sicherung Sie ihn mit einem Metall depressor in der linken Hand; so dass eine ungehinderte Atemwege zur Intubation.
- Ein 0,8 mm Durchmesser LWL-Gewinde, verbunden mit einer Lichtquelle, wird durch die Angiokatheter eingesetzt und erweitert 10 mm über die Spitze. Als depressor mit der linken Hand stützte, ist die beleuchtete Ende des LWL-Faden durch die Mundhöhle und des Rachens mit der rechten Hand geführt, bis die Stimmbänder visualisiert werden. Der Faden wird dann unter direkter Visualisierung durch die sich bewegenden Stimmbänder und in die Luftröhre geführt, zeitlich so auftreten, wenn die Kabel maximal geöffnet sind.
- Die Angiokatheter wird dann über die LWL-Gewinde in die Luftröhre geleitet, bis die Katheterspitze liegt im mittleren Teil der Luftröhre. Für 17-22 Gramm Mäuse, entspricht dies einer 10 mm-Katheter-Segment sichtbar bleibt zwischen dem Anschluss und der Schädelbasis extreme des Themas s Unterkiefer. Der tatsächliche Betrag, um den Katheter übergeben sollte durch direkte Untersuchung von Luft von 2-3 katheterisiert Mäuse der entsprechenden Größe und genetischen Hintergrund bestimmt werden.
- Die faseroptische Faden entfernt und erfolgreiche Intubation wird bestätigt durch die Beobachtung regelmäßiger tiefe Atemzüge (rhythmische Exkursionen des Thorax und Abdomen), die mit sofortiger Wirkung kündigen folgenden Okklusion des Steckers mit dem Daumen. Ein Würgen Reaktion, unabhängig von Daumen-Okklusion, unregelmäßige Atemzüge, oder andere Anzeichen von Atembeschwerden sind bezeichnend für Angiokatheter Fehlstellungen und zeigen normalerweise Speiseröhrenkrebs Intubation.
Entscheidender Schritt Nichtbeachtung schnell umkehren eines ösophagealen Intubation kann tödlich sein. Wenn Speiseröhrenkrebs Intubation vermutet wird, sollte der Katheter schnell entfernt werden und wieder einmal das Tier eine normale Atmung wieder aufgenommen hat. Etomidat ist die Betäubung der Wahl, der alle verfügbaren Nagetier Anästhetika, provoziert dieses Anbieters am wenigsten kardiovaskuläre Toxizität (Hypotonie, Herzrhythmusstörungen, Herzstillstand). - Lower Plethysmographen Tisch, bis parallel mit der Werkbank und wiederum unterliegen 180 ° bis vor Luft Ventilator-Port. Schalten Tier auf seiner Seite vor dem Anschluss an das Beatmungsgerät.
- Ein erfolgreicher Intubation wird auch dadurch bestätigt, wenn nach der Sicherung einer luftdichten Anschluss und Aktivierung der Ventilator (Funktionsweise bei 150 Atemzüge / Minute, 9 ml / g Tidalvolumen, 100% Sauerstoff), thorakoabdominalen Ausflug ist, um mit dem Beatmungsgerät zu sehen.
Intravenöse line:
- A 10 mm, ist 27ga Nadel aus ihrer Spritze-Anschluss durch Schmelzen kostenlos und Verbiegen der Nadel 90 ° in der Mitte mit einer sterilen Pinzette und hemostat entfernt, so dass die Schräge Flächen in den Winkel. Die Nicht-abgeschrägte Ende mit dem PE10 Gasweg des IV-Injektion-Port angeschlossen.
- Um zu verhindern potenziellfatal Luft Embolisation, der Schlauch und Nadel sind mit 37 ° C gespült, 0,9% NaCl über die 1-ml-Spritze. Die Einspritzöffnung besteht aus einem 27ga Nadel, durch ein Loch in den Deckel einer 15ml Zentrifugenröhrchen gebohrt geschoben. Die Kappe ist mit Kochsalzlösung, so dass das Ende der Nadel ständig unter Wasser gefüllt, wodurch die Wahrscheinlichkeit, dass Luft in die Nadel wird mitgerissen werden und intravenös injiziert.
- Mit der Maus noch unter der Wärmelampe, wird die Nadel an der Schwanzflosse extreme des Schwanzes parallel zur und über die seitlichen Ader ausgerichtet. Die Nadel ist leicht unter der Haut laufen, während kranial entlang der Vene s Länge gerichtet und schob subkutan in die Kurve. Erfolgreiche Platzierung IV wird durch die Beobachtung Blut Rückströmung in den IV-Schlauch mit leichtem Ziehen des Spritzenkolbens bestätigt. Darüber hinaus sollte es fließen durch die IV-Leitung behindert werden bei der Injektion von 50-100 ul Kochsalzlösung in die Schwanzvene. Gelegentliche Schwanzvenen kann nicht stabil kanülierten werden. In diesen Fällen kann die Maus 180 Grad gedreht werden, um die andere Seite und die anderen Schwanz IV in der Regel problemlos abgerufen.
- Nach dem Entfernen der Wärmelampe aus dem Setup wird das Thema in den Plethysmographen eingeschlossen, danach als luftdicht mit der Anwendung von 4 befestigt wird.
Entscheidender Schritt erlauben die Wärmelampe auf bleibt die Luft im Plethysmographen Kammer Hitze und möglicherweise zu verändern nachfolgenden Messungen von R RS Sterilität iv Nadeln und Lösungen müssen gepflegt werden. Sterilisation der Nadeln wird durch Eintauchen und Spülen mit 70% igem Ethanol durch Spülen und Spülen mit steriler Kochsalzlösung vor der iv-Insertion durchgeführt. Darüber hinaus sollte der Schwanz mit 70% Ethanol oder Isopropanol vor iv Einsetzen gereinigt werden.
Airway Widerstandsmessungen:
- Peak-Widerstand wird durch kontinuierliche Quantifizierung der Quotient bestimmt dpt / V (wo DPt ist der Wechsel in die Luftröhre Druck und V wird der Luftstrom) an Punkten gleich Lungenvolumen (70% Tidalvolumen). DPT ist mit einem Druckwandler verbunden, die tracheale Angiokatheter bestimmt. Um festzustellen, V, sind Plethysmographen Druckschwankungen zu Änderungen in der Lautstärke über die physiologischen Bereichen studierte kalibriert. Die Differenz von Plethysmographen Volumen im Laufe der Zeit, wie die Vorverstärker-Modul berechnet wird, ist V. Nach dem Aufbau einer stabilen Basislinie R RS (<5% Abweichung von mehr als 3 Minuten), fünf aufeinander folgenden Dosen (volume = 2 ul / g Körpergewicht) erhöht Konzentrationen von Acetylcholin-Chlorid (0,058, 0,18, 0,59, 1,58 und 5,8 mg / kg Körpergewicht, in 0,9% iger Kochsalzlösung bei pH 7,4, gehalten auf dem Eis und Hand angewärmt vor jeder Injektion) werden über eine Sekunde über die iv injiziert, mit jeder weiteren Dosis nach der Rückkehr von R RS zum Ausgangswert verabreicht, bis eine Verdreifachung der Grundlinie Widerstand (ca. 12 cm H 2 O x ml -1 x sec, dh, eine 200% ige Erhöhung der Atemwegswiderstand über den typischen Baseline von ca. 4 cm H 2 O x ml -1 x sec) erreicht ist. Die provokative Konzentration von Ach, in mg / g Körpergewicht, dass eine 200% ige Erhöhung der R RS von Baseline-Werte (sog. PC 200) verursacht, wird durch mathematische Interpolation der Ach-R RS Dosis-Wirkungs-Kurven berechnet.
- Sobald PC 200 Werte erreicht wurden, lassen Verbindungselemente, und der Abbau des Plethysmographen. Es können maximal 5 ansteigende Dosen von Ach gegeben ist. Die Ach-Konzentration oben angegebenen Bereich ist für das Erreichen PC 200 Werte für die meisten naive Maus-Stämme.
Kritischer Schritt bei einem Ausgangswert von etwa 4 cm H 2 O x ml -1 x sec auf den Widerstand Monitor für 30 Sekunden aufgebaut ist, kann ein 60 ul physiologischer Kochsalzlösung injiziert iv zu bestätigen, dass die entsprechende Ebene der Anästhesie erreicht wurde. Mit Vollnarkose, wird es keine signifikante Änderung des Widerstands werden, eine Erhöhung des Widerstandes oder der Bewegung von Gliedmaßen oder Schwanz ist ein Zeichen von körperlicher Not und zeigt die Notwendigkeit für zusätzliche Betäubung. - Entfernen IV aus der Schwanzvene und trennen Sie dann das Tier aus dem Ventilator, die Aufrechterhaltung der Atemwege, indem sie die Trachealkanüle in Kraft. Gelegentliche Tiere nicht, Spontanatmung sofort wieder aufzunehmen. In diesen Fällen kann die Atmung durch leichtes Massieren des Thorax gefördert werden.
Entscheidender Schritt Spontanatmung muss vor festgestellt werden, um die Erholung Kammer übertragen, ansonsten Todesfälle auftreten. - Bei Wiederaufnahme der Spontanatmung, werden Mäuse mit Trachealkanülen in Raum gebracht wurde, in eine Kammer mit 100% O 2 und Pflege bei 37 ° C gespült mit einer Wärmelampe. Innerhalb von 15-20 min, sind Mäuse Atmung stark und fangen an, ihre Extremitäten zu bewegen, an welchem Punkt der trachealen Katheter entfernt werden kann und Tieren safely zu ihrem regulären Käfige übertragen.
Entscheidender Schritt die Atemwege leicht in das Unbewusste der Maus durch Acetylcholin-induzierte Hyper-Speichelfluss behindert und ist der Hauptgrund für die Erstickung Todesfälle in narkotisierten Mäusen nach Atemwege physiologische Messungen. Aus diesem Grund muss die Trachealkanüle in Kraft bleiben, auch bei Mäusen nicht unterziehen BAL, bis sie erweckbar und sollten nicht entfernt werden, bis hyper-salivaton hat aufgehört werden.
BAL:
- Sammlung von BAL Flüssigkeit ist sicher, wenn Mäuse ausreichend zu erholen ihren Würgereflex (~ 20 min nach der Platzierung in der Genesung Kammer). Der Würgereflex wird durch leichtes Verschieben der Angiokatheter nach innen und außen zu beurteilen; offensichtlich Husten oder kämpfen zeigen, dass die Würgereflex ist zurückgekehrt.
Entscheidender Schritt erlauben auch eine Erholungszeit verlängert wird erheblich verringert die Effizienz der BAL Rückkehr von einzelnen Mäusen, damit die Würgereflex müssen alle paar Minuten kontrolliert werden, nach dem vorgeschlagenen 20 min Ruhepause. Wenn Mäuse nicht in der Lage Lavage Verfahren aufgrund der teilweisen Erwachen tolerieren sind, können 3,2% Isofluran Dampf Anästhesie verwendet werden. - Ein metallischer Führungsdraht Intubation (0,5 OD), mit einer kontinuierlichen Kurve von ~ 30 ° nach links Lungenlappen gerichtet ist, in die Angiokatheter eingefügt. Der Führungsdraht und Angiokatheter werden zusammen in den linken Lungenflügel fortgeschritten, so dass der Katheter (Hub ausgeschlossen) erstreckt sich über die vorderen Zähne von nur 1mm.
Entscheidender Schritt Nichtbeachtung der linken Lunge zu isolieren wird erheblich reduziert Ertrag und verbessert gleichzeitig die Wahrscheinlichkeit von tierischen Tod. Es muss darauf geachtet, um sicherzustellen, dass die Spitze des Führungsdrahtes nicht durch das offene Ende des Angiokatheter weiterzugeben. Advancing the angiocathether mit der metallischen Spitze vorstehende könnte führen ein Tracheallazeration und Tod durch tracheale Bruch. - Keeping the Angiokatheter statt, der Führungsdraht entfernt und 300 ul PBS (pH 7,4, steril) wird in der linken Lunge über eine 1 ml Spritze gespült. Unmittelbar nach, während der Ausarbeitung der Spritzenkolben Unterdruck erzeugen, der Angiokatheter langsam ist (3 s) entfernt, während intensiv massiert die Lunge. Eine BAL Rückkehr von 100-200 ul erwartet.
- Sofort wieder gespült Mäusen, die 37 ° C, 100% O 2-Kammer unter ständigem Massieren der Brust. Legen Mäuse auf ihrer linken Seite, bis sie vollständig erholt (~ 20 min). Die Tiere werden dann wieder in ihre Käfige gesetzt.
TIMING:
Per Maus, sollte das gesamte Verfahren nicht länger als 1 Stunde zu erreichen: Schritt 3-4, 5-10 min; Schritte 5-21, 10 min; Schritt 22, 20-30 min; Schritte 23-24,... 10 min. Mit zunehmender Professionalität und durch die Staffelung Themen in das Protokoll, bis zu 3 Mäuse / Stunde verarbeitet werden können.
Repräsentative Ergebnisse:
Airway Hyperreaktivität bei Mäusen, als durch Maßnahmen der PC 200 Werte bestimmt wird, ist eine Folge der Aktivierung und Rekrutierung in die Lunge von T-Zellen und die Sekretion des Zytokins IL-135-7. So ist Atemwege Hyperreaktivität nicht die unausweichliche Konsequenz der Atemwege Herausforderung mit Allergen, sondern hängt von einer intakten T-Zell-Immunantwort Fach und die Zeit für T-Zell-Reaktionen benötigt, um in die Einstellung der wiederholten Kontakt mit dem Allergen zu entwickeln. Wie in Abb.. 2a, Atemwegs-Hyperreaktivität, wie PC 200 Werte, die signifikant im Vergleich zu den Ausgangswerten nach 5 Allergen Herausforderungen ohne weitere deutliche Steigerung nach der sechsten Herausforderung entwickelt sind niedriger definiert. Aus Gründen, die nicht vollständig verstanden werden, verringert Atemwegsreaktivität (PC 200 Werte erhöht) nach dem ersten Allergen-Provokation (Abb. 2a). Ähnliche Trends sind erkennbar durch den Vergleich Ach Dosis-Wirkungs-Kurven für den gleichen Mäusen (Abb. 2b). Allerdings ist es offensichtlich ist hier, dass die vollständige Atemwege Hyperreaktivität abrupt nach dem fünften Allergen-Provokation entwickelt, so dass Mäuse mehr als 30-fach empfindlicher geworden zu Ach zwischen dem vierten und sechsten Herausforderungen. Zusammen zeigen diese Ergebnisse, dass die zuverlässigsten Messungen der AHR nach sechs Allergen Herausforderungen (12 Tage) erhalten; Messungen an frühere Zeitpunkte werden wahrscheinlich sehr variablen Daten zu erhalten. Mäuse wiederholt mit Fahrzeug intranasal (Kochsalzlösung) herausgefordert entwickeln keine Atemwege Hyperreaktivität, und bei allen Dosen von Ach gegeben, R RS-Messungen nicht signifikant gegenüber dem Ausgangswert Werte variieren (Abb. 3 und Daten nicht gezeigt).
Vor der Entstehung von AHR robust, war die dominante Zelltyp der Atemwege durch Allergen induziert die Neutrophilen (Abb. 4). Ähnlich wie der Trend für AHR jedoch Eosinophilie allmählich verstärkt mit wiederholten Allergen-Provokation und der Eosinophilen wurde die zahlenmäßig dominierende Zelltyp in BAL-Flüssigkeit after der sechste Herausforderung, gleichzeitig mit einem deutlichen Rückgang in neutrophis Zahlen (Abb. 4). Makrophagen zunächst erhöhte Zahl mit den ersten paar Allergen Herausforderungen und schwankte in Hülle und Fülle danach. Lymphozyten Fülle nicht signifikant, unabhängig von der Anzahl der Allergen-Herausforderungen zu ändern und, paradoxerweise aufgrund ihrer primären Bedeutung, um das Modell, sind in der Regel am wenigsten zahlreiche Zellen in der BAL-Flüssigkeit.
Airway Widerstandsmessungen in Mäusen, die weder Allergen-Provokation noch BAL Probenahme nicht über die 17 Tage des Experiments variieren. Wiederholte BAL-Flüssigkeit Probenahme in Abwesenheit der Atemwege Physiologie Messungen oder Allergen-Provokation wurden ebenfalls durchgeführt, und zeigte nur eine verbesserte Neutrophilen und Makrophagen Rekrutierung der Atemwege, die nicht über 5 Tage (Daten nicht gezeigt) hat fortbestehen. Diese Ergebnisse zeigen, dass die prominenten Neutrophilie Allergen herausgefordert Mäusen weitgehend ist das Ergebnis des Verfahrens und nicht das Antigen.
In der Kontrollgruppe, PBS-herausgefordert Mäuse, Atemwegswiderstand Messungen auch nicht signifikant unterschiedlich im Laufe der Zeit. Verbesserte Makrophagen und neutrophilen Granulozyten, aber nicht eosinophilen, Rekrutierung von BAL-Flüssigkeit wurde auch in diesen Mäusen, ähnlich denen Veränderungen in Mäusen, die nur wiederholt BAL-Flüssigkeit Probenahme (Abb. 4 b, d) beobachtet gesehen. Gemeinsam unterstreichen diese Daten die Bedeutung des Allergens, und nicht die verschiedenen Manipulationen der Atemwege, zur Induktion der beiden allergisch (eosinophile) Entzündung der Atemwege und AHR.
Ähnliche Ergebnisse zu erwarten mit intranasal Allergene analog zu den Proteinase, die wir hier haben, verwendet werden. Allerdings verwenden viele Forscher Ovalbumin, um allergische Lungenerkrankungen hervorrufen. Nach einer angemessenen Frist intradermale oder intraperitoneale Grundierung (1-2 Wochen) mit Ovalbumin ausgefällt in einem Aluminium-Salz, eine robuste Asthma-Phänotyp, einschließlich der Atemwege Hyperreaktivität, können innerhalb von 24 Stunden nach einer einzigen intranasale Herausforderung mit löslichem Ovalbumin erwarten.
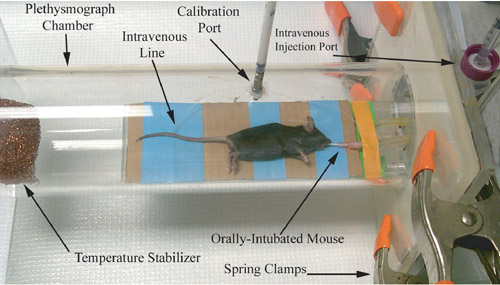
Abbildung 1. Fotografische Darstellung von einem Nagetier Plethysmographen, unmittelbar vor der Atemwege Physiologie Messwerterfassung.

Abbildung 2. Airway Widerstandsmessungen. A) Für statistische Zwecke werden antilog PC 200 Werte berichtet. Beachten Sie die starke Zunahme der antilog PC 200 nach der ersten Herausforderung und die anschließende Abnahme nach weiteren Herausforderungen. B) Atemwege Widerstand (RRS): Beachten Sie die Steilheit der Ach-RRS Dosis-Wirkungs-Kurven nach der sechsten und siebten Herausforderungen. Fehlerbalken stellen SEM.
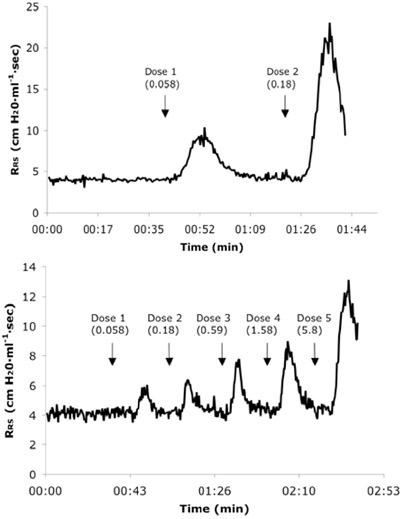
Abbildung 3. Representative Echtzeit Atemwege Widerstand (R RS) Kurven von einem naiven (A) und 6X Allergen herausgefordert Maus (B) erhalten in Folge IV Dosen von Ach. Dose Werte sind in mg / kg-Einheiten präsentiert.

Abbildung 4. Differential Immunsystem Zellzahlen in der BAL-Proben von der linken Lunge von Mäusen mit 7 aufeinanderfolgenden intranasale Herausforderungen behandelt wurden. Prozent (%) Fülle von Immunzellen von Mäusen mit Allergen (A) oder PBS (B) behandelt. Anzahl der Immunzellen von Mäusen mit Allergen (C) oder PBS (D) behandelt. Werte dargestellt als Mittelwert + / - sem.
Diskussion
Die Studie von Asthma und verschiedenen anderen Atemwegs-obstruktiven, stellt eine aktive und wachsende Gebiet der biomedizinischen Forschung. Ein wichtiger Bestandteil der Asthma-experimentelle Forschung ist die Fähigkeit, Veränderungen der Atemwege Größe unter verschiedenen Bedingungen zu messen. Übermäßige Verengung der Atemwege in Reaktion auf provokative Herausforderung, eine kanonische Funktion von Asthma und Lungenerkrankungen und eine Eigenschaft der Atemwege bezeichnet Atemwegshyperreaktivität, ist ein ...
Danksagungen
Wir danken Herrn Dr. W. Mintzer für den Vorschlag, Fiberoptik orotracheale Intubation durchzuführen. Unterstützt von Zuschüssen U19AI070973, R01AI057696, K02HL75243 und R01HL082487 von den National Institutes of Health.
Materialien
Airway Physiologie Messsoftware (Rescomp) wurde speziell vorbereitet (Millennium Premier Group; 415-519-4371).
Daten wurden unter Verwendung eines PC-Arbeitsplatzes unter Windows XP mit einem Pentium III-Prozessor (Intel, Inc. Santa Clara, CA) und einem 17-poligen analogen zum digitalen Signal-Konverter (National Instruments, # PC-LPM16) ausgestattet.
Ein kleines Tier Atemwege Physiologie Workstation wurde speziell zusammengestellt (Millennium Premier-Gruppe) mit kommerziell erhältlichen Drucksensoren (Teil # TRD5700 und TRD4510), Vorverstärker-Module (Teil # MAX2270), Fahrwerk (Teil # MAX1320, alle aus Buxco, Inc. Wilmington, NC ) und ein maßgeschneidertes kleines Tier Plethysmographen.
0,5 mm Außendurchmesser Glasfaser-Gewinde, verbunden mit der Lichtquelle (Cole Palmer Illuminator, 41722-Serie)
Ventilator (Harvard Apparatus Maus Ventilator, # 687)
10 mm, 27ga Nadel (BD Biosciences, cat. Nr. 309602)
Wärmelampe
1 ml Spritze (BD Biosciences, cat. Nr. 305109)
4 Klammern (Pony 3200 Federklammer)
0,5 mm externen Draht zur Intubation Guide
Hämazytometer
Superfrost / plus Objektträger (Fisher Katze. Nr. 12-550-15)
Shandon Filter Cards (Thermo Katze. Nr. 5991022)
Differential Zelle schieben Fleck (Fisher Katze. Nr. 122911)
Lichtmikroskop (Leica)
Cytospin 3 (Shandon)
20 GA, 1,25 Zoll PROTECTIV intravenösen Kathetern (Smith Medical)
0,5 mm Polymer Optical Fiber (Edmund Optics # NT02-532).
Referenzen
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten