このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
DNA修復タンパク質の作用のメカニズムを調べるためにストップトフロー速度論の手法の適用
要約
MSH2 - MSH6 DNAの複製エラーの修復を開始するのに責任があります。ここでは、この重要なタンパク質がどのように動作するか理解に向かって遷移速度論のアプローチを提示する。報告書は、結合DNAの結合とDNA修復のアクションのMSH2、MSH6メカニズムの基礎となるATPアーゼの動態を測定するためのストップトフロー実験を示しています。
要約
このアプローチは、活性部位の濃度と高分子の機能を支配する本質的な速度定数を含むメカニズムに関する情報が得られるので、一時的な動態解析は、生体高分子の働きを理解する上で不可欠である。酵素の場合には、例えば、一時的または前定常状態の測定は、反応経路の個々のイベントを同定し、定常状態の測定値は、全体的な触媒の効率と特異性をもたらすのに対し。このようなタンパク質 - タンパク質またはタンパク質 - リガンド相互作用およびレート制限立体構造変化などの個々のイベントは、多くの場合、ミリ秒のタイムスケールで発生し、ストップトフローと化学クエンチフロー法によって直接測定することができます。このような蛍光などの光信号を考えると、ストップトフローは、製品リリースと触媒回転率の1,2に結合する基質から反応の進行を監視するための強力かつアクセス可能なツールとして機能します。
ここで、我々は、MSH2、MSH6の作用のメカニズム、DNAと信号のミスマッチ修復(MMR)3-5の塩基対のミスマッチ、挿入/削除のループを認識する真核生物のDNA修復蛋白質を調べるためにストップトフロー速度論の応用を報告する。そうすることで、このようにMSH2 - MSH6増える3桁(エラーの頻度が〜10 -6〜10 -9塩基から減少)によるDNA複製の正確さ、とは、ゲノムの完全性を維持することができます。驚くことではないが、欠陥のある人間MSH2 - MSH6機能は、遺伝性非ポリポーシス大腸癌と他の散発性の癌6月8日に関連付けられています。この重要なDNA代謝蛋白質の作用機序を理解するために、我々はミスマッチDNAだけでなく、MMRの燃料そのアクションをATPase活性とMSH2 - MSH6相互作用のダイナミクスをプロービングしている。 Tミスマッチとリアルタイムで2 - アミノプリンの蛍光の結果として増加を監視する:DNA結合は、急速にGに隣接する2 - アミノプリン(2 - AP)蛍光体を含むDNAとMSH2 - MSH6を混合することによって測定されます。 T(2 - AP)ラベルのないトラップのDNAと時間9以上の蛍光でモニタリングの減少とのミスマッチの複雑な:DNA解離は、予め形成MSH2 - MSH6 Gを混合することによって測定されます。前定常状態のATPアーゼの速度は、7 - ジエチルアミノ-3 - ((((2 - maleimidyl)エチル)アミノ)カルボニル)クマリン)で標識された結合リン酸のリン酸結合タンパク質(MDCC - PBP)(の蛍光の変化によって測定されるPiは)ATPの加水分解9,10以下のMSH2 - MSH6によって解放。
T複雑な、ターン結果にATP結合型のタンパク質のATP加水分解と安定化の抑制に:長寿命MSH2 - MSH6 GのTミスマッチと形成:データはGにMSH2、MSH6の急速な結合を明らかに。反応速度は、二重らせんのミスマッチ塩基対をバインドする方法のATP -結合MSH2 - MSH6信号のDNA修復その仮説のための明確なサポートを提供しています。
F.ノアビロと潔宅が平等にこの論文に貢献した。
プロトコル
MSH2 - MSH6 DNA結合速度のA.測定
1。 MSH2 - MSH6 DNA結合反応速度の実験用サンプルの準備
ストップトフローの蛍光ベースの運動DNA結合実験用試薬の調製は、蛍光光度計での平衡の実験の場合と同様です。確かに平衡結合分析は、運動解析のために反応条件を最適化するために、相互作用の解離定数(K D)を推定するために最初に実行されるべきである。ストップトフロー実験では平衡または定常状態の実験と比較して生物学的物質のより大きな量を必要とする、蛋白質の低ミリグラム量は11,12およびリガンドの同様の量の利用可能な場合、そのため、アプローチが最も実現可能であるが調製または購入することができます。
- 我々は過剰発現するS.出芽酵母E.におけるMSH2、MSH6 大腸菌およびイオン交換クロマトグラフィー(図1)11によってタンパク質のミリグラム単位を清める。
- 2 - アミノプリンの蛍光物質の有無にかかわらずDNAの試薬は、化学的に合成することができます。我々は、2 - アミノプリンで修飾した37塩基長一本鎖DNAを購入し、Gに隣接する2 - アミノプリンと二本鎖DNAを準備するには、2つの相補鎖をアニール:Tのミスマッチ(図2)。 DNAをポリアクリルアミド変性ゲル電気泳動により、製造業者によって、または研究室で精製することができるが、後者は一般的に高い利回りが得られます。
- T(2 - AP)のDNA結合バッファー中のDNAとMSH2 - MSH6タンパク質サンプル(20mMトリス- HCl、pH8.0の、5 mMのMgCl 2、100mMのNaCl):DNA結合速度の場合は、別々のGを準備。 MSH2 - MSH6とDNA濃度は1:1混合比を持つ単一の混合実験では0.4μMおよび0.06μMの最終濃度が得られるそれぞれ0.8μMおよび0.12μM、です。 T(2 - AP)のDNA、およびGを非標識8μMと別のサンプル:DNA解離動力学の場合は、0.8μMMSH2 - MSH6および0.12μMGを含むつのサンプルを準備するTのDNAフリーMSH2 - MSH6のためのトラップとして。氷上でサンプルを調製し、保管してください。これらの反応では、タンパク質濃度は、MSH2、MSH6 - DNA相互作用とDNA濃度のためにも10 nMのK Dを超えている堅牢な蛍光信号(実験的に決定)で十分です。サンプルあたり400μlの体積は約10運動のトレース(表1)を得るのに十分です。
- 蛍光タンパク質の不純物、DNA、およびバッファの準備の自由な高品質の化学品を使用してください。微粒子でストップトフローを目詰まりを避けるために0.2μmの膜を介してすべてのバッファをフィルタリングします。
- 蛍光団は可視光を吸収する場合、準備と実験は、低光の条件の下で実行する必要があります。
2。 MSH2 - MSH6 DNA -結合速度のための計器の準備
ストップトフロー装置は、原理的に非常に簡単です。それが急速に混合装置にドライブのシリンジに2つのソリューションをプッシュする駆動モータを使用して、混合溶液は、その後、データ収集(図3)の観測セルに流れる。我々はKinTekが低いサンプルのボリュームを必要とする、フローを停止して使用し、光信号の様々な、単一または反応物の混合順次検出を可能にし、非常に使いやすいです。ストップトフロー測定器は、同様に他のいくつかのメーカーから提供されています。
- 実験のためにストップトフロー測定器を準備するためには、コンピュータとコントローラの電源がオフになっていることを確認してください。ランプを冷却するため、周囲温度(℃25℃)に設定されて循環水浴をオンにします。ランプに火を付ける。所望の励起波長(2 - アミノプリンの場合の315 nm)にモノクロメータを設定します。希望のスリット幅(低退色と経験的にバランスの高い蛍光体の励起)にスリットのホイールを回します。コントローラとコンピュータの電源を入れます。実験(30 ° C、S.セレビシエ MSH2 - MSH6の場合)中に所望の温度で反応を維持するウォータージャケットを埋めるために循環水浴をオンにします。
- 次に、ストップトフロープログラムを実行してください。この場合、フルオロフォア(350nmのカットオフ2 - アミノプリンの場合には、フィルタ)のための適切な干渉フィルタと光電子増倍管(PMT)である選択、の検出器をオンにします。 PMTに電圧を印加。どんなバックグラウンドの電気ノイズを補正するための暗電流を測定します。
- ストップトフロードライブシリンジと観察セルは、サンプルをロードする前に洗浄する必要があります。 LOADの位置にサンプルローディングバルブを設定します。脱イオン、ろ過し、水で1ミリリットル注射器をいっぱいに、ドライブの注射器の下に置かれたロードポートに接続し、手動で2つのシリンジを数回の間に水を押してください。実験で使用する各ドライブの注射のために二度のプロセスを繰り返します。次に、観察細胞を洗浄する水でドライブシリンジを埋める。 FIREの位置にサンプルローディングバルブを切り替えます。調整シリンジドライブを使用して、駆動モータを制御し、観測セルを通過し、出口ラインに水をプッシュするようにドライブプレートを下げるコマンドを、。ドライブシリンジの一番最後にプランジャーを押ししないように注意してください。ドライブプレートを持ち上げます。 LOADの位置にバルブを切り替えて。手動で反応バッファーでシリンジを洗浄し、空のままにしておきます。楽器が使用できるようになりました。
3。 MSH2 - MSH6 DNA結合実験とデータ解析
- チューブから新鮮な1 mlのシリンジに各サンプルを転送します。ロードポートに各サンプルのシリンジを接続し、ドライブのシリンジにソリューションをプッシュ。手動で断続的な休止を挟みながら何度か2つのシリンジ間で解決策を押すことにより、すべての気泡を除去するように注意してください。それは、連絡先ドライブの注射器の上部にまで、ドライブプレートを下ろします。反応は数分間、周囲温度に平衡化してみましょう。
- データ収集のため、セット時間/チャンネルウィンドウを開いて、データ収集チャンネル(PMT)を選択し、データ解析のモード(蛍光)、および収集するトレース数(ショット)。 1000個のデータポイントが収集される間、データ収集の時間を入力してください。未知の反応は、任意の遅い段階を検出するために、数秒にわたって監視する必要があります。経験的に平衡又は定常状態と≥6半減期に設定されたデータの収集時間に達するまでに要する時間を見積もります。 MSH2 - MSH6の場合には最適な時間枠は、Gのために2秒です:T解離動力学:GのTミスマッチ結合速度と60秒。今FIREの位置にバルブを設定し、収集データのボタンをクリック。このアクションは、観察セル、2 - アミノプリンの蛍光物質の励起と時間をかけて蛍光シグナルのコレクションへの反応のMSH2、MSH6とDNA、エントリの混合開始。高品質のデータを取得し、ファイルを保存するために少なくとも5つの運動トレースを収集します。
- 実験が完了すると、ランプの電源を入れます。前述のように水を注射器や観察セルを洗う。その後、循環水浴を除いて、機器の残りの部分をオフにしてください。水は、ランプを冷却するためにさらに15分間循環される。
- 数学演算やデータフィッティングは実験中に反応速度の感覚を得るために、KinTekソフトウェア自体で行うことができます。さらなる分析は、複数の運動のトレースを平均化し、他のデータ解析/グラフ作成ソフトに平均ファイルを保存し、エクスポートすることによって行うことができます。
4。 MSH2 - MSH6 DNA結合速度のための代表的な結果
GとMSH2 - MSH6相互作用の動力学的データ:TのミスマッチのDNAは、単一の指数関数にフィットし、3〜クローズ時に速い結合速度定数kを得ることができる× 10 7 M - 1second - 1(図4A)と遅い急速にTミスマッチと約60秒〜13の半減期で非常に安定した複合体を形成する:MSH2 - MSH6はGを結合することを明らかに0.012秒-1(図4B)、の解離定数 k OFF。
MSH2 - MSH6 ATPアーゼキネティクスのB.測定
1。 MSH2 - MSH6 ATPaseの反応速度の実験用サンプルの準備
- 未標識DNAを用いて、前述のようにMSH2 - MSH6とDNAの試薬を準備します。さらに、E.からリン酸結合タンパク質(PBP)を精製大腸菌とMDCCの蛍光体(図5)14,15と、それにラベルを付ける。 MDCC - PBPはMDCC蛍光(図6)の劇的な増加をもたらす、急速に(ON kは 1 × 10 8 M -1秒-1に等しい)と高い親和性(K D = 100 nm)の遊離リン酸を結合する。 MDCC - PBPは、したがって、前定常状態のATP加水分解とリン酸の放出動態14,15の堅牢なレポーターです。それは、このアッセイのバックグラウンドのリン酸塩のレベルを最小限に抑えるために不可欠であることに注意してください。従って、ガラスの使用は厳密に試薬の準備のすべての段階で回避する必要があります。
- T DNA、1:1混合比を持つ単一の混合実験では2μM、3μMの最終濃度が得られる:6μMGの有無に関係なくMSH2 - MSH6タンパク質4μMでサンプルを準備します。目的の信号は、単一の売上高または最初の数触媒のターンオーバーからのものであるので、前定常状態の実験は高酵素濃度を必要とすることに注意してください。たてのATPと20μMMDCC - PBPレポーターを溶解を1mMを含む別のサンプルを準備します。あらゆる汚染リン酸を一掃するのに役立つサンプル、するプリンヌクレオシドホスホリラーゼの0.10単位/ mlおよび200μM7 -メチルグアノシンを追加。少なくとも20分(表2)のために氷上でサンプルをインキュベートする。
2。 MSH2 - MSH6 ATPaseの反応速度のための計器の準備
- 前述のように実験のためにストップトフロー測定器を準備します。さらに、0.5単位/ mlのプリンNUでドライブシリンジからリン酸汚染物質を吸い取るcleosideのホスホリラーゼおよび200μMの20分間に7 - メチル。 425 nmに励起波長を設定し、MDCC - PBPの蛍光を検出するためのPMTで450nmのカットオフフィルターを使用してください。
3。 MSH2 - MSH6 ATPアーゼの実験とデータ解析
- 前述のようにサンプルでドライブシリンジをロードする。 MSH2 - MSH6と時間をかけてMDCC - PBP蛍光の結合の増加により、ATPとMDCC - PBPとモニターのリン酸のリリースでMSH2、MSH6を混在させるデータの収集をクリックしてください。高品質のデータセットを取得してファイルを保存するために少なくとも5つの運動トレースを収集します。平均的な複数の運動のトレースは、分析用のデータファイルをエクスポートします。
- リン酸塩濃度とMDCC - PBP蛍光間の線形関係を決定するために検量線を準備します。ストップトフローでの同一実験条件下で、その別のリン酸塩濃度とのミックスMDCC - PBPを行う、とそれぞれのリン酸塩の濃度で最大MDCC - PBP蛍光を測定するために。
- 検量線(図7)のための各リン酸塩濃度に対する最大MDCC - PBP蛍光をプロットし、MSH2、MSH6反応でリン酸塩濃度を得るためにスロープを使用してください。プロットのリン酸塩濃度対時間と指数関数と線形関数にデータをフィット。この関数は、反応の線形定常状態の位相が続く前定常状態のATP加水分解とリン酸の放出のバーストを説明します。
4。 MSH2 - MSH6 ATPaseの反応速度論のための代表的な結果
運動データは、第1触媒売上高は1.4秒-1で急速にそのMSH2 - MSH6加水分解するATPとリリースのリン酸塩を示す。この相は、0.2秒-1(図8A)の7倍遅い定常状態の k catに、後続のターンオーバーを制限する反応の遅い段階が続きます。しかし、MSH2、MSH6はミスマッチDNA、ATPの加水分解とリン酸の放出のバーストにバインドされている場合は、抑制、およびMSH2 - MSH6は、長い時間のためのATP結合状態のままになります。

図1 S.の精製E.から出芽酵母 MSH2、MSH6 大腸菌。MSH2とMSH6遺伝子はpET11aベクターにクローニングし、E.で過剰発現させた大腸菌 BL21(DE3)細胞。タンパク質複合体は、SP -セファロース、ヘパリン、およびQ -セファロース樹脂のカラムクロマトグラフィーにより精製した。ここに示されているSDS - PAGE分析では、Q -セファロースカラムからのタンパク質の分画が含まれています。
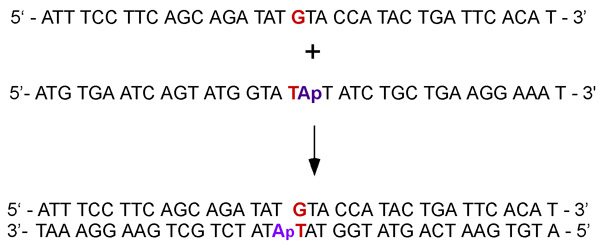
隣接するアデノシン(ATPアーゼの実験の場合)または2 -アミノアデノシンの蛍光ベースのアナログ(DNA結合実験用)とTミスマッチ: 図2の相補一本鎖DNAは、Gを含む二重鎖を形成するためにアニールされています。
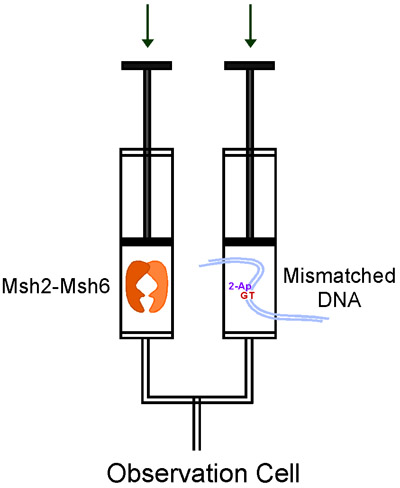
図3。KinTekにおける反応物のフローは単一の混合実験中にフローを停止。

図4a GとMSH2 - MSH6相互作用の速度論:Tミスマッチ。 Gを含む二重鎖DNA(0.12μM)の混合:MSH2 - MSH6(0.8μM)とT 2 -アミノプリンの隣には、時間の経過とともに蛍光の増加につながる、と= 2.4 10 7 M -1 sで二分子速度定数 k が得られます相互作用の場合は-1になります。
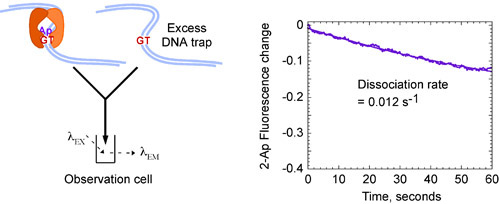
図4b GとMSH2 - MSH6相互作用の速度論:Tミスマッチ。ミキシング予め形成されたMSH2 - MSH6 G:T(2 - AP)過剰の非標識Gとの複雑な:T DNA(8μM)をトラップするには、任意のフリーMSH2 - MSH6リード時間をかけて蛍光に減少する、と遅い解離速度定数が得られる、 〜60秒の長い半減期を持つ安定な複合体を示す= 0.012 s -1を OFF K、。最終濃度:0.4μMMSH2 - MSH6、標識されたDNA 0.06μM、Gを非標識4μM:TのDNAのトラップ。
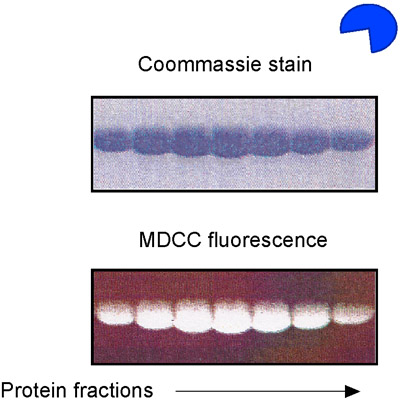
図5。MDCC - PBPの準備。 E.のSDS - PAGE分析大腸菌リン酸結合タンパク質(PBP)は、精製し、MDCC蛍光団で標識。
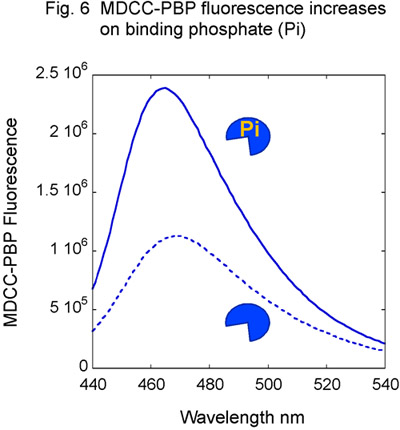
図6。リンにMDCC - PBP応答。増加MDCC蛍光におけるリン酸塩(Pi)の結果とMDCC - PBPの滴定。

図7a。リン酸塩の調製(パイ)標準曲線。 - MDCC - PBP(20μM)は、円周率の様々な量(8μM0)と混合される平衡に達するまでD蛍光は経時的に測定。最終濃度:10μMMDCC - PBP、0から4μMのパイ。
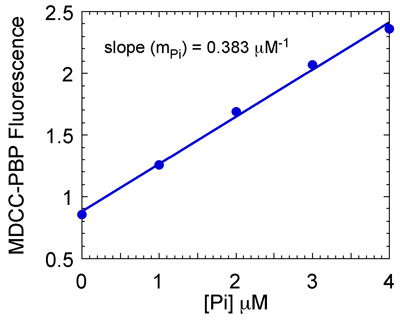
図7b。リン酸塩の調製(パイ)標準曲線。最大MDCC - PBP蛍光は、[PI]標準曲線を得ることに対してプロットされる。線の傾き(この場合は-1を 0.383μM)は、Piの濃度にMDCC - PBP蛍光に変換するために使用されます。
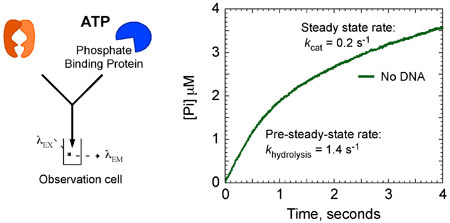
図8a。MSH2 - MSH6 ATPアーゼの動態。不在GにおけるMSH2 - MSH6(4μM)、:ATP(1mM)のとMDCC - PBP(20μM)と急速に混合TのDNAは、ATPの加水分解とPiの放出のバーストを示す。 - 0.4μMsの速度で直線的、定常状態の位相が続いているバースト位相、の、データ解析は、速度(k個の 加水分解 = 1.4秒-1)と振幅(MSH2 - MSH6あたり1サイト2μM)を得られます1(K 猫 = 0.2秒-1)。
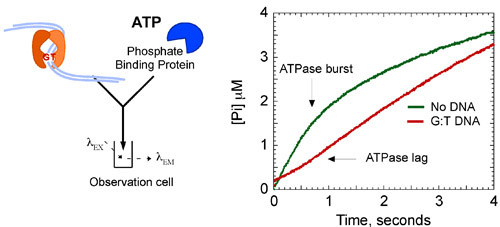
図8b。MSH2、MSH6 ATPアーゼ反応速度。 Gの加算:反応にT DNA(6μM)は、ATP結合状態での複合体を安定化、ATPの加水分解のバーストを抑制。最終濃度:2μMMSH2 - MSH6、500μMATP、3μMのDNA、10μMのMDCC - PBP。バースト速度は次式でフィッティングされています:[PI] = A 0 E - K T + Vtが、ここで、[Pi]はリン酸塩の濃度は、0は 、kは観測されたバーストの速度定数バーストの振幅であり、Vは速度です。線形位相(K 猫 = V / [MSH2 - MSH6])。
| サンプル | タンパク | DNA | ||||
| 試薬 | 在庫切れ | 操作 | μL巻、 | 在庫切れ | 操作 | μL巻、 |
| MSH2、MSH6 | 5μM | 0.8μM | 64 | - | - | - |
| 2ApG:T | - | - | - | 10μM | 0.12μM | 4.8 |
| 緩衝 | 10倍 | 1X | 40 | 10倍 | 1X | 40 |
| のddH 2 O | - | - | 296 | - | - | 355 |
| 合計 | 400 | 400 | ||||
表1 DNA結合反応
| サンプル | タンパク | タンパク質- DNA | ATP | ||||||
| 試薬 | 在庫切れ | 操作 | μL巻、 | 在庫切れ | 操作 | μL巻、 | 在庫切れ | 操作 | μL巻、 |
| MSH2、MSH6 | 20μM | 4μM | 80 | 20μM | 4μM | 80 | - | - | - |
| G:T | - | - | - | 100 | 6 | 24 | - | - | - |
| ATP | - | - | - | - | - | - | 50mMの | 1mMの | 8 |
| 7 - MEG | 250X | 1X | 1.6 | 250X | 1X | 1.6 | 250X | 1X | 1.6 |
| PNPase | 100倍 | 1X | 4 | 100倍 | 1X | 4 | 100倍 | 1X | 4 |
| PBP - MDCC | 150μM | 20μM | 53.3 | 150μM | 20μM | 53.3 | - | - | - |
| バッファ | 10倍 | 1X | 40 | 10倍 | 1X | 40 | 10倍 | 1X | 40 |
| のddH 2 O | - | - | 221 | - | - | 197 | - | - | 346 |
| 合計 | 400 | 400 | 400 | ||||||
表2 ATPアーゼ反応
ディスカッション
ここに記載されたDNAのミスマッチ結合タンパク質の例は、生体分子のメカニズムを研究するための一時的な運動方法のパワーと実用性を示しています。シングルターンオーバーの時間スケールでのストップトフロー測定は、ミスマッチ塩基対と反応9の長寿命のタンパク質のXのDNA複合体の形成にMSH2、MSH6タンパク質の迅速かつ特異的結合のための明白な証拠を提供した。また、ATPase活?...
謝辞
この作業は、NSFのキャリア賞(MMH)、バリーM.ゴールドウォーター奨学金(FNB)とASBMB学部研究賞(CWD)によってサポートされていました。 PBPの過剰発現用クローンは、親切にドクターマーティンウェッブ(MRC、英国)から提供された。
資料
| DNAの名 | シーケンス |
| 37 G | 5' - ATT TCC TTC AGC AGA TAT G TA CCA TAC TGA TTC ACAのT -3' |
| 37 T(2 - AP) | 5' - ATG TGA ATC AGT ATG GTA T のAp T ATC TGC TGA AGG AAAのT -3' |
| 37 T | 5' - ATG TGA ATC AGT ATG GTA T T ATC TGC TGA AGG AAAのT -3' |
参考文献
- Johnson, K. A. Advances in transient-state kinetics. Curr Opin Biotechnol. 9 (1), 87-89 (1998).
- Johnson, K. A. E. . Kinetic analysis of macromolecules. , (2003).
- Obmolova, G., Ban, C., Hsieh, P., Yang, W. Crystal structures of mismatch repair protein MutS and its complex with a substrate DNA. Nature. 407 (6805), 703-710 (2000).
- Lamers, M. H. The crystal structure of DNA mismatch repair protein MutS binding to a G x T mismatch. Nature. 407 (6805), 711-717 (2000).
- Warren, J. J. Structure of the human MutSalpha DNA lesion recognition complex. Mol Cell. 26 (4), 579-592 (2007).
- Kunkel, T. A. &. a. m. p. ;. a. m. p., Erie, D. A. . DNA Mismatch Repair. Annu Rev Biochem. 74, 681-710 (2005).
- Jiricny, J. The multifaceted mismatch-repair system. Nat Rev Mol Cell Biol. 7 (5), 335-346 (2006).
- Hsieh, P., Yamane, K. DNA mismatch repair: Molecular mechanism, cancer, and ageing. Mech Ageing Dev. 129 (7-8), 391-407 (2008).
- Jacobs-Palmer, E., Hingorani, M. M. The effects of nucleotides on MutS-DNA binding kinetics clarify the role of MutS ATPase activity in mismatch repair. J Mol Biol. 366 (4), 1087-1098 (2007).
- Antony, E., Khubchandani, S., Chen, S., Hingorani, M. M., M, M. Contribution of Msh2 and Msh6 subunits to the asymmetric ATPase and DNA mismatch binding activities of Saccharomyces cerevisiae Msh2-Msh6 mismatch repair protein. DNA Repair (Amst). 5 (2), 153-162 (2006).
- Antony, E., Hingorani, M. M. Mismatch recognition-coupled stabilization of Msh2-Msh6 in an ATP-bound state at the initiation of DNA repair. Biochemistry. 42 (25), 7682-7693 (2003).
- Finkelstein, J., Antony, E., Hingorani, M. M., O'Donnell, M. Overproduction and analysis of eukaryotic multiprotein complexes in Escherichia coli using a dual-vector strategy. Anal Biochem. 319 (1), 78-87 (2003).
- Zhai, J., Hingorani, M. M. S. cerevisiae Msh2-Msh6 DNA binding kinetics reveal a mechanism of targeting sites for DNA mismatch repair. Proc Natl Acad Sci U S A. 107 (2), 680-685 (2010).
- Brune, M., Hunter, J. L., Corrie, J. E., Webb, M. R. Direct, real-time measurement of rapid inorganic phosphate release using a novel fluorescent probe and its application to actomyosin subfragment 1 ATPase. Biochemistry. 33 (27), 8262-8271 (1994).
- Brune, M. Mechanism of inorganic phosphate interaction with phosphate binding protein from Escherichia coli. Biochemistry. 37 (29), 10370-10380 (1998).
- Antony, E., Hingorani, M. M. Asymmetric ATP binding and hydrolysis activity of the Thermus aquaticus MutS dimer is key to modulation of its interactions with mismatched DNA. Biochemistry. 43 (41), 13115-13128 (2004).
- Gradia, S., Acharya, S., Fishel, R. The human mismatch recognition complex hMSH2-hMSH6 functions as a novel molecular switch. Cell. 91 (7), 995-1005 (1997).
- Mazur, D. J., Mendillo, M. L., Kolodner, R. D., D, R. Inhibition of Msh6 ATPase activity by mispaired DNA induces a Msh2(ATP)-Msh6(ATP) state capable of hydrolysis-independent movement along DNA. Mol Cell. 22 (1), 39-49 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved