Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Применение Остановлен поток Кинетика методы по расследованию Механизм действия белков репарации ДНК
Резюме
MSH2-Msh6 отвечает за инициирование ремонт ошибок репликации ДНК. Здесь мы представляем переходных подход кинетики к пониманию того, как этот критический белка работ. В докладе показано, остановил поток экспериментов для измерения связаны обязательными ДНК и АТФ-азы кинетики основной MSH2-Msh6 механизм действия в репарации ДНК.
Аннотация
Transient kinetic analysis is indispensable for understanding the workings of biological macromolecules, since this approach yields mechanistic information including active site concentrations and intrinsic rate constants that govern macromolecular function. In case of enzymes, for example, transient or pre-steady state measurements identify and characterize individual events in the reaction pathway, whereas steady state measurements only yield overall catalytic efficiency and specificity. Individual events such as protein-protein or protein-ligand interactions and rate-limiting conformational changes often occur in the millisecond timescale, and can be measured directly by stopped-flow and chemical-quench flow methods. Given an optical signal such as fluorescence, stopped-flow serves as a powerful and accessible tool for monitoring reaction progress from substrate binding to product release and catalytic turnover1,2.
Here, we report application of stopped-flow kinetics to probe the mechanism of action of Msh2-Msh6, a eukaryotic DNA repair protein that recognizes base-pair mismatches and insertion/deletion loops in DNA and signals mismatch repair (MMR)3-5. In doing so, Msh2-Msh6 increases the accuracy of DNA replication by three orders of magnitude (error frequency decreases from ~10-6 to10-9 bases), and thus helps preserve genomic integrity. Not surprisingly, defective human Msh2-Msh6 function is associated with hereditary non-polyposis colon cancer and other sporadic cancers6-8. In order to understand the mechanism of action of this critical DNA metabolic protein, we are probing the dynamics of Msh2-Msh6 interaction with mismatched DNA as well as the ATPase activity that fuels its actions in MMR. DNA binding is measured by rapidly mixing Msh2-Msh6 with DNA containing a 2-aminopurine (2-Ap) fluorophore adjacent to a G:T mismatch and monitoring the resulting increase in 2-aminopurine fluorescence in real time. DNA dissociation is measured by mixing pre-formed Msh2-Msh6 G:T(2-Ap) mismatch complex with unlabeled trap DNA and monitoring decrease in fluorescence over time9. Pre-steady state ATPase kinetics are measured by the change in fluorescence of 7-diethylamino-3-((((2-maleimidyl)ethyl)amino)carbonyl) coumarin)-labeled Phosphate Binding Protein (MDCC-PBP) on binding phosphate (Pi) released by Msh2-Msh6 following ATP hydrolysis9,10.
The data reveal rapid binding of Msh2-Msh6 to a G:T mismatch and formation of a long-lived Msh2-Msh6 G:T complex, which in turn results in suppression of ATP hydrolysis and stabilization of the protein in an ATP-bound form. The reaction kinetics provide clear support for the hypothesis that ATP-bound Msh2-Msh6 signals DNA repair on binding a mismatched base pair in the double helix.
F. Noah Biro and Jie Zhai contributed to this paper equally.
протокол
А. Измерение MSH2-Msh6 связывания ДНК Кинетика
1. Подготовка образцов для MSH2-Msh6 связывания ДНК эксперимент кинетики
Подготовка реагентов для флуоресценции основе кинетической связывания ДНК эксперимент по остановил поток похож на, что для равновесия эксперимент по флуорометр. Действительно равновесного связывания анализ должен быть выполнен первый оценить константу диссоциации (K D) для взаимодействия с целью оптимизации условий реакции для кинетического анализа. Остановлен поток эксперименты требуют больших количеств биологических материалов по сравнению с равновесия или стационарного экспериментов, поэтому подход является наиболее целесообразным при низких миллиграмм количества белка доступны 11,12 и аналогичные объемы лигандов можно приготовить или купить.
- Мы по-экспресс С. CEREVISIAE MSH2-Msh6 в E. палочки и очистить миллиграмм количества белка ионообменной хроматографии (рис. 1) 11.
- ДНК реагентов или без 2-аминопурин флуорофора может быть химически синтезированные. Мы покупаем 37 нуклеотидных длины одноцепочечных ДНК, изменение с 2-аминопурин и отжига двух комплементарных нитей для подготовки дуплексных ДНК с 2-аминопурин прилегающих к G: T не совпадают (рис. 2). ДНК может быть очищен производителя или в лабораторных условиях, денатурирующих электрофореза в полиакриламидном геле, вторые как правило, дает более высокие урожаи.
- Для связывания ДНК кинетика, подготовить отдельные G: T (2-Ар) ДНК и MSH2-Msh6 образцы белков в ДНК связывающим буфером (20 мМ Трис-HCl, рН 8,0, 5 мМ MgCl 2, 100 мМ NaCl). MSH2-Msh6 и ДНК концентрации 0,8 мкМ и 0,12 мкм соответственно, что дает 0,4 мкм и 0,06 мкм конечные концентрации в одном смешивания экспериментировать с 1:01 смешивания. Для ДНК диссоциации кинетика, подготовить один образец, содержащий 0,8 мкМ MSH2-Msh6 и 0,12 мкМ G: T (2-Ар) ДНК, и еще один образец с 8 мкМ немеченого G: T ДНК в качестве ловушки для свободных MSH2-Msh6. Готовьте и храните образцы на льду. В этих реакциях, концентрация белка, что значительно выше 10 нМ К D для MSH2-Msh6-ДНК взаимодействия и концентрации ДНК достаточно для надежного сигнала флуоресценции (определяется опытным путем). Объемом 400 мкл на пробу достаточно для получения около 10 кинетическую следы (табл. 1).
- Используйте высокие качества химических веществ, которые свободны от примесей в флуоресцентные белки, ДНК, и буферных препаратов. Фильтровать все буферы через 0,2 мкм мембраны, чтобы избежать засорения остановился потока с твердыми частицами.
- Если флуорофора поглощают видимый свет, подготовка и опыт должны быть выполнены в условиях низкой освещенности.
2. Инструмент подготовки к MSH2-Msh6 ДНК-связывающим кинетики
Остановил поток инструмент очень прост в принципе. Он использует двигатель быстро нажать два решения в приводе шприцев в смесительное устройство, смешанный раствор поступает затем в наблюдении ячейки для сбора данных (рис. 3). Мы используем KinTek остановил поток, который требует небольшого объема образца, позволяет одним или последовательного смешивания реагентов, обнаружение различных оптических сигналов, и очень проста в использовании. Остановлен поток инструменты доступны из нескольких других производителей, а также.
- Для того чтобы подготовить остановил поток инструментом для экспериментов, убедитесь, что компьютер и контроллер выключен. Включите оборотной воды баню до температуры окружающей среды (25 град; С) для охлаждения лампы. Зажигать лампу. Установите монохроматор к желаемой длины волны возбуждения (315 нм в случае 2-аминопурин). Поверните колесо, чтобы щель желаемой ширины щели (эмпирически баланс высоких возбуждения флуорофора с низким фотообесцвечивания). Включите контроллер и компьютер. Включите циркулирующих водяной бане, чтобы заполнить водяной рубашкой, которая поддерживает реагентов на желаемую температуру в ходе эксперимента (30 ° C в случае С. CEREVISIAE MSH2-Msh6).
- Затем выполните остановил поток программы. Включите детектор выбора, который в данном случае является фотоумножителя (ФЭУ) с интерференционный фильтр подходит для флуорофора (350 нм отсечки фильтра в случае 2-аминопурин). Подавать напряжение на ФЭУ. Мера темнового тока для коррекции любой фон электрических помех.
- Остановил поток диск шприцы и наблюдения клетка должна быть вымыты перед загрузкой образцов. Установите клапан загрузки образца в нагрузку позиции. Заполните шприц 1 мл деионизированной, фильтруют воду, приложите его к порту погрузки расположен под диск шприц, и вручную толкать воду между двумя шприцами несколько раз. Повторите процесс дважды для каждого диска шприц, который будет использоваться в эксперименте. Затем заполнить диск шприцы с водой для мытья наблюдения клетки. Переключатель клапана Пример загрузки на огневой позиции. Используйте регулировка привода ШприцКоманда, которая контролирует двигатель, и нижней пластины диска толкать воду через наблюдение клеток и в выходе линии. Заботьтесь, чтобы не толкать поршень до самого конца диска шприц. Поднимите привод пластины. Переключатель клапана НАГРУЗКИ позиции. Ручная стирка шприцы с реакционного буфера и оставить пустым. Прибор готов к использованию.
3. MSH2-Msh6 связывания ДНК эксперимента и анализа данных
- Передача каждого образца с трубкой на свежий 1 мл шприца. Прикрепить каждого образца шприц порт погрузки и нажмите раствора в шприце диск. Позаботьтесь, чтобы удалить все пузырьки воздуха, вручную нажатием решение между двумя шприцами несколько раз с прерывистым пауз. Нижний диск пластину до контактов верхней части диска шприцы. Пусть реагентов равновесие до температуры окружающей среды в течение нескольких минут.
- Для сбора данных, откройте Time Set / Каналы окне выберите канал сбора данных (ФЭУ), способ анализа данных (флуоресценции), и количество следов (Shots) должны быть собраны. Введите время сбора данных во время которых 1000 точек данных будут собраны. Неизвестные реакции должны быть проверены в течение нескольких секунд, чтобы обнаружить любые медленные фазы. Эмпирически оценить время, необходимое для достижения равновесия или стационарного состояния и набора сбора данных время ≥ 6 полураспада. В случае MSH2-Msh6 оптимальный срок составляет 2 секунды для G: T несоответствия обязательным кинетики и 60 секунд для G: T диссоциации кинетики. Теперь установите клапан для огневой позиции и нажмите кнопку Сбор данных. Это действие инициирует смешивания MSH2-Msh6 и ДНК, вступление в реакцию наблюдения клетке, возбуждение 2-аминопурин флуорофора и сбор сигнала флуоресценции с течением времени. Сбор не менее 5 кинетической следов для получения высококачественных данных и сохраните файл.
- Если эксперимент завершится, поворот лампы. Вымойте шприцы и наблюдения кювете с водой, как описано выше. Затем выключите остальное оборудование, за исключением оборотной воды ванны. Вода циркулирует за дополнительные 15 минут для охлаждения лампы.
- Math операции и данные установки могут быть выполнены с помощью программного обеспечения KinTek себя, для того, чтобы получить представление о том кинетики реакции в ходе эксперимента. Дальнейший анализ также может быть выполнена путем усреднения нескольких кинетической следы и сохранения и экспорта файлов усредненные другим данным анализа / графическое программное обеспечение.
4. Представитель результаты MSH2-Msh6 связывания ДНК кинетики
Кинетические данные для MSH2-Msh6 взаимодействия с G: T несоответствие ДНК, может быть пригодным к одной показательной функцией и выход быстро обязательные константы скорости К на около 3 х 10 7 М-1 сек-1 (рис. 4) и медленные константа диссоциации к ВЫКЛ 0,012 второй -1 (рис. 4, б), который показывает, что MSH2-Msh6 связывает G: T несоответствия быстро и образует очень стабильный комплекс с периодом полураспада около 60 секунд 13.
Б. Измерение MSH2-Msh6 АТФазы Кинетика
1. Подготовка образцов для MSH2-Msh6 эксперимент АТФазы кинетики
- Подготовка MSH2-Msh6 и ДНК реагенты, как описано выше, с использованием немеченого ДНК. Кроме того, очистить фосфат связывающий белок (PBP) от E. палочки и назовите его с флуорофора MDCC (рис. 5) 14,15. MDCC-PBP связывает свободные фосфат быстро (к ON равна 1 х 10 8 М -1 второй -1) и с высоким сродством (К D = 100 нм), что приводит к резкому увеличению MDCC флуоресценции (рис. 6). MDCC-PBP Поэтому надежная корреспондент предварительно устойчивом состоянии гидролиз АТФ и фосфатов релиз кинетики 14,15. Обратите внимание, что крайне важно, чтобы свести к минимуму фон фосфатов для этого теста, поэтому использование стекла должна быть строго избегать на всех этапах приготовления реагентов.
- Подготовка образца с 4 мкМ MSH2-Msh6 белка с или без 6 мкМ G: T ДНК, что дает 2 мкм и 3 мкМ конечные концентрации в одном смешивания экспериментировать с 1:01 смешивания. Обратите внимание, что предварительно устойчивое состояние эксперименты требуют высокой концентрации фермента, так как сигнал интересов с одного оборота или первые несколько каталитических обороты. Подготовка другого образца, содержащего 1 мМ недавно растворенного АТФ и 20 мкМ MDCC-PBP репортер. Добавить 0,10 ед / мл пуриновых нуклеозидов фосфорилазы и 200 мкМ 7-methylguanosine для образцов, которая служит для зачистки любые загрязняющие фосфата. Инкубируйте образцы на льду в течение по крайней мере 20 минут (табл. 2).
2. Инструмент подготовки к MSH2-Msh6 АТФазы кинетики
- Подготовка остановил поток инструментом для экспериментов, как описано выше. Кроме того, зачистить фосфатов загрязнителем из дисковода шприцы с 0,5 ед / мл пуриновых нюcleoside фосфорилазы и 200 мкМ 7-methylguanosine течение 20 минут. Установить длины волны возбуждения до 425 нм и использовать 450 нм отсечки фильтра с ФЭУ для обнаружения MDCC-PBP флуоресценции.
3. MSH2-Msh6 АТФазы эксперимента и анализа данных
- Загрузите диск шприцы с образцами, как описано выше. Нажмите на сбор данных для смешивания MSH2-Msh6 с АТФ и MDCC-PBP и контролировать фосфат-релизе MSH2-Msh6 и связанной увеличение MDCC-PBP флуоресценции с течением времени. Сбор не менее 5 кинетической следы получить высокое качество набора данных и сохраните файл. Средняя кинетическая несколько следов и экспорта файлов данных для анализа.
- Подготовка калибровочной кривой для определения линейной зависимости между концентрацией фосфата и MDCC-PBP флуоресценции. Для того, чтобы сделать это, смешать MDCC-PBP с различным содержанием фосфатов в тех же экспериментальных условиях в остановили поток, и измерить максимальное MDCC-PBP флуоресценции при каждой концентрации фосфатов.
- Участок максимального MDCC-PBP флуоресценции по сравнению с каждой концентрации фосфатов для калибровочной кривой (рис. 7) и использовать наклон для получения концентрации фосфатов в MSH2-Msh6 реакций. Участок концентрации фосфатов в зависимости от времени и подобрать данные, которые экспоненциальной и линейной функции. Эта функция описывает взрыв предварительно устойчивом состоянии гидролиз АТФ и фосфатов релиз следуют линейной устойчивое фазовое состояние реакции.
4. Представитель результаты MSH2-Msh6 АТФазы кинетики
Кинетические данные показывают, что MSH2-Msh6 гидролизует АТФ и освобождает фосфат быстро на 1,4 второй -1 в первый каталитический оборота. Эта фаза сопровождается медленным шагом в реакцию, которая ограничивает последующие обороты, чтобы в 7 раз медленнее устойчивый к кошке состоянием 0,2 секунды -1 (рис. 8А). Однако, когда MSH2-Msh6 обязан несоответствие ДНК, взрыв гидролиз АТФ и фосфатов релиз подавлено, а MSH2-Msh6 остается в АТП-связанном состоянии в течение более длительного времени.

Рисунок 1. Очистка С. CEREVISIAE MSH2-Msh6 от E. палочки. MSH2 и Msh6 гены были клонированы в вектор pET11a и более выраженным в E. кишечной BL21 (DE3) клеток. Белкового комплекса очищали колоночной хроматографией на SP-сефарозе, гепарин, и Q-сефарозе смол. SDS-PAGE анализа показано здесь содержатся белковые фракции с Q-сефарозой колонке.
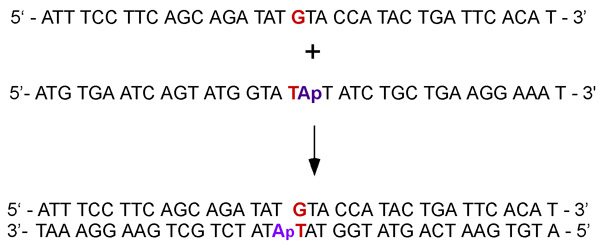
. Рисунок 2 Дополнительные одноцепочечных ДНК, отжига для формирования дуплекса, содержащего G: T несовпадение с соседними аденозин (АТФ-азы для экспериментов) или 2-аминопурин флуоресцентные аналоговой базе аденозина (для связывания ДНК экспериментов).
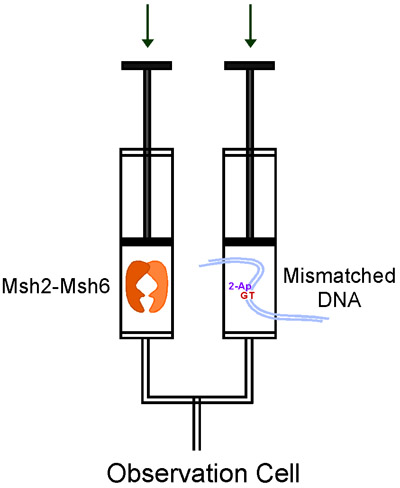
Рисунок 3. Поток реагентов в KinTek остановил поток в течение одного смешивания эксперимента.

Рисунок 4а Кинетика MSH2-Msh6 взаимодействия с G:. Т несоответствие. Смешивание дуплекса ДНК (0,12 мкм), содержащие G: T, прилегающих к 2-аминопурин с MSH2-Msh6 (0,8 мкм) приводит к увеличению флуоресценции с течением времени, и дает бимолекулярной константы скорости к ВКЛ = 2,4 10 7 М -1 с -1 для взаимодействия.
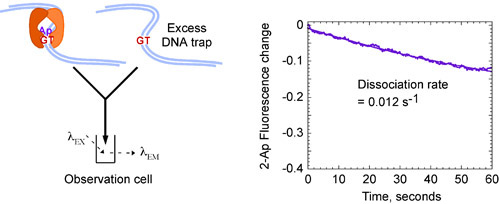
На рисунке 4б Кинетика MSH2-Msh6 взаимодействия с G:. Т несоответствие. Смешивание предварительно сформированных MSH2-Msh6 G: T (2-Ар) комплекса с избытком немеченого G: T ДНК (8 мкм), что ловушки любой свободный MSH2-Msh6 приводит к снижению флуоресценции с течением времени, и дает медленный темп константа диссоциации, А OFF = 0,012 с -1, что указывает на стабильный комплекс с длинным периодом полураспада ~ 60 секунд. Заключительные концентрации: 0,4 мкМ MSH2-Msh6, 0,06 мкМ меченых ДНК, 4 мкМ немеченого G: T ДНК ловушку.
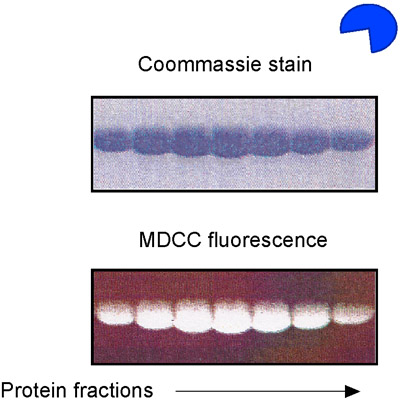
Рисунок 5. MDCC-PBP подготовки. SDS-PAGE анализа E. кишечной фосфат связывающий белок (PBP), очищают и помечены MDCC флуорофора.
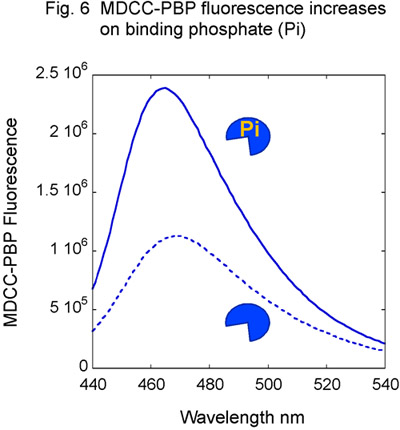
Рисунок 6. MDCC-PBP ответ на фосфаты. Титрование MDCC-PBP с фосфата (Pi) приводит к увеличению флуоресценции MDCC.

Рис 7а. Подготовка фосфата (Pi) стандартной кривой. MDCC-PBP (20 мкМ) смешивается с разным количеством Pi (0 - 8 мкм)г флуоресценции измеряли в течение долгого времени, пока не будет достигнуто равновесие. Заключительные концентрациях: 10 мкМ MDCC-PBP, 0 - 4 мкМ Pi.
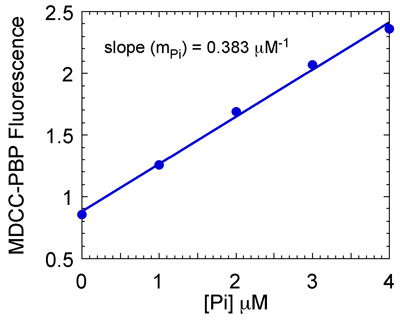
Рисунок 7b. Подготовка фосфата (Pi) стандартной кривой. Максимальная MDCC-PBP флуоресценции построена по сравнению с [Pi] для получения стандартной кривой. Наклон линии (0,383 мкМ -1 в данном случае) используется для преобразования MDCC-PBP флуоресценции в концентрационные Pi.
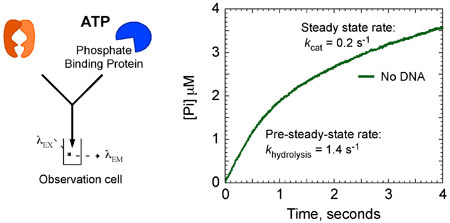
На рисунке 8а. MSH2-Msh6 АТФазы кинетики. MSH2-Msh6 (4 мкм), при отсутствии G: T ДНК, смешанные быстро с АТФ (1 мМ) и MDCC-PBP (20 мкМ) экспонатов взрыв гидролиз АТФ и Pi релизе. Анализ данных дает скорость (к гидролизу = 1,4 с -1) и амплитуды (2 мкМ; 1 сайт в MSH2-Msh6) всплеска фазе, за которой следует линейная, устойчивое фазовое состояние в размере 0,4 мкм с - 1 (к кошке = 0,2 с -1).
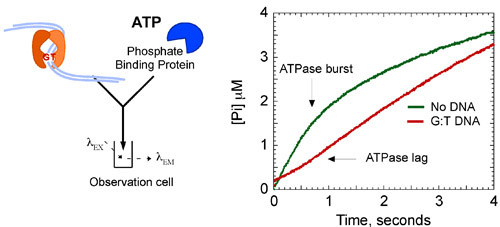
На рисунке 8б. MSH2-Msh6 АТФазы кинетики. Добавление G: T ДНК для реакции (6 мкМ) подавляет взрыв гидролиза АТФ, стабилизации комплекса в АТП-связанном состоянии. Заключительные концентрациях: 2 мкМ MSH2-Msh6, 500 мкМ АТФ, 3 мкМ ДНК, 10 мкМ MDCC-PBP. Кинетики съемки пригодны по следующей формуле: [Pi] = 0 е-к т + Vt, где [Pi] является концентрация фосфатов, 0, всплеск амплитуды, к-наблюдаемую скорость взрыв постоянный и V-скорость линейной фазовой характеристикой (к кошке = V / [MSH2-Msh6]).
| Образец | Белок | ДНК | ||||
| Реагент | Акции | Рабочий | Том, мкл | Акции | Рабочий | Том, мкл |
| MSH2-Msh6 | 5 мкМ | 0,8 мкМ | 64 | - | - | - |
| 2ApG: T | - | - | - | 10 мкМ | 0,12 мкм | 4,8 |
| буфер | 10x | 1x | 40 | 10x | 1x | 40 |
| DDH 2 O | - | - | 296 | - | - | 355 |
| Общий | 400 | 400 | ||||
Таблица 1 реакции связывания ДНК
| Образец | Белок | Белок-ДНК | ATP | ||||||
| Реагент | Акции | Рабочий | Том, мкл | Акции | Рабочий | Том, мкл | Акции | Рабочий | Том, мкл |
| MSH2-Msh6 | 20 мкМ | 4 мкМ | 80 | 20 мкМ | 4 мкМ | 80 | - | - | - |
| G: T | - | - | - | 100 | 6 | 24 | - | - | - |
| ATP | - | - | - | - | - | - | 50 мМ | 1 мМ | 8 |
| 7-MEG | 250x | 1x | 1,6 | 250x | 1x | 1,6 | 250x | 1x | 1,6 |
| PNPase | 100x | 1x | 4 | 100x | 1x | 4 | 100x | 1x | 4 |
| PBP-MDCC | 150 мкМ | 20 мкМ | 53,3 | 150 мкМ | 20 мкМ | 53,3 | - | - | - |
| Буфер | 10x | 1x | 40 | 10x | 1x | 40 | 10x | 1x | 40 |
| DDH 2 O | - | - | 221 | - | - | 197 | - | - | 346 |
| Общий | 400 | 400 | 400 | ||||||
Таблица 2 АТФазы реакции
Обсуждение
Примером несоответствия ДНК связывающего белка, описанные здесь иллюстрирует силу и полезность переходных кинетических методов для изучения механизмов биологических молекул. Остановлено потока измерений на единой шкале времени оборота при условии, однозначно указывает на быстрое ?...
Благодарности
Эта работа была поддержана премии NSF КАРЬЕРА (MMH), Барри М. Голдуотера стипендий (FNB) и ASBMB бакалавриат исследований (УХО). Клона более-выражение PBP был любезно предоставлен д-р Мартин Уэбб (MRC, Великобритания).
Материалы
| ДНК имя | Последовательность |
| 37 G | 5'-ATT TCC TTC AGC AGA ТАТ G TA ОСО TAC TGA TTC ACA T -3 ' |
| 37 т (2-Ар) | 5'-ATG TGA УВД АГТ ATG GTA Т Ар Т УВД ТГК TGA AGG AAA T -3 ' |
| 37 Т | 5'-ATG TGA УВД АГТ ATG GTA Т Т УВД ТГК TGA AGG AAA T -3 ' |
Ссылки
- Johnson, K. A. Advances in transient-state kinetics. Curr Opin Biotechnol. 9 (1), 87-89 (1998).
- Johnson, K. A. E. . Kinetic analysis of macromolecules. , (2003).
- Obmolova, G., Ban, C., Hsieh, P., Yang, W. Crystal structures of mismatch repair protein MutS and its complex with a substrate DNA. Nature. 407 (6805), 703-710 (2000).
- Lamers, M. H. The crystal structure of DNA mismatch repair protein MutS binding to a G x T mismatch. Nature. 407 (6805), 711-717 (2000).
- Warren, J. J. Structure of the human MutSalpha DNA lesion recognition complex. Mol Cell. 26 (4), 579-592 (2007).
- Kunkel, T. A. &. a. m. p. ;. a. m. p., Erie, D. A. . DNA Mismatch Repair. Annu Rev Biochem. 74, 681-710 (2005).
- Jiricny, J. The multifaceted mismatch-repair system. Nat Rev Mol Cell Biol. 7 (5), 335-346 (2006).
- Hsieh, P., Yamane, K. DNA mismatch repair: Molecular mechanism, cancer, and ageing. Mech Ageing Dev. 129 (7-8), 391-407 (2008).
- Jacobs-Palmer, E., Hingorani, M. M. The effects of nucleotides on MutS-DNA binding kinetics clarify the role of MutS ATPase activity in mismatch repair. J Mol Biol. 366 (4), 1087-1098 (2007).
- Antony, E., Khubchandani, S., Chen, S., Hingorani, M. M., M, M. Contribution of Msh2 and Msh6 subunits to the asymmetric ATPase and DNA mismatch binding activities of Saccharomyces cerevisiae Msh2-Msh6 mismatch repair protein. DNA Repair (Amst). 5 (2), 153-162 (2006).
- Antony, E., Hingorani, M. M. Mismatch recognition-coupled stabilization of Msh2-Msh6 in an ATP-bound state at the initiation of DNA repair. Biochemistry. 42 (25), 7682-7693 (2003).
- Finkelstein, J., Antony, E., Hingorani, M. M., O'Donnell, M. Overproduction and analysis of eukaryotic multiprotein complexes in Escherichia coli using a dual-vector strategy. Anal Biochem. 319 (1), 78-87 (2003).
- Zhai, J., Hingorani, M. M. S. cerevisiae Msh2-Msh6 DNA binding kinetics reveal a mechanism of targeting sites for DNA mismatch repair. Proc Natl Acad Sci U S A. 107 (2), 680-685 (2010).
- Brune, M., Hunter, J. L., Corrie, J. E., Webb, M. R. Direct, real-time measurement of rapid inorganic phosphate release using a novel fluorescent probe and its application to actomyosin subfragment 1 ATPase. Biochemistry. 33 (27), 8262-8271 (1994).
- Brune, M. Mechanism of inorganic phosphate interaction with phosphate binding protein from Escherichia coli. Biochemistry. 37 (29), 10370-10380 (1998).
- Antony, E., Hingorani, M. M. Asymmetric ATP binding and hydrolysis activity of the Thermus aquaticus MutS dimer is key to modulation of its interactions with mismatched DNA. Biochemistry. 43 (41), 13115-13128 (2004).
- Gradia, S., Acharya, S., Fishel, R. The human mismatch recognition complex hMSH2-hMSH6 functions as a novel molecular switch. Cell. 91 (7), 995-1005 (1997).
- Mazur, D. J., Mendillo, M. L., Kolodner, R. D., D, R. Inhibition of Msh6 ATPase activity by mispaired DNA induces a Msh2(ATP)-Msh6(ATP) state capable of hydrolysis-independent movement along DNA. Mol Cell. 22 (1), 39-49 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены