Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Application des méthodes Kinetics stopped-flow pour étudier le mécanisme d'action d'une protéine réparation de l'ADN
Dans cet article
Résumé
MSH2-MSH6 est chargé d'initier la réparation des erreurs de réplication de l'ADN. Nous présentons ici une approche transitoire vers la compréhension de la cinétique comment cette protéine essentielle fonctionne. Le rapport illustre stopped-flow expériences pour mesurer la liaison à l'ADN et de la cinétique couplé ATPase sous-jacente MSH2-MSH6 mécanisme d'action en réparation de l'ADN.
Résumé
Transient analyse cinétique est indispensable pour comprendre le fonctionnement des macromolécules biologiques, car cette approche donne des informations mécanistiques et notamment les concentrations site actif et les constantes de vitesse intrinsèques qui régissent la fonction macromoléculaires. Dans le cas des enzymes, par exemple, des mesures transitoires Etat ou de pré-stable identifier et de caractériser les épreuves individuelles de la voie de réaction, alors que les mesures que l'état d'équilibre rendement global d'efficacité catalytique et la spécificité. Les épreuves individuelles telles que les protéines-protéines ou interactions protéine-ligand et de limitation de vitesse des changements de conformation se produisent souvent dans les délais milliseconde, et peuvent être mesurés directement par stopped-flow et aux produits chimiques étancher les méthodes d'écoulement. Etant donné un signal optique comme la fluorescence, stopped-flow est un outil puissant et accessible pour les progrès de la réaction de surveillance de liaison du substrat à la sortie du produit et de 1,2 roulement catalytique.
Nous rapportons ici l'application de stopped-flow cinétiques de sonder le mécanisme d'action de MSH2-MSH6, une protéine ADN eucaryote réparation qui reconnaît paires de bases inadéquations et d'insertion / délétion boucles dans l'ADN et de réparation des mésappariements signaux (ROR) 3-5. Ce faisant, MSH2-MSH6 augmente la précision de la réplication de l'ADN par trois ordres de grandeur (fréquence d'erreur diminue à partir de ~ 10 -6 à 10 -9 bases), et contribue ainsi à préserver l'intégrité du génome. Sans surprise, défectueux humaine MSH2-MSH6 fonction est associée à un cancer du côlon héréditaire sans polypose et d'autres cancers sporadiques 6-8. Afin de comprendre le mécanisme d'action de cette protéine ADN métaboliques critique, nous étudierons la dynamique de MSH2-MSH6 interaction avec l'ADN ne correspondent pas ainsi que l'activité ATPase qui alimente ses actions dans le ROR. Liaison à l'ADN est mesurée par le mélange rapide MSH2-MSH6 avec l'ADN contenant un 2-aminopurine (2-Ap) fluorophore à côté d'un G: T mismatch et le suivi de l'augmentation résultante de la 2-aminopurine de fluorescence en temps réel. L'ADN de dissociation est mesurée par le mélange de pré-formé MSH2-MSH6 G: T (2-Ap) complexes décalage avec l'ADN piège sans étiquette et la diminution de surveillance de la fluorescence au cours du temps 9. Pré-constante cinétique de l'ATPase État sont mesurés par le changement de fluorescence de 7-diéthylamino-3-((((2-maléimidyle) éthyl) amino) carbonyl) coumarine) protéine marquée Phosphate Binding (MDCC-PBP) sur le phosphate de liaison ( Pi) publié par MSH2-MSH6 suivantes hydrolyse de l'ATP 9,10.
Les données révèlent contraignantes rapide de MSH2-MSH6 à un G: Incompatibilité T et formation d'une longue durée de vie MSH2-MSH6 G: T complexes, ce qui entraîne à son tour dans la suppression de l'hydrolyse de l'ATP et la stabilisation de la protéine sous une forme liée à l'ATP . La cinétique de la réaction de fournir un soutien clair à l'hypothèse que l'ATP lié MSH2-MSH6 signaux réparation de l'ADN sur la liaison d'une paire de base ne correspondent pas à la double hélice.
F. Noah Biro et Jie Zhai contribué à ce document également.
Protocole
A. Mesure de MSH2-MSH6 ADN cinétique de liaison
1. La préparation des échantillons pour l'expérience cinétique de MSH2-MSH6 liaison à l'ADN
Préparation des réactifs pour une expérience de fluorescence basée sur l'ADN cinétiques contraignante sur un stopped-flow est similaire à celle d'une expérience d'équilibre sur un fluorimètre. En effet l'analyse d'équilibre contraignant devrait être effectuée en premier afin d'estimer la constante de dissociation (K D) pour l'interaction en vue d'optimiser les conditions de réaction pour l'analyse cinétique. Stopped-flow expériences nécessitent de grandes quantités de matériaux biologiques par rapport aux expériences d'équilibre ou état stationnaire, par conséquent, l'approche est plus faisable quand faibles quantités milligramme de protéine sont disponibles 11,12 et des quantités similaires de ligands peuvent être préparés ou achetés.
- Nous sur-expriment S. cerevisiae MSH2-MSH6 dans E. coli et purifier des quantités milligramme de la protéine par chromatographie échangeuse d'ions (Fig. 1) 11.
- Réactifs ADN avec ou sans le fluorophore 2-aminopurine peuvent être synthétisés chimiquement. Nous achetons 37 nucléotides de longueur ADN simple brin modifié avec la 2-aminopurine et recuit deux brins complémentaires pour préparer l'ADN en duplex avec 2-aminopurine adjacent à un G: Incompatibilité T (Fig. 2). L'ADN peut être purifié par le fabricant ou en laboratoire par électrophorèse sur gel dénaturant de polyacrylamide, ce dernier donne généralement des rendements plus élevés.
- Pour la cinétique de fixation d'ADN, de préparer séparés G: T (2-Ap) de l'ADN et des échantillons de protéines MSH2-MSH6 dans un tampon de liaison à l'ADN (20 mM Tris-HCI, pH 8,0, MgCl2 5 mM, NaCl 100 mM). MSH2-MSH6 et des concentrations d'ADN sont 0,8 uM et 0,12 uM, respectivement, ce qui donne 0,4 uM et 0,06 uM concentrations finales en une seule expérience avec un mélange 1:1 de mélange. Pour l'ADN cinétique de dissociation, de préparer un échantillon contenant 0,8 uM MSH2-MSH6 et 0,12 uM G: T (2-Ap) de l'ADN, et un autre échantillon de 8 uM non étiquetés G: l'ADN T comme un piège pour MSH2-MSH6 gratuitement. Préparer et conserver les échantillons sur glace. Dans ces réactions, la concentration de protéines est bien au-dessus des 10 nM K D pour MSH2-MSH6 ADN interaction et la concentration en ADN est suffisante pour un signal de fluorescence robuste (déterminée empiriquement). Un volume de 400 ul par échantillon est suffisant pour obtenir environ 10 traces cinétique (tableau 1).
- Utiliser des produits chimiques de haute qualité qui sont exempts d'impuretés fluorescentes dans les protéines, l'ADN, et les préparatifs de mémoire tampon. Filtre tous les tampons à travers une membrane de 0,2 um pour éviter le colmatage de la stopped-flow avec des particules.
- Si le fluorophore absorbe la lumière visible, la préparation et l'expérience doit être réalisée dans des conditions de faible luminosité.
2. Instrument pour la préparation de MSH2-MSH6 cinétique de liaison à l'ADN
Un instrument stopped-flow est assez simple dans son principe. Il utilise un moteur d'entraînement de rapidement pousser deux solutions dans des seringues lecteur dans un dispositif de mélange, la solution mixte s'écoule ensuite dans une cellule d'observation pour la collecte des données (Fig. 3). Nous utilisons les KinTek stopped-flow, ce qui nécessite un volume d'échantillon faible, permet la détection simple ou séquentielle de mélange de réactifs, d'une variété de signaux optiques, et est très facile à utiliser. Stopped-flow instruments sont disponibles auprès de plusieurs autres fabricants aussi.
- Afin de préparer l'instrument stopped-flow pour des expériences, assurez-vous que l'ordinateur et le contrôleur sont éteints. Mettez le bain d'eau circulant mis à température ambiante (25 °; C) pour refroidir la lampe. Allumer la lampe. Réglez le monochromateur à la longueur d'onde d'excitation désiré (315 nm dans le cas de la 2-aminopurine). Tournez la roue fente pour la largeur de fente désirée (empiriquement d'excitation fluorophore solde élevé avec photoblanchiment faible). Mettez le contrôleur et l'ordinateur. Mettez le bain d'eau circulant à remplir la chemise d'eau qui maintient les réactifs à une température souhaitée pendant l'expérience (30 ° C dans le cas de S. cerevisiae MSH2-MSH6).
- Ensuite, exécutez le programme stopped-flow. Allumez le détecteur de choix, qui dans ce cas est un tube photomultiplicateur (PMT) avec un filtre d'interférence approprié pour le fluorophore (350 nm de coupure du filtre dans le cas de la 2-aminopurine). Appliquer la tension au PMT. Mesurer le courant d'obscurité pour corriger le bruit de fond électrique.
- Les seringues d'entraînement stopped-flow et la cellule d'observation doivent être lavés avant le chargement des échantillons. Régler la vanne de chargement de l'échantillon en position de chargement. Remplir une seringue 1ml avec déminéralisée, eau filtrée, l'attacher au port de chargement situé sous la seringue d'entraînement, et pousser manuellement de l'eau entre les deux seringues à quelques reprises. Répétez le processus deux fois pour chaque seringue d'entraînement pour être utilisés dans l'expérience. Ensuite, remplissez les seringues d'entraînement avec de l'eau pour laver la cellule d'observation. Placez la vanne de chargement de l'échantillon à la position FEU. Utilisez le lecteur seringue Ajustercommande, qui commande le moteur d'entraînement, et abaisser le plateau d'entraînement pour pousser l'eau à travers la cellule d'observation et dans la ligne de sortie. Prenez soin de ne pas pousser le piston jusqu'à la fin de la seringue d'entraînement. Soulevez le plateau d'entraînement. Mettez la vanne à la position de la charge. Manuellement laver les seringues avec le tampon de réaction et de laisser vide. L'instrument est maintenant prêt à utiliser.
3. MSH2-MSH6 ADN expérience de liaison et d'analyse de données
- Transférer chaque échantillon dans le tube à une nouvelle seringue de 1 ml. Attachez chaque seringue échantillon à un port de chargement et de pousser la solution dans la seringue d'entraînement. Prendre soin d'enlever toutes les bulles d'air en poussant manuellement la solution entre les deux seringues à quelques reprises avec pauses intermittentes. Abaissez le plateau d'entraînement jusqu'à ce qu'il touche le haut de la seringue d'entraînement. Laissez les réactifs s'équilibrer à température ambiante pendant quelques minutes.
- Pour la collecte de données, ouvrez le Set Time / fenêtre Couches, sélectionnez la collecte de données de canal (PMT), le mode d'analyse de données (fluorescence), et le nombre de traces (coups) d'être collectées. Entrez le temps de collecte de données au cours de laquelle 1000 points de données seront collectées. Une réaction inconnues doivent être surveillés sur plusieurs secondes afin de détecter toute phases lentes. Empiriquement estimer le temps nécessaire pour atteindre l'équilibre ou l'état d'équilibre et de temps de collecte de données pour mettre des vies ≥ moitié 6. Dans le cas de MSH2-MSH6 le délai optimal est de 2 secondes pour G: cinétique décalage T contraignant et 60 secondes pour G: T cinétique de dissociation. Maintenant, placez la valve à la position FASI et cliquez sur le bouton Collecter des données. Cette action lance le mélange de MSH2-MSH6 et de l'ADN, l'entrée de la réaction dans la cellule d'observation, l'excitation du fluorophore 2-aminopurine et la collecte du signal de fluorescence au cours du temps. Recueillir au moins 5 traces cinétiques d'obtenir des données de haute qualité et enregistrez le fichier.
- Lorsque l'expérience est terminée, mettez de la lampe. Lavez les seringues et les cellules d'observation avec de l'eau comme décrit précédemment. Ensuite, éteignez le reste de l'équipement, sauf pour le bain d'eau circulant. L'eau est distribuée pour 15 minutes supplémentaires pour refroidir la lampe.
- Opérations mathématiques et l'ajustement des données peut être réalisée avec le logiciel KinTek lui-même, afin d'avoir une idée de la cinétique de réaction pendant l'expérience. Une analyse plus poussée peut également être effectuée en calculant la moyenne de plusieurs traces cinétique et l'épargne et l'exportation du fichier en moyenne à d'autres analyses de données / logiciel graphique.
4. Des résultats représentatifs pour MSH2-MSH6 ADN cinétique de liaison
Les données cinétiques pour MSH2-MSH6 interactions avec G: mésappariements de l'ADN T, peut être adapté à une seule fonction exponentielle et donnent un rythme rapide liant k constante sur près de 3 x 10 7 M-1 seconde-1 (figure 4A) et une lente la dissociation constante k OFF de 0,012 secondes -1 (figure 4B), qui révèle que le MSH2-MSH6 lie un G: T discordance rapidement et forme un complexe très stable avec une demi-vie de près de 60 secondes 13.
B. Mesure de MSH2-MSH6 Kinetics ATPase
1. La préparation des échantillons pour l'expérience MSH2-MSH6 cinétique de l'ATPase
- Préparer MSH2-MSH6 et réactifs ADN tel que décrit précédemment, en utilisant l'ADN non étiquetés. En outre, les purifier des protéines Phosphate Binding (PBP) de E. coli et étiquette avec le fluorophore MDCC (fig. 5) 14,15. MDCC-PBP se lie rapidement sans phosphate (K sur est égal à 1 x 10 8 M -1 secondes -1) et avec une haute affinité (Kd = 100 nM), résultant en une augmentation spectaculaire de la MDCC fluorescence (Fig. 6). MDCC-PBP est donc un journaliste robuste de pré-état d'équilibre ATP hydrolyse et la libération de phosphate cinétique de 14,15. Notez qu'il est essentiel de minimiser les niveaux de phosphate de fond pour ce test, par conséquent, l'utilisation du verre doit être strictement évitée à toutes les étapes de la préparation des réactifs.
- Préparer un échantillon avec 4 uM MSH2-MSH6 protéines avec ou sans 6 uM G: T de l'ADN, ce qui donne 2 uM et 3 uM concentrations finales en une seule expérience avec un mélange 1:1 de mélange. Notez que les expériences de l'état de pré-régulière nécessitent des concentrations d'enzyme élevé depuis le signal d'intérêt est à partir d'un chiffre unique ou les quelques premiers chiffres d'affaires catalytique. Préparer un autre échantillon contenant 1 mM fraîchement dissous ATP et 20 uM MDCC-PBP journaliste. Ajouter 0,10 unités / ml de purine nucléoside phosphorylase et 200 uM 7-méthylguanosine aux échantillons, qui sert à éponger les phosphates contaminantes. Incuber les échantillons sur la glace pendant au moins 20 minutes (tableau 2).
2. Instrument pour la préparation de la cinétique de MSH2-MSH6 ATPase
- Préparation de l'instrument stopped-flow pour des expériences comme décrit précédemment. En outre, les éponger contaminant phosphate de l'entraînement des seringues avec 0,5 unités / ml purine nuphosphorylase cleoside et 200 uM 7-méthylguanosine pendant 20 minutes. Régler la longueur d'onde d'excitation à 425 nm et 450 nm utiliser un filtre de coupure avec le PMT pour la détection de MDCC-PBP fluorescence.
3. MSH2-MSH6 expérimentation ATPase et d'analyse de données
- Charger les seringues d'entraînement avec les échantillons comme décrit précédemment. Cliquez sur Recueillir des données pour mélanger MSH2-MSH6 avec l'ATP et la MDCC-PBP et la libération de phosphate moniteur en MSH2-MSH6 et de l'augmentation conjuguée de MDCC-PBP de fluorescence au cours du temps. Recueillir au moins 5 traces cinétiques d'obtenir une haute qualité ensemble de données et enregistrer le fichier. Moyenne des multiples traces cinétique et exporter le fichier de données pour analyse.
- Préparer une courbe d'étalonnage pour déterminer la relation linéaire entre la concentration de phosphate et MDCC-PBP fluorescence. Pour ce faire, mélangez-MDCC PBP avec différentes concentrations de phosphate dans les mêmes conditions expérimentales dans les stopped-flow, et mesurer au maximum MDCC-PBP fluorescence à chaque concentration de phosphate.
- Terrain au maximum MDCC-PBP fluorescence en fonction de chaque concentration de phosphate pour la courbe de calibration (Fig. 7) et utiliser la pente pour obtenir la concentration de phosphate dans les réactions MSH2-MSH6. Concentration de phosphate Terrain fonction du temps et ajuster les données d'une fonction exponentielle et linéaire. Cette fonction décrit un éclat de pré-état d'équilibre ATP hydrolyse et la libération de phosphate suivie par la phase de l'état d'équilibre linéaire de la réaction.
4. Des résultats représentatifs pour MSH2-MSH6 cinétiques ATPase
Les données cinétiques montrent que MSH2-MSH6 hydrolyse de l'ATP et de phosphate libère rapidement à 1,4 -1 secondes dans le premier chiffre d'affaires catalytique. Cette phase est suivie d'un pas lent dans la réaction que les limites de chiffres d'affaires suite à un 7 fois plus lent cat état stationnaire k de 0,2 secondes -1 (figure 8A). Toutefois, lorsque MSH2-MSH6 est lié à l'ADN ne correspondent pas, l'éclatement de l'hydrolyse d'ATP et la libération de phosphate est supprimée, et MSH2-MSH6 reste dans un état ATP en partance pour un temps plus long.

Figure 1. Purification de S. cerevisiae MSH2-MSH6 de E. coli. MSH2 et MSH6 gènes ont été clonés dans pET11a vecteur et sur-exprimé dans E. coli BL21 (DE3) des cellules. Le complexe protéine a été purifiée par chromatographie sur colonne de SP-sépharose, l'héparine, et Q-sépharose résines. Analyse SDS-PAGE montré ici contient des fractions protéiques provenant d'une colonne de Q-sépharose.
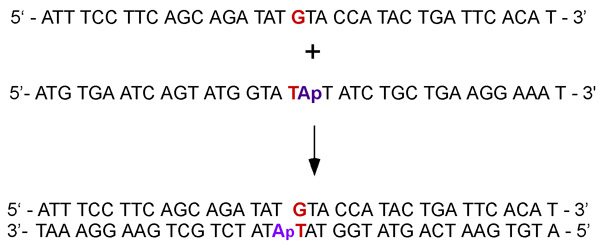
. Figure 2 complémentaire ADN simple brin sont recuits pour former un duplex contenant G: Incompatibilité avec un T adénosine adjacentes (pour les expériences de l'ATPase) ou 2-aminopurine analogiques de base fluorescente de l'adénosine (pour des expériences de liaison à l'ADN).
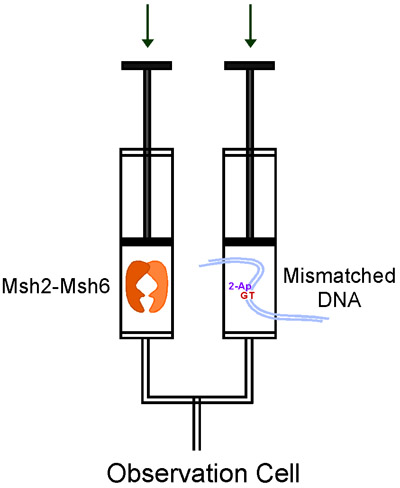
Figure 3. Flux des réactifs dans le KinTek stopped-flow au cours d'une seule expérience de mélange.

La figure 4a Cinétique de MSH2-MSH6 interaction avec un G:. Décalage T. Mélange de l'ADN double brin (0,12 M) contenant un G: à côté de la 2-aminopurine T avec MSH2-MSH6 (0,8 M) conduit à l'augmentation de la fluorescence au cours du temps, et donne une vitesse k bimoléculaire constante sur = 2,4 10 7 M -1 s -1 pour l'interaction.
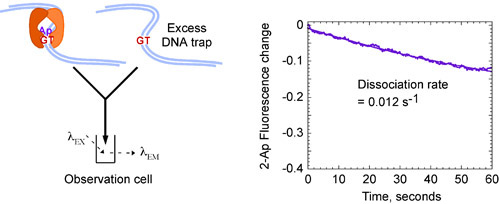
Figure 4b Cinétique de MSH2-MSH6 interaction avec un G:. Décalage T. Le mélange pré-formé MSH2-MSH6 G: T (2-Ap) avec un excès de complexes non étiquetés G: T l'ADN (8 uM) qui piège les sans-MSH2 MSH6 conduit à diminution de la fluorescence au cours du temps, et donne un rythme lent constante de dissociation, k OFF = 0,012 s -1, indiquant un complexe stable avec une longue demi-vie d'environ 60 secondes. Les concentrations finales: 0,4 uM MSH2-MSH6, 0,06 uM d'ADN marqués, 4 uM non étiquetés G: piège ADN-T.
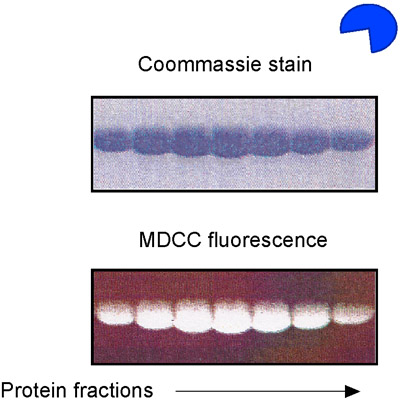
Figure 5. MDCC-PBP préparation. Analyse SDS-PAGE de E. protéines liant phosphate coli (PBP), purifié et marqué avec le fluorophore MDCC.
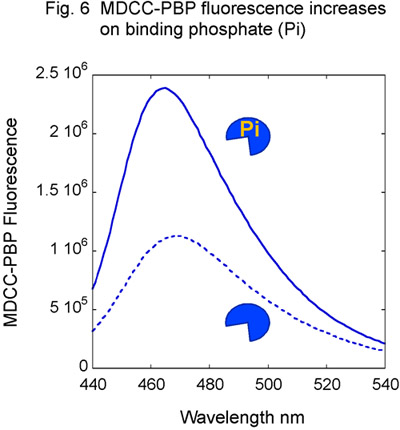
Figure 6. MDCC-PBP réponse à des phosphates. Le titrage de MDCC-PBP avec le phosphate (Pi) des résultats de la fluorescence MDCC croissante.

La figure 7a. Préparation du phosphate (Pi) standard courbe. MDCC-PBP (20 uM) est mélangé avec des quantités variables de Pi (0 - 8 uM) uned fluorescence mesurée au cours du temps jusqu'à ce qu'un équilibre soit atteint. Les concentrations finales: 10 uM MDCC-PBP, 0 - 4 Pi uM.
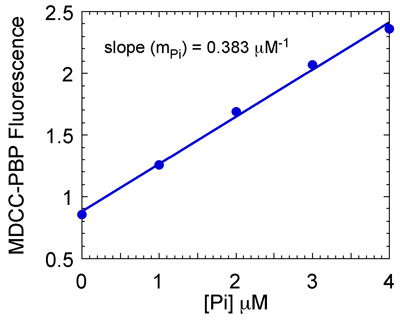
Figure 7b. Préparation du phosphate (Pi) standard courbe. Maximum MDCC-PBP fluorescence est tracée en fonction de [Pi] pour donner une courbe standard. La pente de la ligne (0,383 uM -1 dans ce cas) est utilisé pour convertir MDCC-PBP de fluorescence en concentration Pi.
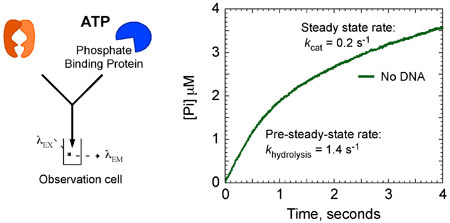
Figure 8a. MSH2-MSH6 cinétique de l'ATPase. MSH2-MSH6 (4 M), au sein du G absence: l'ADN T, mélangé rapidement avec l'ATP (1 mM) et MDCC-PBP (20 uM) présente une explosion de l'hydrolyse d'ATP et la libération Pi. L'analyse des données du taux de rendements (hydrolyse k = 1,4 s -1) et l'amplitude (2 uM; 1 site par MSH2-MSH6) de la phase de burst, qui est suivie par un linéaire, phase de l'état stationnaire à un taux de 0,4 s uM - 1 (k cat = 0,2 s -1).
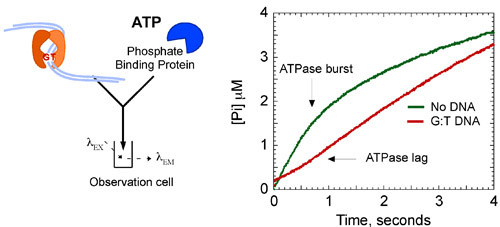
Figure 8b. MSH2-MSH6 cinétique de l'ATPase. L'addition de G: ADN-T à la réaction (6 M) supprime l'éclatement de l'hydrolyse de l'ATP, la stabilisation du complexe de l'ATP dans un état lié. Les concentrations finales: 2 uM MSH2-MSH6, 500 uM ATP, 3 ADN uM, 10 uM MDCC-PBP. Cinétique de Burst sont ajustés à l'équation suivante: [Pi] = A 0 e-k t + Vt, où [Pi] est la concentration de phosphate, un 0 est l'amplitude éclater, k est le taux observés éclatement constante et V est la vitesse de la phase linéaire (k cat = V / [MSH2-MSH6]).
| Exemple | Protéines | L'ADN | ||||
| Réactifs | Stock | De travail | Vol, uL | Stock | De travail | Vol, uL |
| MSH2-MSH6 | 5 uM | 0,8 uM | 64 | - | - | - |
| 2ApG: T | - | - | - | 10 pM | 0,12 uM | 4.8 |
| mémoire tampon | 10x | 1x | 40 | 10x | 1x | 40 |
| ddH 2 O | - | - | 296 | - | - | 355 |
| Total des | 400 | 400 | ||||
Tableau 1 réaction liaison à l'ADN
| Exemple | Protéines | Protéine-ADN | ATP | ||||||
| Réactifs | Stock | De travail | Vol, uL | Stock | De travail | Vol, uL | Stock | De travail | Vol, uL |
| MSH2-MSH6 | 20 pM | 4 pM | 80 | 20 pM | 4 pM | 80 | - | - | - |
| G: T | - | - | - | 100 | 6 | 24 | - | - | - |
| ATP | - | - | - | - | - | - | 50 mM | 1 mM | 8 |
| 7-MEG | 250x | 1x | 1.6 | 250x | 1x | 1.6 | 250x | 1x | 1.6 |
| PNPase | 100x | 1x | 4 | 100x | 1x | 4 | 100x | 1x | 4 |
| PBP-MDCC | 150 uM | 20 pM | 53,3 | 150 uM | 20 pM | 53,3 | - | - | - |
| Tampon | 10x | 1x | 40 | 10x | 1x | 40 | 10x | 1x | 40 |
| ddH 2 O | - | - | 221 | - | - | 197 | - | - | 346 |
| Total des | 400 | 400 | 400 | ||||||
Tableau 2 réaction ATPase
Discussion
L'exemple d'une protéine de liaison à l'ADN non-concordance décrit ici illustre la puissance et l'utilité des méthodes cinétiques transitoires pour étudier les mécanismes de molécules biologiques. Stopped-flow des mesures sur l'échelle de temps le chiffre d'affaires unique prévu preuves sans équivoque pour la liaison rapide et spécifique de MSH2-MSH6 protéine à une paire de base dépareillés et formation d'un complexe de longue durée protéine X de l'ADN dans la réaction...
Remerciements
Ce travail a été soutenu par une bourse de carrière NSF (MMH), un Barry M. Goldwater bourse (FNB) et une bourse de recherche de premier cycle ASBMB (MDC). Le clone d'une sur-expression de PBP a été aimablement fourni par le Dr Martin Webb (MRC, Royaume-Uni).
matériels
| Nom ADN | Séquence |
| 37 G | 5'-ATT CCT TTC CAG AGA TAT G TA CCA TAC TGA TTC ACA -3 T ' |
| 37 T (2-AP) | 5'-TGA ATC ATG AGT ATG GTA T Ap T ATC TGC ATG AGG AAA -3 T ' |
| 37 T | 5'-TGA ATC ATG AGT ATG GTA T A T ATC TGC ATG AGG AAA -3 T ' |
Références
- Johnson, K. A. Advances in transient-state kinetics. Curr Opin Biotechnol. 9 (1), 87-89 (1998).
- Johnson, K. A. E. . Kinetic analysis of macromolecules. , (2003).
- Obmolova, G., Ban, C., Hsieh, P., Yang, W. Crystal structures of mismatch repair protein MutS and its complex with a substrate DNA. Nature. 407 (6805), 703-710 (2000).
- Lamers, M. H. The crystal structure of DNA mismatch repair protein MutS binding to a G x T mismatch. Nature. 407 (6805), 711-717 (2000).
- Warren, J. J. Structure of the human MutSalpha DNA lesion recognition complex. Mol Cell. 26 (4), 579-592 (2007).
- Kunkel, T. A. &. a. m. p. ;. a. m. p., Erie, D. A. . DNA Mismatch Repair. Annu Rev Biochem. 74, 681-710 (2005).
- Jiricny, J. The multifaceted mismatch-repair system. Nat Rev Mol Cell Biol. 7 (5), 335-346 (2006).
- Hsieh, P., Yamane, K. DNA mismatch repair: Molecular mechanism, cancer, and ageing. Mech Ageing Dev. 129 (7-8), 391-407 (2008).
- Jacobs-Palmer, E., Hingorani, M. M. The effects of nucleotides on MutS-DNA binding kinetics clarify the role of MutS ATPase activity in mismatch repair. J Mol Biol. 366 (4), 1087-1098 (2007).
- Antony, E., Khubchandani, S., Chen, S., Hingorani, M. M., M, M. Contribution of Msh2 and Msh6 subunits to the asymmetric ATPase and DNA mismatch binding activities of Saccharomyces cerevisiae Msh2-Msh6 mismatch repair protein. DNA Repair (Amst). 5 (2), 153-162 (2006).
- Antony, E., Hingorani, M. M. Mismatch recognition-coupled stabilization of Msh2-Msh6 in an ATP-bound state at the initiation of DNA repair. Biochemistry. 42 (25), 7682-7693 (2003).
- Finkelstein, J., Antony, E., Hingorani, M. M., O'Donnell, M. Overproduction and analysis of eukaryotic multiprotein complexes in Escherichia coli using a dual-vector strategy. Anal Biochem. 319 (1), 78-87 (2003).
- Zhai, J., Hingorani, M. M. S. cerevisiae Msh2-Msh6 DNA binding kinetics reveal a mechanism of targeting sites for DNA mismatch repair. Proc Natl Acad Sci U S A. 107 (2), 680-685 (2010).
- Brune, M., Hunter, J. L., Corrie, J. E., Webb, M. R. Direct, real-time measurement of rapid inorganic phosphate release using a novel fluorescent probe and its application to actomyosin subfragment 1 ATPase. Biochemistry. 33 (27), 8262-8271 (1994).
- Brune, M. Mechanism of inorganic phosphate interaction with phosphate binding protein from Escherichia coli. Biochemistry. 37 (29), 10370-10380 (1998).
- Antony, E., Hingorani, M. M. Asymmetric ATP binding and hydrolysis activity of the Thermus aquaticus MutS dimer is key to modulation of its interactions with mismatched DNA. Biochemistry. 43 (41), 13115-13128 (2004).
- Gradia, S., Acharya, S., Fishel, R. The human mismatch recognition complex hMSH2-hMSH6 functions as a novel molecular switch. Cell. 91 (7), 995-1005 (1997).
- Mazur, D. J., Mendillo, M. L., Kolodner, R. D., D, R. Inhibition of Msh6 ATPase activity by mispaired DNA induces a Msh2(ATP)-Msh6(ATP) state capable of hydrolysis-independent movement along DNA. Mol Cell. 22 (1), 39-49 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon