Method Article
スライスの準備、器官組織培養と視交叉上核における時計遺伝子の活動のルシフェラーゼ記録
要約
成体マウス視床下部視交叉上核(SCN)、そして文化への迅速な方法器官培養条件下でのSCNの組織を含む準備スライス、の手順が報告されています。さらに、動的なルシフェラーゼレポーターの技術を使用して振動時計遺伝子のタンパク質発現の測定が記述されています。
要約
生理学と行動で毎日のリズムを調整する中心的な概日リズム(〜24時間)クロックは、視床下部前部にある視交叉上核(SCN)に存在する。クロックは、直接網膜と視神経を介して光によって同期化されます。概日振動は、 周期 ( 単位 )の遺伝子を含む、いわゆる"時計遺伝子"と、そのタンパク質産物の数、負のフィードバックループを相互作用によって生成されます。コアクロックはまた、膜の脱分極、カルシウムやキャンプ1に依存しています。 SCNは、時計遺伝子の発現、代謝活性と自発電気活動の毎日の振動を示しています。驚くべきことに、この内因性の周期的活動は、SCN 2-4の成体組織スライスに保持されます。この方法では、体内時計は簡単にペースメーカー機能の分子、電気生理学的及び代謝の研究を可能にする、in vitroで研究することができます。
SCNは、右の視交叉5の上方に位置する小規模な、よく定義された二国間の構造体です。ラットでは、それぞれの核に〜8.000ニューロンが含まれており、約947ミクロン(長さ、rostrocaudal軸)× 424μmの(幅)× 390μmの(高さ)6の寸法を有する。それは、SCNを識別することができる脳の特定のレベルでの脳のスライスをカットするために必要なSCNを分析する。ここで、我々は、マウスやラットの脳についても同様であるSCN、の解剖とスライスの手順を説明します。さらに、我々はどのように膜7、山崎らによってSCNの組織培養用に開発された技術上organotypically解剖組織培養に示す。8。最後に、我々は、動的なルシフェラーゼレポーターテクノロジー、もともとGeusz ら概測定に使用されたメソッドを使用して時計遺伝子/タンパク質の発現を測定するために使用する方法をトランスジェニック組織を示しています。9。 :我々はトランスジェニックノックインPERIOD2からSCN組織をここでを使用してください:。ユジンらが生成されるルシフェラーゼマウス10。マウスは、PERIOD(PER)の融合タンパク質を含んで2とホタルの酵素ルシフェラーゼ。ルシフェラーゼは、ルシフェリンの酸化を触媒するときにルシフェラーゼの基質の存在下で翻訳されている場合PER2、すなわちルシフェリン、PER2の発現を生物発光として監視することができます。放出されるフォトンの数は、積極的に生産さPER2蛋白質の量に相関し、そして生物発光リズムは生体 10 で PER2蛋白質のリズムと一致している。この方法ではPER2の発現の周期的な変動が継続的に多くの日中にリアルタイムに監視することができます。我々は組織培養とリアルタイムの生物発光のレコーディングに従うプロトコルは、徹底的に山崎と高橋11で記載されている。
プロトコル
1。ソリューションの準備
- 空気緩衝能力を含む培地
- 約800 mlの滅菌H 2 O(オートクレーブ処理ミリQ H 2 O)で1リットルボトルを埋める。
- 撹拌しながら、追加し、以下の物質を混ぜる:1コンテナ低グルコース、炭酸水素ナトリウムとせずに、無血清DMEM 2902粉末をフェノールレッド(フェノールレッドは、生物発光の信号に干渉する)、20mLのB27サプリメント50倍、7.5%のNaHCO 3の4.7 mLの解決策(または0.35グラムのNaHCO 3)、10mLのHEPES 1M、2.5mLのPenStrep 10,000 U / mLおよび3.5グラムのD -グルコース。成分が完全に溶解されるまで、メディアの話題を呼んでみましょう。
最終的な培地(1リットル)が含まれます:
1X DMEM、1 × B27サプリメント、4.2 mMの炭酸水素ナトリウム、10mMのHEPES、25 U / mlペニシリン、25 U / mlのストレプトマイシン、19 mMのD -グルコース。 - 減少または塩酸pHを高めるために、そして滅菌H 2 Oで1リットルにボリュームを起動するためにNaOHを使用して、7.2にpHを調整する
- H 2 O(減少浸透圧)またはD -グルコース(増加浸透圧)との浸透圧を調整します。浸透圧は285から315 mOsm / kgのでなければなりませんが、最適な範囲は300から310 mOsm / kgである。 5%以上培地を希釈してください。
- 無菌フード内でコーニング無菌真空濾過セットを(例えば2孔径0.22μmの持つ× 500 mL)を用いて培養液をフィルタ。 4℃で培地を保ち、アルミ箔を使用して、光から保護する。我々はメディアが3ヶ月以内に使用されていることをお勧めします。
- サプリメントとのハンクス平衡塩溶液(HBSS)緩衝液(カットスライス用)
- 〜600 mlの滅菌(オートクレーブ処理したミリQ)、H 2 Oで1リットルのガラスボトルを記入し、以下の物質に追加:100 mLのHBSS 10倍株を、10 mLのペニシリン-ストレプトマイシン10,000 U / mLの5 7.5パーセントNaHCO 3溶液の添加と10mLのHEPES 1M。
最終的な切削液が含まれます:
1 × HBSS、10mMのHEPES、4.5 mMの炭酸水素ナトリウム、100 U / mlペニシリンおよび100 U / mlのストレプトマイシン。 - pHをチェックし、必要に応じて、7.2にpHを調整し、滅菌H 2 Oで1リットルにボリュームを持ち出す
- 285から315 mOsm / kgのでなければ浸透圧を、確認してください。
- 4℃にHBSSを冷却HBSSバッファは、代謝をダウンさせ、組織の生存を維持するために、スライス/切断手順の実行中に(4℃)非常に寒さにする必要があります。
- 〜600 mlの滅菌(オートクレーブ処理したミリQ)、H 2 Oで1リットルのガラスボトルを記入し、以下の物質に追加:100 mLのHBSS 10倍株を、10 mLのペニシリン-ストレプトマイシン10,000 U / mLの5 7.5パーセントNaHCO 3溶液の添加と10mLのHEPES 1M。
2。カッティングや培養スライス前の準備
- 組織は、CO 2のない暖かい乾燥室で培養されています。文化の乾燥を避けるためには、グリースで皿に取り付けられたカバーガラスで封印する必要があります。この目的のために、シリコーン系真空グリースで5 mLシリンジを埋める。アルミ箔の小片でシリンジの先端をカバーし、それらをオートクレーブ。また、オートクレーブろ紙(手順をスライスする時に使用される)。
- 右の手順をスライスし、35ミリメートルシャーレのトップリングの表面に高圧蒸気滅菌真空グリースを塗布してください。各スライス培養のための別個のペトリ皿を準備します。
- 手順すべての非滅菌器具をスライス開始する前に、カミソリの刃、ビブラトームブレード、カバーガラスと他の材料は滅菌する必要がスライスと文化手順での使用。 70%エタノールですべての非滅菌装置を吹き付けます。培養前にUV露光少なくとも30分間滅菌フードに紫外線を備えた機器と油を塗ったシャーレを公開。
- 同時に、(それぞれの文化は1.2 mLをカウント、8の文化は、例えば10mLの培地を調製するため)空気緩衝培地でファルコンチューブに充填し、新鮮な融解ルシフェリン(0.1 Mのストック溶液、プロメガ社、マディソン、WI)を追加する(10μLルシフェリンを10mLの培地に、終濃度0.1mMの)。
- ルシフェリンは光に敏感であり、両方のストック溶液とルシフェリンを含む培地では、光から保護する必要があります。暗黒36から37℃の加熱室にルシフェリン-培地でファルコンチューブを置きます。適切な場合には、ルシフェリンは、切削時の培養皿に直接追加することができます。ルシフェリンが追加されていない場合は、ルシフェラーゼとルシフェリンため、組織からの信号がない間には光反応は存在しません。
- UV露光後、ビブラトームに滅菌ブレードを取り付けます。
3。 SCNスライス手順
次の手順では、C57/BL6マウス、通常は2〜4ヶ月歳、大人のスライスについて説明します。注意してください:カッティング手順だけでなく、夜間の動物の露光を、差動SCNの位相をリセットすることができます。実質的な位相が12手順により発生するシフトしない場合にこの問題を回避するには、切断および培養は、好ましくはZT 6月12日の間に、光の時間帯に実行する必要があります。 SCNは、暗闇でサンプリングする必要がある場合は、3.1および3.2は、光誘起位相シフトを避けるために、赤いライトや夜間のゴーグルで実行する必要があります。
- GLAのイソフルラン(バクスター)、好ましくは、マウスを麻酔SSチャンバー。動物はその痛みの反射を(足の爪でつまんで確認)が失われたが、まだ(可能な限り酸素供給を維持するために)呼吸が停止されていないときは、速やかにハサミまたは類似のペアで頭を刎ねる。
注意:これは動物の不安を促進することが報告されているが、一部の国ではCO 2曝露(高炭酸ガス血症)は、まだ、麻酔法として認められている。加えて、頸椎脱臼は断頭の前に必要となる場合があります。動物を安楽死するときにローカル立法に従ってください。 - SCNに損傷を与える可能性視神経の歪みと、さらに励起を防ぐためにハサミで頭から目を外します。
- まだ取り付けられ、側面に沿って頭蓋骨の両側に1つずつカット、皮膚を除去する(図1a)とハサミの素晴らしいペア(インスタンスアイリスはさみ用)を持つ2つのカットを行う、はさみを持つ最後の子宮頸脊椎動物をはずして、こうして作る取り外し可能な"蓋"。
- マイクロ骨鉗子ツール(微細な解剖ハサミをマウスでも使用できる)で頭蓋骨を開き、嗅球が見られるまで、すべての骨を削除してください。腹側SCN(図1b)をの損傷を防ぐために、ツールを使って脳を押し下げることはない、上向きに働く。
- 慎重に春のはさみを解剖細かいマイクロを使用して嗅球と半球間の視神経を切断。 SCNと破裂のスライスに損傷が発生することが視神経の延伸以来、神経が完全に切断されていることを確認します。
- 上下逆さまに頭を回し、そのまま脳に充填した容器(例えばガラスのペトリ皿≈10cm)の中に(まだ脳に接続されている場合、他の脳神経の視神経に尾切断する必要があるかもしれない)から落としてください脳の急速な冷却を可能にする50〜100 mLの冷HBSS。できれば2つの視神経は、(図1C)無傷のままである。脳が冷却されていることを確認するHBSS 30〜60秒で脳を保つ。
- スプーンまたは同様のを使用して(例えば、ガラスのペトリ皿の蓋が上下逆さま)無菌切断面に、冷えた脳、背側表面を置きます。冠状カットを準備するためには、このように小脳を除去し、大脳半球と小脳の間に無菌のかみそりの刃またはメスで切断直角を作る。
- vibroslicer /ビブラトームに属する乾燥したプラットフォーム上で瞬間接着剤を適用します。
- 吻側部に鋭い、湾曲鉗子を挿入して脳を(小脳なしと嗅球なし大脳半球)ピックアップし、慎重に、まだピンセットで脳を持って、滅菌ろ紙上にHBSSをふいて乾かす。 (代わりに鉗子を挿入する代わり、滅菌ろ紙の小片が脳を添付して転送するために使用することができます)。
- 吻側端の上方と切刃に最も近い腹側表面との接着されたプラットフォームの上に半球を修正。ビブラトーム(カムデンインスツルメンツ、英国からのインスタンスのため)に属する所有者にプラットフォームを接続し、すぐに冷たいHBSSでそれを埋める。垂直カットが適切に行われている場合は、半球は両側のSCNを含む冠状カットを作るために必要な良い角度を提供するので、まっすぐ上に立つべきである。
- ターゲットSCNの領域に到達するために、ビブラトームの高または最高速度で半球の厚いセクション(500〜800μm)を切り取り始める。ブレードを移動すると、視床下部に到達する前の初期段階で非常に高速になることができますが、視交叉が表示されたとき(振動刃と遅い動きの高い周波数は水平にスライスの生存率を高めることが、スライスの間に細胞の損傷を減少させる)遅くする必要があります。視交叉が大きくなる(広い)と前交連が小さくなると100μmとするセクションを減らします。 two SCNの原子核が現われ始めるまで、半ばSCNのセクションを取得するために、(尾方向)自分自身"ダウン"働く。虫眼鏡は、核を可視化するために必要となる場合があります。ご注意:ラットの脳に比べてマウスの脳内のSCNは、視交叉のより尾側に位置しています。
- SCNの希望するレベルに到達したとき(SCNは、この時点では、より多くの定義として現れる円形またはアーモンド形の構造になります。図1dは、約マウス13、ブレグマのSCNの中心領域のためのブレグマ- 0.46 -0.70 MM -ラット14 0.92 - -1.40 mm)は、SCNのセクション(図1E)をカット。スライスの適当な厚さは、マウス250 ±50μm程度です。ラット350 ±50μmのために。
- 柔らかいブラシを使用して、解剖顕微鏡またはステレオスコープの下に配置冷HBSSで満たされた中規模のペトリ皿、から蓋にSCNのスライスを持ち上げて、転送する。二国間のSCNがはっきりと表示されている場合倍率で確認してください。 SCNの中間領域が(必ずしも唯一の"最適な"スライスレベルとなるが、我々が考えていることがスライス手順を標準化し、ばらつきを減らすために最も簡単な方法である場合があります)が選択される場合、それは明らかに、少なくともで見られるべきであるの片側スライスのセクション。カットがあまりにも吻側だった場合、別のセクションを作成し、倍率でSCNを確認してください。
4。器官SCNの文化
- HBSSで満たされたペトリ皿の蓋では、解剖顕微鏡下で滅菌外科用メスのペアを持つ正方形の組織(〜1.5ミリメートルの各側)として二国間のSCNをばらばらにする。視交叉の小片は、外植片に接続されたままになりますが、他の核を入れるべきではありません。 SCNの組織を削除せずにできるだけ近いカット。
- 計画的な実験に適している場合、二国間のSCNは、2つの片側のSCNを取得するために半分にカットすることができます。一側性化SCNは、制御(図2A)として使用することができます。
- ≈35ミリメートルシャーレにルシフェリン-培地の1200μLを記入し、液面(2B)の上に文化の膜(ミリCM0.4μmの、ミリポア、ベッドフォード、MA)を置きます。培地の量は、培養細胞膜は培養皿ではなく、媒体11のフロートや岩の基部にしっかりと座る必要として、非常に重要です。膜の下に気泡がないことを確認します。ルシフェリンを扱うときに不要な光の露出を避けてください。
- 外植片は、ピックアップに小さいと難しいです。したがって、1000μLピペット+ティップ先端にSCNの外植片を吸うと、膜のそれを押すようにしてください。植が容易に1000μLピペットチップ(例えば、ラットのSCN、およびマウス二国間SCN)に収まるには大きすぎる場合には先端が広い開口部を作成するための滅菌ツールで切断されることがあります。ピペットと膜に過度のHBSSを捨てる。記録管は、皿から放出される全ての光子を検出し、別の組織からの信号を区別していないとしてルシフェラーゼ録音のために、1つだけのSCN /皿(図2b)を置きます。
- カバーガラス(≈40ミリメートル、メンツェル- Glaser氏、ドイツ)と真空グリース(ダウコーニング社製、米国)11で料理をシール。シールが(図2C)タイトであることを確認してください。されていない場合は、より多くのグリースで密封する。
- 36〜37℃の遮光チャンバーに料理を移し、すぐにPMT -録音を開始します。
5。録音の生物発光によるルシフェラーゼ活性の測定
小さいSCNの組織からのルシフェラーゼ誘導性生物発光シグナルが検出され、光タイトチャンバ内に取り付けられたphotonmultiplier -チューブ(PMT)検出器のアセンブリで増幅されています。光電子増倍管は通常、〜1〜2センチメートル培養皿8の上方に配置されている。 PMTのレコーディングのセットアップは、カスタムメイドまたは11市販されていることができます。
- PMT(光電子増倍管から発生する熱は、カバーガラスに結露が削除されます)の下に皿を置き、チャンバーを閉じます。チャンバーは、(20未満光子/分)SCNの組織のために使用される光電子増倍管の暗計数として遮光100%が非常に低い場合であることを確認してください。光電子増倍管でも最も弱い光の漏れを検出する。
- ソフトウェア(; Actimetrics社、ウィルメット、イリノイ州、米国のインスタンスLumiCycle用)で行われるデータ収集を、開始します。光子数は、遺伝子/タンパク質発現の高解像度を得るために10から10分間隔で統合されています。
- ClockLab、Actimetrics; LumiCycle、Actimetrics社、クロノ、Roennebergティル、ミュンヘン大学、記録が完了した後、遺伝子/タンパク質の得られる概日発現は、適切なソフトウェア(起源、OriginLabの、ノーサンプトン、マサチューセッツ、米国で分析することができます位相、周期(1サイクルの時間)とリズムの振幅を決定するためにミュンヘン、ドイツ)。遺伝子やタンパク質のピーク発現は、主に基準点として使用され、1サイクルの間に最高の光子の数として定義されています。データは、信号/雑音比が低い場合は特に、位相、周期と振幅の解析前に平滑化することができます。ベースラインは時々変更し、解析が実行される前に減算する必要があります。
6。代表的な結果:
ここでは、振動PER2を提示::LUCの発現を培養組織の実行可能性と条件を読み出すように。組織は、PER2、生きている場合、最適条件下では、と::図3に示すように、LUCの発現は、概日リズムを発振します。 SCNにおけるPER2は、最大限Zeitgeber時間12月13日(:暗サイクルZT 12は12時12時間の光の照明を消し表す)の周りに典型的に表現されます。生きている組織はサイズが大きく、より高い光子数は次のようになります。しかし、organotypically培養組織の大きさと厚さが厚く500μmより7 15 MM 2 11より大きくはなく、好ましくは、組織が 使用不可能に保つために小さな値にすべきである。組織がホモ接合PER2からサンプリングされている場合SCNは、ここで説明するように切開した場合、通常は10.000-40.000/minの間に光子のカウントを示しています::LUCの動物。器官SCN培養における振動の振幅は、次のサイクルと比較して、最初のサイクル中に典型的には非常に高いです。最初のサイクルが非常に高いamplitを持っている理由は全く明らかではないUDE。一つの可能な説明は、組織中の細胞の大部分がこのように最初のサイクル後にルシフェリンを利用していない、最初の切断および培養直後に死ぬかもしれないということです。カットの手順では、また最初のサイクルでルシフェラーゼ信号を増幅することが過度の興奮を引き起こすことがあります。
図3は、SCNのスライスからの発光の痕跡を示しており、最初は健康的ではなかったスライスから得られた一方のトレース(赤)が含まれています。デッドオア不健康な組織は、低い光子カウントベースラインを持っている。 (さらに、死んだ組織がしばしば皿で解離と一体で膜から削除することはできません。)
このレポートで説明する手法は有益薬理学的実験に使用することができます。図4は、我々はHCNチャネル遮断薬(ZD7288、10μM)で1日目と2の間に治療を受けたことの文化からのトレースを示しています。図に見られると、15以前に公開することができるように、ブロッカーが大幅PER2の概日振動の振幅を減少しますが、通常の培養液で洗い流し後、発振がブロッカーは分子時計が影響を受けたことを示している、戻ってきた組織は生存可能で健康的だった。
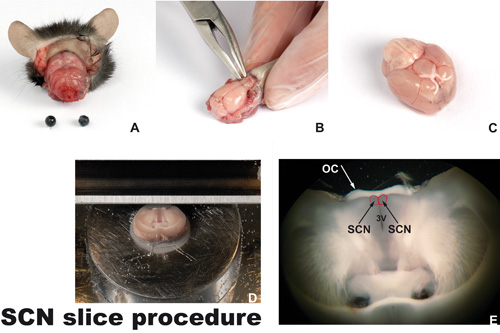
図1。手順をスライスする
A)削除された目や皮膚に安楽死首を切らマウスの頭が。B)頭蓋骨は、マイクロ骨鉗子ツールを使用して削除されます。ツールを使用する場合、一つは上向きに働くとツールを使って脳を下に押してはいけません。C)脳が逆さまに示すように、(上腹側)嗅球なし。 twoそのまま視神経と白の視交叉を見ることができます。視交叉上核(SCN、赤でマークされた境界線が)近くに視交叉に位置しています。vibroslicerのプラットフォームに接続されたD)coronallyカット脳、SCNのレベルで。E)冠状脳切片(250μm厚)視交叉(OC)、第三脳室(3V)と二国間の視交叉上核(SCN)を含む。

図2。器官組織培養。
A)スライスから解剖two一方的なSCNの原子核(挿入)が示すようにB)文化膜、培地及び植片が、真空グリースとカバーガラスなしで培養皿(35ミリのシャーレ)。培地(1.2 mL)をシャーレと膜の間に液体として見ることができます。一一方的なSCNの核を培養膜上に配置されます。小さ な組織の最も白い部分は、視交叉(インサート)の一部です。C)の膜とそのSCNの組織培養皿は、真空グリースと円形カバーガラスで封止した。
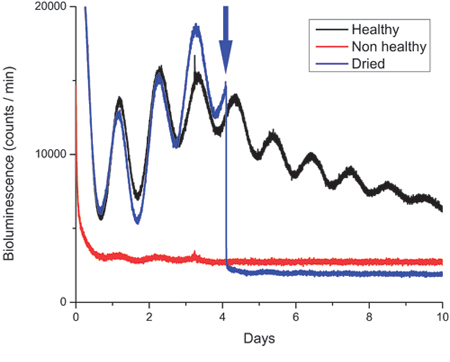
図3。健康と非健康なSCNの組織培養物からの生物発光の録音。
PERIOD2の生物発光の記録の例::ルシフェラーゼ(PER2::LUC)12Hで開催されたマウスから得られた視交叉上核(SCN)スライスの表現:12時間ライト:暗サイクル。 PER2::LUCのタンパク質は、タンパク質の最大発現がZeitgeber時間12月13日に発生する概日(〜24時間)の変動と発振します。このように、遺伝子のリズムの位相は、犠牲にする前に動物が保管された光暗いスケジュールに依存しています。通常は、プロトコルで説明されているように解剖一方的なSCNの組織からの生物発光は〜10.000-40.000/minute間に光子のカウントを示しています。図は、1つの健康(黒)SCNの文化、一つの非健康なSCNの文化(赤)と4日目に密封された培養皿を開いた後に(青)を乾燥し、適切に皿を再シール一つではなくSCN培養物からのトレースを示しています( )の矢印で示されます。
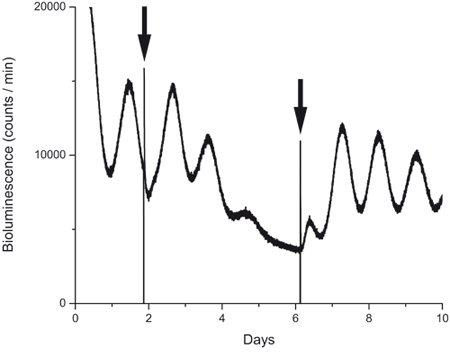
図4。薬物暴露中および後の生物発光の記録。
PER2::前、中およびHCNチャネル遮断薬(ZD7288、10μM)の処置後の培養でLUCの発現。最初の矢印は、ブロッカーが追加された時刻を示します。つ目の矢印は、エアコンのコントロール培地で培地を含有する薬剤を置き換えることによって作られたウォッシュアウトを、示している。薬物暴露、4日目での発振の欠如とウォッシュアウト後のタンパク質のリズムの迅速な回復の2日後に減少した振幅に注意してください。
ディスカッション
ルシフェラーゼレポーターの技術を持つメリットとデメリット
昼間の勉強するために多くの異なる時点(サンプリング周波数に応じて、通常2-4時間の低時間分解能を与える)で組織採取を必要とするin situハイブリダイゼーション及びウエスタンブロットで 、このようなRT - PCRなどのex vivoでの方法とは対照的に、遺伝子と蛋白質の表現の変化、ルシフェラーゼレポーター技術は、高解像度(1-10分)と同じ準備で何日も概日振動の研究をすることができます。したがって、使用する動物の数は最小限に抑えられ、リズムの位相と周期への影響の詳細な研究は、通常、低時間分解能と、従来のサンプリング技術を利用可能ではない、実現可能である。しかし、リズムの相対的な振幅の測定が可能であるが、それはレポーター技術は定量的でないため、転写された遺伝子または翻訳されたタンパク質の量を測定するために使用することができないことが強調されるべきである。
組織の記録は、器官SCNの文化は成人の脳の長期的な(週)薬理学的操作を可能に開始し、直ちに培養、直接生体内光誘起位相シフトなどで 、 生体のストレスでの分子の影響を研究するための大きな利点の後に分析することができます無傷の成熟したシナプスのネットワークとルシフェラーゼレポーターの技術を含む組織は、何週間も安定した記録が可能になります。したがって、組織が健全な文化を得るために新生児または出生後早期にする必要はありません、と急性スライス慢性の薬理学的治療とは対照的に行うことができます。エピジェネティックな変化が検討される場合はないゲノムへのDNAの取り込みにつながるか細胞培養におけるプラスミド - レポータートランスフェクション、とは対照的に、トランスジェニックルシフェラーゼ - 動物モデル(だけでなく、レンティ-ウイルスのトランスフェクション)が良好である。それはこの文脈でも発光イメージングは、レコーディングにも概日リズムを研究の主要な研究室によって利用される単一のSCNのニューロン(〜60から10ミクロン)や他の細胞型、許されるように、高感度CCDカメラ11で、今日可能であることが述べられるべきである。最後に、いくつかの概日研究者は、一般的に時計遺伝子/蛋白質の振動16-19を勉強するために、そのような緑色蛍光タンパク質として、他のレポーターを用いた分子の発現のモニタリングを使用してください。
スライス厚の側面
必要に応じて、ここで推奨SCNのスライス(200〜300ミクロン)の厚さが減少または増加させることができた。組織の文化の中で数日後に膜に平坦化するが、しかし、、それは組織7の実行可能性を維持するために最初にカットスライスの500μmの厚さを超えることは推奨されません。が100μmよりも薄いスライスは取り扱いが困難機械的および実際的な理由からです。 SCNの組織が不均質であるため、SCN(例えば、"シェル"と"コア"、と背比べ腹側の領域)内の異なる領域が異なる位相で振動するので、スライスの厚さは、ルシフェラーゼの出力信号の位相に影響を及ぼす可能性がありますフェーズの後に20と差動再同期は、21をシフト。より多くの組織は、光子の大きい数を発するので、スライスの厚さも光子数のベースラインに影響を与えます。分子振動の振幅は、このように間接的に植の大きさによって影響を受ける可能性があります。これらの理由から、制御と処理培養物は、常に同じ大きさ、厚さであることと同じ位相で、同じ振幅で発振するために、SCNの同じ領域を含む必要があります。 two一方的な核は、その一方で、ビブラトームカットが順番に小脳と二つの半球の間に切断分離が垂直であることに依存している水平方向と(角度がない限り、お互いにと同様の振幅と位相で振動するテーブルの表面に)。 SCNの培養を行う研究者は、SCNの文化は互いに位相で発振しないことが発生する可能性があります。練習とスライシング技術の標準化、スライスは常にSCNの同じrostro -尾レベルでカットされている、すなわち、結果が改善されます。
重要なステップ
- 酸素供給は重要です。
脳は酸素22の多くを必要とするため、スライシング手続きは迅速である必要がある(3.1から3.10に近い、より良い、それが組織を健康に保つためにある〜5-6分です)。 - SCNは、温度変化や培地交換に敏感です。
SCNは、温度に敏感であり、大きな温度変化は、位相ペースメーカーをシフトし、実験的なアーティファクト23を引き起こす可能性があります。培地やソリューションは、培養中の数日後に薬を適用するなどの継続的な実験、、培地またはsolutio中に交換または追加される場合nは、さらに前に36〜37 ° C(チャンバー内と同じ温度)に事前に温める必要があります。培地交換を伴う薬理学的実験では、それは常に事前にエアコンの細胞培養培地と連携することが重要です。さらに/新鮮な、無条件の培地でアウト洗浄は、潜在的に分子のSCNのリズム24だけでなく、他の細胞型の培養25を位相シフトすることができます。 - 培地組成物。
正しいpH及び浸透圧の文化組織をすることが重要です。空気緩衝培地はpHが6.8から8.2の範囲で最適なバッファ容量を持ち、細胞の呼吸の結果として発生する可能性のあるpHの変化をバッファリングするためにも適切であるHEPESが大量に含まれています。 HEPESは、一方、として培地中に少量に含まれている炭酸水素ナトリウム、と比較して温度変化に対して敏感です。重炭酸ナトリウムは、CO 2雰囲気下でこのように適切な低いpH(5.1〜7.1)範囲26内のより大きな緩衝能力を持っています。しかし、空気緩衝培地(DMEM 2902)に重炭酸ナトリウムの量を増加が大幅に浸透圧を増加させると同時に培地、アミノ酸、ビタミンおよびイオンの不正確な組成のターン結果に含めます。希釈することなく追加することができます。
培地を調製するためのアドバイス:- 媒体とを混合する際、正確なと注意してください。
- だけ新鮮か新鮮解凍したストック溶液を使用してください。
- 非常に高い浸透圧の場合には、希釈する価値はありません。以上の5から6パーセントに希釈した培地は、ほとんどの場合動作しません。それが低すぎる場合浸透圧を高めるために、D -グルコースを使用してください。
- フェーズは準備時間に起因するシフト
スライス標本の時間は非常に重要です。スライスの手順はZT 6月12日12の間に実行された場合、位相でゼロまたは最小限の効果が得られる。すべてのスライスの解離は、準備の間の位相変動に起因する誤差を最小化するために、日周または概日周期の同位相で実行する必要があります。
実行可能な変更
- スライスが開始する前に酸素(95%O 2、5%CO 2)で飽和バッファー、急性SCNの電気生理学の場合、スライスはリンガー(ACSF人工脳脊髄液)で実行する必要があります。さらに、酸素は、電気とシナプス活動は、酸素の電源22に直接依存しているとして、全体のスライス手順の実行中にバッファに連続して追加する必要があります。
- 水平方向と矢状スライスは正常に準備し、SCNを培養することができる。著者は、我々の経験によるとコロナのカットと比較して低い振幅で概日振動を与える水平スライスにおけるルシフェラーゼの録音と経験を、持っている。
- SCNはrostro - 尾側に長さ約1mmであるとスライシング技術は、ここで説明する中央部にSCNのセクションを取得を対象としています。ただし、複数のSCNのセクションは、SCNの核のより吻側対尾側レベルでの概日遺伝子/タンパク質発現の調査を可能にする、マウスおよびラットの脳から得ることができる。
- さらに、若い動物、出生後の仔や胚からスライスの培養物は、また、調製することができる。非常に若い子犬の脳と頭蓋骨は非常に柔らかく、敏感であることに注意してください。さらに、視神経は薄いと十分に発達していないです。 SCNの領域が損傷していないように仔の脳を解剖する際はご注意ください。彼らは大きすぎるので、例えば、マイクロ骨鉗子のツールは、仔マウスの頭蓋骨を開くために使用することができます。ファインはさみは若い仔で軟部組織を切断するのに十分です。
- ここで説明するカバーガラスベースの培養技術は、単一SCNのニューロンでは、CCD / EM - CCDカメラを用いた画像の発光にも使用できます。
- 他の中枢神経系領域とトランスジェニックPER2から末梢器官組織::LUCの動物が容易にPER2として、分子振動の面で、得られる培養し、分析することができます::LUCの発現が他の組織の数にも多くの日のために発振し続けると細胞のタイプ10。これらの末梢組織のほとんどは、インスタンスの肝臓のために、生存のための膜を必要としないのではなく、直接媒体11を浴びて培養されています。により、切片にシフトその位相を注意してください、培養と培地交換はSCNと同じ原則に従っていない可能性があります。
意義
トランスジェニックマウスとラット系統(:mPER2:LUC、mPer1 - lucを8、10、27)でルシフェラーゼ酵素活性は、タンパク質や遺伝子発現のリズムを反映し、生物発光の記録によって評価することができる。ルシフェラーゼによって生成される生物発光は、微弱な信号を与えるが、バックグラウンド発光は、この方法が有利なこと、ゼロに近いです。また、ルシフェラーゼ分子は不安定で速やかに分解されるためにはpHはありません長期的な興奮照明28の間に表示される可能性難聴、。一緒に、これらのプロパティは、概日研究において非常に有利なルシフェラーゼレポーターの技術を作る長期的な実験を可能にする。
開示事項
謝辞
FONCICYT 000000000091984; Jeansson、セーデルストレームKönigska sjukhemmet、マーサLundqvistさんとシグルドOCHエルザの基礎この作品は、スウェーデンの医学研究評議会(K2009 - 75SX - 21028〜01 - 3、K2008 - 61X - 20700〜01 - 3)によって賄われていたGoljesミンヌ、および医学SLS - 95151のスウェーデンの社会。教授ジーンD.ブロック、UCLAは、感謝して原稿上で貴重なコメントで知られています。我々はビデオ顕微鏡を提供するための博士マイケルAndäng博士とヘレナJohard HCNチャネルブロッカーのため、教授とアブデルエルManiraに感謝する。
倫理的配慮:
動物のすべての実験はカロリンスカ研究所と"ストックホルムのノーラDjurförsöksetiska Nämnd"で定められたガイドラインおよび規制に準拠して行った。全ての動物実験は、動物へのあらゆる可能なストレスや不快感を最小限に抑える目的で行われます。
資料
| Name | Company | Catalog Number | Comments |
| B27 supplement 50x | Invitrogen | 17504-044 | |
| Cover glasses | Menzel-Glaser | 40#1 | ≈ 40 mm |
| Culture membranes | EMD Millipore | PICMORG50 | 0.4 μm |
| DMEM low glucose w/o phenol red | Sigma-Aldrich | D2902 | Powder for 1L |
| Filter paper | Whatman, GE Healthcare | 1003 055 | ≈ 55 mm |
| Filtration set | Corning | 431097 | Pore size 0.22 μmPolyethersulfone |
| Forceps | Allgaier Instrumente | 0203-7-PS | Dumant #7 |
| HEPES | Invitrogen | 15630-056 | 100 ml |
| HBSS 10x | Invitrogen | 14065-049 | 500 ml |
| NaOCH3 7.5% | Invitrogen | 25080-060 | 50 ml |
| Luciferin | Promega Corp. | E1602 | Beetle luciferin, potassium salt |
| Micro rongeur tool | Allgaier Instrumente | 332-097-140 | |
| PenStrep 10,000 U/ml | Invitrogen | 15140-122 | 100 ml |
| Petri dishes | Corning | 430165 | ≈ 35 mm |
| PMT | Hamamatsu Corp. | H9319-11MOD | |
| Disposable scalpels | Paragon | P503 | Size 11 |
| Vacuum filter | Fisher Scientific | 09-761-5 | |
| Vacuum grease | Dow Corning | 50 g | |
| Vibratome | Campden Instruments |
参考文献
- Welsh, D. K., Takahashi, J. S., Kay, S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Annu Rev Physiol. 72, 551-577 (2010).
- Green, D. J., Gillette, R. Circadian rhythm of firing rate recorded from single cells in the rat suprachiasmatic brain slice. Brain Res. 245, 198-200 (1982).
- Shibata, S., Oomura, Y., Kita, H., Hattori, K. Circadian rhythmic changes of neuronal activity in the suprachiasmatic nucleus of the rat hypothalamic slice. Brain Res. 247, 154-158 (1982).
- Groos, G., Hendriks, J. Circadian rhythms in electrical discharge of rat suprachiasmatic neurones recorded in vitro. Neurosci Lett. 34, 283-288 (1982).
- Moore, R. Y., Klein, D., Moore, R., Reppert, S. The suprachiasmatic nucleus and the circadian timing system. Suprachiasmatic nucleus--The mind's clock. , 13-15 (1991).
- Pol, A. N. V. a. n. d. e. n. The hypothalamic suprachiasmatic nucleus of rat: intrinsic anatomy. J Comp Neurol. 191, 661-702 (1980).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Yamazaki, S., Numano, R., Abe, M., Hida, A., Takahashi, R., Ueda, M., Block, G. D., Sakaki, Y., Menaker, M., Tei, H. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Geusz, M. E., Fletcher, C., Block, G. D., Straume, M., Copeland, N. G., Jenkins, N. A., Kay, S. A., RN, D. a. y. Long-term monitoring of circadian rhythms in c-fos gene expression from suprachiasmatic nucleus cultures. Curr Biol. 7, 758-766 (1997).
- Ko, C. H., Buhr, E. D., Siepka, S. M., Hong, H. K., Oh, W. J., Yoo, O. J., Menaker, M., Takahashi, J. S. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci U S A. 101, 5339-5346 (2004).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Yoshikawa, T., Yamazaki, S., Menaker, M. Effects of preparation time on phase of cultured tissues reveal complexity of circadian organization. J Biol Rhythms. 20, 500-512 (2005).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (1997).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1998).
- O'Neill, J. S., Maywood, E. S., Chesham, J. E., Takahashi, J. S., Hastings, M. H. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Hughes, A. T., Guilding, C., Lennox, L., Samuels, R. E., McMahon, D. G., Piggins, H. D. Live imaging of altered period1 expression in the suprachiasmatic nuclei of Vipr2-/- mice. J Neurochem. 106, 1646-1657 (2008).
- Zhang, D. Q., Zhou, T., Ruan, G. X., McMahon, D. G. Circadian rhythm of Period1 clock gene expression in NOS amacrine cells of the mouse retina. Brain Res. 1050, 101-109 (2005).
- Quintero, J. E., Kuhlman, S. J., McMahon, D. G. The biological clock nucleus: a multiphasic oscillator network regulated by light. J Neurosci. 23, 8070-8076 (2003).
- LeSauter, J., Yan, L., Vishnubhotla, B., Quintero, J. E., Kuhlman, S. J., McMahon, D. G., Silver, R. A short half-life GFP mouse model for analysis of suprachiasmatic nucleus organization. Brain Res. 964, 279-287 (2003).
- Nakamura, W., Yamazaki, S., Takasu, N. N., Mishima, K., Block, G. D. Differential response of Period 1 expression within the suprachiasmatic nucleus. J Neurosci. 25, 5481-5487 (2005).
- Davidson, A. J., Yamazaki, S., Arble, D. M., Menaker, M., Block, G. D. Resetting of central and peripheral circadian oscillators in aged rats. Neurobiol Aging. 29, 471-477 (2008).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81, 103-111 (1998).
- Burgoon, P. W., Boulant, J. A. Temperature-sensitive properties of rat suprachiasmatic nucleus neurons. Am J Physiol Regul Integr Comp Physiol. 281, 706-715 (2001).
- Nishide, S. Y., Honma, S., Honma, K. The circadian pacemaker in the cultured suprachiasmatic nucleus from pup mice is highly sensitive to external perturbation. Eur J Neurosci. 27, 2686-2690 (2008).
- Yoshikawa, T., Sellix, M., Pezuk, P., Menaker, M. Timing of the ovarian circadian clock is regulated by gonadotropins. Endocrinology. 150, 4338-4347 (2009).
- Kohn, R. A., Dunlap, T. F. Calculation of the buffering capacity of bicarbonate in the rumen and in vitro. J Anim Sci. 76, 1702-1709 (1998).
- Wilsbacher, L. D., Yamazaki, S., Herzog, E. D., Song, E. J., Radcliffe, L. A., Abe, M., Block, G., Spitznagel, E., Menaker, M., Takahashi, J. S. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc Natl Acad Sci U S A. 99, 489-494 (2002).
- Sellix, M. T., Currie, J., Menaker, M., Wijnen, H. Fluorescence/luminescence circadian imaging of complex tissues at single-cell resolution. J Biol Rhythms. 25, 228-232 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved