Method Article
Préparation Trancher, culture de tissus organotypiques et enregistrement de la luciférase de l'activité des gènes d'horloge dans le noyau suprachiasmatique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La procédure de préparation des tranches contenant les souris adulte hypothalamique suprachiasmatique noyau (SCN), et un moyen rapide de la culture des tissus SCN dans un état de culture organotypique, sont rapportés. En outre, la mesure de l'expression de la protéine horloge oscillatoires gènes en utilisant la technologie Dynamic rapporteur de la luciférase est décrite.
Résumé
Une centrale circadien (~ 24 h) coordonner l'horloge rythmes quotidiens dans la physiologie et le comportement réside dans le noyau suprachiasmatique (NSC), situé dans l'hypothalamus antérieur. L'horloge est directement synchronisé par la lumière via la rétine et du nerf optique. Oscillations circadiens sont générés par l'interaction des boucles de rétroaction négative d'un certain nombre de soi-disant «gènes de l'horloge» et leurs produits protéiques, y compris la période (Per) des gènes. L'horloge de base est également dépendante de dépolarisation de la membrane, le calcium et le camp 1. Le SCN indique oscillations quotidiennes de l'expression des gènes d'horloge, l'activité métabolique et activité électrique spontanée. Remarquablement, cette activité cyclique endogène persiste dans des tranches de tissu adulte du SCN 2-4. De cette façon, l'horloge biologique peut facilement être étudié in vitro, permettant d'enquêtes moléculaires, électrophysiologiques et métaboliques de la fonction de stimulateur cardiaque.
Le RCS est un petit, bien définis structure bilatérale situé juste au-dessus du chiasma optique 5. Chez le rat qu'il contient ~ 8.000 neurones dans chaque noyau et a des dimensions d'environ 947 um (longueur, axe rostrocaudal) x 424 um (largeur) x 390 um (hauteur) 6. Pour disséquer le SCN, il est nécessaire de couper une tranche de cerveau au niveau spécifique du cerveau où le SCN peuvent être identifiés. Ici, nous décrivons la procédure de dissection et tranchage du SCN, qui est semblable pour les souris et les cerveaux de rats. En outre, nous montrons comment la culture des tissus disséqués organotypically sur une membrane 7, une technique développée pour la culture de tissus SCN par Yamazaki et al. 8. Enfin, nous montrons comment les tissus transgéniques peuvent être utilisés pour mesurer l'expression des gènes de l'horloge / protéines en utilisant la technologie Dynamic rapporteur de la luciférase, une méthode qui était à l'origine utilisé pour les mesures du rythme circadien par la Geusz et al. 9. Nous avons ici l'utilisation des tissus de la SCN transgéniques knock-in période2:: souris luciférase produite par Yoo et al 10.. Les souris contiennent une protéine de fusion de PÉRIODE (PER) 2 et l'enzyme luciférase Firefly. Lorsque PER2 est traduit dans la présence du substrat de la luciférase, c'est à dire la luciférine, l'expression PER2 peut être contrôlé que lorsque la bioluminescence luciférase catalyse l'oxydation de la luciférine. Le nombre de photons émis est positivement corrélée à la quantité de protéine produite PER2, et les rythmes de bioluminescence adapté au rythme des protéines in vivo PER2 10. De cette façon, la variation cyclique de l'expression PER2 peuvent être surveillés en permanence en temps réel pendant plusieurs jours. Le protocole que nous suivons pour la culture des tissus et l'enregistrement de bioluminescence en temps réel a été minutieusement décrites par Yamazaki et Takahashi 11.
Protocole
1. Préparation de la solution
- Le milieu de culture avec de l'air-capacité tampon
- Remplir une bouteille de 1 litre avec environ 800 ml stériles H 2 O (autoclavés milliQ H 2 O).
- Tout en remuant, ajouter et mélanger des substances suivantes: 1 de glucose contenant faibles, DMEM sans sérum 2902 poudre sans bicarbonate de sodium et rouge de phénol (rouge de phénol interfère avec le signal de bioluminescence), 20 ml B27 complément 50x, 4,7 ml d'un 7,5% de NaHCO 3 solution (ou 0,35 g de NaHCO 3), 10 ml d'HEPES 1M, 2,5 mL Penstrep 10000 U / ml et 3,5 g de D-glucose. Laissez le support remuer jusqu'à ce que les ingrédients soient complètement dissous.
Le milieu final (1 litre) doit contenir:
1x DMEM, 1x B27 supplément, 4,2 mM NaHCO 3, 10 mM HEPES, 25 U / ml de pénicilline, 25 U / ml de streptomycine et 19 mM de D-glucose. - Ajuster le pH à 7,2, en utilisant du NaOH ou du HCl à diminuer pour augmenter le pH, et amener le volume à 1 litre avec H 2 O. stériles
- Ajustez l'osmolalité avec H 2 O (osmolalité diminution) ou D-glucose (osmolalité augmentation). L'osmolalité doit être comprise entre 285 à 315 mOsm / kg, mais la fourchette optimale est de 300 à 310 mOsm / kg. Ne pas diluer le support de plus de 5%.
- Filtrer le milieu de culture en utilisant Corning stériles ensembles de filtration sous vide (par exemple 2 x 500 ml avec la taille des pores de 0,22 um) dans une hotte stérile. Gardez le support en 4 ° C et le protéger de la lumière en utilisant du papier d'aluminium. Nous recommandons que le milieu est utilisé dans les 3 mois.
- Hank solution équilibrée sel (HBSS) tampon avec suppléments (pour les tranches de coupe)
- Remplir une bouteille verre de 1 litre avec ~ 600 ml stériles (autoclavés milliQ) H 2 O et d'ajouter les substances suivantes: 100 ml de HBSS stock de 10x, 10 ml de pénicilline-streptomycine 10000 U / ml, 5 ml d'un 7,5% solution de NaHCO 3 10 ml d'HEPES 1M.
La solution de coupe final contiendra:
1x HBSS, HEPES 10 mM, 4,5 mM NaHCO 3, 100 U / ml de pénicilline et 100 U / ml de streptomycine. - Vérifier le pH et, si nécessaire, ajuster le pH à 7,2 et porter le volume à 1 litre avec H 2 O. stériles
- Vérifiez l'osmolalité, qui doit être comprise entre 285 à 315 mOsm / kg.
- Refroidir le HBSS à 4 ° C. Le tampon HBSS doit être très froide (4 ° C) pendant le tranchage / coupe procédure afin de faire baisser le métabolisme et de préserver la viabilité des tissus.
- Remplir une bouteille verre de 1 litre avec ~ 600 ml stériles (autoclavés milliQ) H 2 O et d'ajouter les substances suivantes: 100 ml de HBSS stock de 10x, 10 ml de pénicilline-streptomycine 10000 U / ml, 5 ml d'un 7,5% solution de NaHCO 3 10 ml d'HEPES 1M.
2. Préparatifs Avant Tranches de coupe et la culture
- Les tissus sont cultivés dans une chambre chaude et sèche sans CO 2. Afin d'éviter le dessèchement des cultures doivent être scellés avec des lunettes couvercle attaché à la vaisselle à la graisse. Pour ce faire, remplissez seringues de 5 ml avec de la graisse sous vide à base de silicone. Couvrir les embouts de seringue avec de petits morceaux de papier d'aluminium et les autoclaves. En outre, l'autoclave papiers filtres (utilisé pendant le tranchage procédure).
- Juste avant le tranchage procédure, appliquer de la graisse à vide autoclavés sur la surface de la bague supérieure de 35 boîtes de Pétri mm. Préparer un plat à part de Pétri pour chaque culture tranche.
- Avant de commencer la procédure de tranchage tous les instruments non stériles, lames de rasoir, des lames vibratome, lunettes de couverture et autres matériels utilisés pour la procédure de tranche et la culture doivent être stérilisés. Vaporiser tout le matériel non stérile avec 70% d'éthanol. Exposer les instruments et les boîtes de Pétri graissé avec UV dans une hotte stérile pendant au moins 30 minutes d'exposition aux UV avant la culture.
- Dans le même temps, remplir un tube Falcon de milieu de culture de l'air-buffering (compter 1,2 ml de chaque culture; pour 8 cultures préparer ml de milieu par exemple 10) et ajouter fraîchement dégelé luciférine (0,1 M solution stock; Promega, Madison, WI) (10 à 10 uL luciférine ml de milieu; concentration finale 0,1 mM).
- La luciférine est sensible à la lumière et des solutions de stock à la fois et le milieu luciférine contenant doivent être protégés de la lumière. Placer le tube Falcon avec la luciférine-support dans un endroit sombre 36-37 ° C la chambre de chauffage. Le cas échéant, la luciférine peut aussi être ajouté directement dans les boîtes de culture au moment de la découpe. Si luciférine n'est pas ajouté, il n'y aura aucune réaction de la lumière entre la luciférase et la luciférine et donc pas de signal provenant du tissu.
- Après exposition aux UV, joindre une lame stérile à l'vibratome.
3. SCN Tranchage procédure
La procédure suivante décrit le tranchage des adultes, généralement 2-4 mois vieux, C57/BL6 souris. S'il vous plaît noter: la procédure de découpage, ainsi que l'exposition de lumière de l'animal pendant la nuit, peut différentielle réinitialiser la phase de la SCN. Pour éviter cela, le découpage et la culture doit être effectuée pendant les heures de lumière, de préférence entre ZT 6-12, où aucune phase substantielle des changements dus à la procédure de produire 12. Si SCN doit être échantillonnée dans l'obscurité, 3.1 et 3.2 doivent être effectuées à la lumière rouge ou avec des lunettes de nuit pour éviter les décalages de phase induite par la lumière.
- Anesthésier la souris de préférence par isofluorane (Baxter) dans une glass chambre. Lorsque l'animal a perdu ses réflexes douleur (vérifiez en pinçant avec les ongles dans la patte), mais n'a pas encore arrêté de respirer (pour maintenir un approvisionnement en oxygène le plus longtemps possible), rapidement décapiter la tête avec une paire de ciseaux ou similaire.
S'il vous plaît noter: dans certains pays CO 2 d'exposition (hypercapnie) est encore autorisée en tant que méthode d'anesthésie, bien qu'il ait été signalé à promouvoir l'anxiété des animaux. En outre, la dislocation cervicale peut être nécessaire avant la décapitation. S'il vous plaît suivez les législations locales en euthanasier les animaux. - Retirez les yeux de la tête avec des ciseaux afin d'éviter la fatigue et l'excitation encore des nerfs optiques, qui peuvent endommager le SCN.
- Si encore attaché, retirez les vertébrés dernière cervicale avec des ciseaux, enlever la peau (figure 1a) et faire deux coupes avec une belle paire de ciseaux (pour ciseaux à iris par exemple), une coupe de chaque côté du crâne sur les côtés, rendant ainsi amovible "couvercle".
- Ouvrez le crâne avec un outil de micro-rongeur (fine paire de ciseaux de dissection peut aussi être utilisé sur une souris) et enlever tous les os jusqu'à la bulbes olfactifs peuvent être vus. La hausse du travail, jamais pressant le cerveau avec l'outil, afin de prévenir tout dommage sur le SCN ventrale (Fig 1b).
- Découpez soigneusement le nerf optique entre les bulbes olfactifs et les hémisphères utilisant des micro fines disséquer des ciseaux à ressort. Assurez-vous que le nerf est complètement coupé depuis l'étirement du nerf optique peut entraîner des dommages dans le SCN et les tranches de rupture.
- Tournez la tête en bas et de laisser le cerveau intact tomber (si elle est encore attachée au cerveau, d'autres nerfs crâniens peuvent avoir besoin d'être coupés caudale du nerf optique) dans un récipient (par exemple un plat en verre de Pétri ≈ 10 cm) rempli avec 50-100 mL HBSS froid permettant un refroidissement rapide du cerveau. Idéalement, les deux nerfs optiques doit rester intacte (figure 1c). Gardez le cerveau dans les 30-60 secondes HBSS pour s'assurer que le cerveau est refroidi.
- Utilisez une cuillère ou similaires et le lieu du cerveau réfrigérés, surface dorsale haut, sur une surface de coupe stérile (par exemple un couvercle en verre boîte de Pétri à l'envers). Afin de préparer une coupe coronale, faire une coupe perpendiculaire avec des lames de rasoir stérile ou scalpels entre les hémisphères cérébraux et le cervelet, supprimant ainsi le cervelet.
- Appliquer la superglue sur la plateforme sèches appartenant à la vibroslicer / vibratome.
- Ramassez le cerveau (hémisphères cérébraux, sans le cervelet et sans bulbes olfactifs) en insérant un dièse, une pince courbe dans la partie rostrale et sécher soigneusement hors de la HBSS sur un papier filtre stérile, tenant toujours le cerveau avec la pince. (Au lieu d'insérer une pince, un petit morceau de papier filtre stérile peut être utilisé pour attacher et le transfert du cerveau).
- Fixer les hémisphères sur la plateforme collés avec la pointe vers le haut et la surface ventrale rostrale plus proche de la lame de coupe. Fixez la plate-forme dans le support appartenant à la vibratome (par exemple de Campden Instruments, Royaume-Uni) et immédiatement le remplir avec du HBSS froid. Si la coupe perpendiculaire est faite correctement, les hémisphères devraient tenir debout offrant ainsi un bon angle nécessaire pour faire une coupe coronale contenant le SCN bilatérales.
- Afin d'atteindre la zone cible de SCN, commencez couper des sections plus épaisses (500-800 um) des hémisphères à une vitesse élevée ou maximale du vibratome. Déplacement de la lame peut être assez rapide au début, avant d'atteindre l'hypothalamus, mais devrait être ralenti lorsque le chiasma optique devient visible (haute fréquence de la lame vibrante et le mouvement lent diminue horizontalement dommages cellulaires au cours de tranchage, augmentant ainsi la viabilité tranche). Réduire les sections à 100 um quand le chiasma optique devient plus grande (plus large) et la commissure antérieure devient plus petit. Afin d'acquérir une partie mi-SCN, le travail vous-même "bas" (direction caudale) jusqu'à ce que les deux noyaux SCN commencent à apparaître. Une loupe peut être nécessaire pour visualiser les noyaux. S'il vous plaît noter: le SCN dans le cerveau de la souris est située à plus caudale du chiasma optique par rapport au cerveau de rat.
- Lorsque le niveau souhaité de SCN a été atteint (SCN sera à ce point apparaissent comme plus définis, ronds ou en forme de structures d'amande; 1d Fig; environ Bregma-0,46 à -0,70 mm pour la région centre du SCN chez la souris 13, Bregma - 0.92 à -1.40 mm pour le rat 14), couper la section SCN (figure 1E). Épaisseur convenable de la tranche est pour la souris 250 ± 50 um; pour le rat 350 ± 50 um.
- Utiliser une brosse douce, l'ascenseur et le transfert de la tranche SCN à un couvercle d'une boîte de Pétri remplie de taille moyenne avec HBSS froid, placé sous un microscope à dissection ou stéréoscope. Vérifiez si le sous grossissement SCN bilatérale est clairement visible. Si le milieu de la région du SCN sera choisi (qui peut ne pas nécessairement être le seul niveau "optimal" tranche mais que nous considérons est la meilleure façon de normaliser la procédure de découpage et de réduire les variations), il devrait être clairement visible au moins sur un côté de lala section tranche. Si la coupe était trop rostrale, faire une autre section et vérifiez la SCN sous grossissement.
4. Culture organotypique SCN
- Dans le couvercle boîte de Pétri remplie de HBSS, disséquer le SCN bilatéraux comme un tissu carré (~ 1,5 mm de chaque côté) avec une paire de scalpels stériles sous un microscope à dissection. Un petit morceau du chiasma optique restera attaché à l'explant, mais pas d'autres noyaux devraient être inclus. Couper le plus près possible sans enlever les tissus du RCS.
- Le cas échéant de l'expérience prévue, le SCN bilatérale peut alors être coupé en deux pour obtenir deux SCN unilatérale. Un SCN unilatérale peut alors être utilisé comme contrôle (figure 2a).
- Remplissez 1200 uL de la luciférine-support dans un plat à ≈ 35 mm de Pétri et placer une membrane de la culture (Milli-CM 0,4 um, Millipore, Bedford, MA) sur le dessus de la surface du liquide (2b). Le volume milieu de culture est cruciale, car la membrane de la culture doit s'asseoir solidement sur la base de la boîte de culture, non pas flotter ou de roche dans le milieu 11. Assurez-vous qu'il n'ya pas de bulles d'air sous la membrane. Éviter l'exposition lumière inutile quand on travaille avec la luciférine.
- Les explants sont petites et difficiles à ramasser. Par conséquent l'utilisation d'une pipette 1000 uL + pourboire à sucer l'explant SCN dans la pointe et appuyez sur la membrane. Dans le cas de l'explant est trop grande pour s'intégrer facilement dans une pipette uL 1000 (SCN de rats, par exemple, et la souris SCN bilatéraux) de la pointe peut être coupé avec un outil stériles pour créer une ouverture plus large. Jeter HBSS excessive sur la membrane avec la pipette. Pour l'enregistrement de la luciférase, placer un seul SCN / plat (figure 2b) que les tubes d'enregistrement de détecter tous les photons émis par l'antenne et ne distinguent pas entre les signaux provenant de différents tissus.
- Sceller le plat avec un couvercle en verre (≈ 40 mm, Menzel-Glaser, Allemagne) et de la graisse à vide (Dow Corning Corp, USA) 11. Assurez-vous que le joint est serré (figure 2C). Si non, joint avec plus de graisse.
- Placer les boîtes dans une 36-37 ° C étanche à la lumière de chambre et de commencer PMT-enregistrements immédiatement.
5. Mesure de l'activité luciférase par bioluminescence enregistrement
Signaux de bioluminescence luciférase induite par le tissu de petites SCN sont détectés et amplifiés avec photonmultiplier tube assemblées détecteur (PMT) monté à l'intérieur d'une chambre étanche à la lumière. Les PMT sont normalement positionnés ~ 1-2 cm au-dessus des 8 boîtes de culture. Configurations d'enregistrement PMT peuvent être fabriqués ou qui sont disponibles dans le commerce 11.
- Placer le plat sous un PMT (la chaleur produite à partir de la PMT va supprimer la condensation sur le couvercle en verre) et fermer la chambre. Assurez-vous que la chambre est de 100% étanche à la lumière que le nombre de sombres de PMT utilisée pour les tissus SCN est très faible (moins de 20 photons / min). Le PMT détecter même les fuites les plus faibles de lumière.
- Démarrer l'acquisition de données, qui est réalisée avec le logiciel (pour LumiCycle exemple; Actimetrics Inc, Wilmette, Illinois, USA). Compte Photon sont intégrés sur des intervalles de 10 à 10 min pour obtenir la résolution élevée de l'expression des gènes / protéines.
- Après l'enregistrement est terminé, l'expression obtenue circadienne du gène / protéine peut être analysé avec un logiciel approprié (Origine, OriginLab, Northampton, MA, USA; ClockLab, Actimetrics; LumiCycle, Actimetrics Inc; Chrono, Till Roenneberg de l'Université de Munich, Munich, Allemagne) pour déterminer la phase, la période (le temps pour un cycle) et l'amplitude du rythme. Le pic de l'expression des gènes ou de protéines est surtout utilisé comme point de référence et est défini comme le nombre le plus élevé de photons pendant un cycle. Les données peuvent être lissés avant les analyses de la phase, la période et d'amplitude, surtout si le rapport signal / bruit est faible. La ligne de base, parfois des changements et doivent être soustraites avant les analyses sont effectuées.
6. Les résultats représentatifs:
Nous présentons ici l'PER2 oscillatoires:: expression LUC comme une lecture de la viabilité et l'état des cultures de tissus. Dans des conditions optimales, et si le tissu est vivant, le PER2:: expression LUC oscille avec un rythme circadien comme le montre la figure 3. PER2 dans le SCN est au maximum exprimé généralement autour de l'heure zeitgeber 12-13 (où 12 représente ZT feux éteints dans une 12:12 h lumière: obscurité de cycle). La plus grande taille le tissu vivant est élevé, plus le nombre de photons devient. Toutefois, la taille et l'épaisseur des tissus cultivés organotypically doit rester faible afin de maintenir le tissu viable, de préférence pas plus de 15 mm 2 11 et non plus épais de 500 um 7. Le SCN, si disséqué comme décrit ici, montre généralement compte photons entre 10.000-40.000/min si le tissu est prélevé à partir d'un PER2 homozygote:: animaux LUC. L'amplitude de l'oscillation dans les cultures organotypiques SCN est généralement très élevé durant le premier cycle par rapport aux cycles suivants. Il n'est pas très bien pourquoi le premier cycle a amplit très élevéUde. Une explication possible est qu'une partie importante de cellules dans les tissus peuvent mourir peu de temps après la coupe initiale et de culture, donc pas en utilisant la luciférine après le premier cycle. La procédure de coupe peuvent également provoquer une excitation excessive, ce qui pourrait amplifier le signal luciférase cours du premier cycle.
La figure 3 montre des traces de luminescence à partir de tranches SCN et contient une trace (en rouge) obtenues à partir d'un morceau qui n'était pas initialement en bonne santé. Tissus morts ou insalubres ont de faibles bases comptent photon. (En outre, les tissus morts souvent dissocier dans le plat et ne peuvent pas être retirés de la membrane en un seul morceau.)
La technique décrite dans ce rapport peuvent être avantageusement utilisées dans des expériences pharmacologiques. La figure 4 montre une trace d'une culture qui nous avons traité entre le jour 1 et 2 avec un bloqueur des canaux HCN (ZD7288, 10 uM). Comme on peut le voir sur la figure et tel que publié antérieurement 15, le bloqueur considérablement réduit l'amplitude de l'oscillation circadienne de PER2; cependant, après un lavage avec un milieu de culture normale de l'oscillation est revenu, prouvant que le bloqueur affecté l'horloge moléculaire, mais le tissus était viable et sain.
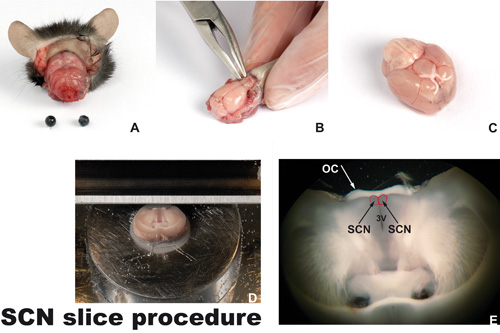
Figure 1. Tranchage procédure
A) La tête d'une souris euthanasiées décapité avec les yeux et la peau enlevée. B) Le crâne est enlevée avec un outil de micro-rongeur. Lorsque vous utilisez l'outil, il faut travailler à la hausse et jamais appuyer le cerveau avec l'outil. C) Le cerveau montre l'envers (face ventrale) sans bulbes olfactifs. Le chiasma optique blanche avec les deux intacts les nerfs optiques peuvent être vus. Le noyau suprachiasmatique (NSC, les frontières marqués en rouge) est situé à proximité du chiasma optique. D) Un cerveau coupé coronaire attaché à la plate-forme dans le vibroslicer, au niveau de la SCN. E) la section du cerveau coronale (250 um d'épaisseur) contenant le chiasma optique (CO), le troisième ventricule (3V) et les noyaux bilatéraux suprachiasmatique (NSC).

Figure 2. Culture de tissus organotypiques.
A) Les deux noyaux SCN unilatérale (insert) disséqué de la tranche indiquée. B) boîte de culture (35 mm boîte de Petri) avec membrane de la culture, à moyen et expiant, mais sans graisse à vide et le couvercle en verre. Le milieu (1,2 ml) peut être considérée comme liquide entre le plat et la membrane. Un noyau SCN unilatérale est placé sur la membrane de la culture. The Whitest partie du tissu de petites est un morceau du chiasma optique (insert). C) La boîte de culture avec sa membrane et son tissu SCN, scellé avec de la graisse à vide et un couvercle en verre rond.
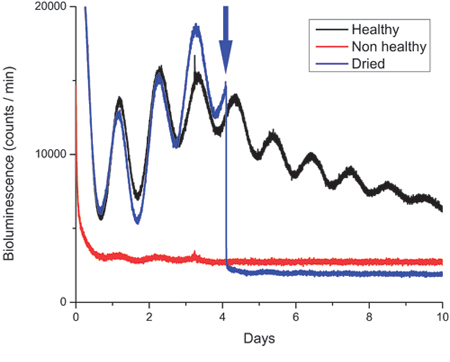
Figure 3. Enregistrements de bioluminescence sain et non des cultures de tissus sains du RCS.
Exemples d'enregistrements de la période2 bioluminescence: la luciférase (PER2:: LUC) expression dans le noyau suprachiasmatique (NSC) tranches obtenues chez la souris dans un lieu à 12h: 12h de lumière: obscurité de cycle. Le PER2:: protéines LUC oscille avec une circadien (~ 24 h) la variation dans laquelle l'expression maximale de la protéine se produit au moment zeitgeber 12-13. Ainsi, la phase du rythme gène est dépendant de l'horaire de lumière noire dans laquelle l'animal a été conservé avant sacrifié. Typiquement, la bioluminescence des tissus disséqués SCN unilatérale telle que décrite dans le protocole présente les chiffres de photons entre ~ 10.000-40.000/minute. La figure montre des traces d'une culture saine SCN (noir), une culture SCN non sains (rouge) et une culture que les SCN séché (en bleu) après l'ouverture de la boîte de culture scellées au jour 4 et non re-sceller le plat correctement ( indiqué par la flèche).
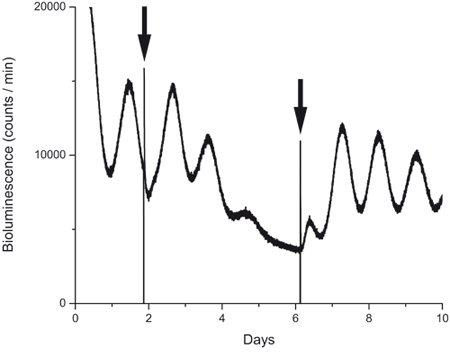
Figure 4. L'enregistrement bioluminescence pendant et après l'exposition au médicament.
PER2:: expression LUC dans une culture avant, pendant et après l'action d'un bloqueur de canal HCN (ZD7288, 10 uM). La première flèche indique le moment où le dresseur a été ajouté. La deuxième flèche indique lavage, ce qui a été faite en remplaçant le médicament contenant un milieu avec des moyennes de contrôle conditionné. Notez l'amplitude réduite après 2 jours d'exposition au médicament, le manque d'oscillation à jour 4 et le rétablissement rapide du rythme de la protéine après lavage.
Discussion
Avantages et inconvénients de la technologie rapporteur de la luciférase
Contrairement à l'ex méthodes in vivo, comme la RT-PCR, hybridation in situ et Western blot qui nécessitent l'échantillonnage des tissus à de nombreux points de temps différentes (donnant une résolution temporelle faible normalement 2-4 heures selon la fréquence d'échantillonnage), afin d'étudier diurnes les variations dans les expressions des gènes et des protéines, la technologie permet rapporteur de la luciférase à haute résolution (1-10 min) des études sur les oscillations circadiennes pendant plusieurs jours dans la même préparation. Des études Ainsi, le nombre d'animaux utilisés est réduit au minimum et détaillée des effets sur la phase et la période du rythme sont possibles, ce qui n'est normalement pas possible en utilisant des techniques d'échantillonnage classiques avec une résolution temporelle faible. Cependant, bien que les mesures d'amplitude relative de rythme sont possibles, il convient de souligner que la technologie journaliste n'est pas quantitatif et ne peut donc pas être utilisés pour mesurer les quantités de gènes transcrits ou des protéines traduites.
Les enregistrements de tissu peut être démarré et analysés immédiatement après mise en culture, un grand avantage pour étudier directement les effets du stress moléculaire in vivo, en phase de changements in vivo induite par la lumière etc La culture organotypique SCN permet à long terme (semaines) la manipulation pharmacologique du cerveau adulte tissu contenant une intactes réseau mature synaptique et la technologie rapporteur luciférase permet des enregistrements stables pendant plusieurs semaines. Ainsi, le tissu n'a pas besoin d'être postnatale néonatale ou tôt afin d'obtenir des cultures saines, et contrairement à la tranche aiguë chronique traitements pharmacologiques peuvent être effectuées. Contrairement à un plasmide reporter de transfections dans des cultures cellulaires, ce qui ne pas conduire à l'incorporation de l'ADN dans le génome, la luciférase transgéniques-modèles animaux (ainsi que lenti-virus transfections) sont favorables si altérations épigénétiques sont à étudier. Il devrait dans ce contexte également être mentionné que l'imagerie de luminescence est aujourd'hui possible avec des caméras CCD très sensible 11, qui permet des enregistrements même en neurones SCN unique (~ 60-10 um) et d'autres types cellulaires, utilisés par les grands laboratoires étudient les rythmes circadiens. Enfin, plusieurs enquêteurs circadien utilisent couramment le suivi d'expression moléculaire en utilisant d'autres reporters, comme la protéine fluorescente verte, afin d'étudier des gènes d'horloge / oscillations protéines 16-19.
Aspects de l'épaisseur de coupe
Les épaisseurs recommandé ici de la tranche SCN (200-300 um) pourrait être réduit ou augmenté, si désiré. Cependant, bien que le tissu s'aplatit sur la membrane après quelques jours de culture, il est recommandé de ne pas dépasser 500 um d'épaisseur de la tranche d'abord coupé afin de préserver la viabilité du tissu 7. Une tranche mince de 100 um est de raisons mécaniques et pratiques difficiles à manipuler. Parce que le tissu SCN est hétérogène de l'épaisseur de la tranche peut affecter la phase du signal de sortie de la luciférase, depuis les différentes régions au sein du SCN (par exemple le «noyau» par rapport à la «coquille», et les régions dorsale par rapport ventrale) oscillent avec les différentes phases 20 et différentiellement re-synchroniser après déphasages 21. L'épaisseur de la tranche affecte également la base du nombre de photons, depuis plus de tissu émet un plus grand nombre de photons. L'amplitude des oscillations moléculaires peuvent de cette manière être indirectement affectés par la taille de l'explant. Pour ces raisons, le contrôle et les cultures traitées doivent toujours être de la taille, la même épaisseur et contenant la même région du SCN afin d'osciller dans la même phase et avec la même amplitude. Les deux noyaux unilatérale, d'autre part, oscillent en phase les uns avec les autres et avec des amplitudes similaires aussi longtemps que la coupe vibratome est horizontal et non incliné (qui à son tour dépend de celui de la séparation nette entre le cervelet et les deux hémisphères est perpendiculaire la surface de la table). L'enquêteur qui effectue la culture SCN pourraient éprouver que les cultures SCN ne oscillent en phase les uns avec les autres. Pratiquer et la standardisation de la technique de tranchage, à savoir les tranches sont toujours coupées à la même rostro-caudale niveau de la SCN, permettra d'améliorer le résultat.
Les étapes critiques
- D'alimentation en oxygène est critique.
Parce que le cerveau a besoin de beaucoup d'oxygène 22, la procédure de tranchage doit être rapide (Le plus proche est de 03/01 à 03/10 ~ 5-6 minutes, le mieux c'est dans le but de garder les tissus sains). - Le SCN est sensible aux changements de température et d'échange à moyen terme.
Le SCN est sensible à la température et les changements de température peuvent grands déphasage du stimulateur cardiaque et provoquer des artefacts expérimentaux 23. Si le milieu ou les solutions sont échangés ou ajouté lors d'une expérience en cours, par exemple lors de l'application d'un médicament après quelques jours de culture, le milieu ou la solution doit être préchauffée à 36-37 ° C (la température de même que dans la chambre) avant l'addition. Dans les expériences pharmacologiques qui impliquent des échanges moyen, il est important de toujours travailler avec pré-conditionné milieu de culture cellulaire. Ajout / wash-out avec des produits frais, moyen inconditionnée peut potentiellement déphasage du rythme SCN 24 moléculaires ainsi que d'autres cultures de cellules de type 25. - La composition du milieu.
Il est important de la culture de tissus dans bon pH et l'osmolalité. Le milieu de l'air-tampon contient une grande quantité d'HEPES, qui a une capacité tampon optimale dans la gamme de pH 6.8 à 8.2 et est également approprié pour la mise en mémoire tampon des changements de pH qui peuvent survenir à la suite de la respiration cellulaire. HEPES, d'autre part, est plus sensible aux variations de température par rapport au bicarbonate de sodium, qui est inclus en petites quantités dans le milieu de culture. Le bicarbonate de sodium a une capacité plus grande mémoire tampon dans le bas du pH (05/01 au 07/01) rang 26, donc approprié dans une atmosphère de CO 2. Cependant, l'augmentation des quantités de bicarbonate de sodium dans le milieu de l'air-buffering (DMEM 2902) augmente significativement l'osmolalité et ne peuvent pas être ajoutés sans simultanément dilution du milieu, ce qui entraîne à son tour dans la composition incorrecte d'acides aminés, des vitamines et des ions.
Conseils pour la préparation du milieu:- Soyez précis et prudent quand mélanger le médium.
- Utilisez des solutions stock uniquement frais ou fraîchement décongelé.
- En cas d'osmolalité très élevé, il ne vaut pas diluer. Plus que 5-6% de la dilution moyenne sera très probablement ne fonctionnera pas. Utilisez le D-glucose pour augmenter l'osmolalité si elle est trop faible.
- Déphasages dus au temps de préparation
Le temps de préparation de tranches est critique. Effet nul ou minime sur la phase est obtenue si la procédure de tranche est réalisée entre ZT 6 au 12 décembre. Tous les dissections tranche devrait être réalisée à la même phase du cycle circadien diurne ou afin de minimiser les erreurs dues à la variation entre la phase des préparatifs.
D'éventuelles modifications
- Pour électrophysiologie SCN aiguë, le tranchage doit être réalisé avec une sonnerie (Artificial liquide céphalorachidien; ACSF) tampon, saturée en oxygène (95% d'O 2, 5% CO 2) avant le début de tranchage. En outre, l'oxygène doit être ajouté en continu à la mémoire tampon pendant toute la procédure de tranchage, de l'activité électrique et synaptique est directement dépendante de l'apport d'oxygène 22.
- Tranches horizontales et sagittal peut également être préparé avec succès et cultivée de la SCN. Les auteurs ont de l'expérience avec des enregistrements luciférase en tranches horizontales, ce qui, selon notre expérience donnent oscillations circadiennes avec faible amplitude par rapport à la coupe coronale.
- Le SCN est d'environ 1 mm de long rostro-caudales et la technique de découpage décrite ici est orientée vers l'acquisition d'une section SCN dans la région centrale. Cependant, plus d'une section SCN peuvent être obtenus auprès de la souris et cerveaux de rats, permettant à l'enquête sur circadien gène / protéine d'expression à des niveaux plus rostrale par rapport caudale du noyau du RCS.
- Trancher les cultures de jeunes animaux, chiots postnatale, ou même des embryons, peut également être préparé. S'il vous plaît noter que le cerveau et le crâne chez les chiots très jeunes enfants sont très doux et sensible. En outre, le nerf optique est mince et pas complètement développé. Prenez garde en disséquant le cerveau des bébés afin que la région SCN n'est pas endommagé. Par exemple, des outils de micro rongeur ne peut pas être utilisé pour ouvrir le crâne des bébés souris, car elles sont trop grosses. Ciseaux fins suffisent pour couper les tissus mous de jeunes chiots.
- Le couvercle en verre de la culture technique basée décrites ici peuvent aussi être utilisés pour la luminescence image à l'aide d'une caméra CCD / EM-CCD, également dans les neurones SCN unique.
- Autres régions centrales du système nerveux et des tissus d'organes périphériques à partir transgéniques PER2:: LUC animaux peuvent être facilement obtenus, cultivés et analysés en termes d'oscillations moléculaires, comme la PER2:: expression LUC continue à osciller pendant plusieurs jours aussi dans un certain nombre d'autres tissus types de cellules et 10. La plupart de ces tissus périphériques, pour le foie, par exemple, ne nécessitent pas une membrane pour la survie, mais sont plutôt cultivées directement baigné dans le milieu 11. S'il vous plaît noter que le déphasage dû à la coupe, la culture et l'échange moyennes peuvent ne pas suivre les mêmes principes que pour SCN.
Signification
Dans des souris transgéniques et les souches de rat (mPER2:: LUC; mPer1-Luc 8, 10, 27) l'activité enzyme luciférase reflète protéines ou des rythmes expression des gènes et peut être évaluée par l'enregistrement de bioluminescence. La bioluminescence luciférase produite donne un signal faible mais la luminescence de fond est proche de zéro, ce qui rend cette méthode avantageuse. Par ailleurs, parce que la molécule est instable et la luciférase rapidement dégradé il n'ya pas de phototoxicité, qui peuvent apparaître pendant une longue illumination excitateurs 28. Pris ensemble, ces propriétés permettent à long terme des expériences rendant la technologie rapporteur luciférase très avantageux dans la recherche du rythme circadien.
Déclarations de divulgation
Remerciements
Ce travail a été financé par le Conseil suédois de la recherche médicale (K2009-75SX-21028-01-3, K2008-61X-20700-01-3); FONCICYT 000000000091984; les fondements de la Jeansson, Söderström Königska sjukhemmet, Martha Lundqvist et Sigurd och Elsa Goljes Minne et la Société suédoise de médecine SLS-95151. Professeur Gene D. Block, UCLA, est remerciées pour leurs précieux commentaires sur le manuscrit. Nous remercions le Dr Michael Andäng et le Dr Hélène Johard pour le bloqueur des canaux HCN, et le professeur Abdel El-Manira pour fournir des vidéo-microscope.
Considérations éthiques:
Toutes les expériences sur les animaux ont été effectuées en conformité avec les directives et règlements établis par l'Institut Karolinska et de "Stockholm Norra Djurförsöksetiska Nämnd". Toutes les expérimentations animales sont réalisées avec l'intention de minimiser tout éventuel stress ou d'inconfort à l'animal.
matériels
| Name | Company | Catalog Number | Comments |
| B27 supplement 50x | Invitrogen | 17504-044 | |
| Cover glasses | Menzel-Glaser | 40#1 | ≈ 40 mm |
| Culture membranes | EMD Millipore | PICMORG50 | 0.4 μm |
| DMEM low glucose w/o phenol red | Sigma-Aldrich | D2902 | Powder for 1L |
| Filter paper | Whatman, GE Healthcare | 1003 055 | ≈ 55 mm |
| Filtration set | Corning | 431097 | Pore size 0.22 μmPolyethersulfone |
| Forceps | Allgaier Instrumente | 0203-7-PS | Dumant #7 |
| HEPES | Invitrogen | 15630-056 | 100 ml |
| HBSS 10x | Invitrogen | 14065-049 | 500 ml |
| NaOCH3 7.5% | Invitrogen | 25080-060 | 50 ml |
| Luciferin | Promega Corp. | E1602 | Beetle luciferin, potassium salt |
| Micro rongeur tool | Allgaier Instrumente | 332-097-140 | |
| PenStrep 10,000 U/ml | Invitrogen | 15140-122 | 100 ml |
| Petri dishes | Corning | 430165 | ≈ 35 mm |
| PMT | Hamamatsu Corp. | H9319-11MOD | |
| Disposable scalpels | Paragon | P503 | Size 11 |
| Vacuum filter | Fisher Scientific | 09-761-5 | |
| Vacuum grease | Dow Corning | 50 g | |
| Vibratome | Campden Instruments |
Références
- Welsh, D. K., Takahashi, J. S., Kay, S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Annu Rev Physiol. 72, 551-577 (2010).
- Green, D. J., Gillette, R. Circadian rhythm of firing rate recorded from single cells in the rat suprachiasmatic brain slice. Brain Res. 245, 198-200 (1982).
- Shibata, S., Oomura, Y., Kita, H., Hattori, K. Circadian rhythmic changes of neuronal activity in the suprachiasmatic nucleus of the rat hypothalamic slice. Brain Res. 247, 154-158 (1982).
- Groos, G., Hendriks, J. Circadian rhythms in electrical discharge of rat suprachiasmatic neurones recorded in vitro. Neurosci Lett. 34, 283-288 (1982).
- Moore, R. Y., Klein, D., Moore, R., Reppert, S. The suprachiasmatic nucleus and the circadian timing system. Suprachiasmatic nucleus--The mind's clock. , 13-15 (1991).
- Pol, A. N. V. a. n. d. e. n. The hypothalamic suprachiasmatic nucleus of rat: intrinsic anatomy. J Comp Neurol. 191, 661-702 (1980).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Yamazaki, S., Numano, R., Abe, M., Hida, A., Takahashi, R., Ueda, M., Block, G. D., Sakaki, Y., Menaker, M., Tei, H. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Geusz, M. E., Fletcher, C., Block, G. D., Straume, M., Copeland, N. G., Jenkins, N. A., Kay, S. A., RN, D. a. y. Long-term monitoring of circadian rhythms in c-fos gene expression from suprachiasmatic nucleus cultures. Curr Biol. 7, 758-766 (1997).
- Ko, C. H., Buhr, E. D., Siepka, S. M., Hong, H. K., Oh, W. J., Yoo, O. J., Menaker, M., Takahashi, J. S. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci U S A. 101, 5339-5346 (2004).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Yoshikawa, T., Yamazaki, S., Menaker, M. Effects of preparation time on phase of cultured tissues reveal complexity of circadian organization. J Biol Rhythms. 20, 500-512 (2005).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (1997).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1998).
- O'Neill, J. S., Maywood, E. S., Chesham, J. E., Takahashi, J. S., Hastings, M. H. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Hughes, A. T., Guilding, C., Lennox, L., Samuels, R. E., McMahon, D. G., Piggins, H. D. Live imaging of altered period1 expression in the suprachiasmatic nuclei of Vipr2-/- mice. J Neurochem. 106, 1646-1657 (2008).
- Zhang, D. Q., Zhou, T., Ruan, G. X., McMahon, D. G. Circadian rhythm of Period1 clock gene expression in NOS amacrine cells of the mouse retina. Brain Res. 1050, 101-109 (2005).
- Quintero, J. E., Kuhlman, S. J., McMahon, D. G. The biological clock nucleus: a multiphasic oscillator network regulated by light. J Neurosci. 23, 8070-8076 (2003).
- LeSauter, J., Yan, L., Vishnubhotla, B., Quintero, J. E., Kuhlman, S. J., McMahon, D. G., Silver, R. A short half-life GFP mouse model for analysis of suprachiasmatic nucleus organization. Brain Res. 964, 279-287 (2003).
- Nakamura, W., Yamazaki, S., Takasu, N. N., Mishima, K., Block, G. D. Differential response of Period 1 expression within the suprachiasmatic nucleus. J Neurosci. 25, 5481-5487 (2005).
- Davidson, A. J., Yamazaki, S., Arble, D. M., Menaker, M., Block, G. D. Resetting of central and peripheral circadian oscillators in aged rats. Neurobiol Aging. 29, 471-477 (2008).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81, 103-111 (1998).
- Burgoon, P. W., Boulant, J. A. Temperature-sensitive properties of rat suprachiasmatic nucleus neurons. Am J Physiol Regul Integr Comp Physiol. 281, 706-715 (2001).
- Nishide, S. Y., Honma, S., Honma, K. The circadian pacemaker in the cultured suprachiasmatic nucleus from pup mice is highly sensitive to external perturbation. Eur J Neurosci. 27, 2686-2690 (2008).
- Yoshikawa, T., Sellix, M., Pezuk, P., Menaker, M. Timing of the ovarian circadian clock is regulated by gonadotropins. Endocrinology. 150, 4338-4347 (2009).
- Kohn, R. A., Dunlap, T. F. Calculation of the buffering capacity of bicarbonate in the rumen and in vitro. J Anim Sci. 76, 1702-1709 (1998).
- Wilsbacher, L. D., Yamazaki, S., Herzog, E. D., Song, E. J., Radcliffe, L. A., Abe, M., Block, G., Spitznagel, E., Menaker, M., Takahashi, J. S. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc Natl Acad Sci U S A. 99, 489-494 (2002).
- Sellix, M. T., Currie, J., Menaker, M., Wijnen, H. Fluorescence/luminescence circadian imaging of complex tissues at single-cell resolution. J Biol Rhythms. 25, 228-232 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon