Method Article
Preparación Cortar, cultivo de tejidos organotípicos y grabación de la actividad luciferasa de reloj de genes en el núcleo supraquiasmático
* Estos autores han contribuido por igual
En este artículo
Resumen
El procedimiento de preparación de cortes que contiene el ratón adulto núcleo supraquiasmático del hipotálamo (NSQ), y de una manera rápida a la cultura del tejido SCN en condiciones de cultivo organotípico, se informó. Además, la medición de la expresión de la proteína del gen del reloj oscilatorio utilizando la tecnología dinámica de luciferasa se describe.
Resumen
Un centro circadiano (~ 24 h) la coordinación de los ritmos diarios del reloj en la fisiología y el comportamiento reside en el núcleo supraquiasmático (NSQ), ubicado en el hipotálamo anterior. El reloj se sincroniza directamente con la luz a través de la retina y el nervio óptico. Oscilaciones circadiano son generados por la interacción bucles de retroalimentación negativa de un número de los llamados "genes reloj" y sus productos proteicos, incluyendo el período de (por) los genes. El reloj de núcleo también depende de la despolarización de la membrana, el calcio y el campamento 1. El SCN presenta oscilaciones diarias en la expresión de genes reloj, la actividad metabólica y la actividad eléctrica espontánea. Cabe destacar que esta actividad cíclica endógena persiste en cortes de tejido adulto de la SCN 2-4. De esta manera, el reloj biológico puede ser estudiada in vitro, lo que permite las investigaciones moleculares, electrofisiológicas y metabólicas del funcionamiento del marcapasos.
El SCN es una pequeña y bien definida estructura bilateral situada justo por encima del quiasma óptico 5. En la rata que contiene ~ 8.000 neuronas en cada núcleo y tiene unas dimensiones de aproximadamente 947 m (largo, eje rostrocaudal) x 424 m (ancho) x 390 m (altura) 6. Para diseccionar el SCN, es necesario cortar una rodaja del cerebro en el nivel específico del cerebro donde se encuentra el SCN identificadas. Aquí se describe el procedimiento de disección y el corte de la SCN, que es similar para el ratón y el cerebro de las ratas. Además, nos muestran cómo la cultura de los tejidos disecados organotypically en una membrana de 7, una técnica desarrollada para el cultivo de tejidos SCN por Yamazaki et al. 8. Por último, demostrar cómo el tejido transgénico puede ser utilizado para medir la expresión de los genes del reloj / proteínas de uso de la tecnología dinámica de luciferasa, un método que fue utilizado originalmente para la medición circadiano por Geusz et al. 9. Estamos aquí, usar pañuelos SCN de los transgénicos knock-in período2:: ratones luciferasa producida por Yoo et al 10.. Los ratones que contienen una proteína de fusión del período (PER) 2 y la enzima luciferasa de luciérnaga. Cuando PER2 se traduce en la presencia del sustrato para la luciferasa, luciferina, es decir, la expresión PER2 se puede controlar con bioluminiscencia cuando luciferasa cataliza la oxidación de la luciferina. El número de fotones emitidos se correlaciona positivamente con la cantidad de proteína producida PER2, y los ritmos de la bioluminiscencia coincidir con el ritmo de proteínas PER2 in vivo 10. De esta manera, la variación cíclica en la expresión PER2 puede ser de un seguimiento continuo en tiempo real durante muchos días. El protocolo que siguen para el cultivo de tejidos y la grabación en tiempo real bioluminiscencia ha sido completamente descrito por Yamazaki y Takahashi 11.
Protocolo
1. Preparación de la solución
- Medio de cultivo con una capacidad de amortiguación de aire
- Llenar una botella de 1 litro, con aproximadamente 800 ml estéril H 2 O (autoclave milliQ H 2 O).
- Mientras se agita, añadir y mezclar las sustancias siguientes: 1 contenedor de la glucosa baja, libre de suero en polvo DMEM 2902 sin bicarbonato de sodio y fenol rojo (rojo fenol interfiere con la señal de bioluminiscencia), 20 ml de suplemento B27 50x, 4,7 ml de un 7,5% de NaHCO3 solución (o 0,35 g de NaHCO 3), 10 ml de HEPES 1M, 2,5 ml Penstrep 10,000 U / mL y 3,5 g de D-glucosa. Que el medio revuelva hasta que los ingredientes se hayan disuelto completamente.
El medio final (1 litro) contendrá:
1x DMEM, 1x suplemento B27, 4,2 mM NaHCO 3, 10 mM HEPES, 25 U / ml de penicilina, 25 U / ml de estreptomicina y 19 mM D-glucosa. - Ajustar el pH a 7,2, con NaOH o HCl para reducir al aumentar el pH, y llevar el volumen hasta 1 litro con agua estéril H 2 O.
- Ajustar la osmolaridad con H 2 O (osmolalidad disminución) o D-glucosa (osmolalidad de aumento). La osmolalidad debe estar entre 285-315 mOsm / Kg, pero el rango óptimo es 300 a 310 mOsm / Kg. No diluir el medio de más del 5%.
- Filtrar el medio de cultivo estéril con Corning establece filtración al vacío (por ejemplo, 2 x 500 ml con tamaño de poro 0.22 micras) en una campana estéril. Mantener el medio en el 4 ° C y protegerlo de la luz con papel de aluminio. Recomendamos que el medio se utiliza dentro de 3 meses.
- Hank equilibrado de solución de sal (HBSS) de búfer con los suplementos (por rodajas de corte)
- Llenar una botella de litro con un vaso estéril ~ 600 ml (autoclave milliQ) H 2 O y añadir las siguientes sustancias: 100 ml de caldo de HBSS 10 veces, 10 ml de penicilina-estreptomicina 10.000 U / ml, 5 ml de un 7,5% y solución de NaHCO3 10 ml de HEPES 1M.
La solución de corte final contendrá:
1x HBSS, HEPES 10 mM, 4,5 mM NaHCO 3, 100 U / ml de penicilina y estreptomicina 100 U / mL. - Verificar el pH y, si es necesario, ajustar el pH a 7.2 y llevar el volumen hasta 1 litro con agua estéril H 2 O.
- Compruebe la osmolaridad, que debe estar entre 285-315 mOsm / Kg.
- Enfriar la HBSS a 4 ° C. El buffer HBSS tiene que ser muy frío (4 ° C) durante el corte / corte de procedimiento con el fin de reducir el metabolismo y mantener la viabilidad del tejido.
- Llenar una botella de litro con un vaso estéril ~ 600 ml (autoclave milliQ) H 2 O y añadir las siguientes sustancias: 100 ml de caldo de HBSS 10 veces, 10 ml de penicilina-estreptomicina 10.000 U / ml, 5 ml de un 7,5% y solución de NaHCO3 10 ml de HEPES 1M.
2. Preparativos Antes Rebanadas de corte y cultivo
- Los tejidos se cultivaron en una cámara de calentamiento en seco sin CO 2. Para evitar que se sequen las culturas deben ser sellados con cubiertas de vidrio unido a los platos por la grasa. Para ello, llenar jeringas de 5 ml con grasa de vacío a base de silicona. Cubrir las puntas de jeringa con pequeños trozos de papel de aluminio y autoclave ellos. Además, los papeles de filtro autoclave (utilizado durante la corte de procedimiento).
- Justo antes de cortar el procedimiento, aplicar grasa de vacío en autoclave en la superficie superior del anillo de 35 mm placas de Petri. Preparar una placa de Petri separada para cada cultura rebanada.
- Antes de iniciar el procedimiento de corte de todos los instrumentos no estériles, navajas de afeitar, cuchillas vibratome, cubiertas de vidrio y otros materiales utilizados para el procedimiento de corte y la cultura tienen que ser esterilizados. Rocíe todo el equipo no estéril con etanol al 70%. Exponer los instrumentos y las placas de Petri engrasada con UV en una campana estéril durante al menos 30 minutos de exposición UV antes de cultivo.
- Al mismo tiempo, llenar un tubo Falcon con medio de cultivo aire-buffering (recuento de 1,2 ml de cada cultura, de 8 a prepararse para las culturas ml de medio ejemplo 10) y añadir recién descongelado luciferina (0,1 M de solución madre, Promega, Madison, WI) (10 l luciferina a 10 ml de medio, la concentración final de 0,1 mM).
- La luciferina es sensible a la luz y las dos soluciones madre y el medio que contiene luciferina necesitan ser protegidos de la luz. Coloque el tubo Falcon con luciferina-medio en una oscura cámara de calentamiento 36-37 ° C. En su caso, la luciferina también se pueden añadir directamente en las placas de cultivo en el momento del corte. Si no se añade la luciferina, no habrá ninguna reacción a la luz entre la luciferasa y luciferina y por lo tanto no hay ninguna señal de los tejidos.
- Después de la exposición UV, adjunte una hoja limpia en las vibratome.
3. SCN rebanar Procedimiento
El siguiente procedimiento describe el corte de adultos, por lo general 2-4 meses de edad, C57/BL6 ratones. Tenga en cuenta: el procedimiento de corte, así como la exposición a la luz de los animales durante la noche, diferencial puede restablecer la fase de la SCN. Para evitar esto, la tala y el cultivo se debe realizar durante las horas de luz, preferiblemente entre ZT 06.12, cuando no hay cambios sustanciales de fase debido al procedimiento de ocurrir 12. Si SCN tiene que ser degustados en la oscuridad, 3.1 y 3.2 tienen que ser realizadas en el semáforo en rojo o con gafas de noche para evitar la luz inducida por los cambios de fase.
- Anestesiar el ratón de preferencia por isofluorano (Baxter) en un glass de la cámara. Cuando el animal ha perdido sus reflejos dolor (ver pellizcando con los clavos en la pata) pero aún no ha dejado de respirar (para mantener el suministro de oxígeno el mayor tiempo posible), rápidamente decapitar a la cabeza con un par de tijeras o similar.
Tenga en cuenta: en algunos países de la exposición de CO 2 (hipercapnia) todavía se permite como método anestésico, aunque se ha informado a la promoción de la ansiedad de los animales. Además, la dislocación cervical puede ser necesaria antes de la decapitación. Por favor, siga las legislaciones locales, cuando la eutanasia de los animales. - Quitar los ojos de la cabeza con unas tijeras a fin de evitar la tensión y la excitación adicional de los nervios ópticos, que pueden dañar el SCN.
- Si todavía conectado, extraiga la última vértebra cervical con una tijera, quitar la piel (Fig. 1a) y hacer dos cortes con un buen par de tijeras (por ejemplo tijeras iris), un corte a cada lado del cráneo a lo largo de los lados, lo que hace removible "tapa".
- Abrir el cráneo con una herramienta de micro gubia (tijeras de disección fina también se puede utilizar en un ratón) y eliminar todos los huesos hasta los bulbos olfativos se pueden ver. El trabajo nunca hacia arriba, presionando el cerebro con la herramienta, con el fin de prevenir el daño de la SCN ventral (Fig. 1B).
- Corte cuidadosamente el nervio óptico entre los bulbos olfatorios y hemisferios del uso de micro fina Tijeras de disección de primavera. Asegúrese de que el nervio se corta completamente ya que el estiramiento del nervio óptico puede conducir a daños en el SCN y las rodajas de ruptura.
- Gire la cabeza hacia abajo y dejar que el cerebro intacto caer (si todavía está conectado al cerebro, otros nervios craneales puede ser necesario cortar caudal al nervio óptico) en un recipiente (por ejemplo, un plato de Petri de vidrio ≈ 10 cm) llena de 50-100 ml de HBSS frío que permite un rápido enfriamiento del cerebro. Lo ideal sería que los dos nervios ópticos deben permanecer intactos (Fig. 1c). Mantener el cerebro en el HBSS 30-60 segundos para asegurarse de que el cerebro se enfría.
- Use una cuchara o similar y el lugar del cerebro frío, la superficie dorsal hacia arriba, sobre una superficie de corte estériles (por ejemplo, una tapa de vidrio una caja de petri al revés). Con el fin de preparar un corte coronal, hacer un corte perpendicular con hojas de afeitar estéril o bisturís entre los hemisferios cerebrales y el cerebelo, lo que elimina el cerebelo.
- Aplique pegamento en la plataforma seca que pertenecen a la vibroslicer / vibratome.
- Levante el cerebro (los hemisferios cerebrales, sin cerebelo y el bulbo olfatorio sin) mediante la inserción de una pinza fuerte y curvo en la parte rostral y Secar cuidadosamente el HBSS en un papel de filtro estéril, sin soltar el cerebro con las pinzas. (En lugar de insertar una pinza, un pequeño trozo de papel de filtro estéril puede ser usado para conectar y transferir el cerebro).
- Fijar los hemisferios en la plataforma pegada con la punta hacia arriba y la superficie ventral rostral más cerca de la cuchilla de corte. Coloque la plataforma en el soporte que pertenecen a la vibratome (por ejemplo, de Campden Instruments, Reino Unido) e inmediatamente se llenan de HBSS frío. Si el corte perpendicular se realiza correctamente, los hemisferios deben estar hacia arriba proporcionando así un buen ángulo necesario para hacer un corte coronal que contiene el SCN bilateral.
- Con el fin de llegar a la zona SCN objetivo, empezar a cortar las secciones más gruesas (500-800 micras) de los hemisferios a una velocidad alta o máxima de la vibratome. Traslado de la hoja puede ser bastante rápido en el comienzo antes de llegar al hipotálamo, pero debe ser reducida cuando el quiasma óptico se hace visible (alta frecuencia de vibración de la hoja y el movimiento lento horizontal disminuye el daño celular durante el corte, lo que aumenta la viabilidad de corte). Reducir las secciones de 100 m cuando el quiasma óptico se hace más grande (mayor) y la comisura anterior se hace más pequeño. Con el fin de adquirir una sección media SCN, el trabajo mismo "abajo" (dirección caudal) hasta los núcleos SCN dos comienzan a aparecer. Una lupa puede ser necesario para la visualización de los núcleos. Tenga en cuenta: el SCN en el cerebro del ratón se encuentra más caudal del quiasma óptico en comparación con el cerebro de la rata.
- Cuando el nivel deseado de SCN se ha alcanzado (el SCN se en este momento aparecen como más definido, las estructuras de forma redonda o de almendra, la figura 1d, aproximadamente Bregma-0.46--0.70 mm para la región centro del SCN en el ratón 13, Bregma - 0.92 hasta -1.40 mm para las ratas 14), cortar la sección SCN (Fig. 1e). Espesor adecuado del segmento es de 250 ± 50 ratón m; para la rata de 350 ± 50 micras.
- Con un cepillo suave, ascensor y la transferencia de la rebanada de SCN a una tapa de una placa de Petri de tamaño mediano lleno de HBSS frío, bajo un microscopio de disección o estereoscopio. Comprobar con una lupa si el SCN bilateral es claramente visible. Si la región media de la SCN será elegido (que no necesariamente puede ser el único nivel "óptimo" tajada, pero que consideramos que es la forma más fácil de estandarizar el procedimiento de cortar y reducir la variación), debe ser visto claramente por lo menos en un lado de lade sección. Si el corte es demasiado rostral, que otra sección y comprobar la SCN bajo la lupa.
4. Cultura SCN organotípicos
- En la tapa de la placa de Petri llena con HBSS, diseccionar el SCN bilateral como un tejido de cuadrados (alrededor de 1,5 mm a cada lado) con un par de bisturí estéril bajo un microscopio de disección. Un pequeño trozo del quiasma óptico se mantendrá unido al explante, pero no hay otros núcleos deberían ser incluidos. Corte lo más cerca posible sin la eliminación de tejido SCN.
- Si es apropiado para el experimento planeado, el SCN bilateral puede ser reducido a la mitad para obtener dos SCN unilateral. Una SCN unilateral puede ser utilizado como control (Figura 2a).
- Rellene 1200 L de la luciferina-medio en un ≈ 35 mm placa de Petri y colocar una membrana de la cultura (Milli-CM 0,4 micras, Millipore, Bedford, MA) en la parte superior de la superficie del líquido (2b). El volumen medio de cultivo es fundamental, ya que la membrana de la cultura debe sentarse de forma segura en la base de la placa de cultivo, no float o de la roca en el medio 11. Asegúrese de que no hay burbujas de aire debajo de la membrana. Evitar la exposición a la luz innecesaria cuando se trabaja con luciferina.
- Los explantes son pequeños y difíciles de recoger. Por lo tanto el uso de una pipeta 1.000 l + propina para succionar el explante SCN en la punta y presione sobre la membrana. En caso de que el explante es demasiado grande para caber fácilmente en una punta de 1.000 l pipeta (SCN por ejemplo, la rata y ratón SCN bilateral) de la punta se puede cortar con una herramienta estéril para crear una abertura más amplia. Deseche HBSS excesiva en la membrana con la pipeta. Para la grabación de la luciferasa, único lugar donde uno SCN / plato (Fig 2b), como los tubos de grabación de detectar todos los fotones emitidos por el plato y no distinguir entre las señales de diferentes tejidos.
- Selle el recipiente con una tapa de vidrio (≈ 40 mm, Menzel-Gläser, Alemania) y grasa de vacío (Dow Corning Corp., EE.UU.) 11. Asegúrese de que la junta esté bien apretado (Figura 2c). Si no, el sello con más grasa.
- Las placas en un 36-37 ° C opaca a la luz la cámara y empezar a PMT-grabaciones inmediatamente.
5. Medición de la actividad luciferasa por bioluminiscencia de grabación
Luciferasa inducida por las señales de la bioluminiscencia de los tejidos SCN pequeños son detectados y amplificados con conjuntos de tubos photonmultiplier-detector (PMT) montado dentro de una cámara estanca a la luz. El PMT se colocan normalmente ~ 2.1 cm por encima del 8 placas de cultivo. PMT configuraciones de grabación puede ser por encargo o están disponibles en el 11.
- Coloque el plato en una PMT (el calor producido por el PMT se eliminará la condensación en la cubierta de cristal) y cerrar la cámara. Asegúrese de que la cámara es 100% a prueba de luz como la oscuridad de contar con PMT utiliza para los tejidos SCN es muy bajo (menos de 20 fotones / min). El PMT detectar hasta el más débil de la fuga de luz.
- Iniciar la adquisición de datos, que se realiza con el software (por ejemplo LumiCycle; Actimetrics Inc., Wilmette, Illinois, EE.UU.). Cuenta de fotones se integran en intervalos de 10-10 minutos para llegar de alta resolución de la expresión de genes / proteínas.
- Después de terminada la grabación, la expresión obtenida circadiano de los genes / proteínas pueden ser analizados con el software adecuado (Origen, OriginLab, Northampton, MA, EE.UU.; ClockLab, Actimetrics; LumiCycle, Actimetrics Inc, Chrono, Till Roenneberg de la Universidad de Munich, Munich, Alemania) para determinar la etapa, período (tiempo de un ciclo) y la amplitud del ritmo. La máxima expresión del gen o la proteína se utiliza sobre todo como punto de referencia y se define como el más alto número de fotones durante un ciclo. Los datos pueden ser suavizadas antes de los análisis de la fase, periodo y la amplitud, sobre todo si la relación señal / ruido es bajo. La línea de base a veces cambia y hay que resta antes de los análisis se llevan a cabo.
6. Los resultados representativos:
Presentamos aquí la PER2 oscilatorio:: expresión LUC como lectura para la viabilidad y las condiciones del cultivo de tejidos. Bajo condiciones óptimas, y si el tejido está vivo, el PER2:: expresión LUC oscila con un ritmo circadiano, como se muestra en la figura 3. PER2 en el SCN es la máxima expresada por lo general alrededor de Tiempo Zeitgeber 12-13 (ZT donde 12 representa las luces apagadas en 12:12 h luz: oscuridad ciclo). El de mayor tamaño del tejido vivo, mayor es el número de fotones se convierte. Sin embargo, el tamaño y el grosor del tejido organotypically cultivadas deben mantenerse pequeños con el fin de mantener el tejido viable, de preferencia no más de 15 mm 2 11 y no más gruesa de 500 m 7. El SCN, si disecados como se describe aquí, por lo general muestra el recuento de fotones entre 10.000-40.000/min si el tejido proviene de una homocigotos PER2:: animal LUC. La amplitud de la oscilación en las culturas SCN organotípicos suele ser muy alto durante el primer ciclo, en comparación con los ciclos siguientes. No está del todo claro por qué el primer ciclo tiene una muy alta amplitude. Una posible explicación es que una parte sustancial de las células en el tejido pueden morir poco después del corte inicial y el cultivo, por lo tanto no utilizar luciferina después del primer ciclo. El procedimiento de corte también puede causar excitación excesiva, lo que podría amplificar la señal de luciferasa en el primer ciclo.
La Figura 3 muestra las huellas de luminiscencia de las lonjas de SCN y contiene una traza (rojo) obtenidos a partir de un sector que no estaba inicialmente sanas. Tejidos muertos o insalubres tienen un bajo recuento de fotones líneas de base. (Además, los tejidos muertos a menudo se disocian en el plato y no se puede quitar de la membrana de una sola pieza.)
La técnica descrita en este informe beneficiosa puede ser utilizado en experimentos farmacológicos. La Figura 4 muestra una huella de una cultura que hemos tratado entre los días 1 y 2 con un bloqueador del canal de HCN (ZD7288, 10 M). Como se puede observar en la figura y como publicó anteriormente con el 15, el bloqueador redujo significativamente la amplitud de la oscilación circadiana de PER2, sin embargo, después del lavado con medio de cultivo normal de la oscilación volvió, lo que demuestra que el bloqueador de afectados del reloj molecular, pero la tejido era viable y saludable.
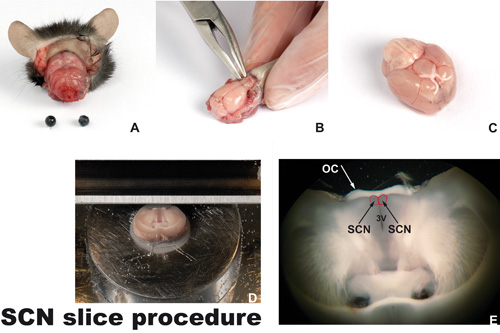
Figura 1. Corte de procedimiento
A) La cabeza decapitada de un ratón de la eutanasia con los ojos y la piel extirpada. B) El cráneo es removido con una herramienta de micro gubia. Al usar la herramienta, se debe trabajar hacia arriba y no presionar el cerebro con la herramienta. C) El cerebro se muestra al revés (lado ventral), sin bulbos olfatorios. El quiasma óptico blanco con los dos nervios ópticos intactos se pueden ver. El núcleo supraquiasmático (SCN, las fronteras marcadas en rojo) se encuentra cerca del quiasma óptico. D) Un cerebro coronal corte unido a la plataforma en la vibroslicer, en el ámbito de la NCS. E) Sección coronal del cerebro (250 m de espesor) que contiene el quiasma óptico (CO), el tercer ventrículo (3V) y los núcleos bilateral supraquiasmático (NSQ).

Figura 2. Cultivo de tejidos organotípicos.
A) Los dos núcleos SCN unilateral (insertar) disecados de la corte se muestra. B) placa de cultivo (35 mm placa de Petri) con la membrana de la cultura, el medio y explante, pero sin grasa de vacío y tapa de vidrio. El medio (1,2 ml) puede ser visto como líquido entre el plato y la membrana. Un núcleo SCN unilateral se coloca en la membrana de la cultura. El blanco más parte del tejido del pequeño es un pedazo del quiasma óptico (insertar). C) La placa de cultivo con su membrana y el tejido SCN, sellado con grasa de vacío y una cubierta de vidrio redondo.
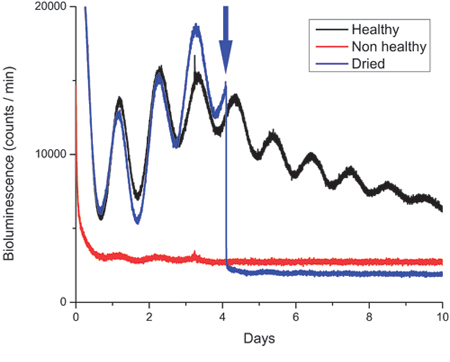
Figura 3. Grabaciones de la bioluminiscencia de cultivo de tejidos sanos y no sanos-SCN.
Ejemplos de las grabaciones de la bioluminiscencia de período2:: luciferasa (PER2:: LUC) expresión en el núcleo supraquiasmático (NSQ) rebanadas obtenidas de ratones a cabo en un 12 h: 12 h luz: oscuridad ciclo. El PER2:: LUC proteína oscila con un ritmo circadiano (~ 24 horas) la variación en el que la máxima expresión de la proteína se produce en el momento Zeitgeber 12-13. Por lo tanto, la fase del ritmo de genes depende del horario de la luz oscura en la que se mantuvo al animal sacrificado antes. Por lo general, la bioluminiscencia de los tejidos del SCN unilaterales disecados como se describe en el protocolo muestra el recuento de fotones entre ~ 10.000-40.000/minute. La figura muestra las huellas de una cultura saludable SCN (negro), una organización no-cultura saludable SCN (rojo) y una cultura de SCN que se secó (azul) después de abrir la caja de cultivo sellada en el día 4 y no volver a sellar el plato correctamente ( indicado por la flecha).
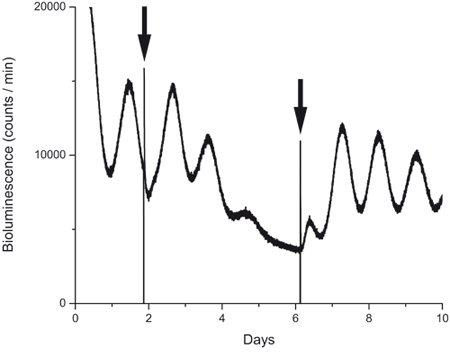
Figura 4. Bioluminiscencia de grabación durante y después de la exposición al fármaco.
PER2:: LUC expresión de una cultura antes, durante y después de la acción de un bloqueador de canal de HCN (ZD7288, 10 M). La primera flecha indica el momento en que el bloqueo se añadió. La segunda flecha indica lavado, que se hizo mediante la sustitución de la droga que contienen medio con un medio de control acondicionado. Tenga en cuenta la amplitud reducida después de 2 días de exposición a las drogas, la falta de oscilación en el día 4 y la rápida recuperación del ritmo de proteína después de lavado.
Discusión
Ventajas y desventajas de la tecnología de luciferasa
En contraste con los métodos ex vivo, tales como RT-PCR, hibridación in situ y Western blot que requieren muestras de tejido en muchos diferentes puntos de tiempo (dando un tiempo de resolución de baja normalmente 2-4 horas dependiendo de la frecuencia de muestreo) para estudiar diurna variaciones en la expresión de genes y proteínas, la tecnología de luciferasa permite alta resolución (1-10 min) los estudios de las oscilaciones circadiano durante muchos días en la misma preparación. Estudios por lo tanto, el número de animales utilizados se reduce al mínimo y detallado de los efectos de la fase y el período del ritmo son factibles, que normalmente no es posible utilizando técnicas convencionales de muestreo con el tiempo de resolución de baja. Sin embargo, a pesar de las mediciones relativas amplitud del ritmo es posible, hay que destacar que la tecnología de periodista no es cuantitativo y no puede ser utilizado para medir las cantidades de los genes transcritos o traducidos proteínas.
Las grabaciones de los tejidos se pueden iniciar y analizadas inmediatamente después de un cultivo, una gran ventaja para estudiar directamente los efectos moleculares de estrés en vivo, en vivo los cambios de fase inducido por la luz, etc La cultura SCN organotípicos permite a largo plazo (semanas) la manipulación farmacológica del cerebro adulto tejido que contiene una intacta red madura sináptica y la tecnología permite grabaciones de luciferasa estable durante varias semanas. Por lo tanto, el tejido no tiene por qué ser postnatal neonatal o principios con el fin de obtener cultivos sanos, y en contraste con el agudo corte tratamientos farmacológicos crónicos se puede realizar. En contraste con transfections plásmido reportero en cultivos de células, que no hacer lugar a la incorporación de ADN en el genoma, la luciferasa transgénicos modelos animales (así como transfecciones lenti-virus) son favorables si las alteraciones epigenéticas son objeto de estudio. Se debe en este contexto también se mencionó que las imágenes de luminiscencia es hoy en día es posible con cámaras CCD de alta sensibilidad 11, lo que permite grabaciones, incluso en las neuronas SCN sola (~ 6.10 m) y otros tipos de células, utilizada por los principales laboratorios estudian los ritmos circadianos. Finalmente, varios investigadores circadiano comúnmente seguimiento del uso de la expresión molecular mediante la prensa, como la proteína verde fluorescente, con el fin de estudiar genes reloj / oscilaciones de proteínas 16-19.
Los aspectos de grosor de corte
Los espesores aquí se recomienda el corte de SCN (200-300 micras) podrían reducirse o aumentarse si así lo desea. Sin embargo, aunque el tejido se aplana en la membrana después de unos días en la cultura, no se recomienda para más de 500 micras de espesor de la rebanada cortada inicialmente con el fin de preservar la viabilidad de los tejidos 7. Una rebanada de menos de 100 m es de razones mecánicas y prácticos difíciles de manejar. Debido a que el tejido SCN es heterogéneo el grosor del corte puede afectar a la fase de la señal de salida de la luciferasa, ya que las diferentes regiones del SNC (por ejemplo, el "núcleo" versus la "cáscara", y en comparación con las regiones dorsal ventral) oscilan con las diferentes fases 20 y diferencialmente volver a sincronizar los cambios después de la fase 21. El grosor de la rebanada también afecta a la línea de base del recuento de fotones, ya que más tejido emite un mayor número de fotones. La amplitud de las oscilaciones moleculares pueden de esta manera indirectamente verse afectada por el tamaño de los explantes. Por estas razones, el control y cultivos tratados deben ser siempre del mismo tamaño, grosor, y que contiene la misma región del SCN, para oscilar en la misma fase y con la misma amplitud. Los dos núcleos unilateral, por su parte, oscilan en fase con los demás y con amplitudes similares, siempre y cuando el corte es horizontal y no vibratome y en ángulo (que a su vez depende de que el corte de separación entre el cerebelo y los dos hemisferios es perpendicular a la superficie de la mesa). Un investigador que realiza el cultivo de SCN pueden experimentar las culturas SCN no oscilan en fase con la otra. La práctica y la estandarización de la técnica de corte, es decir, los cortes siempre se cortan en el mismo rostro-caudal a nivel del SNC, mejorará el resultado.
Los pasos críticos
- Suministro de oxígeno es crítico.
Dado que el cerebro requiere una gran cantidad de oxígeno 22, el procedimiento de corte tiene que ser rápido (cuanto más cerca 3,1-3,10 es ~ 6.5 minutos, el mejor es el fin de mantener el tejido sano). - El SCN es sensible a los cambios de temperatura y el intercambio de mediano plazo.
El SCN es sensible a la temperatura y los cambios de temperatura grandes pueden desplazamiento de fase del marcapasos y causar artefactos experimentales 23. Si el medio o las soluciones que se intercambian o añadidos durante un experimento en curso, por ejemplo, al aplicar un fármaco después de un par de días en la cultura, el medio o solution tiene que ser pre-calentado a 36-37 ° C (la misma temperatura en la cámara) antes de la adición. En experimentos farmacológicos que implican intercambios medio, es importante trabajar siempre con pre-condicionada medio de cultivo celular. Además / lavado con agua dulce, medio condicionado potencialmente cambio de fase del ritmo molecular SCN 24, así como otros cultivos de células de tipo 25. - Composición del medio.
Es importante a la cultura del tejido en el pH y la osmolalidad correcta. El medio de aire buffer contiene una gran cantidad de HEPES, que tiene una capacidad de amortiguación óptima en el rango de pH 6.8 a 8.2 y también es apropiado para amortiguar los cambios de pH que pueden ocurrir como resultado de la respiración celular. HEPES, por el contrario, es más sensible a los cambios de temperatura en comparación con bicarbonato de sodio, que se incluye en pequeñas cantidades en el medio de cultivo. El bicarbonato de sodio tiene una mayor capacidad de amortiguación en el pH bajo (5,1-7,1) entre 26 y, por lo tanto apropiado en una atmósfera de CO 2. Sin embargo, el aumento de cantidades de bicarbonato de sodio en el medio del aire-buffering (DMEM 2902) aumenta la osmolaridad de manera significativa y no se puede añadir al mismo tiempo, sin diluir el medio, lo que a su vez se traduce en la composición incorrecta de aminoácidos, vitaminas e iones.
Consejos para preparar el medio:- Sea preciso y cuidado al mezclar el medio.
- Utilice las soluciones madre sólo fresco o descongelado recientemente.
- En el caso de osmolalidad muy alta que no vale la pena diluyendo. Más de 6.5% diluido en medio no lo más probable es el trabajo. El uso de D-glucosa para aumentar la osmolaridad si es demasiado baja.
- Cambios de fase debido al tiempo de preparación
El tiempo de preparación rebanada es fundamental. Efecto nulo o mínimo en la fase se obtiene si el procedimiento de corte se realiza entre 6 a 12 dic. ZT. Todas las disecciones corte debe realizarse en la misma fase del ciclo diurno o circadiano con el fin de minimizar el error debido a la fase de variación entre los preparativos.
Posibles modificaciones
- De electrofisiología SCN aguda, el corte debe realizarse con un timbre (líquido cerebro espinal artificial; ACSF) de amortiguación, saturada de oxígeno (95% O 2, 5% CO 2) antes de que comience la corte. Además, el oxígeno es necesario agregar continuamente al búfer durante todo el procedimiento corte, como la actividad eléctrica y sináptica depende directamente del suministro de oxígeno 22.
- Cortes horizontales y sagitales también puede ser preparado con éxito y culto de la SCN. Los autores tienen experiencia con las grabaciones de la luciferasa en cortes horizontales, que de acuerdo a nuestra experiencia dan oscilaciones circadiano de menor amplitud, en comparación con el corte coronal.
- El SCN es de aproximadamente 1 mm de longitud rostro-caudal y el método de los cortes se describe aquí se dirige hacia la adquisición de una sección de SCN en la región central. Sin embargo, más de una sección SCN se pueden obtener de ratón y los cerebros de ratas, lo que permite la investigación de la circadiano de genes / proteínas de expresión en los niveles más rostrales versus caudal del núcleo SCN.
- Culturas sector a partir de los animales más jóvenes, las crías después del parto o de embriones, también se pueden preparar. Tenga en cuenta que el cerebro y el cráneo en cachorros muy jóvenes son muy suaves y sensibles. Además, el nervio óptico es delgado y no ha desarrollado plenamente. Tenga cuidado cuando la disección del cerebro de las crías para que la región SCN no está dañado. Por ejemplo, micro herramientas gubia no puede ser utilizada para abrir el cráneo de crías de ratón, ya que son demasiado grandes. Tijeras finas son suficientes para cortar los tejidos blandos de los cachorros.
- La técnica del cristal de la cubierta cultura basada descritos aquí también se puede utilizar para la luminiscencia de la imagen utilizando una cámara CCD / EM-CCD, también en las neuronas SCN sola.
- Otras regiones del sistema nervioso central y los tejidos periféricos de órganos de transgénicos PER2:: Los LUC se puede obtener fácilmente, cultivadas y analizadas en términos de las oscilaciones moleculares, como el PER2:: expresión LUC sigue oscilando durante muchos días, también en una serie de otros tejidos y tipos de células 10. La mayoría de estos tejidos periféricos, por ejemplo, el hígado, no requieren de una membrana para la supervivencia, sino que son cultivadas directamente bañada por el medio 11. Tenga en cuenta que el desplazamiento de fase debido a la corte, el cultivo y el intercambio de medio no puede seguir los mismos principios que para el SCN.
Significado
En ratones transgénicos y las cepas de ratas (mPER2:: LUC; mPer1-Luc 8, 10, 27), actividad de la enzima luciferasa refleja las proteínas o los ritmos de la expresión génica y pueden evaluarse mediante el registro de la bioluminiscencia. La bioluminiscencia luciferasa generado da una señal débil, pero la luminiscencia de fondo es cercano a cero, por lo que este método ventajoso. Por otra parte, porque la molécula de luciferasa es inestable y se degrada rápidamente que no hay phototoxicidad, que puede aparecer durante la iluminación de larga duración de excitación 28. En conjunto, estas propiedades permiten a los experimentos de larga duración haciendo que la tecnología de luciferasa muy ventajosa en la investigación circadiano.
Divulgaciones
Agradecimientos
Este trabajo fue financiado por el Consejo Sueco de Investigación Médica (K2009-75SX-21.028-01-3, K2008-61X-20700-01-3); FONCICYT 000000000091984, los cimientos de Jeansson, Söderström Königska sjukhemmet, Lundqvist Marta y Sigurd och Elsa Goljes Minne, y la Sociedad Sueca de Medicina SLS-95151. Profesor Gene D. Block, UCLA, se agradece por sus valiosos comentarios sobre el manuscrito. Se agradece al Dr. Michael Andang y la Dra. Helena Johard para el bloqueador del canal de HCN, y el Prof. Abdel El Manira para proporcionar video microscopio.
Consideraciones éticas:
Todos los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por el Instituto Karolinska y "Estocolmo Norra Djurförsöksetiska Nämnd". Todos los experimentos con animales se llevan a cabo con la intención de reducir al mínimo cualquier posible estrés o incomodidad para el animal.
Materiales
| Name | Company | Catalog Number | Comments |
| B27 supplement 50x | Invitrogen | 17504-044 | |
| Cover glasses | Menzel-Glaser | 40#1 | ≈ 40 mm |
| Culture membranes | EMD Millipore | PICMORG50 | 0.4 μm |
| DMEM low glucose w/o phenol red | Sigma-Aldrich | D2902 | Powder for 1L |
| Filter paper | Whatman, GE Healthcare | 1003 055 | ≈ 55 mm |
| Filtration set | Corning | 431097 | Pore size 0.22 μmPolyethersulfone |
| Forceps | Allgaier Instrumente | 0203-7-PS | Dumant #7 |
| HEPES | Invitrogen | 15630-056 | 100 ml |
| HBSS 10x | Invitrogen | 14065-049 | 500 ml |
| NaOCH3 7.5% | Invitrogen | 25080-060 | 50 ml |
| Luciferin | Promega Corp. | E1602 | Beetle luciferin, potassium salt |
| Micro rongeur tool | Allgaier Instrumente | 332-097-140 | |
| PenStrep 10,000 U/ml | Invitrogen | 15140-122 | 100 ml |
| Petri dishes | Corning | 430165 | ≈ 35 mm |
| PMT | Hamamatsu Corp. | H9319-11MOD | |
| Disposable scalpels | Paragon | P503 | Size 11 |
| Vacuum filter | Fisher Scientific | 09-761-5 | |
| Vacuum grease | Dow Corning | 50 g | |
| Vibratome | Campden Instruments |
Referencias
- Welsh, D. K., Takahashi, J. S., Kay, S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Annu Rev Physiol. 72, 551-577 (2010).
- Green, D. J., Gillette, R. Circadian rhythm of firing rate recorded from single cells in the rat suprachiasmatic brain slice. Brain Res. 245, 198-200 (1982).
- Shibata, S., Oomura, Y., Kita, H., Hattori, K. Circadian rhythmic changes of neuronal activity in the suprachiasmatic nucleus of the rat hypothalamic slice. Brain Res. 247, 154-158 (1982).
- Groos, G., Hendriks, J. Circadian rhythms in electrical discharge of rat suprachiasmatic neurones recorded in vitro. Neurosci Lett. 34, 283-288 (1982).
- Moore, R. Y., Klein, D., Moore, R., Reppert, S. The suprachiasmatic nucleus and the circadian timing system. Suprachiasmatic nucleus--The mind's clock. , 13-15 (1991).
- Pol, A. N. V. a. n. d. e. n. The hypothalamic suprachiasmatic nucleus of rat: intrinsic anatomy. J Comp Neurol. 191, 661-702 (1980).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Yamazaki, S., Numano, R., Abe, M., Hida, A., Takahashi, R., Ueda, M., Block, G. D., Sakaki, Y., Menaker, M., Tei, H. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Geusz, M. E., Fletcher, C., Block, G. D., Straume, M., Copeland, N. G., Jenkins, N. A., Kay, S. A., RN, D. a. y. Long-term monitoring of circadian rhythms in c-fos gene expression from suprachiasmatic nucleus cultures. Curr Biol. 7, 758-766 (1997).
- Ko, C. H., Buhr, E. D., Siepka, S. M., Hong, H. K., Oh, W. J., Yoo, O. J., Menaker, M., Takahashi, J. S. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci U S A. 101, 5339-5346 (2004).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Yoshikawa, T., Yamazaki, S., Menaker, M. Effects of preparation time on phase of cultured tissues reveal complexity of circadian organization. J Biol Rhythms. 20, 500-512 (2005).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (1997).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1998).
- O'Neill, J. S., Maywood, E. S., Chesham, J. E., Takahashi, J. S., Hastings, M. H. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Hughes, A. T., Guilding, C., Lennox, L., Samuels, R. E., McMahon, D. G., Piggins, H. D. Live imaging of altered period1 expression in the suprachiasmatic nuclei of Vipr2-/- mice. J Neurochem. 106, 1646-1657 (2008).
- Zhang, D. Q., Zhou, T., Ruan, G. X., McMahon, D. G. Circadian rhythm of Period1 clock gene expression in NOS amacrine cells of the mouse retina. Brain Res. 1050, 101-109 (2005).
- Quintero, J. E., Kuhlman, S. J., McMahon, D. G. The biological clock nucleus: a multiphasic oscillator network regulated by light. J Neurosci. 23, 8070-8076 (2003).
- LeSauter, J., Yan, L., Vishnubhotla, B., Quintero, J. E., Kuhlman, S. J., McMahon, D. G., Silver, R. A short half-life GFP mouse model for analysis of suprachiasmatic nucleus organization. Brain Res. 964, 279-287 (2003).
- Nakamura, W., Yamazaki, S., Takasu, N. N., Mishima, K., Block, G. D. Differential response of Period 1 expression within the suprachiasmatic nucleus. J Neurosci. 25, 5481-5487 (2005).
- Davidson, A. J., Yamazaki, S., Arble, D. M., Menaker, M., Block, G. D. Resetting of central and peripheral circadian oscillators in aged rats. Neurobiol Aging. 29, 471-477 (2008).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81, 103-111 (1998).
- Burgoon, P. W., Boulant, J. A. Temperature-sensitive properties of rat suprachiasmatic nucleus neurons. Am J Physiol Regul Integr Comp Physiol. 281, 706-715 (2001).
- Nishide, S. Y., Honma, S., Honma, K. The circadian pacemaker in the cultured suprachiasmatic nucleus from pup mice is highly sensitive to external perturbation. Eur J Neurosci. 27, 2686-2690 (2008).
- Yoshikawa, T., Sellix, M., Pezuk, P., Menaker, M. Timing of the ovarian circadian clock is regulated by gonadotropins. Endocrinology. 150, 4338-4347 (2009).
- Kohn, R. A., Dunlap, T. F. Calculation of the buffering capacity of bicarbonate in the rumen and in vitro. J Anim Sci. 76, 1702-1709 (1998).
- Wilsbacher, L. D., Yamazaki, S., Herzog, E. D., Song, E. J., Radcliffe, L. A., Abe, M., Block, G., Spitznagel, E., Menaker, M., Takahashi, J. S. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc Natl Acad Sci U S A. 99, 489-494 (2002).
- Sellix, M. T., Currie, J., Menaker, M., Wijnen, H. Fluorescence/luminescence circadian imaging of complex tissues at single-cell resolution. J Biol Rhythms. 25, 228-232 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados