Method Article
슬라이스 준비, Organotypic 조직 Culturing과 Suprachiasmatic 핵의 시계 유전자 활동의 루시페라제 녹음
요약
성인 마우스 hypothalamic suprachiasmatic 핵 (SCN), 그리고 문화에 빠른 방법 organotypic 문화 상태에있는 SCN의 조직을 포함 준비 슬라이스의 절차가보고됩니다. 또한, 동적 루시페라제 리포터 기술을 사용하여 oscillatory 시계 유전자 단백질 표현의 측정이 설명되어 있습니다.
초록
생리와 행동의 일상 리듬을 조정 중앙 circadian (~ 24 시간) 시계 앞쪽에 시상 하부에있는 suprachiasmatic 핵 (SCN)에 있습니다. 시계는 직접 망막과 시신경을 통해 빛이 의해 동기화됩니다. Circadian oscillations는 시대 (당) 유전자를 포함하는 소위 "시계 유전자"와 그들의 단백질 제품의 여러 부정적인 피드백 루프를 상호 작용에 의해 생성됩니다. 코어 클럭은 멤브레인 탈분극, 칼슘 및 캠프 1에 따라 달라집니다. SCN은 시계 유전자 발현, 신진 대사 활동과 자발적인 전기적 활동에 매일 oscillations을 보여줍니다. 현저하게,이 내생 순환 활동 SCN 2-4 성인 조직 슬라이스에 지속. 이러한 방법으로 생물 학적 시계는 쉽게 맥박 조정기 함수의 분자, electrophysiological 및 신진 대사 조사를 허용, 체외에서 공부하실 수 있습니다.
SCN 바로 광학 chiasm 5 위에있는 작은, 잘 정의된 양자 구조입니다. 쥐에서는 각 핵에서 ~ 8.000 뉴런을 포함하여 약 947 μm의 (길이, rostrocaudal 축) × 424 μm의 (폭) × 390 μm의 (높이) 6 규격이 있습니다. 그것은 SCN이 확인할 수 있습니다 두뇌의 특정 수준에서 뇌 슬라이스를 잘라하는 데 필요한 SCN을 해부하다합니다. 여기서는 마우스 및 쥐 머리가 비슷합니다 SCN의 해부와 깔끔히 절차를 설명합니다. 또한, 우리는 어떻게 막 7, 야마자키 외 의해 SCN 조직 문화의 개발 기술에 organotypically 해부하는 조직 문화를 보여줍니다. 8. 마지막으로, 우리는 유전자 변형 조직은 시계 유전자 / 동적 루시페라제 리포터 기술, 원래 Geusz 외 의해 circadian 측정에 사용된 방법입니다. 9를 사용 단백질의 표현을 측정하는 데 사용할 수 방법을 보여줍니다. 우리는 여기서 유전자 변형에서 SCN의 조직을 사용하는 PERIOD2 인 노크 : 유 외 제작한 루시페라제 쥐 10.. 마우스는 시대의 융합 단백질 (당) 2 반딧불의 효소 루시페라제가 포함되어 있습니다. 루시페라제은 luciferin의 산화를 catalyzes 때 PER2가 루시페라제 즉, luciferin을위한 기판의 존재로 번역하면 PER2 표현식은 bioluminescence으로 모니터링할 수 있습니다. 방출 광자의 개수는 긍정적으로 생산 PER2 단백질의 금액에 상호 및 bioluminescence 리듬은 생체내 10 PER2 단백질 리듬을 일치합니다. 이런 방식으로 PER2 표현의 주기적 변화는 지속적으로 며칠 동안 실시간으로 모니터링할 수 있습니다. 우리가 조직 culturing 실시간 bioluminescence 기록에 대한 수행 프로토콜은 철저하게 야마자키와 다카하시 11 설명했습니다.
프로토콜
1. 솔루션 준비
- 공기 버퍼링 용량 문화 매체
- 약 800 ML 살균 H 2 O (autoclaved milliQ H 2 O)와 1리터 병을 채우십시오.
- 감동 동안 추가하고 다음과 같은 물질을 혼합 : 1 컨테이너 낮은 포도당, 나트륨 중탄산염 및없이 혈청이없는 DMEM 2902 분말 페놀 레드 (페놀 레드 bioluminescence 신호 방해) 20 ML B27 보충 50x, 7.5 % NaHCO 3 4.7 ML 솔루션 (또는 0.35 g NaHCO 3), 10 ML의 HEPES 1M, 2.5 ML PenStrep 10,000 U / ML 및 3.5 g D - 글루코오스. 재료가 완전히 해산 때까지 매체 저어 보자.
최종 중간 (1 리터)가 포함됩니다 :
1X DMEM, 1X B27 보충, 4.2 MM NaHCO 3, 10 MM HEPES, 25 U / ML 페니실린, 25 U / ML의 스트렙토 마이신 19 MM D - 글루코오스. - NaOH가 감소하거나 HCL 산도를 증가하고, 무균 H 2 O.과 1리터에 볼륨을 가지고 사용 7.2 산도를 조정
- H 2 O (감소 osmolality) 또는 D - 글루코오스 (증가 osmolality)와 osmolality를 조정합니다. osmolality는 285-315 mOsm / kg 사이 여야합니다하지만 최적의 범위는 300-310 mOsm / kg이다. 5% 이상의 매체를 희석하지 마십시오.
- 멸균 모자 코닝 살균 진공 여과 세트 (예 :이 기공 크기가 0.22 μm의와 X 500 ML)를 사용하여 문화 매체를 필터링합니다. 4 ° C에서 매체를 유지하고 알루미늄 호일을 사용하여 빛으로부터 그것을 보호합니다. 우리는 매체가 3 개월 이내에 사용하는 것이 좋습니다.
- 보조제와 행크의 균형 소금 용액 (HBSS) 버퍼 (절삭 조각에 대한)
- ~ 600 ML 멸균 (autoclaved milliQ) H 2 O와 1리터 유리병을 입력하고 다음과 같은 물질 추가 : 100 ML의 HBSS 10X 주식을 10 ML 페니실린 - 스트렙토 마이신 10,000 U / ML, 5 7.5 % NaHCO 3 솔루션의 ML과 10 ML은 1M HEPES.
최종 절단 솔루션은 포함됩니다 :
1X HBSS, 10 MM HEPES, 4.5 MM NaHCO 3, 100 U / ML 페니실린과 100 U / ML 스트렙토 마이신. - 산도를 확인하고, 필요한 경우 7.2 산도를 조절하고 살균 H 2 O.과 1리터 수있는 볼륨을 가지고
- 285-315 mOsm / kg 사이 여야합니다 이는 osmolality를 확인합니다.
- 4 ° C.에 HBSS를 쿨 HBSS 버퍼 깔끔히 / 신진 대사를 쓰러 뜨리과 조직 생존을 보존하기 위해 절차를 절단하는 동안 (4 ° C) 매우 추운해야합니다.
- ~ 600 ML 멸균 (autoclaved milliQ) H 2 O와 1리터 유리병을 입력하고 다음과 같은 물질 추가 : 100 ML의 HBSS 10X 주식을 10 ML 페니실린 - 스트렙토 마이신 10,000 U / ML, 5 7.5 % NaHCO 3 솔루션의 ML과 10 ML은 1M HEPES.
2. 절단 및 조각 Culturing 전에 준비
- 조직은 CO 2가없는 따뜻하고 건조한 실내에서 양식입니다. 문화를 건조하지 않도록하기 위해서는 기름으로 요리에 부착된 커버 안경과 날인해야합니다. 이러한 목적으로, 실리콘 기반의 진공 그리스 5 ML 주사기를 입력합니다. 알루미늄 호일의 작은 조각으로 주사기 도움말 커버 그들을 압력솥. 또한, 압력솥 여과지 (프로 시저를 깔끔히하는 동안 사용).
- 오른쪽 절차를 깔끔히 전에 35mm 배양 접시의 맨 링 표면에 autoclaved 진공 그리스를 적용합니다. 각 슬라이스의 문화에 대해 별도의 페트리 접시를 준비합니다.
- 절차 이외의 모든 살균 악기를 깔끔히 시작하기 전에, 면도날, vibratome 블레이드, 커버 안경 및 기타 자료 소독해야 슬라이스 문화와 절차에 사용됩니다. 70 % 에탄올 모든 비 멸균 장비를 스프레이. culturing 전에 최소 30 분 자외선 노출에 대한 살균 모자 UV와 악기와 기름칠 배양 접시를 쉽게받을 수 있습니다.
- 동시에 공기 버퍼링 문화 매체 (각 문화의 1.2 ML를 포함, 8 문화는 예를 들어 10 ML 매체에 대한 준비를위한)와 팰컨 튜브를 기입하여 신선한 해동 luciferin (0.1 M 주식 솔루션, Promega, 매디슨, WI)를 추가 (10 μL luciferin 10 ML 매체로, 최종 농도 0.1 ㎜).
- luciferin는 빛을 구분 및 재고 솔루션과 luciferin 함유 매체 모두 빛으로부터 보호해야합니다. 어두운 36-37 ° C 가열 챔버에서 luciferin - 중간과 팰컨 튜브를 놓습니다. 적절한 경우, luciferin도 절단시 문화 요리에 직접 추가할 수 있습니다. luciferin를 추가하지 않으면 루시페라제 및 luciferin 따라서 조직에서 신호 사이에 가벼운 반응이 없을 것입니다.
- UV 노출 후, vibratome에 살균 칼날을 첨부합니다.
3. 절차 칼자국 SCN
다음 절차는 성인, 일반적으로 2-4개월 오래된 C57/BL6 생쥐의 깔끔히을 설명합니다. 절단 절차를,뿐만 아니라 야간 동물의 빛 노출로 differentially SCN의 단계를 재설 정할 수 있습니다 참고하시기 바랍니다. 더 실질적인 단계는 12 절차로 인해 발생 교대 없을 때 이것을 방지하려면, 절단 및 culturing은 선호 ZT 6-12 사이의 빛의 시간 동안 수행되어야합니다. SCN은 어둠 속에서 맛볼 수있다면, 3.1 및 3.2 가벼운 유도된 위상 변화를 방지하는 빨간 불빛이나 야간 고글을 수행할 수 있습니다.
- GLA의 isofluorane (박스터)에 의해 낫게 마우스를 마취SS 챔버. 동물의 고통의 반사 신경 (앞발의 손톱 곤란하여 확인) 손실이 있지만 아직은 (가능한 한 산소 공급을 유지하기 위해) 호흡을 중지하지 않은 경우, 신속하게 가위 또는 이와 유사한 한 쌍의로 머리를 목을 벨.
참고 : 그것이 동물의 불안을 촉진하는 것으로보고되었습니다하지만 일부 국가에서는 CO 2 노출 (hypercapnia)이 여전히 마취 방법으로 허용됩니다. 또한, 자궁 전위가 잘린 전에해야 할 수 있습니다. 동물을 euthanizing 때 지역 legislations를 따르시기 바랍니다. - 변형과 SCN 손상을 줄 수 광 신경의 추가 여기를 방지하기 위해 가위로 머리에서 눈을 제거합니다.
- 아직 첨부하면, 따라서 만들기, 가위로 마지막 자궁 경부 척추를 제거 피부 (그림 1A)를 제거하고 가위의 벌금 쌍 (예 : 이리스 가위)을 두 개의 상처, 측면을 따라 두개골 양쪽에 한 컷을 이동식 "뚜껑".
- 마이크로 rongeur 도구 (미세 해부 가위가 마우스도 사용할 수 있습니다)으로 두개골을 열고 후각 구근을 볼 수있을 때까지 모든 뼈를 제거합니다. 작업 이상은 복부 SCN (그림의 1B)의 손상을 방지하기 위해 도구를 사용하여 머리를 아래로 눌러하지 마십시오.
- 조심스럽게 스프링 가위를 해부 벌금 마이크로를 사용하여 후각 구근과 반구 사이의 시신경을 했네요. SCN 및 파열 조각에 손상을 초래할 수있는 시신경의 스트레칭부터 신경이 완전히 절단되어 있는지 확인합니다.
- 거꾸로 머리를 켜고 그대로 두뇌가 가득한 컨테이너 (예를 들어 유리 페트리 접시 ≈ 10cm)에 (여전히 뇌로 연결된 경우, 다른 두개골 신경이 시신경에 꼬리 절단해야 할 수도 있습니다) 밖으로 떨어뜨 리다 두뇌의 급속한 냉각을 허용 50-100 ML 차가운 HBSS. 이상적으로, 두 광학 신경 (그림 1C) 그대로 유지한다. 두뇌가 냉각되어 있는지 확인하기 위해 HBSS 30-60초의 뇌는 보관하십시오.
- 숟가락 또는 유사한를 사용하여 (예를 들어 유리 페트리 접시의 뚜껑이 뒤집어) 멸균 절단 표면에 차게 뇌, 등 부분의 표면을 놓으십시오. 코로나 상처를 준비하기 위해, 따라서 소뇌를 제거, 대뇌 반구와 소뇌 사이에 멸균 면도날이나 scalpels와 수직 절단합니다.
- vibroslicer / vibratome에 속한 마른 플랫폼에서 superglue을 적용합니다.
- 주동이의 부분에 날카로운, 곡선 포셉를 삽입하여 뇌 (소뇌없이 후각 구근없이 대뇌 반구) 들고 조심스럽게 아직 포셉로 머리를 들고, 살균 필터 종이에 HBSS를 건조. (대신 집게를 삽입, 살균 필터 종이의 작은 조각이 두뇌를 첨부하고 전송하는 데 사용할 수 있습니다.)
- 주동이의 팁 위쪽 및 절단 칼날에 가장 가까운 복부 표면과 접착 플랫폼에 반구를 수정. vibratome (캠덴 인스 트루먼, 영국의 예를 들어)에 속하는 자의 플랫폼을 첨부하고 즉시 차가운 HBSS로 가득 채웁니다. 수직 절단이 제대로 만들어진 경우, 반구 따라서 양국 SCN을 포함하는 코로나 상처를 만드는 데 필요한 좋은 각도를 제공하는 최대 똑바로 서서해야합니다.
- 대상 SCN 영역에 도달하기 위해서는 vibratome 높은 또는 최대 속도 반구의 두꺼운 부분 (500-800 μm의)를 잘라 시작합니다. 칼날을 이동하면 시상 하부에 도달하기 전에 처음에 상당히 빠른 수 있지만 광학 chiasm가 표시되면 속도가 느려졌해야합니다 (진동 칼날과 느린 움직임의 높은 주파수는 수평 따라서 슬라이스 생존을 증가, 깔끔히하는 동안 세포 손상을 감소.) 섹션 광학 chiasm 크게된다 (넓은)와 앞쪽에 접합면이 작아집니다 100 μm의로 줄입니다. 두 SCN의 핵이 나타 시작까지 중간 SCN 섹션을 습득하기 위해, (꼬리 방향으로) 자신을 "아래"작동합니다. 돋보기는 핵 시각화를 위해 필요할 수 있습니다. 참고 : 쥐의 두뇌에 비해 마우스 두뇌에 SCN은 광학 chiasm보다 꼬리에 위치해 있습니다.
- SCN의 원하는 수준에 도달하면 (SCN이 시점에서 더 정의로 나타납니다 원형이나 아몬드 모양의 구조 것이다; 그림의 1D, 약 마우스 13 Bregma에서 SCN의 중심 지역에 대한 Bregma - 0.46 - -0.70 mm - 쥐 14 0.92 - -1.40 mm)은 SCN과 (그림 1E)를 잘라. 슬라이스의 적당한 두께 마우스를 250 ± 50 μm의입니다, 쥐 350 ± 50 μm의하십시오.
- 부드러운 브러쉬를 사용하여, 리프트 및 해부 현미경 또는 입체경하에 놓여 감기 HBSS로 가득 크기의 중간 배양 접시에서 뚜껑에 SCN의 슬라이스를 전송할 수 있습니다. 양국 SCN이 명확하게 보이는 경우 확대에 따라 확인합니다. SCN의 중간 지역이 (반드시는 "최적의"슬라이스 레벨 수 있지만 우리가 깔끔히 절차를 표준화하고 변형을 줄이기 위해 가장 쉬운 방법입니다 고려하지 않을 수 있습니다)을 선택할 수있다면, 그것은 분명 최소한 볼 수 있어야 한쪽슬라이스 섹션을 참조하십시오. 상처가 너무 주동이의 경우, 다른 부분을 확대하고 아래에있는 SCN 확인합니다.
4. Organotypic SCN 문화
- HBSS 가득 페트리 접시의 뚜껑에 해부 현미경으로 살균 scalpels 한 쌍의있는 사각형 조직 (~ 1.5 mm의 각 측면)으로 양국 SCN을 해부하다. 광학 chiasm의 작은 조각은 explant에 연결된 상태로 유지됩니다,하지만 다른 핵이 포함되지 않을 것입니다. SCN 조직을 제거하지 않고 최대한 잘라.
- 계획 실험에 적합한 경우, 양국 SCN이 후 두 일방적 SCN을 얻는 반으로 수 있습니다. 한 일방적 SCN 그런 다음 제어 (그림 2A)로 사용할 수 있습니다.
- ≈ 35mm 페트리 접시에 luciferin - 매체의 1,200 μL를 입력하고 액체 표면 (2B) 위에 문화 막 (밀리 CM 0.4 μm의, Millipore, 베드 포드, MA)를 놓으십시오. 문화 막이 부동이나 매체 11 바위, 문화 요리의 기초에 안전하지 앉아 정상적으로 문화 매체 볼륨이 중요합니다. 멤브레인 아래에는 공기 방울이 없습니다 있는지 확인합니다. luciferin 작업시 불필요한 조명 노출을 피하십시오.
- explants가 데리러 작고 어렵습니다. 따라서 + 끝에 SCN의 explant를 빨아과 멤브레인에 그것을 누르면 팁 1000 μL 피펫을 사용합니다. 팁이 넓은 개방을 만들 살균 도구를 사용하여 절단 될 수 있으며, 경우에 explant 쉽게 1000 μL 피펫 팁 (마우스 양국 SCN 예 : 쥐 SCN)에 맞게 너무 큽니다. 피펫으로 멤브레인에 과도한 HBSS를 폐기하십시오. 레코딩 튜브는 접시에서 방출되는 모든 광자를 감지하고 여러 조직의 신호를 구별하지 않는 루시페라제 레코딩을위한 단 하나의 SCN / 접시 (그림 2B)를 놓으십시오.
- 커버 유리 (≈ 40mm, 멘젤 - 글레이저, 독일)와 진공 그리스 (다우 코닝 사, 미국) 11 접시를 밀봉합니다. 봉인이 (그림 2C) 꽉 있는지 확인하십시오. 그렇지 않다면, 더 많은 기름과 인감.
- 36-37 ° C 가벼운 꽉 챔버로 요리를 전송하고 즉시 PMT - 녹음을 시작합니다.
5. 녹음 Bioluminescence에 의해 루시페라제 활동 측정
작은 SCN 조직에서 루시페라제 유발 bioluminescence 신호를 감지하고 가벼운 꽉 챔버 내부에 탑재된 photonmultiplier - 튜브 (PMT) 검출기 어셈블리와 함께 증폭됩니다. PMTs은 일반적으로 ~ 1~2cm 문화 요리 8 위에 위치하고 있습니다. PMT 기록 설정 사용자 정의 만든 또는 11 상업적으로 사용할 수 있습니다 수 있습니다.
- PMT (PMT에서 생산 열기가 커버 유리에 응축을 제거합니다) 아래에있는 접시를 놓고 챔버를 닫습니다. 챔버가 (20 명 미만 광자 / 분) SCN 조직에 사용 PMTs의 어두운 카운트와 같은 가벼운 꽉 100 % 매우 낮은 있는지 확인하십시오. PMTs도 약한 빛의 누출을 감지.
- 소프트웨어 (; Actimetrics 주식 회사, 윌메트, IL, 미국 인스턴스 LumiCycle)을 함께 수행되는 데이터 수집을 시작합니다. 광자 카운트는 유전자 / 단백질 표현의 높은 해상도를 얻을 10-10 분 간격을 통해 통합되어 있습니다.
- ClockLab, Actimetrics,, LumiCycle, Actimetrics 병원, Chrono, Roenneberg까지, 뮌헨 대학, 녹음이 완료되면, 유전자 / 단백질의 획득 circadian 표현이 적절한 소프트웨어 (유래, OriginLab, 노샘프턴, MA, 미국과 함께 분석할 수 뮌헨, 독일) 단계, 기간 (한 사이클 시간)과 리듬의 진폭을 결정합니다. 유전자 또는 단백질의 정상 표현은 주로 기준점으로 사용됩니다 한주기 동안 가장 높은 광자의 개수로 정의됩니다. 데이터 신호 / 잡음 비율이 낮은 특히, 위상, 기간 및 진폭의 분석 전에 smoothed 수 있습니다. 기준 때로는 변화와 분석이 수행되기 전에 빼서해야합니다.
6. 대표 결과 :
우리는 여기 oscillatory PER2 제시 : 루크의 표현은 교양 조직의 생존 능력과 조건을 위해 읽은 상태로. 조직이 PER2, 살아있다면 최적의 조건에서, 그리고 : : 그림 3과 같이 루크 표현은 circadian 리듬과 진동. SCN의 PER2는 maximally Zeitgeber 시간 12-13 (어두운주기 ZT 12 12시 12분 HR 빛을 조명을 나타냅니다) 주위에 일반적으로 표시됩니다. 크기 큰 살아있는 조직이며, 높은 광자의 개수가된다. 그러나, organotypically 교양 조직의 크기와 두께가 두꺼운 500 μm의 7 15mm 2 11보다 큰 아니라 선호, 조직은 가능한하지 유지하기 위해서는 작은 보관해야합니다. 조직이 homozygous PER2에서 샘플 경우 SCN은 여기에 설명된 해부하는 경우, 일반적으로 10.000-40.000/min 사이에 광자 카운트를 보여줍니다 : 루크 동물. 다음과 같은 순환과 비교 organotypic SCN 문화의 진동의 진폭은 첫 번째주기 동안 일반적으로 매우 높습니다. 그것은 첫 번째주기가 매우 높은 amplit을 가지고 완전히 명확하지 않습니다ude. 한 가지 가능한 설명은 조직에있는 세포의 상당한 부분이 있으므로 첫 번째 사이클 이후 luciferin을 활용하지, 초기 절단 및 culturing 직후 죽을 수있다는 것입니다. 절단 과정은 첫 번째 사이클 동안 신호를 증폭 루시페라제 수있는 과도한 여기를 발생할 수 있습니다.
그림 3은 SCN의 조각에서 발광의 흔적을 보여 주며 처음 건강한 아니었 슬라이스에서 얻은 추적 하나 (적색)가 포함되어 있습니다. 데드하거나 건강하지 못한 조직은 낮은 광자 카운트 baselines 있습니다. (또한, 죽은 조직은 종종 요리에 교제를 끊다 한 조각의 멤브레인에서 제거할 수 없습니다.)
이 보고서에 설명된 기술은 beneficially 약리 실험에서 사용할 수 있습니다. 그림 4는 우리가 HCN 채널 차단 (ZD7288, 10 μm의)와 일 1과 2 사이 치료하는 문화의 흔적을 보여줍니다. 그림에서 볼 수와 같은 이전 15 게시될 수 있듯이, 차단기는 상당히 PER2의 circadian 진동의 진폭을 감소하지만, 일반적인 문화 매체와 함께 세척 후 진동이 차단기는 분자 시계 영향을 것을 보여주는, 돌아 왔지만 조직 가능한 건강되었습니다.
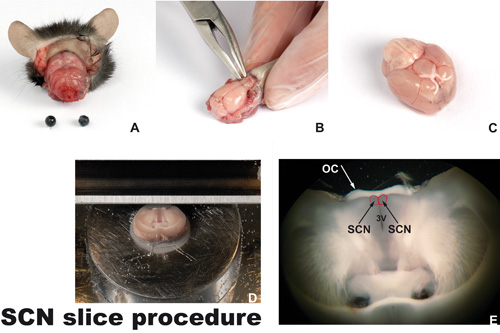
그림 1. 절차를 깔끔히
A) 눈과 피부 euthanized 참수 마우스의 머리. B) 두개골은 마이크로 rongeur 도구를 사용하여 제거됩니다 삭제되었습니다. 도구를 사용할 때, 하나는 도구 이상의 작동과 작업의 두뇌를 눌러 절대해야합니다. C) 두뇌는 후각 구근없이 (복부 측면까지) 거꾸로 표시됩니다. 두 손상 광학 신경을 함께 흰색 광 chiasm 볼 수 있습니다. suprachiasmatic 핵 (SCN, 빨간색으로 표시된 경계)이 가까운 시각 chiasm에 위치하고 있습니다. D) SCN 수준에서 vibroslicer의 플랫폼에 부착된 coronally 컷 뇌. E) 코로나 두뇌 섹션 (250 μm의 두께) 광학 chiasm (OC), 셋째 뇌실 (3V)와 양국 suprachiasmatic 핵 (SCN)을 포함.

그림 2. Organotypic 조직 culturing.
A) 슬라이스에서 해부하는 두 일방적 SCN의 핵 (삽입)가 표시됩니다. B) 문화 막, 중간 및 explant하지만, 진공 그리스와 커버 유리없이 함께 문화 요리 (35mm 페트리 접시). 매체 (1.2 ML)은 요리와 막 사이에 액체로 볼 수 있습니다. 하나의 일방적 SCN의 핵은 문화 막에 배치됩니다. 작은 조직의 하얀 부분은 시신경 chiasm (삽입)의 일부입니다. C)의 막과 SCN 조직과 문화 요리는 진공 그리스와 원형 커버 유리 밀봉.
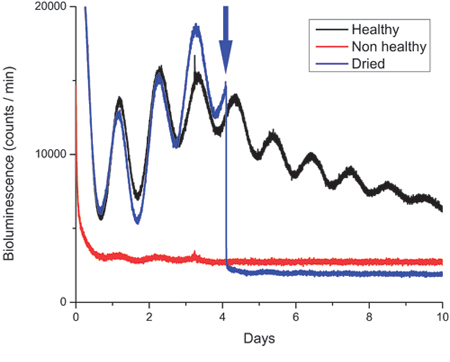
그림 3. 건강하고 비 건강 SCN 조직 문화에서 Bioluminescence 레코딩.
PERIOD2의 bioluminescence 레코딩의 예 : 루시페라제 (PER2 : 루크) suprachiasmatic 핵 표현 (SCN) 12h에서 개최 생쥐에서 얻은 조각 : 12h 조명 : 어두운주기. PER2 : 루크 단백질은 단백질의 최대 표현 Zeitgeber 시간 12-13에서 발생하는 circadian (~ 24 시간) 변화와 진동. 따라서 유전자 리듬의 단계는 희생하기 전에 동물 보관어진 빛이 어두운 일정에 따라 달라집니다. 일반적으로 프로토콜에서 설명한대로 해부 일방적 SCN 조직에서 bioluminescence는 ~ 10.000-40.000/minute 사이에 광자 카운트를 보여줍니다. 그림 한 건강 (블랙) SCN 문화, 하나가 아닌 건강한 SCN 문화 (적색)와 일 4 봉인 문화 접시를 여는 후 (파란색) 밖으로 건조하고 제대로 요리를 다시 밀봉 하나도 SCN 문화의 흔적을 보여줍니다 ( ) 화살표로 표시.
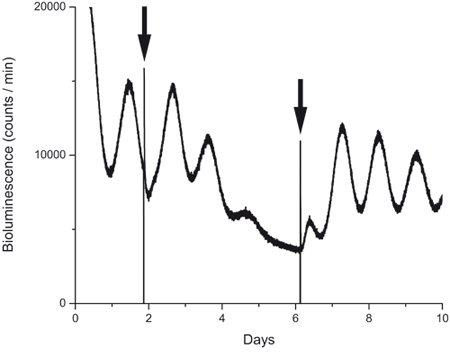
그림 4. 약물 노출 기간 후 Bioluminescence 녹음.
PER2 : 전에 도중 HCN 채널 차단기 (ZD7288, 10 μm의) 조치 후 문화 루크 표현. 첫 번째 화살표는 차단기가 추가된 시간을 나타냅니다. 두 번째 화살표는 제어 에어컨 매체와 매체를 포함하는 약물을 대체하여 만든 막가는를 나타냅니다. 약물 노출, 일 4 진동의 부족과 워시 아웃 후 단백질 리듬의 빠른 회복 2 일 후에 감소 진폭을 확인합니다.
토론
루시페라제 리포터 기술과 장점과 단점
낮의를 공부하기 위해서는 여러 시간 포인트 (샘플링 주파수에 따라 일반적으로 2-4 시간의 낮은 시간 해상도를 제공)에서 조직 샘플을 필요로 원위치 하이브리드화과 서양 얼룩 이러한 RT - PCR로 전직 생체내 방법, 달리 유전자와 단백질 표현의 변화, 루시페라제 리포터 기술은 높은 해상도 (10-10 분) 같은 준비에 많은 일 동안 circadian oscillations의 연구를 수 있습니다. 리듬의 위상 및 기간에 대한 효과 그러므로, 사용하는 동물의 수를 최소화하고 상세한 연구는 일반적으로 낮은 시간 해상도로 기존의 샘플링 기법을 사용 불가능한지, 가능합니다. 리듬의 상대 진폭 측정이 가능 있지만 그러나, 그것은 기자의 기술은 양적하지 않으며 따라서 베꼈는데 유전자 또는 단백질 번역의 양을 측정하는 데 사용할 수 없다는 것을 강조해야합니다.
조직 녹음 organotypic SCN 문화는 성인 뇌의 장기 (주) 약리 조작을 허용하기 시작하고 즉시 culturing, 직접 생체내 빛을 유도 위상 교대 등, 생체내 스트레스의 분자 효과를 공부에 대한 큰 장점 후 분석할 수 손상 성숙한 신경 네트워크와 루시페라제 리포터 기술을 포함하는 조직은 여러 주 동안 안정적인 레코딩이 가능합니다. 따라서 조직은 건강한 문화를 얻기 위해서는 신생아 또는 출생 후의 초기 필요하지 않으며, 급성 만성 슬라이스 약리 치료와는 대조적으로 수행할 수 있습니다. epigenetic 변경은 연구해야하는 경우없이 염색체에 DNA의 결합으로 이어질 할 셀 문화에 플라스미드 - 기자 transfections, 대조적으로, 유전자 변형 루시페라제 - 동물 모델 (뿐만 아니라 lenti 바이러스 transfections)이 유리합니다. 그것은이 상황에서도 발광 이미징은 녹음도 circadian 리듬을 공부 전공 실험실로 활용 단일 SCN의 뉴런 (~ 60-10 μm의)와 다른 세포 유형에 있으므로, 매우 민감한 CCD 카메라 11 요즘 가능하다는 것을 언급해야합니다. 마지막으로, 여러 circadian 조사는 일반적으로 시계 유전자 / 단백질 oscillations 16-19를 공부하기 위해서는 이러한 그린 형광 단백질과 같은 다른 기자를 사용하여 분자 표현의 모니터링을 사용합니다.
슬라이스 두께의 측면
여기에서 권장하는 SCN 슬라이스 (200-300 μm의)의 두께가 감소하거나 원할 경우 증가 수 있습니다. 조직 문화의 몇 일 후에 막에 나가 flattens하지만 그러나, 그것은 조직 7 생존을 보존하기 위해 처음 컷 단면 500 μm의 두께를 초과하지 않는 것이 좋습니다. 100 μm의보다 얇은 슬라이스가 처리하기 어려운 기계 및 실질적인 이유입니다. SCN (예를 들어 '껍질', 그리고 지느러미 대 복부 지역 대의 "핵심") 이내에 다른 지역은 다른 단계와 함께 진동 SCN 조직 이질 때문에 슬라이스의 두께가 루시페라제 출력 신호의 위상에 영향을 미칠 수, 이후 20 differentially이 단계 이후에 다시 동기화 21 교대. 더 많은 조직이 광자의 큰 숫자를 방출 이후 슬라이스의 두께는 광자 개수의 기준에 영향을 미칩니다. 분자 oscillations의 진폭이 방식으로 간접적으로 explant의 크기에 의해 영향을받을 수 있습니다. 이러한 이유로, 제어 및 치료 문화는 항상 같은 크기, 두께가 같은 위상과 같은 진폭과 진동하기 위하여 SCN의 동일한 영역을 포함해야합니다. 두 일방적 핵은 반면에, 서로와 한 유사한 amplitudes와 단계에 진동 vibratome 컷 (차례로 소뇌와 두 반구 사이의 절단 분리는 직각입니다에 의존하는 직각 수평이 아니므로 테이블 표면). SCN의 culturing을 수행하는 조사는 SCN의 문화가 서로 단계에서 진동하지 않는 경험을 할 수도 있습니다. 연습과 깔끔히 기술의 표준화, 조각은 항상 SCN의 동일한 rostro - 꼬리 수준 버렸어요 즉, 결과를 향상됩니다.
중요 단계
- 산소 공급이 중요합니다.
두뇌는 산소 22이 많이 필요하기 때문에, 깔끔히 절차 빨리해야합니다 (3.1-3.10 가까이수록 그것은 조직을 건강하게 유지하기 위해서입니다 ~ 5~6분하는 것입니다.) - SCN은 온도 변화와 매체 교환을 구분합니다.
SCN은 온도 민감하고 큰 온도 변화가 단계 맥박 조정기를 이동하고 실험 유물 23가 발생할 수 있습니다. 중간이나 솔루션은 문화에 며칠 후에 약물을 적용하는 예를 들어, 지속적인 실험, 매체 또는 솔루션을 도중에 교환 또는 추가하는 경우n은 사전 예열 36-37로 ° C (챔버와 동일한 온도)뿐만 아니라 전에해야합니다. 중간 교류를 포함 약리 실험에서, 항상 사전에 시설 세포 배양 매체와 함께 작업하는 것이 중요합니다. 또한 / 신선한와 함께 씻어, 무조건 매체는 잠재적으로 분자 SCN 리듬 24뿐만 아니라 다른 세포 유형 문화 25 단계 이동하실 수 있습니다. - 중간 구성.
정확한 산도와 osmolality 문화 조직을하는 것이 중요합니다. 공기 버퍼링 매체 산도 6.8-8.2의 범위에서 최적의 버퍼 용량을 가지고 있으며, 세포 호흡의 결과로 발생할 수있는 산도의 변화를 버퍼링에 적합합니다 HEPES 많은 양의가 포함되어 있습니다. HEPES는 반면에, 같은 문화 매체 소량에 포함되어있는 나트륨 중탄산염,에 비해 온도 변화에 더 민감합니다. 나트륨 중탄산염는 CO 2 분위기 때문에 적절한 낮은 PH (5.1-7.1) 범위 26에서 큰 버퍼링 용량이 있습니다. 그러나, 공기 버퍼링 매체 (DMEM 2902)에서 나트륨 중탄산염의 금액을 증가 상당히 osmolality를 증가 동시에 매체, 아미노산, 비타민 및 이온의 잘못된 구성에 차례 결과 인치를 diluting없이 추가할 수 없습니다
매체를 준비 조언 :- 매체를 혼합하면 정확하고주의하십시오.
- 오직 신선한 또는 갓 해동 주식 솔루션을 사용합니다.
- 매우 높은 osmolality의 경우 그것은 diluting 가치가되지 않습니다. 이상 5~6% - 희석 매체는 대부분 작동하지 않습니다. 너무 낮으면 osmolality를 증가 D - 포도당을 사용합니다.
- 단계는 준비 시간으로 인해 교대
슬라이스 준비의 시간은 중요합니다. 슬라이스 절차가 ZT 12월 6일부터 12일까지 사이에 수행되는 경우에는 단계에 제로 또는 최소한의 효과를 얻을 수 있습니다. 모든 슬라이스 해부은 준비 사이의 유사 콘텐츠를 위상으로 인한 오류를 최소화하기 위해 낮의 또는 circadian 사이클의 동일한 단계에서 수행해야합니다.
가능한 수정
- 깔끔히 시작하기 전에 산소 (95% O 2, 5 % CO 2)의 포화 버퍼; 급성 SCN의 전기 생리학은 깔끔히는 링어 (ACSF 인공 세리 브로 척수)으로 수행되어야한다. 또한, 산소는 전기 시냅스 활동이 산소 공급 22에 직접 의존으로 전체 깔끔히 절차를 수행하는 동안 버퍼에 지속적으로 추가되어야합니다.
- 수평 및 화살 조각도 성공적으로 준비하고 SCN의 교양 수 있습니다. 저자는 코로나 컷과 비교 경험에 따라 낮은 진폭과 circadian oscillations를 제공 수평 조각에 루시페라제 기록과 경험을했습니다.
- SCN은 약 1mm 길이 rostro - caudally이며 깔끔히 여기에서 설명한 기법은 중앙 지역의 SCN 부분을 취득으로 타겟팅됩니다. 그러나, 하나 이상의 SCN 섹션은 SCN의 핵보다 주동이의 비교 꼬리 수준 circadian 유전자 / 단백질 표현의 조사를 허용, 마우스 및 쥐 두뇌에서 구할 수 있습니다.
- 심지어 어린 동물, 출생 후의 새끼 또는 배아에서 슬라이스 문화가도 준비하실 수 있습니다. 아주 어린 새끼의 두뇌와 두개골이 아주 부드럽고 구분 유의하시기 바랍니다. 또한, 시신경이 얇고 완벽하게 개발되지 않습니다. SCN 영역이 손상되지 않도록 새끼의 머리를 해부 때주의를 가져가라. 그들이 너무 큰 있기 때문에 예를 들어, 마이크로 rongeur 도구는 마우스 새끼의 두개골을 열어 사용할 수 없습니다. 좋은 가위는 어린 새끼에있는 부드러운 조직을 절단 정도입니다.
- 여기에 설명된 커버 유리 기반 문화 기술은 또한 하나의 SCN의 뉴런에서 CCD / EM - CCD 카메라를 사용하여 이미지 발광에도 사용할 수 있습니다.
- 기타 중추 신경계의 지역 및 유전자 변형 PER2에서 말초 장기의 조직 : 루크 동물 쉽게 PER2로, 분자 oscillations 측면에서 얻은 교양 및 분석할 수 : 루크 표현은 다른 조직의 숫자도 많은 일 동안 진동을 계속 및 세포 유형 10. 이러한 주변 조직의 대부분은 인스턴스 간, 생존을위한 멤브레인 필요하지 않지만 대신에 직접적으로 매체 11 목욕 양식입니다. 인해 sectioning로 변화되는 단계는, culturing와 매체 교환이 SCN과 동일한 원칙을 따르지 않을 수 있습니다 주시기 바랍니다.
의미
유전자 변형 마우스 및 쥐 종자 (mPER2 : 륙, mPer1 - 륙 8, 10, 27)에서 루시페라제 효소 활동은 단백질이나 유전자 발현의 리듬을 반영하고 bioluminescence 기록에 의해 평가하실 수 있습니다. 루시페라제 생성된 bioluminescence는 약한 신호를 제공하지만 배경 발광이 방법이 유리하고, 제로에 가까운 것입니다. 또한, 루시페라제 분자가 불안정하고 급속하게 저하되기 때문에 PH가 없습니다장기적인 흥분성의 조명 28 동안 나타날 수 있습니다 ototoxicity. 함께 촬영이 속성은 circadian 연구 루시페라제 리포터 기술이 매우 유리하게 오랫동안 실험 수 있습니다.
공개
감사의 말
FONCICYT 000000000091984,, Jeansson의 기초, Söderström Königska sjukhemmet, 마사 Lundqvist 및 시거드 루시 엘사이 작품은 스웨덴 의학 연구 협의회 (K2009 - 75SX - 21028-01 - 3, K2008 - 61X - 20700-01 - 3)에 의해 추진하는 사업 Goljes 민, 그리고 의약 SLS - 95151의 스웨덴어 학회. 교수 진 D. 블록, UCLA는 기꺼이 원고에 대한 귀중한 의견을 인정받고 있습니다. 우리는 비디오 현미경 제공을위한 HCN 채널 차단에 대한 박사 마이클 Andäng 및 박사 헬레나 Johard 감사하고, 교수 압델 엘 - Manira.
윤리적인 고려 사항 :
동물의 모든 실험은 Karolinska Institutet와 "스톡홀름의 Norra Djurförsöksetiska Nämnd"에 의해 명시된 지침과 규정에 따라 수행되었다. 모든 동물 실험은 모든 가능한 응력이나 동물에 불편을 최소화하기 위해 의도로 수행됩니다.
자료
| Name | Company | Catalog Number | Comments |
| B27 supplement 50x | Invitrogen | 17504-044 | |
| Cover glasses | Menzel-Glaser | 40#1 | ≈ 40 mm |
| Culture membranes | EMD Millipore | PICMORG50 | 0.4 μm |
| DMEM low glucose w/o phenol red | Sigma-Aldrich | D2902 | Powder for 1L |
| Filter paper | Whatman, GE Healthcare | 1003 055 | ≈ 55 mm |
| Filtration set | Corning | 431097 | Pore size 0.22 μmPolyethersulfone |
| Forceps | Allgaier Instrumente | 0203-7-PS | Dumant #7 |
| HEPES | Invitrogen | 15630-056 | 100 ml |
| HBSS 10x | Invitrogen | 14065-049 | 500 ml |
| NaOCH3 7.5% | Invitrogen | 25080-060 | 50 ml |
| Luciferin | Promega Corp. | E1602 | Beetle luciferin, potassium salt |
| Micro rongeur tool | Allgaier Instrumente | 332-097-140 | |
| PenStrep 10,000 U/ml | Invitrogen | 15140-122 | 100 ml |
| Petri dishes | Corning | 430165 | ≈ 35 mm |
| PMT | Hamamatsu Corp. | H9319-11MOD | |
| Disposable scalpels | Paragon | P503 | Size 11 |
| Vacuum filter | Fisher Scientific | 09-761-5 | |
| Vacuum grease | Dow Corning | 50 g | |
| Vibratome | Campden Instruments |
참고문헌
- Welsh, D. K., Takahashi, J. S., Kay, S. A. Suprachiasmatic nucleus: cell autonomy and network properties. Annu Rev Physiol. 72, 551-577 (2010).
- Green, D. J., Gillette, R. Circadian rhythm of firing rate recorded from single cells in the rat suprachiasmatic brain slice. Brain Res. 245, 198-200 (1982).
- Shibata, S., Oomura, Y., Kita, H., Hattori, K. Circadian rhythmic changes of neuronal activity in the suprachiasmatic nucleus of the rat hypothalamic slice. Brain Res. 247, 154-158 (1982).
- Groos, G., Hendriks, J. Circadian rhythms in electrical discharge of rat suprachiasmatic neurones recorded in vitro. Neurosci Lett. 34, 283-288 (1982).
- Moore, R. Y., Klein, D., Moore, R., Reppert, S. The suprachiasmatic nucleus and the circadian timing system. Suprachiasmatic nucleus--The mind's clock. , 13-15 (1991).
- Pol, A. N. V. a. n. d. e. n. The hypothalamic suprachiasmatic nucleus of rat: intrinsic anatomy. J Comp Neurol. 191, 661-702 (1980).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Yamazaki, S., Numano, R., Abe, M., Hida, A., Takahashi, R., Ueda, M., Block, G. D., Sakaki, Y., Menaker, M., Tei, H. Resetting central and peripheral circadian oscillators in transgenic rats. Science. 288, 682-685 (2000).
- Geusz, M. E., Fletcher, C., Block, G. D., Straume, M., Copeland, N. G., Jenkins, N. A., Kay, S. A., RN, D. a. y. Long-term monitoring of circadian rhythms in c-fos gene expression from suprachiasmatic nucleus cultures. Curr Biol. 7, 758-766 (1997).
- Ko, C. H., Buhr, E. D., Siepka, S. M., Hong, H. K., Oh, W. J., Yoo, O. J., Menaker, M., Takahashi, J. S. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci U S A. 101, 5339-5346 (2004).
- Yamazaki, S., Takahashi, J. S. Real-time luminescence reporting of circadian gene expression in mammals. Methods Enzymol. 393, 288-301 (2005).
- Yoshikawa, T., Yamazaki, S., Menaker, M. Effects of preparation time on phase of cultured tissues reveal complexity of circadian organization. J Biol Rhythms. 20, 500-512 (2005).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (1997).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1998).
- O'Neill, J. S., Maywood, E. S., Chesham, J. E., Takahashi, J. S., Hastings, M. H. cAMP-dependent signaling as a core component of the mammalian circadian pacemaker. Science. 320, 949-953 (2008).
- Hughes, A. T., Guilding, C., Lennox, L., Samuels, R. E., McMahon, D. G., Piggins, H. D. Live imaging of altered period1 expression in the suprachiasmatic nuclei of Vipr2-/- mice. J Neurochem. 106, 1646-1657 (2008).
- Zhang, D. Q., Zhou, T., Ruan, G. X., McMahon, D. G. Circadian rhythm of Period1 clock gene expression in NOS amacrine cells of the mouse retina. Brain Res. 1050, 101-109 (2005).
- Quintero, J. E., Kuhlman, S. J., McMahon, D. G. The biological clock nucleus: a multiphasic oscillator network regulated by light. J Neurosci. 23, 8070-8076 (2003).
- LeSauter, J., Yan, L., Vishnubhotla, B., Quintero, J. E., Kuhlman, S. J., McMahon, D. G., Silver, R. A short half-life GFP mouse model for analysis of suprachiasmatic nucleus organization. Brain Res. 964, 279-287 (2003).
- Nakamura, W., Yamazaki, S., Takasu, N. N., Mishima, K., Block, G. D. Differential response of Period 1 expression within the suprachiasmatic nucleus. J Neurosci. 25, 5481-5487 (2005).
- Davidson, A. J., Yamazaki, S., Arble, D. M., Menaker, M., Block, G. D. Resetting of central and peripheral circadian oscillators in aged rats. Neurobiol Aging. 29, 471-477 (2008).
- Croning, M. D., Haddad, G. G. Comparison of brain slice chamber designs for investigations of oxygen deprivation in vitro. J Neurosci Methods. 81, 103-111 (1998).
- Burgoon, P. W., Boulant, J. A. Temperature-sensitive properties of rat suprachiasmatic nucleus neurons. Am J Physiol Regul Integr Comp Physiol. 281, 706-715 (2001).
- Nishide, S. Y., Honma, S., Honma, K. The circadian pacemaker in the cultured suprachiasmatic nucleus from pup mice is highly sensitive to external perturbation. Eur J Neurosci. 27, 2686-2690 (2008).
- Yoshikawa, T., Sellix, M., Pezuk, P., Menaker, M. Timing of the ovarian circadian clock is regulated by gonadotropins. Endocrinology. 150, 4338-4347 (2009).
- Kohn, R. A., Dunlap, T. F. Calculation of the buffering capacity of bicarbonate in the rumen and in vitro. J Anim Sci. 76, 1702-1709 (1998).
- Wilsbacher, L. D., Yamazaki, S., Herzog, E. D., Song, E. J., Radcliffe, L. A., Abe, M., Block, G., Spitznagel, E., Menaker, M., Takahashi, J. S. Photic and circadian expression of luciferase in mPeriod1-luc transgenic mice in vivo. Proc Natl Acad Sci U S A. 99, 489-494 (2002).
- Sellix, M. T., Currie, J., Menaker, M., Wijnen, H. Fluorescence/luminescence circadian imaging of complex tissues at single-cell resolution. J Biol Rhythms. 25, 228-232 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유