Method Article
細胞死の正確な評価のために修飾されたアネキシンV /ヨウ化プロピジウムのアポトーシスアッセイ
要約
細胞死の評価のための正確な方法が記載されている。プロトコルは、細胞株および動物モデルの広い範囲からの一次細胞は40%、偽陽性のイベントを表示する従来のアネキシンV /ヨウ化プロピジウム(PI)のプロトコル、改良したものです。
要約
細胞のアポトーシスの研究は著しく、フローサイトメトリーベースのメソッドの導入以来、影響されています。ヨウ化プロピジウム(PI)は広く細胞が原形質膜の完全性と透過性の1,2の違いによって、実行可能なアポトーシス、または壊死性かどうかを判断するためにアネキシンVと組み合わせて使用されます。アネキシンV / PIプロトコルでは、アポトーシス細胞3を研究するための一般的に使用されるアプローチです。それは細胞が4,5住んで染料を除外するその能力に基づいて、経済的安定と細胞生存率の良い指標であるため、PIは、より頻繁に他の核染色より使用されています。セルを入力するPIの能力は、膜の透過性に依存しています。PIは、無傷の原形質膜1,2,6の存在によるライブや早期のアポトーシス細胞を染色していません。後期アポトーシスとネクローシス細胞では、プラズマと核膜の完全性は、PIは、膜を通過する核酸にインターカレートし、赤色蛍光1,2,9を表示できるように、7,8を減少させます。残念ながら、我々は従来のアネキシンV / PIプロトコルが細胞質コンパートメント10内にRNAのPI染色に関連付けられている偽陽性のイベント(最大40%)のかなりの数、につながることがわかります。最高発生10を示す:(細胞質比が<0.5核)初代培養細胞や動物モデルの広い範囲の細胞株は大型細胞で、影響を受けます。ここで、我々は、従来の方法に比べて細胞死の評価のための有意な改善を提供する修正アネキシンV / PI法を示しています。このプロトコルは、染色後の細胞に含まれるRNaseのエントリーを促進するための固定細胞中に細胞透過性の変化を利用しています。タイミングとRNaseの濃度の両方が細胞質RNAの除去に最適化されています。その結果、従来のアネキシンV / PIプロトコル(細胞質PI染色で<5%のイベント)に比べて大きな改善です。
プロトコル
この手順は、500μLシリコナイズチューブまたは6 mLのポリスチレン丸底FACSチューブで行うことができます。他の手順と組み合わせて実行可能性分析を行う際に、後者は通常使用されます。与えられたすべてのボリュームは、6 mLのポリスチレン丸底FACSチューブ用です。 500μLシリコナイズチューブの場合は、1 / 5ですべてのボリュームを減らす。
フローサイトメトリー分析のための最適濃度は200μLボリューム2〜4 × 10 6個の細胞です。細胞の損失は、この手順からなることがありますので、我々は、各サンプルは、プロシージャの開始時に4 × 10 6個の細胞から構成されることをお勧めします。
1。細胞の準備
- 収穫の細胞は - 対応する細胞株または初代細胞アイソレーションのための具体的な手順を参照してください。
- 10分間、335 × gでサンプルを遠心し、上清をデカントする。
- 2 mLの1 ×リン酸に再懸濁し細胞(PBS)緩衝生理食塩水- / - (無カルシウム、マグネシウムがない)。
- 10分間、335 × gでサンプルを遠心し、上清をデカントする。
- 1 mLの1 ×アネキシンV結合バッファーで細胞を懸濁します。
- 10分間、335 × gでサンプルを遠心し、上清をデカントする。
- 100μLの1 ×アネキシンV結合バッファーに再懸濁し細胞。
2。アネキシンV / PIのアプリケーションでは、染色
- メーカーの推奨に従ってアネキシンVを追加する[例えば、5μLアネキシンVのAlexa Fluor ® 488(Molecular Probes社、A13201)]。
- 室温で15分間暗所でチューブをインキュベートする。
- 各反応チューブに1 ×アネキシンV結合バッファー100μLを加える。各チューブに約200μLがあるはずです。
- 1 ×アネキシンV結合バッファー(10μL1 ×アネキシンV結合バッファーを持つ、すなわち1μLPI)で1:10に希釈されたPIの4μL(Sigma、カタログ#P - 4864 - 10ML)を追加します。これは、各サンプルに2μg/ mLの最終的なPIの濃度が得られます。
- 室温で15分間暗所でチューブをインキュベートする。
- 細胞を洗浄するために、500μLの1 ×アネキシンV結合バッファーを追加します。
- 10分間、335 × gでサンプルを遠心し、上清をデカントする。
- 500μL1 ×アネキシンVの結合緩衝液と1%のホルムアルデヒド(固定)ソリューションを作成するために500μLの2%ホルムアルデヒドで再懸濁し、細胞。穏やかなフリックでチューブを混ぜる。
- 氷上で10分間サンプルを修正。また、サンプルは4℃で一晩保存することができます℃で暗所で。後者の方法が選択された場合、アネキシンV / PI(補償のコントロールを含む)で標識されたすべてのチューブ全体で一貫していることを確認します。
- 各サンプルへとフリックにより穏やかに混合- / - 1 mLの1 × PBSを追加。
- 8分間425 × gでチューブを遠心し、上清をデカントする。
- 手順2.10と2.11を繰り返します。
- チューブをフリックしてペレットを再懸濁します。
- 濃度50μg/ mlの最終濃度になるように1:100希釈のRNase A(シグマ、R4642)の16μLを追加。 37℃で15分間インキュベート℃に
- / - - 1 mLの1 × PBSを追加し、フリックにより穏やかに混合する。
- 8分間425 × gでチューブを遠心する。
- 現在、サンプルを分析する準備が整いました。アネキシン/ PI染色は他の手続きと並行して実行されている場合、あるいは、試料は、その後の染色工程のために使用することができます。
3。代表的な結果:
偽陽性のPI染色の度合いをした細胞タイプと細胞株の例を図1に示されています。偽陽性のイベントを考慮して、細胞を固定してから(図2B)RNase処理を受けていない細胞と比較して偽陽性のイベント、数の有意な減少でのRNase Aでこの結果を処理した。図2CはRNase処理を持たない細胞に比べて、RNase処理を受けた細胞の代表画像を示す。図3は、固定およびRNase処理のステップで変更されたアネキシンV / PIプロトコルは、偽陽性染色のイベントの数を制限することにより、従来のプロトコルを改良した方法を示しています。

図1。従来のヨウ化プロピジウム染色のプロトコルは、偽陽性のイベントのかなりの数につながる。我々は以前に動物モデルの広範なだけでなく、細胞株10の様々な主要な細胞間の偽陽性染色の程度を評価した。代表的な画像は、3つのユニークな細胞集団( - RAWマクロファージおよびつの主要細胞 - マウス骨髄マクロファージ(BMM)と金魚の主腎マクロファージ(PKM)1つの一般的に使用される細胞株)における偽陽性染色の程度を示す。真陽性のイベントが核コンパートメント内でPIとDRAQ5の間に予想される共局在を(黄色の領域は、PIとDRAQ5の間で共局在を表す)が表示されます。 DRAQ5は非常に体肢です。NE透過性染料その生細胞と死細胞10,11,12の両方で正確に汚れ核コンパートメント。共局在DRAQ5汚れを簡単に視覚的な決定のための緑のpseudocolourを与えられた。
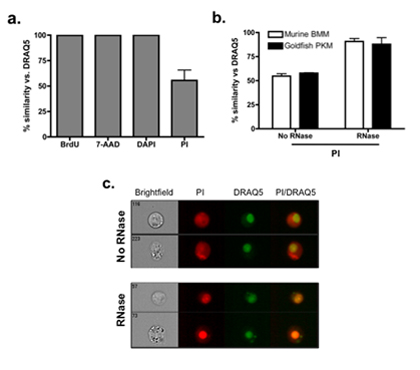
図2。 PI核染色の精度を向上させる 。 (A)我々はDRAQ5に十分に特徴付けられた核染色(BrdUを、7 - AADとDAPI)の数の類似度に基づいて、PI核染色の精度を評価した。のBrdUは増殖細胞のDNAに組み込まれ、そのようにのみ核コンパートメント内に染色される合成ヌクレオシドである。 7 - AADは、PIと同様のDNAと、親和性の高い、無傷の原形質膜を越えることはできません。 DAPIは、DNAに強い親和性を有しており、蛍光顕微鏡で染色核の最も一般的に使用されています。類似度は正確にRAW 264.7マクロファージにおける細胞核を染色する能力を強調し、BrdUを、7 - AAD、DAPIとDRAQ5との間で> 99%であった。対照的に、従来のプロトコルに基づいて細胞質PI染色はDRAQ5に相対的染色のパーセント類似性の著しい低下につながる。マウス骨髄マクロファージ(BMM)と金魚の主腎マクロファージ(PKM):(B)も同様の結果が試験された2つの主要な細胞で観察される。染色手順内の特定の段階では50μg/ mlのRNaseの混入は非核兵器PI染色を削除し、大幅にDRAQ5染色の相対類似度を増加させる。 (C)一次性腎マクロファージの代表的な画像は、RNase処理がある場合とない場合のセルの類似度を示す。治療法の違いを簡単に視覚的判定のために、DRAQ5は緑色を与えられた。黄色の領域は、BrdUとDRAQ5、およびPIとDRAQ5の間で共局在を表しています。
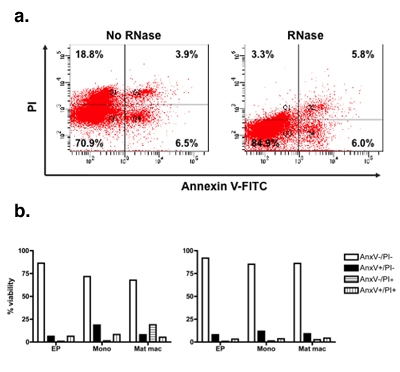
図3。修正されたアネキシンV / PIは大幅に偽のアポトーシス/壊死性イベントを減少します。主な金魚の腎臓のマクロファージ(PKM)は、従来と変更されたアネキシンV / PIプロトコールで染色した。散布図はアネキシンV / PIは、金魚のPKMに染色描く。左の散布図は、PKM細胞の従来のアネキシンV / PI染色(無RNaseを)示しています。右上の散布図は、変更されたアネキシンV / PIプロトコル(RNaseの)で染色PKM細胞を示しています。偽陽性の汚れの除去に起因するPI染色の顕著な減少中のRNaseの結果の追加。 PKM細胞は、培養液、初期の前駆細胞(EP)、単球(モノ)と成熟したマクロファージ(マットMAC)内の異なる個体群に基づいて分析した。偽陽性のイベントの除去に起因する正のPIのイベント数の減少は、より小さな早期の前駆細胞に比べて大規模な成熟したマクロファージ細胞においてより顕著である。従来のプロトコルに基づいて結論が誤って、より成熟したマクロファージサブセットの細胞死に正の相関を示唆しているでしょう。
ディスカッション
アネキシンV / PIプロトコルは、従来のプロトコルの改良版であると考慮もPIに対して高い親和性を持つ細胞質のRNAの存在を取るここで紹介。染色手順の後半で1%ホルムアルデヒド固定ステップの後のRNase A(50μg/ mLの)の導入は、核PI染色の精度を大幅に向上します。負の効果は核PI染色や細胞膜アネキシンV染色で観察されていません。 RNase A処理することなく、PI染色結果の最大40%のカスタマーが、下流の結論10日に潜在的に有意かつ負の影響につながる偽陽性のイベントにつながる可能性があります。
、変更したアネキシンV / PI染色プロトコルは単純で、細胞の種類( プライマリセルの広い範囲で効果的に使用されています:マウス骨髄マクロファージおよび脾細胞;豚肺常駐細胞、肺胞マクロファージ、腸間膜リンパ節の分離株、末梢血白血球、脾細胞、ニワトリ胚盤葉細胞を、金魚の主腎マクロファージ、コイ末梢血白血球、 細胞株 :RAW 264.7マクロファージ、Jurkat T細胞、豚3D4/31マクロファージ、CCL - 71金魚のひれの繊維芽細胞、3B11ナマズのB細胞10)。細胞は差初代細胞は一般的に偽陽性のイベント10の大きい番号を持つとともに、偽陽性のPI染色によって影響されることに注意することは重要です。これらの細胞集団間の違いの偽陽性PI染色が部分的にセルサイズの違いに起因することがありますが、またRNAの含有量の違いから発生する可能性があります。この手順のような、組み込みは、他の人の間で利用する実験系、、遺伝毒性ストレスを受けた細胞は、細胞周期停止のようなチミジンやヒドロキシ尿素などの薬剤、ウイルス感染細胞、および発達進行胚細胞の研究で処理した細胞に特に関連として細胞のRNA合成における離散的な変化によって特徴付けられる。
開示事項
謝辞
この研究は、カナダ自然科学(NSERC)研究助成金のエンジニアリング評議会とDRBにアルバータ州農業資金コンソーシアムの助成金によって支えられている。 AMRは、NSERCヴァニエカナダ大学院奨学金、アルバータ大学の授業助手職とクイーンエリザベスII大学院の奨学金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 1 x PBS-/- | |||
| 1 x Annexin V Binding Buffer | BD Biosciences | 556454 | |
| Annexin V-Alexa Fluor 488 | Molecular Probes, Life Technologies | A13201 | |
| Propidium iodide (PI) | Sigma-Aldrich | P4864 | 1 mg/mL in H2O |
| 2% Formaldehyde | Sigma-Aldrich | F1268 | |
| RNase A from bovine pancreas | Sigma-Aldrich | R4642 | |
| DRAQ5 | Biostatus | DR50050 | Dilute 1:60 in 1 x PBS-/- |
参考文献
- Vermes, I., Haanen, C., Steffens-Nakken, H., Reutelingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labeled Annexin V. J Immunol Methods. 184, 39-51 (1995).
- Vermes, I., Haanen, C., Reutelingsperger, C. Flow cytometry of apoptotic cell death. J Immunol Methods. 243, 167-190 (2000).
- Cornelissen, M., Philippe, J., De Sitter, S., De Ridder, L. Annexin V expression in apoptotic peripheral blood lymphocytes: An electron microscopic evaluation. Apoptosis. 7, 41-47 (2002).
- Fried, J., Perez, A. G., Clarkson, B. D. Flow cytofluorometric analysis of cell cycle distributions using propidium iodide. Properties of the method and mathematical analysis of the data. J Cell Biol. 71, 172-181 (1976).
- Bacso, Z., Everson, R. B., Eliason, J. F. The DNA of Annexin V-binding apoptotic cells is highly fragmented. Cancer Res. 60, 4623-4628 (2000).
- Darzynkiewicz, Z., Bruno, S., Del Bino, G., Gorczyca, W., Hotz, M. A., Lassota, P., Traganos, F. Features of apoptotic cells measured by flow cytometry. Cytometry. 13, 795-808 (1992).
- Kroemer, G., Dallaporta, B., Resche-Rigon, M. The mitochondrial death/life regulator in apoptosis and necrosis. Annu. Rev. Physiol. 60, 619-642 (1998).
- Denecker, G., Vercammen, D., Declercq, W., Vandenabeele, P. Apoptotic and necrotic cell death induced by death domain receptors. Cell Mol. Life Sci. 58, 356-370 (2001).
- Faleiro, L., Lazebnik, Y. Caspases disrupt the nuclear-cytoplasmic barrier. J Cell Biol. 151, 951-959 (2000).
- Rieger, A. M., Hall, B. E., Luong, L. T., Schang, L. M., Barreda, D. R. Conventional apoptosis assays using propidium iodide generate a significant number of false positives that prevent accurate assessment of cell death. J Immunol Methods. 358, 81-92 (2010).
- Edward, R. Minireview: Use of DNA-specific anthraquinone dyes to directly reveal cytoplasmic and nuclear boundaries in live and fixed cells. Mol. Cells. 27, 391-396 (2009).
- Njoh, K. L., Patterson, L. H., Zloh, M., Wiltshire, M., Fisher, J., Chappell, S., Ameer-Beg, S., Bai, Y., Matthews, D., Errington, R. J., Smith, P. J. Spectral analysis of the DNA targeting bisalkylaminoanthraquinone DRAQ5 in intact living cells. Cytometry Part A. 69, 805-814 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved