このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス大動脈内の免疫細胞のフローサイトメトリー分析
要約
本論文では、大動脈の免疫成分を調査するために、フローサイトメトリーベースの方法を提示。本稿では、また別々に周囲の外膜と血管壁を調べることができる追加のテクニックを示しています。このメソッドは、大動脈白血球の表現型解析を実行し、アテローム性動脈硬化症の研究のためにいくつかの免疫学的アッセイを適用する可能性を開きます。
要約
アテローム性動脈硬化症は、泡沫細胞、免疫細胞、血管内皮細胞と平滑筋細胞、血小板、細胞外マトリックス、および広範な壊死を伴う脂質の豊富なコアで構成されたプラークの形成を特徴とされる中規模および大規模血管の慢性炎症性プロセスのことです周囲組織の線維化1免疫応答の自然免疫と獲得武器がアテローム性動脈硬化の開始、開発と持続性に関与している。2、3、証拠の重要な体は樹状突起は、マクロファージなどの免疫細胞の異なるサブセットがあるリンクです。細胞、TおよびBリンパ球は、4健康とアテローム性動脈硬化症を起こしやすいマウスの大動脈内に存在する。さらに、免疫細胞がアテローム発生にこの組織の重要な役割を示唆している周囲の大動脈外膜に記載されています。2
当分の間、免疫細胞、それらの活性化状態、および大動脈壁内の細胞組成の異なる種類の定量的検出は、アテローム性動脈硬化症の研究のためにRT - PCRと免疫組織化学的方法によって限定されていました。いくつかの試みが、人間の大動脈を用いてフローサイトメトリーを実行するために作られた、そしてこのような高い自家蛍光などのさまざまな問題は、5,6を報告されている。人間のアテローム性動脈硬化プラークは、コラゲナーゼ1で消化した、と自由な細胞はCD14のために回収し、染色した+ / CD11cは+マクロファージ由来泡沫細胞を強調する。本研究では、"モック"チャネルは、偽陽性染色を避けるために使用された。消化の過程で蓄積する6壊死性物質は大動脈の試料で高い自家蛍光を発生する破片が大量に生じさせる。この問題を解決するには、陰性および陽性対照のパネルが提案されているが、唯一の二重染色は、これらのサンプルに適用することができます。我々は、免疫細胞組成を分析し、活性化、増殖、健康とアテローム性動脈硬化症を起こしやすい大動脈の免疫細胞の分化を特徴づけるために新たなフローサイトメトリーベースの方法7を開発した。このメソッドは、大動脈壁の免疫細胞組成の調査を可能にし、この病気の免疫的側面の調査のための免疫学的方法の広いスペクトルを使用する可能性を開きます。
プロトコル
1。マウス大動脈の分離
手続きの制度的IACUCの委員会の承認は、マウスで動作するように要求される。
- 50ミリリットルのPBSと混合するためにチューブを反転するヘパリンナトリウム1000単位を追加してheparinzed PBSを準備します。血液および収集する各大動脈のためにPBSを含むコレクションチューブのための空のコレクションチューブを準備します。氷の上にすべてのチューブを保管してください。
- 、血液(1000 U / mlのヘパリンナトリウムの0.1ミリリットル)を描画するための注射器をヘパリンで治療する手術器具を(湾曲鉗子、解剖ハサミ、そしてmicroshearsのペア二組の)準備、および解剖のための解剖舞台。
- NIHと齧歯類の安楽死に関する機関IACUC委員会の方針は、次の承認チャンバー内に二酸化炭素を使用して、マウスを安楽死させる。解剖の段階にマウスを転送する前に有効性を確認してください。
- 簡単に言うと70%エタノールでマウスを浸して、解剖の段階にマウスを固定します。心臓穿刺を介してマウスから血液を描く。
- 腹部と胸の空洞を開きます。 25gの針と10mlのシリンジを使用して、完全にPBSを完全に心臓穿刺により血管から血液を除去するためにヘパリンの2%を含有する血管を灌流。大動脈組織内には血液がないことを確認してください。血流が血管壁内のすべてのプラークがそのまま残ることを保証するために少し圧力を徐々に実行する必要があります。
- 腎臓、心臓、および大動脈をそのまま残し、内臓器官、泌尿生殖器官、ダイアフラムと脾臓を摘出し、削除します。
- 慎重に大動脈と外膜はそのままに、離れて大動脈から脂肪組織および傍大動脈リンパ節を詳細に分析します。胸部、そして腹部の部分、降順、昇順、大動脈弓を含めた全体の大動脈を収集する。 PBSとコレクションチューブの摘出大動脈を置きます。単離操作中に、容器の潤いを維持しようとします。
2。単一の細胞懸濁液の調製
- 2.5 MLSで1X大動脈解離酵素原液(のADE)(125 U / mlのコラゲナーゼタイプXI、60 U / mlのヒアルロニダーゼタイプ1 - S、60 U / mlのDNase I、および450 U / mlのコラゲナーゼI型を、作成しPBSは、Galkina らから変更します )。すべての酵素はSigma - Aldrichからです。氷の上で株式の酵素溶液を置きます。
- 大動脈を含むコレクションチューブからPBSを削除します。各大動脈に1XのADEの2.5 mlを追加します。酵素消化を促進し、全体の大動脈をそのままにしておく小さな断片に大動脈を切る。 37℃で1時間1X酵素溶液で大動脈をインキュベート° C(遅い揺れはオプションです)。
- 1時間のインキュベーション後、離れて大動脈をせん断し、5ミリリットルポリプロピレンFACSチューブ(BDファルコン)に70μmのセルストレーナーを介してそれらを渡すことで、消化大動脈から単細胞懸濁液を準備する。ペレットを遠心分離により細胞(400xg、5分間、4℃)。
- FACSバッファー(PBS、1%のBSAおよび0.05%NaN 3を添加)1mlの中に細胞を再懸濁し、トリパンブルー、血球計数器、および光顕微鏡を用いて大動脈の細胞懸濁液中に存在するセルの数を決定します。消化後に得られた細胞の総数は、マウスの年齢と食事やアテローム性動脈硬化症の重症度に依存します。
3。フローサイトメトリー染色
- 新しいFACSチューブの適切な数のラベルを付けます。一般的には、フローサイトメトリーの実験は、単一の色のチューブのセット以外のステンド制御管、、適切な蛍光マイナスワンコントロール(FMO)8、適切なアイソタイプコントロール、および実験的なチューブのセットが必要です。単離することができる大動脈白血球の数に限りがあるので、脾臓白血球は、単一の制御染色を行うために使用することができます。
- 我々は、大動脈細胞懸濁液を染色するために標準のフローサイトメトリーのプロトコルを使用してください。簡単に言えば、FACSチューブ(s)に大動脈細胞懸濁液から0.5〜1 × 10 6細胞のアリコートを移す。遠心分離によってFACSバッファとペレットを1mlの細胞を追加。デカンテーションによってペレット化した細胞から上清を取り除く。
- 実験的な管、蛍光マイナスワンチューブ、およびアイソタイプチューブ用のFcブロックのソリューションと抗体のカクテルを準備します。チューブと指のフリックや細胞を再懸濁するために穏やかにボルテックスのすべてにFACSバッファにおけるFcブロック(14.2μg/ml、クローン2.4G2)100μLを加える。室温で15〜20分間サンプルをインキュベートする。
- 抗体染色、アイソタイプの染色またはFMO制御染色カクテルを準備します。あなたの予備滴定の実験で抗体の至適濃度を決定する。のFcブロックの存在下では、サンプルチューブに抗体のカクテルを(100ul/0.5-1.0x10 6個の細胞)に追加します。 4℃で20〜30分間インキュベート° Cの暗所で。
- 各チューブにFACS緩衝液の1mlを追加、渦は、遠心分離によって細胞を混合し、ペレットに。手順1つのより多くの時間を繰り返します。
- 上清を再懸濁しますをデカント2パーセントPFAの300μlでペレット化した細胞。フローサイトメーターでサンプルを実行します。
- 注:通常、抗CD45抗体は、(一般的な白血球抗原マーカー)+白血球後でゲートCD45するために試料のすべてに追加されるほか7、CD45 FMOとアイソタイプコントロールは次のようにCD45 +白血球ゲートを配置するために最初に使用されるべきである。 CD45の発現は、白血球の中で異なることがあります。
- 注:表面抗原または低いイベントの抗原を発現する低密度を検出するためには、このようなR -フィコエリスリン(PE)またはアロフィコシアニン(APC)のような"明るい蛍光色素"を使用。さらに、珍しいイベントが一緒にいくつかの一致した大動脈をプールすることによって検出することができます。百万人以上のセルが使用されているしかし、もし、テストごとに使用される抗体の量が比例的に増やす必要があります。
- 注:大動脈細胞懸濁液に分離された大動脈とその結果としての最低限の血液汚染があることを確認するには、いくつかの実験では、追加の染色は、赤血球(RBC)で表さTER - 119、7抗原を行った。血液中の白血球(WBC)の赤血球の数はおよそ10 × 10 6細胞/μlの8 × 10 3細胞/μlになります。大動脈サンプルにおけるTER - 119の発現に基づいて、検体中の血液由来の白血球の割合を計算することができます。一般的に我々は、大動脈のサンプルに血液由来のWBCの0.02%未満を持っている。(図1)
- 注:酵素処理は、表面抗原の発現に影響を及ぼす可能性があるため、酵素消化に対する抵抗性が関心の抗原に対して決定されるべきである。簡単に言えば、末梢リンパ節(PLN)または脾臓の小片を37℃で1時間酵素カクテルの有無にかかわらず℃でインキュベートする。 1時間後、抗原の発現をフローサイトメトリーによって決定されます。酵素カクテルは、複数の表面抗原( 図2)7には影響を与えません。他のいくつかのケースでは、酵素処理は、抗原の発現の有意な損失となりました。この問題は、別の細胞のマーカーを使用することによって回避することができます。
- 注:必要に応じて、ライブ/死細胞の生存率染色は、ステップ4の後に実行することができます。一般的にライブ/デッド修正可能死細胞染色キット(Invitrogen社、Molecular Probes社)を使用します。ライブ/デッド色素で細胞を染色するため、混合するためにPBSと渦を1mlに再溶解し、ライブ/デッド染料の1μlを添加することにより1Xライブ/デッドソリューションを作成します。ライブ/デッドシングル、カクテル、FMOとアイソタイプコントロールサンプルに1Xライブ/デッド染料100〜200μlを添加する。暗所で10分間室温で色素でサンプルをインキュベートする。デッド/ライブのための単一の制御管を56でインキュベートする必要がある·熱ショックによって細胞を殺すために10分間暗所で。遠心分離により細胞をPBSとペレットを1mlで細胞を洗浄する。ステップ5でプロトコルを再開する。
- 注:細胞内抗原およびサイトカインの細胞内染色には、このプロトコルと互換性があります。興味のある抗原に応じて - 簡単に言うと、細胞内の染色は、ベイバイオサイエンスBD Pharmingen社、またはCaltag研究所から細胞固定/膜浸透化試薬を用いて行うことができます。修正し、細胞内染色のための細胞を透過性に、細胞外の染色工程(セクション3のステップ5)の後、製造元の指示に従って、固定/透過のステップを実行します。細胞内の洗浄工程に続いて、ステップ6(3節の手順6)で、我々のプロトコルを再開する。
4。分離された周囲の外膜と血管壁のフローサイトメトリー分析
白血球は、開発された。9は簡単に言えば、全体の大動脈の前にフローサイトメトリーによって、これらの2つの解剖学的部位にフローサイトメトリーを分離して行うためのプロトコルを外膜と大動脈白血球を調べるために、大動脈壁内に大動脈外膜だけでなく、動脈硬化プラークに移行することができますようにのADE(二段ステップ2)大動脈外膜が部分的に消化し、容器の他の部分から削除されて消化されています。外膜を除去し、脇に設定されると、大動脈の残りの部分は血管壁から白血球を解放するためのADEで消化されています。
- 大動脈外膜分離プロトコル
- 1XのADE(セクション2のステップ1)の調製後、2.5ミリリットル/ 1X大動脈外膜の消化酵素溶液(AADES)(781.25 UコラゲナーゼIIと2.5mls PBS(ワーシントン生化学(株)、レイクウッド、ニュージャージー州14.0625 Uエラスターゼの大動脈を準備使用するまで氷上で))9場所原液。
- 大動脈を含むコレクションチューブからPBSを削除します。各大動脈に1X AADESの2.5 mlを追加します。小さい部分に大動脈を切断しないでください。 37℃で10-20分間、1X外膜の酵素溶液℃で大動脈をインキュベート
- 10月20日分の消化に続いて、新鮮なPBSでシャーレに1 × AADESから部分的に消化された大動脈を転送する。非常に慎重に、離れてFR外膜の層をはがし、湾曲鉗子の2つのペアを使用してOM単一ユニットとしての大動脈。
- 注:長い消化時間は、それが簡単に外膜を除去するようですが、外膜が過剰に消化されている場合、それは涙でしょう。
- 外膜は完全に削除されているときは、別のFACSチューブに外膜と大動脈を転送する。外膜のチューブにPBSを1mlを追加し、チューブを氷上に置きます。大動脈の管に1X大動脈解離酵素溶液2.5 MLSを追加し、37℃で40分のための大動脈をインキュベート℃に
- 注:酵素消化を促進するために、大動脈はこの時点で小さな断片に分割することができます。
- 40分の消化に続いて、氷の上大動脈の管を配置し、離れて大動脈と外膜をせん断し、5ミリリットルポリプロピレンFACSチューブ(BDファルコン)に70μmのセルストレーナーを介してそれらを渡すことによって、大動脈および外膜から単一の細胞懸濁液を準備する。ペレットを遠心分離により細胞(400xg、5分間、4℃)。セクション2のステップ4に戻り、プロトコルを再開する。
5。代表的な結果
ここでは、全体の大動脈の免疫成分、大動脈血管壁や周囲の大動脈外膜を分析するために染色フローサイトメトリーを示す数字の数を示す。最初に、我々は、全血および分離された大動脈の細胞懸濁液( 図1)上TER - 119染色を示す代表的なFACSプロットを示す。 TER - 119の正の赤血球は、大動脈の細胞懸濁液から単離した細胞の唯一の0.014パーセントは血液由来であることを示す大動脈細胞懸濁液、中の細胞の18%を占めた。これは明らかに血管を消化しますが、末梢血を循環させるようにすると、大動脈細胞懸濁液で分析したほとんどの白血球のソースであることを示す重要な対照実験です。さらに、この方法を検証するために、我々は脾細胞表面抗原に対する大動脈解離酵素のカクテル( 図2)の効果を評価した。酵素カクテルを含むいくつかの抗原、CD45、CD19、CD3、、TCRαβTCRγδといくつかの他の表面抗原7の発現に影響を与えません。
LIVE / DEAD実行可能性の色素と適切なアイソタイプコントロールと組み合わせてCD45染色は検出して、関心の副ゲートの主要な集団と分析中に細胞残骸を除外するために使用されます。 - / -マウスを図3に、ライブ大動脈CD45 +白血球は、二人の若いapoEのプールされた大動脈内IFNΥ+ T細胞の割合を決定するためにゲートした。図3に示したゲート方式を使用して、この手法の汎用性を強調するために、我々は2つのアポEからCD68 + CD11b +マクロファージおよびIFNγ+TCRαβ+細胞に対して図4代表的な細胞内染色に存在する- / - 12マウス飼育西部の食事療法週間。 / - -などの洋風の食事摂取アポで、期待される。大動脈、大動脈内の白血球の大部分は、マクロファージ(40%CD68 + CD11b +)またはその他の骨髄性細胞(CD11b + 低 CD68とCD11b + CD68 -)です。さらに、Th1細胞は、TCRαβT細胞( 図4)浸潤大動脈の主要な部分を含む。大動脈白血球および白血球サブセットの全体的な割合は、マウスとアテローム性動脈硬化症の重症度の年齢に応じて変化するにつれて、関心の主要な集団のための最適なゲーティング戦略は、経験的に決定されるべきである
フローサイトメトリーの染色のために大動脈外膜を単離する可能性を実証するために、我々は、代表的なCD45 +大動脈と外膜の細胞懸濁液用の白血球染色( 図5)を提示する。簡単に言えば、三高齢アポ - / -マウスの大動脈を消化し 、上述のように(第2条および第4)一緒にプール。 CD45 +白血球の浸潤する外膜(細胞懸濁液の18%)と残りの大動脈(細胞懸濁液の11%)の両方で検出された。
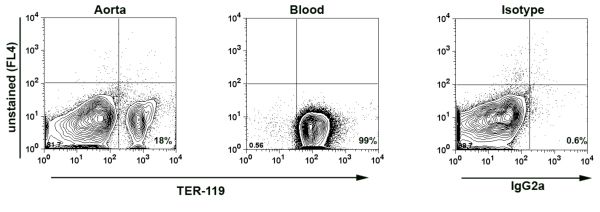
図1:TER - 119消化大動脈細胞懸濁液で染色。大動脈は、PBS、2%のヘパリンを含むで心臓穿刺により灌流した。その後大動脈を37で1時間酵素カクテル℃で消化した大動脈の細胞懸濁液および血液サンプルは、(陽性対照として)抗Ter - 119 - PE腹筋で染色し、フローサイトメトリーによって分析した。 TER - 119陽性赤血球のアカウント大動脈から分離されたすべての白血球のわずか0.014パーセントは、血液由来の白血球になる可能性が高いことを示す大動脈の細胞懸濁液中の全細胞の18%。

図2:酵素カクテルの治療は、リンパ球上のCD45(上部)やCD19(下)の発現に影響を与えません。 未処理(A、B)と酵素カクテル(C、D)で処理から細胞懸濁液LNが得られ、およびAPC - Cy7標識抗CD45とAPC結合抗CD19モノクローナル抗体で染色した。 (、C)の数値は、R1ゲートにCD45 +白血球の割合を表します。 (B、D)の数値は、CD45 + / CD19 +リンパ球の割合を表します。プロファイルは、CD45 +白血球上にゲートがあります。
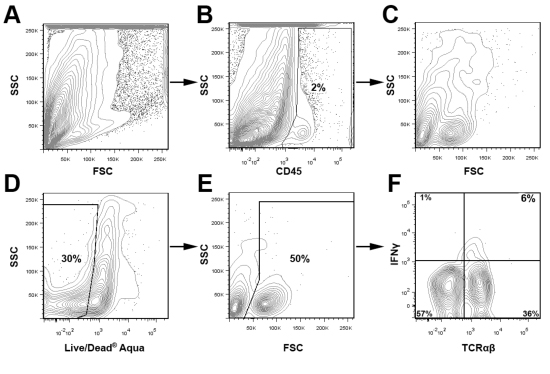
図3大動脈白血球の分析のためのゲーティング戦略つの大動脈がアテローム性動脈硬化が発生しやすいアポから分離し、プールされた- 。。/ -上記のようなマウスと大動脈の細胞懸濁液を調製した。細胞懸濁液は、CD45(PerCP)、TCRαβ(FITC)、IFNγ(eFluor 450)、およびデッド/ライブアクアのために染色し、BD FACSキャリバーをアップグレードCytek DXP 8色を用いて分析した。簡単に言えば、CD45 +白血球はゲートであった(B)、さらに(CF)を分析。死んだ細胞は、ライブ/デッドアクア染色(D)とFSCプロット(E)に基づいて、分析から削除されました。住んでいる大動脈白血球は、TCRαβとIFNγの発現(F)を調べた。
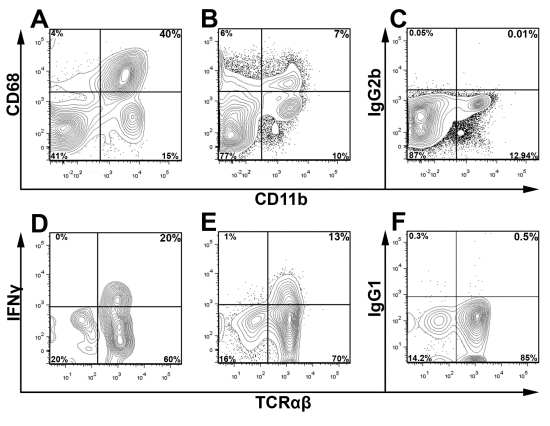
説明されているように大動脈と脾臓- 。。/ - 図4細胞内抗原およびサイトカインの細胞内染色細胞懸濁液は全体アポから調製した。大動脈(A)と(B、C)脾臓細胞懸濁液は、CD45、CD11b、およびCD68またはBD Cytofix / Cytoperm™キット(BD Biosciences)を用いて、アイソタイプコントロールのために染色した。細胞は、CD45 +白血球と破片にゲートは、前方及び側方散乱プロファイルに基づいて除外されていた。細胞内IFNγ染色では、大動脈および脾臓細胞懸濁液は、前述のとおり、ゴルジ停止、PMA、およびイオノマイシンCを添加したRPMI 1640で5時間培養した。9は 、単一の大動脈(D)と(E、F)脾臓細胞懸濁液を刺激したまたはアイソタイプ(IgG1の- eF450、F)、続いてCD3(APC - Cy7)、TCRαβ(FITC)、CD45(PerCP)で染色し、死アクア、およびIFNγを(E eFluor 450)ライブ。 T細胞(DF)は、ゲートライブCD45 +からCD3 +白血球(CD45 + LIVE / DEADアクア)だったとTCRαβとIFNγを調べた。
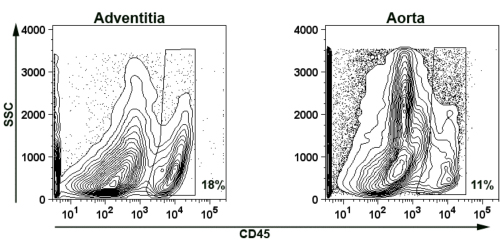
。。 - / -マウスを図5孤立したマウス大動脈外膜と大動脈血管壁の代表的な画像代表フローサイトメトリーカウンターのプロットは、高齢者apoEの外膜と大動脈壁におけるCD45 + T細胞の存在を示しています。 SSC側散乱。破片と壊死組織の自家蛍光を除去するために、プロットは、FSC> 750のゲートでした。ゲートがまたFSC <3500、SSC <3500として設定されてダブレットから追加の自己蛍光を避けるために。パーセンテージはゲート内のCD45 +細胞を示している。
ディスカッション
ここで、我々はマウス大動脈の免疫細胞組成の調査のためにフローサイトメトリーベースの手法を提案する。この方法の主な利点は、単一細胞レベルで大動脈免疫細胞を分析すると大動脈白血球の活性化状態を特徴づけるためにできることです。このメソッドは、マウス大動脈に限定し、我々 (未発表データ)と、他の10は、内胸動脈、大動脈弁、冠状動脈のような人間の標本を分?...
開示事項
謝辞
PO1 HL55798(KLへ)とアメリカ心臓協会サイエンティスト開発グラント0525532U(例に):この作品は、健康補助金の国立研究所によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 材料 | カタログ番号 | 会社 | |
| コラゲナーゼXI | C7657 | シグマアルドリッチ | |
| ヒアルロニダーゼ | H3506 | シグマアルドリッチ | |
| DNアーゼI、タイプ2 | D4527 | シグマアルドリッチ | |
| コラゲナーゼI | C0130 | シグマアルドリッチ | |
| コラゲナーゼII | LS004174 | ワーシントン生化学株式会社 | |
| エラスターゼ | LS002292 | ワーシントン生化学株式会社 |
参考文献
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved