JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Murine Aortas 이내에 면역 세포의 흐름 Cytometry 분석
요약
본 논문은 aortas의 면역 성분을 조사하기 위해 흐름 cytometry 기반 방법을 제공합니다. 신문은 또한 별도로 주변 adventitia 및 혈관 벽을 검사 수 있습니다 추가 기법을 보여줍니다. 이 방법은 대동맥 leukocytes의 phenotypical 분석을 수행하고 죽상 경화증 연구에 대한 몇 가지 면역 assays을 적용하는 가능성을 엽니다.
초록
죽상 경화증은 거품 세포, 면역 세포, 혈관 내피 및 평활근 세포, 혈소판, 세포외 기질, 그리고 광범위한 괴사와 지질이 풍부한 코어로 구성된 plaques의 형성에 의해 특징 있으며 중간 및 대형 선박의 만성 염증성 과정 주변 조직의 섬유증. 면역 반응 1 타고난과 적응 무기가 죽상 경화증의 개시, 개발 및 지속성에 참여합니다. 2, 3이 증거의 중요한 기관이다 같은 macrophages로 면역 세포의 서로 다른 하위 집합, 돌기 그 세포, T 및 B lymphocytes은 건강하고 죽상 경화증 발생하기 쉬운 생쥐 4 aortas 내에 존재한다. 또한 면역 세포는 atherogenesis이 조직의 중요한 역할을 제안 주변 대동맥 adventitia에서 찾을 수 있습니다. 2
얼마 동안, 면역 세포들이 활성화 상태 및 대동맥 벽 내의 세포 성분의 다른 유형의 양적 감지 죽상 경화증의 연구에 대한 RT - PCR과 immunohistochemical 방법으로 제한되었다. 몇 가지 시도는 인간의 aortas를 사용하여 유동세포계측법을 수행하기 위해 만들어진, 그리고 높은 autofluorescence 같은 문제의 숫자가 5,6를보고되었습니다. 인간 atherosclerotic plaques는 collagenase 1 소화했고, 무료로 세포는 CD14에 대한 수집 및 스테인드되었습니다 + / CD11c + 대식 세포 - 파생 거품 세포를 강조합니다. 본 연구에서는, "모의"채널은 거짓 - 긍정적인 얼룩을 방지하는 데 사용되었다. 소화 과정에서 축적 6 괴사성 물질 대동맥 표본에서 높은 autofluorescence를 생성 파편 많은 양의 상승을 제공합니다. 이 문제를 해결하려면, 부정과 긍정적인 컨트롤 패널이 제안되어 있으나, 이중 염색법는이 샘플에 적용 될 수 있습니다. 우리는 면역 세포 성분을 분석하고 활성화, 증식, 건강하고 죽상 경화증 발생하기 쉬운 대동맥에서 면역 세포의 분화를 특징하는 새로운 흐름 cytometry 기반의 방법 7을 개발했습니다. 이 방법은 대동맥 벽의 면역 세포 조성의 조사를 허용하고이 질병의 면역 측면의 조사에 대한 면역 방법의 광범위한 스펙트럼을 사용하는 가능성을 엽니다.
프로토콜
1. murine aortas의 분리
절차의 기관 IACUC위원회의 승인은 마우스 작동하도록해야합니다.
- 50 ML PBS와 혼합하는 반전 튜브에 헤파린 나트륨 1000 단위를 추가하여 heparinzed PBS를 준비합니다. 혈액 및 수거 각 대동맥에 대한 PBS를 포함하는 컬렉션 튜브 빈 컬렉션 튜브를 준비합니다. 얼음의 모든 튜브 보관하십시오.
- 그리기 혈액 (1000 U / ML 헤파린 나트륨의 0.1ml)을 주사기를 Heparinize, 수술 도구 (두 곡선 포셉의 쌍, 해부 가위, 그리고 microshears 한 켤레) 및 해부를위한 해부 무대를 준비합니다.
- NIH와 설치류의 안락사에 관한 기관 IACUC위원회 정책을 다음과 승인 챔버의 이산화탄소를 사용하여 마우스를 안락사. 해부 단계로 마우스를 전송하기 전에 효과가 있는지 확인합니다.
- 간단히 70 % 에탄올로 마우스를 흡수하고 해부 단계로 마우스를 고정. 심장 찔린 통해 마우스에서 혈액을 그립니다.
- 복부와 가슴 충치를 엽니다. 25g의 바늘로 10 ML의 주사기를 사용하여 완전히 PBS 완전히 심장 주사하여 혈관에서 혈액을 제거하는 헤파린의 2 %를 포함하는으로 vasculature을 perfuse. 대동맥 조직 이내에 혈액이 없다는 것을 확인하십시오. 재관류는 선박 벽의 모든 plaques가 그대로 유지되도록 약간의 압력으로 천천히 실시한다.
- 내장 기관, genitourinary 기관, 횡경막과 비장, 신장, 심장, 그리고 대동맥은 그대로 둔를 해부하다하고 제거합니다.
- 조심스럽게 대동맥과 adventitia은 그대로두고, 멀리 대동맥의 지방 조직 및 패러 대동맥 림프절을 해부하다. , 대동맥 아치를 포함하여 전체 대동맥를 수집 오름차순, 내림차순 흉부와 복부 부분. PBS로 컬렉션 관에서 분리된 대동맥를 놓습니다. 격리 절차 동안 선박 촉촉한을 유지하려고합니다.
2. 단세포 suspensions의 준비
- 1X 대동맥 해리 효소 주식 솔루션 (아데스)를 (125 U / ML Collagenase 타입 XI, 60 U / ML Hyaluronidase 타입 1 - S, 60 U / ML DNase I, 450 U / ML Collagenase 유형 I, 2.5에서 MLS 만들기 PBS는 Galkina 외에서 수정되었습니다. 7). 모든 효소는 시그마 - 알드리치에서 있습니다. 얼음 주식 효소 솔루션을 놓습니다.
- 대동맥을 포함하는 컬렉션을 튜브에서 PBS를 제거합니다. 각 대동맥에 1X 아데스 2.5 ML를 추가합니다. 효소 소화를 촉진 또는 전체 대동맥 그대로두고 작은 조각으로 잘라 aortas. 37 1 시간 1X 효소 솔루션 aortas을 품어 ° C (느린 흔들림는 선택 사항입니다.)
- 1 시간 보육에 따라 차별 aortas 전단 및 5ml 폴리 프로필렌 외과 튜브 (BD 팔콘)로 70 μm의 셀 스트레이너를 통해 그들을 통과하여 소화 대동맥에서 단세포 suspensions을 준비합니다. 펠렛 원심 분리하여 세포 (400xg 5 분, 4 ° C).
- 외과 버퍼 (PBS는 1 % BSA와 0.05 % 난 3 보충)의 1ml에있는 세포를 Resuspend하고 trypan 파랑, hemocytometer, 그리고 가벼운 현미경을 사용하여 대동맥 세포 현탁액에 존재 얼마나 많은 세포가 결정합니다. 소화 후 얻은 세포의 총 숫자는 마우스 연령 다이어트 또는 죽상 경화증의 정도에 따라 달라집니다.
3. 유동세포계측법의 염색법
- 새로운 외과 튜브의 적절한 숫자를 라벨. 일반적으로 유동세포계측법 실험은 단일 색상 튜브, 적절한 형광 - 마이너스 - 원 컨트롤 (FMO) 8, 적절한 isotype 컨트롤 및 실험 튜브의 집합의 집합이 아닌 스테인드 제어 튜브를 가질 것입니다. 격리 수있는 대동맥 leukocytes의 제한된 숫자가 있으므로, 지라 leukocytes은 단일 제어 얼룩을 수행하는 데 사용할 수 있습니다.
- 우리는 대동맥 세포 suspensions를 얼룩이 표준 유동세포계측법 프로토콜을 사용합니다. 간단히, 외과 튜브 (S)로 대동맥 세포 현탁액에서 0.5 - 1x10 6 세포의 나누어지는을 전송. 원심 분리에 의해 외과 버퍼와 펠렛의 1ml 세포를 추가합니다. decanting하여 pelleted 세포의 표면에 뜨는를 제거합니다.
- 실험 튜브, 형광 - 마이너스 - 원 튜브와 튜브에 대한 isotype FC 블록 솔루션과 항체 칵테일을 준비합니다. 튜브 및 손가락 영화 또는 세포를 resuspend을 부드럽게 소용돌이 모든 외과 버퍼에 FC 블록 (14.2μg/ml, 클론 2.4G2)의 100μl를 추가합니다. 상온에서 15-20분에 대한 샘플을 품어.
- 항체 얼룩, isotype의 얼룩이나 FMO 제어 얼룩 칵테일을 준비합니다. 귀하의 예비 적정 실험에서 항체의 최적 농도를 결정합니다. FC 블록의 존재에서 샘플 튜브에 항체 칵테일 (100ul/0.5-1.0x10 6 셀)을 추가합니다. 4 20-30 분 품어 ° C를 어둠에 약해.
- 각각의 튜브에 외과 버퍼의 1ml을 추가, 소용돌이 원심 분리하여 세포를 혼합하고, 펠릿 수 있습니다. 절차 한 번 더 반복합니다.
- 뜨는 및 resuspend을 가만히 따르다2퍼센트 PFA의 300μl의 pelleted 세포. 흐름 cytometer에 샘플을 실행합니다.
- 참고 : 일반적으로 안티 CD45 항체는 (일반적인 백혈구 항원 표식) + leukocytes 나중에 게이트 CD45하기 위해 샘플의 모든에 추가됩니다 외에도 7, CD45 FMO 및 isotype 컨트롤로 CD45 + 임파구 게이트 곳으로 처음 사용해야합니다. CD45 표현 leukocytes 사이 다를 수 있습니다.
- 참고 : 표면 항원 또는 낮은 이벤트 항원을 표현하는 저밀도를 감지하려면, 이러한 R - Phycoerythrin (PE) 또는 Allophycocyanin (APC)로 "밝은 fluorochromes"를 사용합니다. 또한, 드문 이벤트를 함께 몇 가지 일치 aortas을 풀링하여 감지할 수, 1 백만명 이상의 세포를 사용하는 경우, 테스트마다 사용하는 항체의 양은 비례 증가한다.
- 참고 : 고립 aortas에서 최소한의 혈액 contaminations있다는 것을 보장하고 결과적으로 대동맥 세포 현탁액에서 몇 가지 실험에 추가 얼룩이 터 - 119, 7 적혈구 (RBC)에 의해 표현 항원에 대해 수행되었다. 혈액에있는 백혈구 (WBC)에 RBC의 수는 약 10x10 6 셀 / μl 8x10 3 셀 / μl하는 것입니다. 대동맥 샘플의 터 - 119의 표현에 따라 샘플의 혈액 파생 백혈구의 비율을 계산하실 수 있습니다. 일반적으로 우리는 대동맥 샘플에서 혈액 파생 WBC 미만 0.02 % 수 있습니다. (Fig.1)
- 참고 : 효소 처리는 표면 항원의 표현에 영향을 미칠 수 있기 때문에 소화 효소에 저항이 관심의 항원에 대한 결정되어야합니다. 간단히, 주변 림프절 (PLN) 또는 비장의 작은 조각은 ° C. 37에서 1 시간 동안이나 효소 칵테일없이 incubated 아르 일시간 후, 항원의 표현은 유동세포계측법에 의해 결정됩니다. 효소 칵테일은 여러 표면 항원 (Fig.2) 7 아무런 영향을 미치지 않습니다. 다른 경우에는 효소 치료는 항원 표현의 상당한 손실 발생. 이 문제는 다른 세포 마커를 사용하여 피할 수 있습니다.
- 참고 : 원하는 경우 라이브 / 죽은 세포 생존의 얼룩은 4 단계 이후에 수행할 수 있습니다. 일반적으로 라이브 / 데드 고칠수 죽은 세포 스테인 키트 (Invitrogen, 분자 프로브)를 사용합니다. 라이브 / 죽은 색소와 함께 세포를 얼룩이, 섞어 PBS와 소용돌이 1ml에 다시 용해 죽은 / 라이브 염료의 1μl를 추가하여 1X 라이브 / 데드 솔루션을 만들 수 있습니다. 죽은 / 라이브 싱글, 칵테일, FMO 및 isotype 제어 샘플을 1X 라이브 / 데드 염료 100-200 μl를 추가합니다. 어둠 속에서 10 분 동안 상온에서 염색과 샘플을 품어. 에 대한 단일 제어 튜브가 죽었 / 라이브 56 incubated되어야 ° 열 충격에 의해 세포를 죽일 10 분 동안 어둠 속에 C. 원심 분리하여 PBS 및 펠릿 세포 1 ML있는 세포를 씻으십시오. 5 단계에서 프로토콜을 재개.
- 참고 : 세포 항원 및 크린 시토킨에 대한 세포내 얼룩이 프로토콜과 호환됩니다. 관심의 항원에 따라 - 잠깐요, 세포내 얼룩이 eBioscience BD Pharmingen, 또는 Caltag 실험실에서 세포 고정 / permeabilization의 시약을 사용하여 수행할 수 있습니다. 수정 및 세포 얼룩에 대한 세포를 permeabilize하려면 세포 얼룩 단계 (제 3 단계 5) 이후 제조 업체의 지침에 따라 고정 / permeabilization 단계를 수행합니다. 세포 세척 단계에 따라 6 단계 (제 3 단계 6) 저희 프로토콜을 재개하십시오.
4. 절연 주변 adventitia 및 선박 벽 유동세포계측법 분석
leukocytes가 유동세포계측법에 의해 adventitial과 대동맥 leukocytes을 확인하기 위해 대동맥 adventitia뿐만 아니라 대동맥 벽 내에 atherosclerotic plaques 마이 그 레이션 수 있듯이이 두 해부 사이트에서 유동세포계측법를 분리하고 수행하기위한 프로토콜이 개발되었다. 9 간단히, 전체 aortas 전에 아데스 (제 2 단계 2) 대동맥 adventitia 부분적으로 소화하고 선박의 나머지 부분에서 제거로 소화하고 있습니다. adventitia 제거하고 따로 설정되면, 대동맥의 나머지는 혈관 벽에서 leukocytes을 해방하기 위해 아데스와 소화합니다.
- 대동맥 Adventitia 격리 프로토콜
- 1X 아데스 (제 2 단계 중 1 단계)의 준비에 따라, 2.5 ML / 1X 대동맥 adventitia의 소화 효소 솔루션 (AADES) (781.25 U Collagenase II 및 2.5mls PBS (워싱턴 생화학 공사, 레이크 우드, 뉴저지에서 14.0625 U 엘라스타제의 대동맥을 준비 사용까지 얼음)) 9. 플레이스 주식 솔루션입니다.
- 대동맥을 포함하는 컬렉션을 튜브에서 PBS를 제거합니다. 각 대동맥에 1X AADES 2.5 ML를 추가합니다. 작은 조각으로 aortas를 잘라하지 마십시오. 37 10~20분에 대한 1X adventitia 효소 솔루션 aortas을 품어 ° C.
- 10-20분의 소화에 따라, 신선한 PBS와 페트리 접시에 1X AADES의 일부 소화 대동맥을 전송합니다. 매우 신중하게, 멀리 천 adventitial 계층 껍질, 곡선 포셉 두 쌍을 사용하나의 단위로 톰 대동맥.
- 참고 : 긴 소화 시간이 쉽게 adventitia를 제거하게되지만, adventitia가 과다 소화있다면 그것은 눈물 것입니다.
- adventitia가 완전히 제거된 경우, adventitia 및 별도의 외과 튜브에 대동맥을 전송하기만하면됩니다. adventitia 튜브에 PBS의 1ml을 추가하고, 얼음 튜브를 놓으십시오. 대동맥 관에 1X 대동맥 해리 효소 솔루션 2.5 MLS를 추가하고 37 40 분 대동맥을 품어 ° C.
- 참고 : 효소 소화를 촉진하기 위해 대동맥이 시점에서 작은 조각으로 나누어 수 있습니다.
- 40 분 소화 다음, 얼음에 대동맥 관을 배치하고 차별 aortas 및 adventitia 전단 및 5ml 폴리 프로필렌 외과 튜브 (BD 팔콘)로 70 μm의 셀 스트레이너를 통해 그들을 통과하여 대동맥과 adventitia에서 단세포 suspensions을 준비합니다. 펠렛 원심 분리하여 세포 (400xg 5 분, 4 ° C). 제 2 단계 4로 돌아가서 프로토콜을 재개한다.
5. 대표 결과
여기 우리는 전체 aortas의 면역 구성, 대동맥 혈관 벽과 그 주변 대동맥 adventitia을 분석 얼룩 유동세포계측법를 보여줍 수치의 번호를 제시한다. 첫째, 우리는 전체 혈액과 절연 대동맥 세포 현탁액 (그림 1)에 터 - 119 염색법을 보여줍니다 대표적인 외과의 계획을 보여줍니다. 터 - 119 긍정적인 적혈구가 대동맥 세포 suspensions으로부터 격리 세포의 유일한 0.014 %가 혈액 파생되는 나타내는 대동맥 세포 현탁액에서 세포의 18 %를 차지한다. 이것은 확실히 소화 혈관을 보여주는 중요한 제어 실험이지만, 주변 혈액 순환하지 않는 것은 대동맥 세포 현탁액에서 분석해 가장 leukocytes의 소스입니다. 또한, 방법을 검증하기 위해, 우리는 splenocyte 표면 항원에 대동맥 해리의 효소 칵테일 (그림 2)의 효과를 평가. 효소 칵테일을 포함한 여러 항원, CD45, CD19, 인 경우에는 3 번 CD, TCRαβ TCRγδ 여러 다른 표면 항원 7 표현에 아무런 영향을 미치지 않습니다.
데드 / 라이브 생존의 염료와 적절한 isotype 컨트롤과 함께 CD45 얼룩은 감지하고 관심의 하위 게이트 주요 인구 및 분석하는 동안 세포 잔해를 제외하는 데 사용됩니다. Fig.3, 라이브 대동맥에서 CD45 + leukocytes는 IFN의 비율을 결정하는 문이되었다 Υ 두 젊은 Apoe의 풀링 aortas 이내 + T 세포 - / - 마우스. Fig.3에 표시되는 게이팅 방식을 사용하여이 방법의 융통성을 강조하기 위해 두 Apoe에서 CD68 + CD11b + macrophages와 IFNγ + TCRαβ + 전지 Fig.4 대표 세포 얼룩에 존재 - / - 12 마우스 공급 웨스턴 다이어트 주. / - - 마찬가지로 서양 음식 먹은 Apoe에서 예상. aortas, 대동맥 내에서 leukocytes의 대부분은 macrophages (40 % CD68 + CD11b +) 또는 기타 골수양 세포 (CD11b + 낮은 CD68와 CD11b + CD68 -)입니다 또한, Th1 세포는 T 세포 TCRαβ (Fig.4)를 침투 대동맥의 주요 부분을 구성. 대동맥 leukocytes 및 백혈구 하위 집합의 전체 비율은 마우스와 죽상 경화증의 심각의 연령에 따라 다릅니다으로 관심의 주요 인구를위한 최적의 게이팅 전략은 경험적으로 결정되어야
유동세포계측법의 얼룩에 대한 대동맥 adventitia를 분리의 가능성을 입증하기 위해, 우리는 대표 CD45을 제시 + 대동맥과 adventitial 세포 suspensions에 대한 백혈구 얼룩 (그림 5). 간단히 세 노인 Apoe - / - 마우스 aortas은 소화되었고 위에서 설명한대로 (제 2 4) 함께 풀링. CD45 +의 leukocytes을 침투하기 adventitia (세포 현탁액의 18 %) 나머지 대동맥 (세포 현탁액의 11 %) 모두에서 발견되었다.
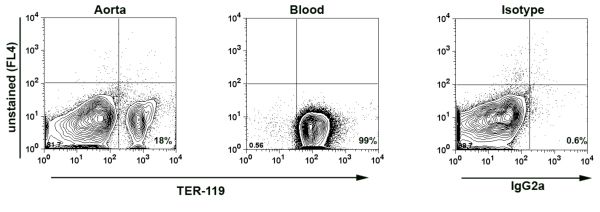
그림 1. 소화 대동맥 세포 현탁액의 터 - 119 얼룩. 대동맥은 PBS 2 %의 헤파린을 포함과 심장 관통하여 perfused했다. 그러면 대동맥은 ° C.는 37에서 1 시간을위한 효소 칵테일과 함께 소화했습니다 대동맥 세포 서스펜션 및 혈액 샘플은 (긍정적인 제어 등) 방지 - 터 - 119 - PE 애비와 스테인드 및 유동세포계측법에 의해 분석되었다. aortas으로부터 격리 모든 leukocytes만이 0.014 %가 혈액 파생 leukocytes 될 가능성이 나타내는 대동맥 세포 현탁액의 모든 세포의 18 %를 터 - 119 - 긍정적인 적혈구 계정.

그림 2. 효소 - 칵테일 치료 CD45 (상단) 또는 CD19 (아래) lymphocytes에 표정에 아무런 영향을 미치지 않습니다. 치료 (A, B)와 효소 - 칵테일 (C, D)로 치료에서 세포 suspensions LN은 취득하고, APC - Cy7 - 복합 백신 CD45과 APC - 복합 백신 CD19 mAbs 물들일되었습니다. (A, C) 번호 R1 게이트에서 CD45 +의 leukocytes의 비율을 나타냅니다. (B, D) 번호 CD45 + / CD19 + lymphocytes의 비율을 나타냅니다. 프로필 CD45 +의 leukocytes에 문이있다.
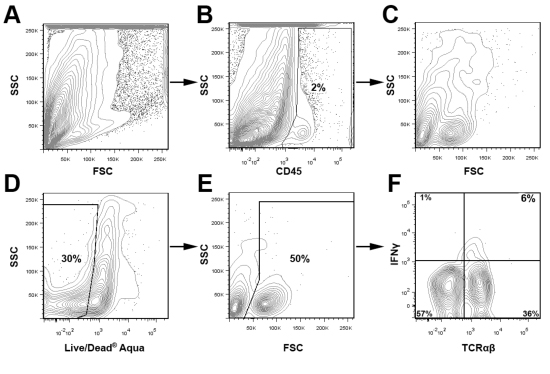
그림 3 대동맥 leukocytes의 분석을위한 게이팅 전략 두 aortas가 atherosclerotic 경향이 Apoe으로부터 격리 및 풀링된 했어요 -.. / - 위에서 설명한대로 마우스 및 대동맥 세포 suspensions이 준비되었습니다. 셀 suspensions은 CD45 (PerCP), TCRαβ (FITC), IFNγ (eFluor 450), 그리고 죽은 / 라이브 아쿠아에 대한 스테인드, 그리고 BD 외과 Calibur을 업그레이 드 Cytek DXP 8 컬러를 사용하여 분석했다. 간단히, CD45 +의 Leukocytes은 문이 있었다 (B) 및 추가 (CF) 분석했다. 죽은 세포가 죽었 / 라이브 아쿠아 얼룩 (D)와 FSC 플롯 (E)에 따라 분석에서 제거되었습니다. 라이브 대동맥 leukocytes 그런 다음 TCRαβ와 IFNγ 표현 (F)를 검사했다.
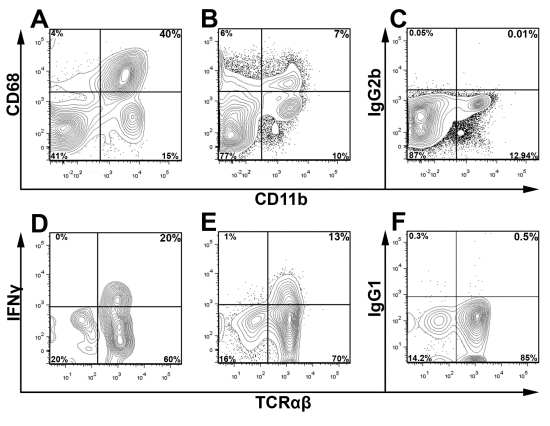
설명한대로 대동맥과 비장 -.. / - 그림 4 세포 항원 및 크린 시토킨에 대한 세포내 얼룩 세포 suspensions은 전체 Apoe에서 준비되었다. 대동맥 (A)와 (B, C) 지라 세포 suspensions는 CD45, CD11b, 그리고 CD68 또는 BD Cytofix / Cytoperm ™ 키트 (BD Biosciences)를 사용 isotype 제어를위한 스테인드되었습니다. 세포는 CD45 +의 leukocytes에 문이되었고 부스러기는 앞으로 및 측면 산란 프로파일에 따라 제외했다. 세포내 IFNγ의 얼룩 경우, 대동맥 및 지라 세포 suspensions 미리 설명한 바와 같이, 잠돌군 Zz 중지, PMA, 그리고 Ionomycin C로 보충 RPMI 1640에서 다섯 시간 동안 교양되었습니다. 9 셀 suspensions했던 단일 대동맥 (D)과 지라를 (E, F) 자극 또는 isotype (IgG1 - eF450, F); 이후 CD45 (PerCP), TCRαβ (FITC), 인 경우에는 3 번 CD (APC - Cy7) 물들일, 데드 아쿠아, 그리고 IFNγ (E eFluor 450) 살고 있습니다. T 세포 (DF)는 문이 라이브 CD45 + 인 경우에는 3 번 CD +에서 leukocytes (CD45 + 데드 / 라이브 아쿠아)되었으며 TCRαβ와 IFNγ에 대한 검사.
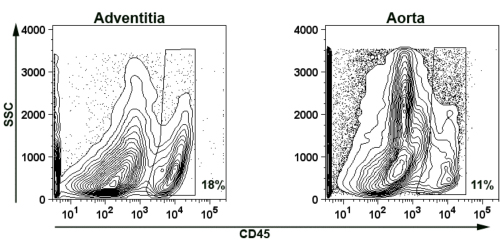
.. / - - 마우스 그림 5 격리 murine 대동맥 adventitia 및 대동맥 혈관 벽 대표 이미지는 대표 유동세포계측법 카운터 줄거리는 CD45의 존재 + 노인 Apoe의 adventitia과 대동맥 벽에 T 세포를 보여줍니다. SSC - 사이드 흩뿌리다. 파편과 괴사 조직의 autofluorescence를 제거하기 위해 플롯은 FSC> 750에 대한 문이 있었다. 게이츠는 또한 FSC <3500, SSC <3500로 설정되었습니다 doublets에서 추가 autofluorescence를 피하려면. 비율은 게이츠의 CD45 + 세포를 나타냅니다.
토론
여기, 우리는 murine aortas의 면역 세포 조성의 조사를위한 흐름 cytometry 기반의 방법을 제시한다. 이 방법의 가장 큰 장점은 단일 세포 수준에서 대동맥 면역 세포를 분석하고 대동맥 leukocytes의 정품 인증 상태를 특징하는 능력입니다. 이 방법은 murine aortas로 제한하고 (발표되지 않은 데이터) 등 10 등 내유 동맥, 대동맥 밸브 및 관상 동맥과 같은 인간의 표본을 분석하기 위해이 접근법을 사?...
공개
감사의 말
PO1 HL55798 (KL)를 미국 심장 협회 과학 발전 부여 0525532U (예)을 :이 작품은 보건 부여의 국립 연구소에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 자료 | 카탈로그 번호 | 회사 | |
| Collagenase XI | C7657 | 시그마 - 알드리치 | |
| Hyaluronidase | H3506 | 시그마 - 알드리치 | |
| DNase I, 2를 입력합니다 | D4527 | 시그마 - 알드리치 | |
| Collagenase I | C0130 | 시그마 - 알드리치 | |
| Collagenase II | LS004174 | 워싱턴 생물 코퍼레이션 | |
| 엘라스타제 | LS002292 | 워싱턴 생물 코퍼레이션 |
참고문헌
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유