Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Проточной цитометрии анализа иммунных клеток мышей В аорты
В этой статье
Резюме
Эта статья представляет проточная цитометрия основе метод для исследования иммунного состав аорты. Документ также показывает дополнительную технику, которая позволяет изучения окружающих и адвентиции стенки сосуда отдельно. Этот метод открывает возможности для выполнения фенотипических анализов аорты лейкоцитов и применить несколько иммунологических анализов для исследования атеросклероза.
Аннотация
Атеросклероз является хроническим воспалительным процессом среднего и большого размера судов, которое характеризуется образованием бляшки, состоящие из пены клетки, клетки иммунной системы, сосудистых эндотелиальных и гладкомышечных клеток, тромбоцитов, внеклеточного матрикса и богатых липидами ядро с обширным некрозом и фиброз окружающих тканей. 1 врожденного и адаптивного руки иммунном ответе принимают участие в инициировании, разработке и настойчивость атеросклероза. 2, 3 Существует значительное количество доказательств того, что различные подмножества иммунных клеток, таких как макрофаги, дендритные клетки, Т-и В-лимфоцитов, присутствуют в пределах здоровых аорты и атеросклероз подверженных мышей 4. Кроме того, клетки иммунной системы находятся в окружающем аорты адвентиции что предполагает важную роль этой ткани в атерогенеза 2.
В течение некоторого времени, количественного определения различных типов иммунных клеток, их статус активации и клеточного состава в стенке аорты была ограничена RT-PCR и иммуногистохимических методов исследования атеросклероза. Мало были предприняты попытки выполнить проточной цитометрии с использованием человеческой аорты, а также ряд проблем, таких как высокая аутофлюоресценция, были зарегистрированы 5,6. Человек атеросклеротических бляшек переваривали коллагеназы 1, а свободные ячейки были собраны и окрашены для CD14 + / + CD11c выделить макрофагами клеток, полученных из пены. В этом исследовании, "ложный" канал используется, чтобы избежать ложноположительных окрашиванию. 6 некротические материалов накапливается в процессе пищеварения приводят в большое количество мусора, который генерирует высокий аутофлюоресценция в аорте образцов. Чтобы решить эту проблему, группа отрицательный и положительный контроли была предложена, но только двойного окрашивания могут быть применены в этих образцах. Мы разработали новый проточной цитометрии Метод, основанный 7 для анализа иммунных клеточного состава и характеризуют активации, пролиферации, дифференцировки клеток иммунной системы у здоровых и атеросклероза подверженных аорты. Этот метод позволяет исследовать иммунную состав ячейки стенки аорты и открывает возможности использования широкого спектра иммунологические методы исследования иммунной аспекты этого заболевания.
протокол
1. Выделение мышиной аорты
Институциональный комитет IACUC утверждении процедуры, необходимые для работы с мышами.
- Подготовка heparinzed PBS путем добавления 1000 единиц гепарина натрия до 50 мл PBS и обращения трубки перемешать. Подготовка пустые трубки коллекцию для крови и сбор трубки, содержащей PBS для каждого аорты должны быть собраны. Держите все пробирки на льду.
- Heparinize шприц для забора крови (0,1 мл на 1000 ед / мл гепарина натрия), подготовить хирургических инструментов (две пары изогнутых щипцов, пару рассечение ножницами, и пару микросдвигов), а рассекает сцену для вскрытия.
- Эвтаназии мыши применения диоксида углерода в утвержденный камеры следующие NIH и институциональные IACUC политики комитета по грызунов эвтаназии. Проверить эффективность перед передачей мыши рассекает сцену.
- Кратко замочить мышь с 70% этанола и закрепить мышь рассечение стадии. Ничья кровь мыши с помощью пункции сердца.
- Открытое брюшной полости и грудной полостей. Использование 10 мл шприц с иглой 25 г, полностью заливать сосудистую с PBS, содержащий 2% гепарина, чтобы полностью удалить кровь из сосудов пункции сердца. Убедитесь, что нет крови в аорте тканей. Перфузии следует проводить медленно, с небольшим давлением, чтобы все бляшек в стенках сосудов остаются нетронутыми.
- Препарировать и удаления внутренних органов, мочеполовых органов, диафрагмы и селезенки, в результате чего почки, сердце и аорта без изменений.
- Осторожно рассекают жировой ткани и парааортальных лимфатических узлов от аорты, в результате чего аорта и адвентиции нетронутыми. Сбор всей аорты, включая дуги аорты, возрастанию, по убыванию, грудной и брюшной части. Место изолированной аорты в пробирки с PBS. Во время процедуры изоляции, старайтесь держать судно влажной.
2. Подготовка одного клеточные суспензии
- Создать 1X аорты диссоциации фермент фондовом Решение (ADES) (125 ед / мл коллагеназы типа XI, 60 ед / мл Гиалуронидаза типа 1-е, 60 ед / мл ДНКазы I, и 450 ед / мл коллагеназы типа I, в 2,5 мл PBS, изменение от Галкина и соавт. 7). Все ферменты от Sigma-Aldrich. Место маточного раствора фермента на льду.
- Удалить PBS из коллекции трубку с аортой. Добавить 2,5 мл 1X ADES каждому аорты. Вырезать аорты на мелкие части, чтобы облегчить ферментативного пищеварения или оставить все аорты без изменений. Инкубируйте аорты с 1X раствор фермента в течение 1 часа при температуре 37 ° C (медленнее качая необязательно).
- После 1 часа инкубации, подготовить единый суспензии клеток из переваривается аорты путем сдвига аорты друг от друга и передавая их через сито 70 мкм ячейки в 5 мл полипропиленовые трубы FACS (BD Falcon). Гранул клетки центрифугированием (400xg, 5 минут, 4 ° С).
- Ресуспендируют клеток в 1 мл FACS буфером (PBS с добавлением 1% БСА и 0,05% NaN 3) и определить, сколько клетки присутствуют в аорте суспензии клеток с трипановым синий, гемоцитометра и светового микроскопа. Общее число клеток, полученных после переваривания будут зависеть от возраста мыши и диеты или тяжесть атеросклероза.
3. Окрашивание Проточная цитометрия
- Этикетка соответствующее количество новых труб СУИМ. В общем, эксперименты проточной цитометрии должны иметь не-окрашенных контроль трубки, набор одиночных труб цвет, соответствующий флуоресценции-минус один-контроль (FMO) 8, надлежащего контроля изотипа, и набор экспериментальных труб. Поскольку Есть ограниченное количество лейкоцитов аорты, которые могут быть изолированы, селезенки лейкоцитов может быть использован для выполнения одного окрашивания контроля.
- Мы используем стандартный протокол проточной цитометрии для окрашивания аорты суспензии клеток. Короче говоря, передача аликвоту 0,5-1x10 6 клеток от аорты суспензии клеток в трубку FACS (ы). Добавить 1 мл FACS буфера и гранулах клетки центрифугированием. Удалить супернатант из гранулированных клеток декантации.
- Подготовка Fc решение блока и антител коктейли для экспериментальные трубы, флуоресценция-минус один труб и изотипа труб. Добавить 100 мкл Fc блока в FACS буфера (14.2μg/ml, клон 2.4G2), чтобы все трубы и пальцем фильм или мягко вихрь для ресуспендирования клеток. Инкубируйте образцы в течение 15-20 минут при комнатной температуре.
- Подготовка антител окрашивание, окрашивание или изотипа FMO коктейли контроль окрашивания. Определить оптимальные концентрации антител в предварительных экспериментах титрования. При наличии блока Fc, добавить антител коктейли (100ul/0.5-1.0x10 6 ячеек) для пробирок с образцами. Инкубируйте в течение 20-30 мин при 4 ° С в темноте.
- Добавить 1 мл буфера FACS в каждую пробирку, вихревые перемешать, и гранул клетки центрифугированием. Повторите процедуру еще раз.
- Декантируйте супернатант и ресуспендируйтегранулированных клеток в 300 мкл 2% PFA. Выполнить образцов на поток цитометр.
- Примечание: Как правило, анти-CD45 антител (общий лейкоцитарный антиген маркер) добавляется на все образцы для того, чтобы ворота CD45 + лейкоцитов более поздней версии 7 Кроме того, CD45 FMO и изотип контроля должны быть применено сначала разместить CD45 + лейкоцитов ворот как. экспрессии CD45 может варьироваться среди лейкоцитов.
- Примечание: Для обнаружения низкой плотности выражения поверхностных антигенов или низкой антигенов события, используйте «светлое флуорохромами", такие как R-фикоэритрин (ПЭ) или Allophycocyanin (APC). Кроме того, редкие события могут быть обнаружены путем объединения нескольких соответствие аорты вместе, однако если более чем один миллион клеток используются, количество антител, применяемых на тест должны быть увеличены пропорционально.
- Примечание: Для того, чтобы Есть минимальные загрязнения крови в изолированной аорты и, следовательно, аорты суспензии клеток, в некоторых экспериментах дополнительного окрашивания проводился для ТЕР-119, 7 антиген выраженных красных кровяных телец (эритроцитов). Число РБК белых кровяных телец (лейкоцитов) в крови составляет примерно 10х10 6 клеток / мкл до 8x10 3 клеток / мкл. На основе выражения ТЕР-119 в образцах аорты, процент крови происхождения белых кровяных клеток в образце могут быть рассчитаны. Обычно у нас меньше, чем 0,02% крови полученных WBC в аорте образцов. (Рис. 1)
- Примечание: Поскольку фермент лечение может влиять на экспрессию поверхностных антигенов, устойчивость к ферментативного расщепления должна быть определена для антигенов, представляющих интерес. Короче говоря, периферических лимфатических узлов (PLN) или маленькие кусочки селезенки инкубировали с или без фермента коктейля в течение 1 часа при температуре 37 ° C. Через 1 час, экспрессия антигенов определяется методом проточной цитометрии. Фермент коктейль не имеет никакого эффекта на несколько поверхностных антигенов (рис. 2) 7. В некоторых других случаях фермент лечение привело к значительной потере экспрессии антигенов. Эту проблему можно обойти, используя альтернативные маркеры клеток.
- Примечание: Live / мертвых окрашивания жизнеспособность клеток может быть выполнена после шага 4, если это необходимо. Обычно использование Live / Мертвые поправимо Мертвого сотовый пятна комплект (Invitrogen, Molecular Probes). Для окраски клеток с Live / Мертвые красителя, создать 1x Live / Мертвые решение, добавляя 1 мкл повторного растворения живых / мертвых красителя в 1 мл PBS и вихревые перемешать. Добавить 100-200 мкл 1x Live / Мертвые красителя жить / мертвых единый коктейль, FMO и образцы изотипа контроля. Инкубируйте образцы с красителем при комнатной температуре в течение 10 минут в темноте. Одной трубой управления для Live / Мертвые должны быть инкубировали при 56 ° С в темноте в течение 10 минут, чтобы убить клетки теплового шока. Вымойте клеток с 1 мл PBS и гранул клетки центрифугированием. Резюме протокол на шаге 5.
- Примечание: внутриклеточное окрашивание на внутриклеточные антигены и цитокины, совместимый с этим протоколом. Короче говоря, внутриклеточные окрашивания можно выполнить с помощью фиксации клеток / пермеабилизации реагенты из BD Pharmingen, eBioscience или Caltag лабораториях - в зависимости от антигенов, представляющих интерес. Чтобы исправить и permeabilize клеток для внутриклеточного окрашивания, выполнить фиксацию / пермеабилизации шагом, следуя инструкциям производителя, после того, внеклеточные шаг окрашивания (раздел 3 этап 5). После внутриклеточной шаг мыть, возобновить наш протокол на шаге 6 (раздел 3 этап 6).
4. Проточная цитометрия анализ изолированных окружающих и адвентиции стенки сосуда
Как лейкоциты могут перейти на адвентиции аорты, а также атеросклеротические бляшки в стенки аорты, изучить адвентиции аорты и лейкоцитах методом проточной цитометрии протокол для изоляции и проведения проточной цитометрии на этих двух анатомических областей был разработан 9. Одним словом, перед всем аорты перевариваются с ADES (раздел 2, п. 2) аорты адвентиции частично переваривается и выводится из остальных судна. После адвентиции удаляется и отложите, остальной аорты, переваривают ADES освободить лейкоцитов из стенки сосуда.
- Аортальный адвентиции Изоляция протокола
- После подготовки 1X ADES (раздел 2 этап 1), подготовить 2,5 мл / аорты 1X аорты адвентиции пищеварения фермента решение (AADES) (781,25 U коллагеназы II и 14,0625 U эластазы в 2.5mls PBS (Уортингтон биохимических Corp, Лейквуд, штат Нью-Джерси )). 9 Место маточного раствора на льду до использования.
- Удалить PBS из коллекции трубку с аортой. Добавить 2,5 мл 1X AADES каждому аорты. Ничего не вырезано аорты на мелкие кусочки. Инкубируйте аорты с ферментом решение 1X адвентиции в течение 10-20 минут при температуре 37 ° C.
- После 10-20 минут пищеварения, передача частично переваренной аорты из 1X AADES в чашке Петри со свежим PBS. Очень тщательно, с использованием двух пар изогнутых щипцов, очистить адвентиции слой от фром аортой как единое целое.
- Примечание: более длительное время пищеварения сделать его легче удалить адвентиции, однако, если адвентиции чрезмерно переваривается она порвется.
- Когда адвентиции была полностью удалена, передачи и адвентиции аорты отделить труб СУИМ. Добавить 1 мл PBS к трубке адвентиции, и место трубки на льду. Добавить 2,5 мл 1X аорты решение фермента диссоциации в аорту трубки, инкубировать аорты в течение 40 минут при температуре 37 ° C.
- Примечание: Для облегчения ферментативного пищеварения, аорты может быть разделен на более мелкие части в этой точке.
- После 40 минут пищеварения, место аорты пробирку на льду и подготовить единый суспензии клеток из аорты и адвентиции путем сдвига аорты и адвентиции друг от друга и передавая их через сито 70 мкм ячейки в 5 мл полипропиленовые трубы FACS (BD Falcon). Гранул клетки центрифугированием (400xg, 5 минут, 4 ° С). Вернуться в раздел 2 шага 4 и возобновить протокола.
5. Представитель Результаты
Здесь мы приведем ряд цифр, который демонстрирует проточной цитометрии окрашивания для анализа иммунных состав целом аорты, аортального сосудистой стенки и окружающих аорты адвентиции. Во-первых, мы демонстрируем представитель участок FACS, который показывает ТЕР-119 пятен на цельной крови и изолированной суспензии клеток аорты (рис. 1). ТЕР-119 положительных эритроцитов приходится 18% клеток в суспензии клеток аорты, которая показывает, что только 0,014% клеток, выделенных из суспензий аорты ячейки крови происхождение. Это очень важный эксперимент управления, который ясно показывает, что переваривается сосудов, но не циркулирует периферической крови является источником для большинства лейкоцитов проанализированы аорты клеточной суспензии. Кроме того, для проверки метода, мы оценили эффект фермента аорты диссоциации коктейль на спленоцитов поверхностных антигенов (рис. 2). Фермент коктейль не влияет на экспрессию ряда антигенов, в том числе, CD45, CD19, CD3, TCRαβ, TCRγδ и несколько других поверхностных антигенов 7.
CD45 окрашивания в сочетании с Live / Мертвые краситель жизнеспособности и надлежащего контроля изотипа используются для обнаружения и суб-ворота основные популяции интерес и для исключения распада клеток во время анализа. В рис.3, живой аорты CD45 + лейкоцитов закрытого для определения процентного содержания ИФН Υ + Т-клеток в пределах объединенных аорты двух молодых ApoE - / - мышей. Для того чтобы подчеркнуть универсальность этого метода, с помощью стробирования схеме, приведенной на рис.3, мы представляем на рис.4 представитель внутриклеточного окрашивания на CD68 + + CD11b макрофагов и IFNγ + TCRαβ + клеток от двух ApoE - / - мышей, которых кормили западную диету в течение 12 недель. Как и ожидалось, в западной диеты кормили ApoE - / - аорты, большинство лейкоцитов в аорте являются макрофаги (40% CD68 + CD11b +) или других миелоидных клеток (CD68 + CD11b низким и CD11b + CD68-). Кроме того, Th1 клетки составляют основную часть аорты проникновения TCRαβ Т-клеток (рис.4). Как общий процент аорты лейкоцитов и лейкоцитарной подмножества варьируется в зависимости от возраста мыши и тяжесть атеросклероза, оптимальная стратегия стробирования для крупных популяций интересов должны быть определены эмпирически
Чтобы продемонстрировать возможности выделения аорты адвентиции для потока окрашивания цитометрии, мы представляем представитель CD45 + лейкоцитов окрашивание на аорте и адвентиции клеточные суспензии (рис. 5). Короче говоря, три в возрасте ApoE - / - мыши аорты были переварены и объединены вместе, как описано выше (разделы 2 и 4). Проникнув CD45 + лейкоциты были обнаружены как в адвентиции (18% клеточной суспензии), а остальные аорты (11% клеточной суспензии).
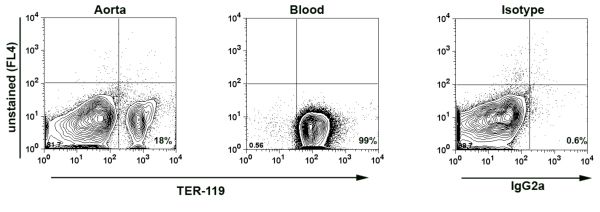
Рисунок 1. ТЕР-119 окрашивания в переваривается суспензии клеток аорты. Аорта была перфузии путем пункции сердца с PBS, содержащий 2% гепарина. Затем аорты переваривали ферментом коктейля в течение 1 часа при температуре 37 ° C. Аортальный подвески клеток и крови (в качестве положительного контроля) окрашивали анти-ТЕР-119-PE Abs и анализировали с помощью проточной цитометрии. ТЕР-119-положительных эритроцитов приходится 18% всех клеток в суспензии клеток аорты о том, что лишь 0,014% всех лейкоцитов изолированы от аорты, вероятно, будут кровь полученных лейкоцитов.

Рисунок 2. Фермент-коктейль лечения не оказывает влияния на CD45 (вверху) или CD19 (внизу) выражение лимфоцитов. Сотовые суспензий из необработанной (A, B) и обрабатывают ферментом-коктейль (C, D), Л. Н. были получены, и окрашивали APC-Cy7-сопряженных анти-CD45 и APC-сопряженных анти-CD19 моноклональных антител. (А, С) цифры представляют процент CD45 + лейкоцитов в R1 ворот. (B, D), числа представляют процент CD45 + / CD19 + лимфоцитов. Профили закрытого на CD45 + лейкоцитов.
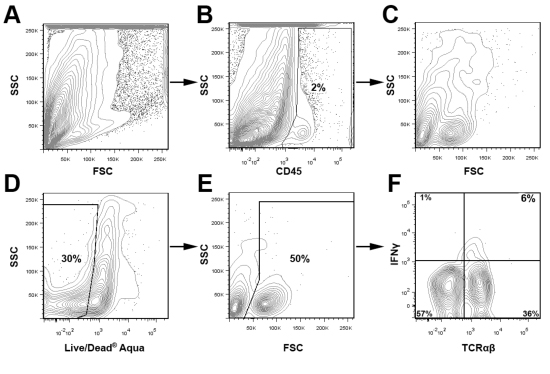
Рисунок 3 Память стратегии для анализа аорты лейкоцитов Два аорты были выделены и объединенных с атеросклеротическими склонны ApoE -.. / - Мышей и аортального суспензии клеток были получены, как описано выше. Клеточные суспензии, были окрашены для CD45 (PerCP), TCRαβ (FITC), IFNγ (eFluor 450), и жить / Dead Aqua, и проанализированы с помощью Cytek DXP 8 Цвет обновлен BD FACS Calibur. Короче говоря, CD45 + Лейкоциты были закрытого (Б) и дальнейшему анализу (CF). Мертвые клетки были удалены из анализа, основанного на Live / Мертвые Аква окрашивания (D) и FSC участки (Е). Живая лейкоцитов аорты затем были исследованы на TCRαβ и IFNγ выражение (F).
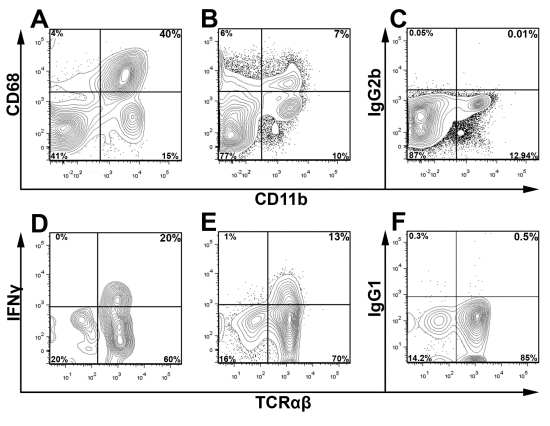
.. Рисунок 4 внутриклеточного окрашивания внутриклеточных антигенов и цитокинов суспензии клеток были получены из целого ApoE - / - аорты и селезенки, как описано. Аорты (А) и селезенки (B, C) суспензии клеток окрашивали CD45, CD11b и CD68 или изотипа управления с помощью BD Cytofix / Cytoperm ™ Kit (BD Biosciences). Клетки закрытого на CD45 + лейкоцитов и обломков был исключен на основе прямых и боковых профилей разброс. Для внутриклеточного окрашивания IFNγ, аорты и селезенки суспензии клеток культивировали в течение пяти часов в RPMI 1640 дополнен Гольджи остановиться, PMA, и иономицина С, как описано ранее 9. Вынужденное одного аорты (D) и селезенки (E, F) суспензии клеток были Впоследствии окрашивали CD45 (PerCP), TCRαβ (FITC), CD3 (APC-Cy7), Live Мертвого Aqua, и IFNγ (eFluor 450; E) или изотипа (IgG1-eF450, F). Т-клетки (DF) были закрытом от живых CD45 + CD3 + лейкоцитов (CD45 + Live / Мертвые Аква-) и исследуют на TCRαβ и IFNγ.
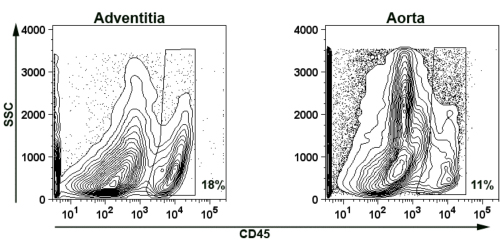
.. Рисунок 5 представитель образ изолированного мышиной аорты и аортального адвентиции стенки сосуда представитель проточной цитометрии счетчик сюжет демонстрирует наличие CD45 + Т-клеток в адвентиции и аортального стене в возрасте ApoE - / - мышей. SSC-сторон разброс. Для устранения аутофлюоресценция от мусора и некротических тканей, участки закрытого для FSC> 750. Чтобы избежать дополнительных аутофлюоресценция из дублетов ворота были созданы также в качестве FSC <3500, SSC <3500. Проценты показывают CD45 +-клеток в ворота.
Обсуждение
Здесь мы представляем потока цитометрии Метод, основанный на исследовании иммунного клеточного состава мышиных аорты. Основным преимуществом этого метода является способность анализировать аорты иммунных клеток на одном уровне клеток и, чтобы охарактеризовать состояние активации ?...
Раскрытие информации
Благодарности
Работа выполнена при поддержке Национального института здоровья гранта: PO1 HL55798 (в КЛ) и Американской кардиологической ассоциации ученых грантов на цели развития 0525532U (Е. Г.).
Материалы
| Name | Company | Catalog Number | Comments |
| Материал | Номер в каталоге | Компания | |
| Коллагеназа XI | C7657 | Sigma-Aldrich | |
| Гиалуронидаза | H3506 | Sigma-Aldrich | |
| ДНКазы I, тип 2 | D4527 | Sigma-Aldrich | |
| Я Коллагеназа | C0130 | Sigma-Aldrich | |
| Коллагеназы II | LS004174 | Уортингтон Биохимические корпорации | |
| Эластазы | LS002292 | Уортингтон Биохимические корпорации |
Ссылки
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены