Method Article
マウス子宮内でエレクトロポレーション:制御時空間遺伝子導入
要約
発展途上のマウス脳への遺伝子導入法は、ユニークな手術法と電極の特殊な形状を用いて記述されます。このユニークな手法は、脳の発達の研究に多くの神経科学者を支援する時間的および空間的にプラスミドDNAのトランスフェクションすることができます。
要約
シグナル伝達分子と軸索ガイダンス分子、地元の遺伝子導入やノックアウト必要とされるなどの発展途上の脳の特定の領域で発現する遺伝子の機能を理解するために。ローカル領域にノックインまたはノックアウト遺伝子ターゲティングは、特定の骨の折れる、高価であるCREライン、、、時間がかかるとの組み合わせで実行することが可能です。したがって、単純なトランスフェクション法、 子宮内エレクトロポレーション法で 、短時間で実行できる、前のトランスジェニック動物の1,2の世代に候補遺伝子の可能な機能をテストするための便利なようになります。これに加えて、 子宮内エレクトロポレーションでは特定のCREのラインが存在しない脳の領域をターゲットとし、胚致死3,4が制限されます。ここで、我々は、脳の発達のターゲット領域に簡単で、便利な遺伝子導入用電極、2つの異なるタイプを組み合わせる子宮内エレクトロポレーションでの方法を提示する。最初に、光ファイバー、光ファイバケーブルを使用して、胚のユニークな保持方法は、対象となる脳の領域5,6に心室と針型電極の挿入にターゲットDNA溶液を注入するための小さな胚が(E9.5から)表示されるようになります。このような皮質領域のような脳のパターニングは、初期胚の段階で発生する、したがって、E9.5からこれらの初期のエレクトロポレーションは、全体面積のパターニングイベントを理解するために大きな貢献をする。第二に、キャピラリーの正確な形状は、毛細管を挿入することによって穴を作ることによって子宮の損傷を防ぎます。さらに、針電極の正確な形状は、タングステン及び白金線を使用して作成し、サンドペーパーを使用して先鋭化しマニキュア7、このプロトコルでは非常に詳細に記載されている方法で絶縁されています。このユニークな手法は、脳の制限区域へのプラスミドDNAのトランスフェクションを可能にし、小さな胚を電気穿孔することが可能になります。これは非常に初期の胚の段階で細胞分化、細胞移動、軸索誘導に取り組んでいる多くの科学者のための新しいウィンドウを開く、するのに役立ちます。また、この手法は、科学者は多くの地域固有のCREの行が関数のゲイン(GOF)または関数(LOF)の分析の損失のために存在していないような視床や視床下部などの脳の発達、の深い部分にプラスミドDNAをトランスフェクトすることができます。
プロトコル
1。注射のためのキャピラリーとDNA溶液の調製
- マキシプレップまたは同等の方法でプラスミドDNAを精製し、2〜3μg/μLの終濃度を行います。一定分量のDNAを100μg、速いグリーン染料(1%株式)とTE(10mMのトリスベース、1mMのEDTA溶液、pH8.0)を10μlの追加と1μgの/への注射のミックスの最終DNA濃度を確認するために100μlにボリュームを調整μL。プラスミドDNAの濃度を変更することができますが、個別にテストする必要がある、そのトランスフェクション効率、また、プラスミドの大きさに依存する、と。
- 室温で14,000 rpmで5分間、DNA溶液をスピンし、残渣を除去する上清を集める。
- マイクロピペットプラーを使用してガラスキャピラリーtubeaのガラスキャピラリーチューブを引き出します。先端は20〜30μmの直径を持つように鉗子で先端を摘み取る。先端から800μmの1ミリメートルを測定し、外径がより小さい60μm以下( 図1A)かどうかをチェック。
- マイクロマニピュレータにキャピラリーを接続し、鉱物油を詰めます。溶液中に先端水没、DNA溶液をキャピラリーを埋めて、DNA溶液を吸い上げる。
2。白金電極を貼り
ここではそのような皮質(図1F)のような脳の表面的な地域、中にエレクトロに棒の白金電極(Nepe遺伝子、CUY611P2 - 1)を使用。
3。微小電極の調製
脳の深い部分(すなわち、視床と視床下部)(図2B - E)にエレクトロに微小電極を使用してください。
- 一タングステンの終わり(負極用)とプラチナ(正極用)ワイヤが金メッキピンのコイルであり、パラフィルムで固定。綿棒の幹にワイヤーを挿入し、パラフィルム(図1B)で両端をラップ。
- それは800 20〜30μmの外径と60μmのミクロン- 1先端のmm(図1CおよびD)に達するまで均等に紙やすりでワイヤの先端をシャープに。
- 絶縁用電線に磨き爪の薄い上着を適用します。マニキュアが乾燥した後、先端(先端から約200μm)からそれを削除するには、アセトンを浸した綿棒を使用してください。重要な注意:マウスの子宮への損傷を防ぐために、先端部800内に部分ミクロン- 1 mmは直径の70以下である(図1E)でなければなりません。
4。手術の準備
- 妊娠マウス(E9.5 - E15.5)を麻酔。私たちは、医薬品グレードのペントバルビタールナトリウムで麻酔を示しています(表II、グラム体重あたり50μgのは、腹腔内に注入し、5分間待つ)。麻酔薬としてペントバルビタールナトリウムの代替手段としては、ケタミン/キシラジン注射またはガス麻酔薬を(ガスは短時間の手順については、望ましいです)が含まれます。注射は、どの臓器を避けるために注意を払いながら行われるべき、それ以外の場合は子宮を損傷したり、動物を殺すことになります。成功するIPが完了すると、生存率は95%以上です。また、手術はオープンエアの環境で実行することができます。前に麻酔薬を確認するために彼らのつま先をつまんに動物による応答の欠乏のための試験、運転を開始した。
- かみそりの刃と50%エタノールを使用して腹部から毛を剃る。 betadineとアルコールのスクラブ(70%)を交互に肌を準備します。
- 細かいはさみで腹部正中線で切開を加えると37の上に慎重にすべての子宮角を引き出す° C予め温めておいたリン酸緩衝生理食塩水(PBS)で湿らせた傷の周囲に配置されている綿のガーゼを、。 PBS時間のすべてを持つ子宮の潤いをキープ。
- 人差し指と中指の間にフレキシブル光ファイバケーブルを保持し、子宮角の下に置きます。使用前に70%EtOHでクリーンケーブル。いいえ顕微鏡や拡大鏡は、視覚化は必要ありません。位置は、光ファイバの光ファイバケーブルと親指の間に子宮、そして近い子宮壁へ胚を押し上げる軽く絞る。
5。 DNAとエレクトロポレーションの注入
- 胚が置かれているときに、ガラスは、ターゲットの心室に慎重にキャピラリーとDNA溶液の約1μ(図2A)を注入挿入。
- electoporation用スティックの白金電極を使用してbrainIfの浅部へのエレクトロポレーションの場合は、子宮の外側に電極を配置し(表I)製造者の指示にしたがって提案された矩形波の電流パルスを適用する。脳の深部にusingForのエレクトロポレーション、nmicroのエレクトロポレーションした場合、eedle型電極が使用されます。 Iinsert DNAを注入心室と二つの電極の間に子宮や場所、対象領域への白金電極に微細なタングステン負極、その後提案された矩形波電流パルス(表I)(図2B)を適用します。
6。ポストエレクトロポレーション
- そのORIGの子宮角のバックを置き、inalと場所、37℃で予め温めておいたPBS 500μLを加える。
- 9ミリメートルautoclipautoクリップ付き外科用縫合糸と密接な外層と内層を縫合。
- 2時間加熱パッドの上に置いて動物が麻酔からの回復を可能にする。このようなカルプロフェンまたはブプレノルフィンとして鎮痛薬は、術後の痛みのために投与することができます。
7。代表的な結果:
pCAG - EYFPの皮質エレクトロポレーションのいくつかの例は、異なる時点で棒の白金電極を使用して構築を図を図32に示す。脳は、E13.5、E14.5およびE15.5に電気穿孔、および出生後の日(P)6で収穫されています。 RORCのAThe ntibody染色GFP抗体染色により明らかにされており、両方のイメージが( 図 3AおよびB)スーパー課されている層4とEYFPトランスフェクトされた細胞の位置の位置を明らかにする。標識された皮質の細胞は、エレクトロ皮質細胞の層は明らかに時間依存エレクトロポレーションは、皮質層固有のGOF / LOF可能に示唆している各々の実験(図32)、で異なっています。
細胞のトランスフェクションの胚と効率性の生存率は胚とエレクトロポレーションの場所の年齢によって異なります。サンプルは表1にリストされている、しかし、条件が舞台と脳の部分に応じて各エレクトロポレーション用に最適化する必要があります。
このようなスティックの白金電極を使用してある視床と視床下部などの深部組織へのエレクトロポレーションは、しばしば低効率(表1)を与える。この問題は、脳の深い部分に達すると、マイクロ電極のwhichelectrodesを、使用することで解決できます。図3図4に開発する間脳にpCAG - EYFPエレクトロポレーションの例。プラスミドDNA溶液は、E11.5で第3脳室に注入し、マイクロエレクトロ( 図 3C4C)が続きます。エレクトロポレーション領域は、ほとんどの軸索のプロジェクトの皮質に( 図 3B4B)視床に制限されています。皮質の層4への軸索投射はまた、全体のニューロンをfillesfills EYFP、可視化することができる。 ( 図 3A4A)。
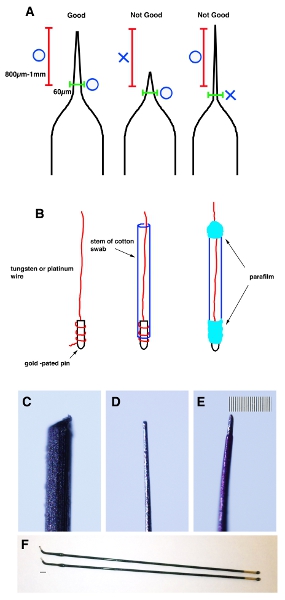
図1キャピラリーの正しい形状を示す漫画の回路図。 (A)ガラスキャピラリーチューブは、一定の形状を作るためにマイクロピペットプラーを使用してプルアップされています。ヒントは、20〜30μmのように鉗子でピンチオフです。先端(赤ブラケット)から800μmの1ミリメートルを測定し、外径が60未満ミクロン(緑のブラケット)であることを確認してください。 (B)タングステンや白金線の一端は、金メッキ端子のコイルであり、パラフィルムで固定。その後20から30μmの外径と先端の1mmから60μmとなるようにその先端を作るためにサンドペーパーを使用してください。整形前のタングステンワイヤーの(C)画像。シェーピング後のタングステンワイヤーの(D)イメージ。マニキュアの薄い上着を適用した後のタングステンワイヤーの(E)イメージ。 Eのスケールバーは、CE用の10μm以下(最小スケール)です。 (F)スティックの白金電極(NEPAの遺伝子。CUY611P2 - 1)。 Fのスケールバーは2mmです。
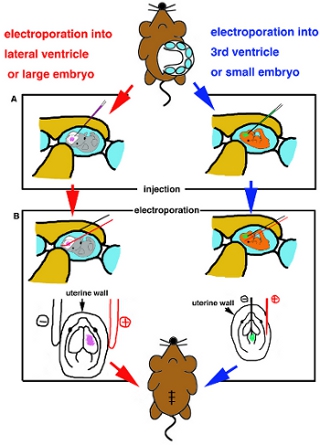
外科的処置の図2。カートゥーンスキーマ。側脳室または大規模な胚(左側)にし、第3脳室や小さな胚(右側)への注入の(A)図。プラチナの棒電極(左側)からと針型電極(右側)によってelectrporationの(B)図。
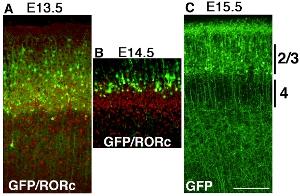
図3。マウス終脳の開発は、E13.5(A)、E14.5(B)とE15.5(C)でpCAG - EYFPでエレクトロとP6で収穫された。脳は別々に冠状切片とGFPの抗体またはRORC抗体で染色し、画像がマージされます。 E13.5トランスフェ多くのレイヤ4のニューロンにおけるプラスミドpCAG - EYFPの(A)エレクトロポレーション。これは4のマーカーRORC層と重なる。レイヤ4のニューロンよりも表面的なE14.5トランスフェクション細胞を、少なくともプラスミドpCAG - EYFPの(B)エレクトロポレーション。 (C)E15.5エレクトロポレーションのラベルなどのレイヤ2 / 3など多くの表面的なニューロン。スケールバーは200μm。
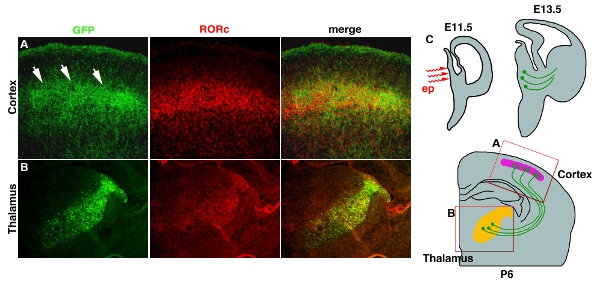
図4。視床-皮質軸索(TCA)にEYFPのトランスフェクション。 (A)皮質層4のTCA末端は、GFP抗体染色により明らかにされます。 RORC抗体染色は層4の位置を明らかにするために使用されます。両方のイメージは、同じセクションから取得され、マージされます。 (B)視床へのエレクトロポレーションの位置はまた、視床11に制限されている表現、GFP抗体染色とRORC染色により示されています。 (C)視床のエレクトロポレーションおよびTCA投影のための漫画の回路図が示されています。スケールバーは200μm。
ディスカッション
このプロトコルでは、我々は、異なる形の電極を使用して小さな胚の脳の限定された領域にpCAG - EYFPトランスフェクションの手法の利点を説明した。異なるプロモーターによるトランスフェクション効率の比較については、細胞型特異性1を示しており、以前に説明されています。しかし、制限が技術のためにある、トランスフェクションが唯一の一時的なもので、プラスミドに依存して変化するような、それは任意のセルの特異性を持っていないし、それがトランスフェクトされた細胞の数を制御することは困難です。 ThereforeHoweverは、他の手法でこのプロトコルを組み合わせると、さらに別の操作メソッドの可能性を提供します。最初に、プラスミドDNAに細胞特異的プロモーターを組み込むことはこのようなニューロン、グリア細胞やアストロサイトなどの細胞型に特異的なトランスフェクションを、できるようになります。第二に、トランスフェクションが一時的であるので、それは後の生活の中で遺伝子の機能を分析する科学者には適していません。そのため、プラスミドDNAがゲノムに組み込ませるトランスポゼースとの組み合わせは、安定なトランスフェクション8に変換されます。次に、テトラオンまたはtet -オフシステムの採用により、タイミングまたはセル8神経細胞の種類特異的な遺伝子発現を操作するようになります。別の方法として、タモキシフェン誘導性のCre - ER(T)リコンビナーゼ9およびレポーターマウス10でこのプロトコルを組み合わせることができます。
組織のこの広範なアクセシビリティが大幅に神経科学で使用されている実験的なデザインを変更します。
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、独立行政法人理化学研究所脳科学総合研究センター(BSI)、ヒューマンフロンティアサイエンスプログラム(HFSP)(TSに授与)と理化学研究所ジュニアリサーチアソシエイトプログラム(JRA、MKに授与)独立行政法人理化学研究所脳科学総合研究センター(BSI)、ヒューマンフロンティアサイエンスプログラムによって資金を供給された(HFSP)(TSに授与)と理化学研究所ジュニアリサーチアソシエイトプログラム(JRA、MKに授与)は、この作業に資金を供給した。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| 裸のタングステン線径125μmの | AMシステム | 797600 | |
| 裸の白金線径125μmの | AMシステム | 767000 | |
| スティック電極 | NEPA遺伝子 | CUY610P4 - 1 | |
| ガラス毛細管 | Stoelting | 50611 | |
| マイクロマニピュレータ | KDサイエンティフィック | KDS310 | |
| はさみ | ROBOZ | RS - 5865 | |
| パルスジェネレータ | AMシステム | 2100 | |
| 9mmのautoclip | ROBOZ | RS - 9260 | |
| 金メッキピン | WPI | 5482 | |
| RORCの抗体 | ペルセウスプロテオミクス | H3925 |
参考文献
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Kataoka, A., Shimogori, T. Fgf8 controls regional identity in the developing thalamus. Development. 135, 2873-2881 (2008).
- Imayoshi, I., Shimogori, T., Ohtsuka, T., Kageyama, R. Hes genes and neurogenin regulate non-neural versus neural fate specification in the dorsal telencephalic midline. Development. 135, 2531-2541 (2008).
- Shimogori, T., Banuchi, V., Ng, H. Y., Strauss, J. B., Grove, E. A. Embryonic signaling centers expressing BMP, WNT and FGF proteins interact to pattern the cerebral cortex. Development. 131, 5639-5647 (2004).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development Growth & Differentiation. 50, 499-506 (2008).
- Takahashi, Y., Watanabe, T., Nakagawa, S., Kawakami, K., Sato, Y. Avian Embryology. Methods in Cell Biology. Vol 87, 2nd Edition, Elsevier Academic Press Inc. 271-271 (2008).
- Feil, R. Ligand-activated site-specific recombination in mice. Proceedings of the National Academy of Sciences of the United States of America. 93, 10887-10890 (1996).
- Indra, A. K. Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases. Nucleic Acids Research. 27, 4324-4327 (1999).
- Nakagawa, Y., O'Leary, D. D. M. Dynamic patterned expression of orphan nuclear receptor genes ROR alpha and ROR beta in developing mouse forebrain. Developmental Neuroscience. 25, 234-244 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved