Method Article
Mouse No Utero Eletroporação: Transfecção Gênica Controlled Spatiotemporal
Neste Artigo
Resumo
Um método de transferência de genes no cérebro do rato em desenvolvimento é descrito usando um único método cirúrgico ea forma especial de eletrodos. Esta técnica exclusiva permite a transfecção de DNA plasmídeo temporal e espacialmente, o que ajudará muitos neurocientistas em estudar o desenvolvimento do cérebro.
Resumo
A fim de compreender a função de genes expressos em região específica do cérebro em desenvolvimento, incluindo moléculas de sinalização e orientação moléculas axônio, a transferência de genes local ou knock-out é necessária. Gene targeting knock-in knock-out ou em regiões local é possível realizar com a combinação com uma linha específica CRE, que é trabalhoso, caro e demorado. Portanto, um método de transfecção simples, uma em técnica de eletroporação útero, que pode ser realizada com curto período de tempo, será útil para testar a possível função de genes candidatos antes da geração de 1,2 animais transgênicos. Além disso, em eletroporação utero alvos áreas do cérebro onde nenhuma linha específica CRE existe, e vai limitar letalidade embrionária 3,4. Aqui, apresentamos um método de eletroporação no útero da combinação de dois diferentes tipos de eletrodos para a transferência de genes simples e conveniente em áreas-alvo do cérebro em desenvolvimento. Primeiro, um método de realização única de embriões utilizando um cabo de fibra óptica a luz óptica vai criar embriões pequenos (de E9.5) visível para injeção de DNA alvo em solução ventrículos e tipo de agulha de inserção de eletrodos para a área do cérebro alvo 5,6. A padronização do cérebro, tais como área cortical ocorrer na fase embrionária precoce, portanto, estes eletroporação início da E9.5 fazer uma grande contribuição para entender evento padronização toda área. Segundo, a forma precisa de um capilar evita danos uterina, fazendo buracos através da inserção do capilar. Além disso, a forma precisa dos eletrodos de agulha são criados com o tungstênio e fio de platina e afiada usando o papel da areia e isolados com unha polonês 7, um método que é descrito em detalhes neste protocolo. Esta técnica exclusiva permite a transfecção de DNA plasmidial em áreas restritas do cérebro e vai permitir embriões pequenos para serem electroporated. Isso vai ajudar a, abrir uma nova janela para muitos cientistas que estão trabalhando na diferenciação celular, migração celular, a orientação dos axônios em muito cedo estágio embrionário. Além disso, esta técnica permitirá aos cientistas transfecção de DNA plasmidial em partes profundas do cérebro em desenvolvimento como o tálamo eo hipotálamo, onde muitos não específicas da região linhas CRE existem para ganho de função (GOF) ou perda de função (LOF) analisa.
Protocolo
1. Preparação da solução capilar e DNA para injecção
- Purificar DNA plasmídeo com um Maxi-prep ou método equivalente, e fazer uma concentração final de 2-3 mcg / mL. Alíquota de 100 mg de DNA, adicionar 10μl do corante verde rápido (1% de ações) e TE (10 mM Tris Base, 1mM EDTA Solution, pH 8.0) e ajustar o volume para 100 ml para fazer a concentração final para DNA mix de injeção para 1μg / mL. A concentração de DNA plasmidial podem ser alteradas depende do tamanho do plasmídeo, e também a sua eficiência de transfecção, que precisa ser testado individualmente.
- Girar a solução de DNA por 5 minutos a 14.000 RPM à temperatura ambiente e recolher o sobrenadante para remover qualquer resíduo.
- Puxar um capilar de vidro tubos de vidro tubea capilar utilizando um extrator de micropipeta. Belisque a ponta com uma pinça para fazer a ponta tem um diâmetro M 20-30. Medida 800 M-1 mm da ponta e verifique o diâmetro externo é menor que 60 mm (Fig. 1A).
- Conectar o capilar ao micromanipulador, e encha com óleo mineral. Para preencher o capilar com a solução de DNA, mergulhe a ponta na solução e sugar até a solução de DNA.
2. Vara eletrodos de platina
Aqui usamos eletrodos revestidos de platina (Nepe gene, CUY611P2-1) para electroporate em região superficial do cérebro, como o córtex (Fig. 1F).
3. Preparação de micro-eletrodos
Use micro-eletrodos para electroporated em partes profundas do cérebro (ie, o tálamo eo hipotálamo) (Fig. 2B-E).
- Uma extremidade do tungstênio (para eletrodos negativos) e platina (para eletrodos positivos) é enrolado em fios dourados e os pinos fixados com parafilme. Insira o fio à haste de um cotonete e embrulhar ambas as extremidades com parafilme (Figura 1B).
- Uniformemente aguçar a ponta do fio com lixa até atingir 20-30 mM diâmetro externo e 60 mm de 800 M-1 mm da ponta (Fig. 1C e D).
- Aplique uma camada fina de unha polonês para o fio para o isolamento. Após a unha polonês secar, use um cotonete embebido em acetona para removê-lo da ponta (cerca de 200 mM da ponta). Importante: A fim de evitar danos ao útero do rato, a parte dentro de 800 M-1 mm da ponta não deve ter mais de 70 m de diâmetro (Fig. 1E).
4. Preparação da cirurgia
- Anestesiar um rato grávidas (E9.5-E15.5). Demonstramos anestesiados com pentobarbital sódico grau farmacêutico (Tabela II, 50 mg por grama de peso corporal, injetar intraperitonealmente e aguarde 5 min). Alternativas para pentobarbital sódico como um anestésico Ketamina incluem injeção / Xilazina ou anestésicos de gás (gás é preferível para os procedimentos de curta duração). A injecção deve ser feito com atenção para evitar quaisquer órgãos, caso contrário ele irá causar danos para o útero ou matar animais. Quando IP sucesso é feito, a taxa de sobrevivência é mais do que 95%. Também a cirurgia pode ser realizada ao ar livre no meio ambiente. Antes de iniciada a operação, teste para a falta de resposta do animal a beliscar seus pés para confirmar anestésico.
- Raspar o cabelo do abdômen com uma lâmina de barbear e EtOH 50%. Prepare a pele com a alternância de scrubs de betadine e álcool (70%).
- Faça uma incisão na linha média abdominal com uma tesoura fina e retire todos os cornos uterinos com cuidado sobre a 37 ° C pré-aquecido tampão fosfato (PBS)-umedecidos gaze de algodão, que é colocado em torno da ferida. Manter a umidade do útero com PBS de todos os tempos.
- Segure um cabo de fibra óptica flexível entre os dedos indicador e médio e colocá-lo sob o corno uterino. Cabo limpo com EtOH 70% antes do uso. Sem microscópio ou lupa é necessário para visualização. Útero posição entre o cabo de fibra óptica a luz óptica eo polegar, e aperte suavemente para empurrar para cima o embrião mais perto da parede uterina.
5. Injeção de DNA e eletroporação
- Quando embrião é posicionado, insira capilar de vidro cuidadosamente em ventrículo-alvo e injetar cerca de 1 mL de solução de DNA (Fig. 2A).
- Eletroporação para a parte superficial da brainIf usando com eletrodos revestidos de platina para electoporation, coloque os eletrodos fora do útero e aplicar sugerido de onda quadrada pulsos de corrente de acordo com a instrução de fabricação (Tabela I). Se usingFor eletroporação a parte mais profunda do cérebro, eletroporação nmicro, eletrodos tipo eedle são usados. Iinsert um eletrodo de tungstênio fino negativo em DNA injetado ventrículo e um eletrodo de platina para o útero e região-alvo lugar entre dois eletrodos, em seguida, aplicar sugerido de onda quadrada pulsos de corrente (Tabela I) (Fig. 2B).
6. Eletroporação pós
- Coloque o corno uterino de volta em sua origlocalização inal com e adicionar 500 mL de 37 ° C pré-aquecido PBS.
- Sutura a camada interna com sutura cirúrgica e camada externa estreita com um clipe autoclipauto 9 mm.
- Animais colocar em uma almofada de aquecimento por 2 horas para permitir a recuperação da anestesia. Analgésicos como o carprofeno ou buprenorfina pode ser administrada para a dor pós-operatória.
7. Resultados representativos:
Alguns exemplos de eletroporação cortical de pCAG-EYFP construir usando eletrodos de platina vara em momentos diferentes são mostradas na figura Figura 32. Cérebros são electroporated na E13.5, E14.5 e E15.5, e colhida no dia pós-natal (P) 6. ÅO coloração ntibody de RORc revela a posição da camada 4 e posição das células transfectadas EYFP são revelados por GFP coloração de anticorpos, e ambas as imagens são super impostas (Fig. 3A e B). Rotulados células corticais são camada de células corticais electroporated é claramente diferente em cada experimento (Fig. 32), o que sugere dependente do tempo eletroporação faz cortical camada específica GOF / LOF possível.
A viabilidade de embriões e eficiência de transfecção de células varia dependendo da idade do embrião e do local de eletroporação. Amostras estão apresentadas na Tabela 1, no entanto, as condições devem ser otimizados para cada eletroporação dependendo do estágio e parte do cérebro.
Eletroporação em tecidos profundos, tais como tálamo eo hipotálamo com o uso de eletrodos de platina pau muitas vezes dar baixa eficiência (Tabela 1). Este problema pode ser resolvido usando micro-eletrodos whichelectrodes, que chegará às partes profundas do cérebro. Figura 3 4 exemplo mostra de pCAG-EYFP eletroporação no diencéfalo desenvolvimento. Solução de DNA plasmídeo é injetado no 3 º ventrículo na E11.5 e seguido por micro eletroporação (Fig. 3C4C). A área é restrita electroporated no tálamo, onde a maioria do projeto axônios para o córtex (Fig. 3B4B). Axon projeção para camada 4 do córtex também pode ser visualizado por EYFP, que fillesfills o neurônio inteiro. (Fig. 3A4A).
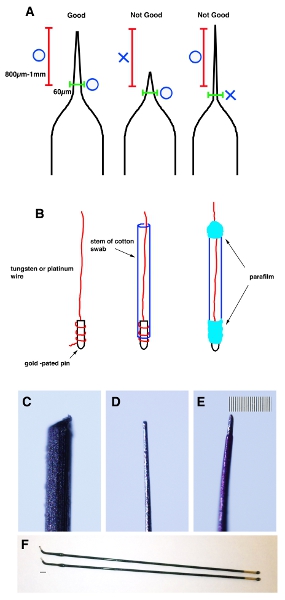
Figura 1. Esquemática dos desenhos animados demonstrando a forma correta do capilar. (A) Um tubo capilar de vidro é puxado através de um puxador de micropipeta para fazer certa forma. Uma dica é off prensado por uma pinça para torná-lo 20-30 mM. Medida 800 M-1 milímetro da ponta (faixa vermelha) e certifique-se que o diâmetro externo é menos de 60 mm (faixa verde). (B) end Um dos fios de tungstênio ou platina é enrolada em pinos banhados a ouro e fixado com parafilme. Em seguida, use uma lixa para fazer sua ponta para se tornar 20-30 mM diâmetro externo e 60 mm a partir de 1 mm da ponta. (C) Imagem do fio de tungstênio antes shaping. (D) Imagem do fio de tungstênio após a modelagem. (E) Imagem do fio de tungstênio após a aplicação de fina camada de unha polonês. Barra de escala em E é de 10 mM (menor escala) para CE. (F) Stick eletrodos de platina (Nepa gene. CUY611P2-1). Barra de escala em F é de 2 mm.
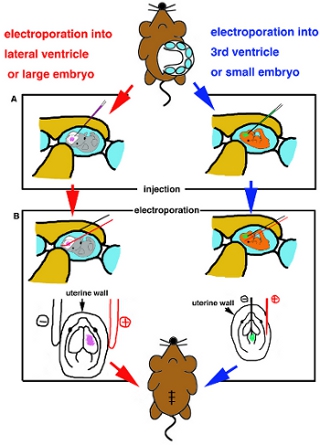
Figura esquema dos desenhos animados 2. Procedimento cirúrgico. (A) Diagrama de injecção ventrículo lateral ou embriões de grandes dimensões (lado esquerdo) e em 3 º ventrículo ou embriões pequenos (lado direito). (B) Diagrama de electrporation pelo eletrodo de platina stick (lado esquerdo) e com agulha de eletrodo tipo (lado direito).
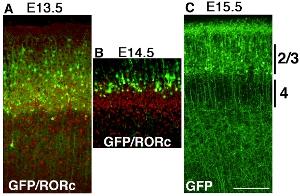
Figura 3. Desenvolvimento do mouse telencéfalo foi electroporated com pCAG-EYFP no E13.5 (A), E14.5 (B) e E15.5 (C) e colhidas em P6. Cérebros foram seccionados coronal e corados com GFP anticorpo ou anticorpos RORc separadamente e imagens são mesclados. (A) de Eletroporação pCAG-EYFP plasmídeo em E13.5 transfectar muitos camada 4 neurônios. que se sobrepõem a camada de 4 marcadores RORc. (B) de Eletroporação pCAG-EYFP plasmídeo de células E14.5 transfecção, que são mais superficiais do que os neurônios da camada 4. (C) E15.5 eletroporação rótulo muitos neurônios superficial, como camada 2 / 3. Barra de escala 200 mM.
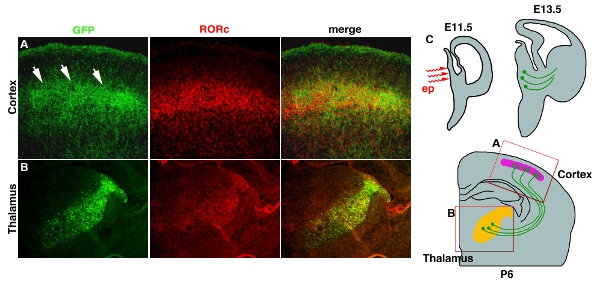
Figura 4. Transfection da EYFP em tálamo-cortical axônios (TCA). (A) terminus TCA na camada cortical 4 é revelado por GFP coloração de anticorpos. RORc coloração do anticorpo é usado para revelar uma posição de camada 4. Ambas as imagens são tiradas de mesma seção e se fundiram. (B) Posição da eletroporação para o tálamo também é indicado pelo GFP coloração de anticorpos e coloração RORc, que a expressão é restrita no tálamo 11. (C) esquema dos desenhos animados para a eletroporação talâmica e projeção TCA são mostrados. Barra de escala 200 mM.
Discussão
Neste protocolo, apenas descreveu os benefícios da técnica de transfecção pCAG-EYFP na área restrita de um cérebro pequeno embrionárias usando diferentes eletrodos em forma. Para comparação da eficiência de transfecção pelo promotor diferente é descrito anteriormente, o que mostra a especificidade de células do tipo 1. No entanto, existem limitações para a técnica, tais como a transfecção é apenas transitória e varia depender do plasmídeo, que não tem qualquer especificidade celular e é difícil controlar o número de células transfectadas. ThereforeHowever, combinando este protocolo com outras técnicas ainda mais possibilidades de fornecer métodos de manipulação diferentes. Primeiro, incorporando promotor célula específica no DNA plasmídeo permitirá célula do tipo de transfecção específicos, tais como neurônios, células gliais e astrócitos. Segundo, uma vez que a transfecção é transitória, não é adequado para cientistas que queiram analisar a função do gene mais tarde na vida. Portanto, a combinação com um transposase fazer DNA plasmídeo integrar o genoma irá convertê-lo em um transfecção estável 8. Adoção, ao lado do tet tet-on ou off-sistema, será possível manipular o tempo ou célula tipo específico de expressão gênica em células neurais 8. Alternativamente, pode-se combinar este protocolo com tamoxifeno induzível por Cre-ER (T) recombinases 9 e ratos repórter 10.
Esta ampla acessibilidade dos tecidos vai mudar drasticamente projetos experimentais usados em neurociência.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pela RIKEN Cérebro Science Institute (BSI), Human Frontier Science Program (HFSP) (atribuído ao TS) e Programa de Pesquisa Riken Júnior Associado (JRA, concedido a MK) RIKEN Cérebro Science Institute (BSI), Human Frontier Science Program (HFSP) (atribuído ao TS) e RIKEN Júnior Programa de Pesquisador Associado (JRA, concedido a MK) financiou este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| diâmetro do fio desencapado de tungstênio 125 M | Sistemas AM | 797600 | |
| diâmetro do fio desencapado de platina 125 mM | Sistemas AM | 767000 | |
| Eletrodos revestidos | Nepa gene | CUY610P4-1 | |
| tubo capilar de vidro | Stoelting | 50611 | |
| micromanipulador | KD Scientific | KDS310 | |
| tesoura | ROBOZ | RS-5865 | |
| gerador de pulso | Sistemas de AM | Modelo 2100 | |
| 9 milímetros autoclip | ROBOZ | RS-9260 | |
| banhado a ouro pinos | WPI | 5482 | |
| Anticorpo RORc | Perseus Proteomics | H3925 |
Referências
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Kataoka, A., Shimogori, T. Fgf8 controls regional identity in the developing thalamus. Development. 135, 2873-2881 (2008).
- Imayoshi, I., Shimogori, T., Ohtsuka, T., Kageyama, R. Hes genes and neurogenin regulate non-neural versus neural fate specification in the dorsal telencephalic midline. Development. 135, 2531-2541 (2008).
- Shimogori, T., Banuchi, V., Ng, H. Y., Strauss, J. B., Grove, E. A. Embryonic signaling centers expressing BMP, WNT and FGF proteins interact to pattern the cerebral cortex. Development. 131, 5639-5647 (2004).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development Growth & Differentiation. 50, 499-506 (2008).
- Takahashi, Y., Watanabe, T., Nakagawa, S., Kawakami, K., Sato, Y. Avian Embryology. Methods in Cell Biology. Vol 87, 271-271 (2008).
- Feil, R. Ligand-activated site-specific recombination in mice. Proceedings of the National Academy of Sciences of the United States of America. 93, 10887-10890 (1996).
- Indra, A. K. Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases. Nucleic Acids Research. 27, 4324-4327 (1999).
- Nakagawa, Y., O'Leary, D. D. M. Dynamic patterned expression of orphan nuclear receptor genes ROR alpha and ROR beta in developing mouse forebrain. Developmental Neuroscience. 25, 234-244 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados