このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
オリゴヌクレオチド結合蛍光マイクロスフェアを使用して複雑な臨床及び環境試料中の細菌の多重検出
要約
我々は、オリゴヌクレオチド結合蛍光ビーズを用いて試料内の微生物の検出のための多重方法を説明します。サンプル内のすべての生物からのアンプリコンは、プローブ結合ビーズのパネルにハイブリダイズさせる。ルミネックスまたはバイオプレックス機器は、ビーズタイプとハイブリダイゼーションシグナルのための各ビーズを照会するために使用されます。
要約
細菌性膣炎(BV)はガルドネレラの膣、Atopobium鞘を含む細菌種の数、支配細菌に乳酸菌 -支配、および他の1〜3の"通常の"微生物の変化によって特徴付けられる、定期的な複数菌症 候群です。この条件は、HIV買収4を含む負の健康アウトカム、の範囲に関連付けられており、それが臨床的に5管理が困難になる可能性があります。また、BVの診断は、様々な数値基準6,7に得点されている膣スワブのスメアのグラム染色の使用に依存してきました。この診断は、シンプルで安価な、とよく資源が限られた設定に適していることが、それは主観的な解釈に関連する問題に苦しむことができますし、それが膣細菌8の組成の詳細なプロファイルを与えるものではありません。最近のディープシーケンシングの取り組みが持つ豊かな、多様な膣細菌叢を明らかにしたBV 11,12の分子診断のための潜在的なターゲットの数の同定の結果になっています9,10、通常考えられているそれらの個人、と比較してBVと診断された患者から採取したサンプルの間に明確な違い。これらの研究は、有用な情報を豊富に提供していますが、深いシーケンシングは、まだ臨床の現場での診断法として実用的ではない。我々は最近、急速にルミネックスプラットフォーム13上の検出とオリゴヌクレオチド結合蛍光ビーズを用いたマルチプレックス形式で膣細菌叢をプロファイリングするための方法を記載している。このメソッドは、現在のグラム染色ベースのメソッドと同様に、迅速かつ簡単ですが、プローブの設計の研究をシーケンシングに起因する分子の知識を悪用するというさらなる利点を追加します。このメソッドは、したがって、高い特異性と感度のカンプでBVを診断するために使用することができます膣スワブに存在する主要な微生物をプロファイルする方法を提供します半定量的かつ迅速な方法で、種の存在感と豊富で追加情報を提供しながら、グラム染色にared。この多重方式では、よく現在のところ、単一の試料14の5または6つの異なるアッセイに限定されている特定の生物の、現在の定量PCRアッセイの範囲を超えて拡張可能です。重要なのは、メソッドが膣スワブの細菌の検出に限定されるものではなく、容易に迅速に関心のほぼすべての微生物群集をプロファイルに適合させることができます。例えば、我々は最近、廃水処理プラントで使用する診断ツールの開発にこの手法を適用し始めている。
プロトコル
このメソッドは、Dumonceaux らに報告された研究で使用されていました。J. CLIN。 。Microbiol 47、4067から4077、DOI:10.1128/jcm.00112-09(2009)。
全体的な手順を示す概略図を図1に示す。
1。ビーズカップリング
これは、(表2参照)ポリスチレンルミネックスのビーズへのオリゴヌクレオチドプローブをカップリングに使用する方法を説明します。ボリュームは、試験的に新しい捕獲プローブの評価のためにわずかに適応している、これらのボリュームは、括弧内に示されています。
- -20℃のデシケーターから1 - エチル-3 - (3 - dimethylamiopropyl)カルボジイミド塩酸(EDC)粉を取り除くと、室温に温めてください。
- その後、約20秒間ボルテックス、20秒のための水浴超音波処理でsonciationによって微小球を再懸濁します。
- (これは5 × 10 6または1.25倍に相当するエッペンドルフチューブに微小球の400μlの(100μl)を転送する10 6ミクロス)。ルミネックスは、チューブに付着し、ビーズの回復を妨げることから、非結合ビーズを防ぐために、低タンパク結合マイクロ遠心チューブ(例えば、エッペンドルフのタンパク質LoBind管、カタログ番号0030 108.094)の使用を示唆している。我々は、これが我々が一般的に使用する標準的なポリプロピレン製マイクロチューブを、(例えば、VWRのカタログ番号87003から298)を使用して問題となったことはありません。
- 1分間14000 × gでペレット。削除し、上清を捨てる。
- (N -モルホリノ)エタンスルホン酸(MES)のpH 4.5 - 室温の0.1 M 2を50μlのマイクロスフェア(12.5μl)を再懸濁します。
- 水に10 mg / mlのEDCの新鮮な溶液を調製します。
- 次いで10 mg / mlに水を加え、分析スケールでEDCの5-10 mgを秤量することにより、このソリューションの1未満mlを調製。
- 5' -アミノC12修飾キャプチャーミクロスフェアへのオリゴヌクレオチド(表2)とボルテックスの1 nmolのを追加。 1 nmolのは、200μMのオリゴを5μlです。ヌクレオチド。
- ミクロスフェアに新鮮なEDCソリューションの2.5μlを加え、5秒間ボルテックスで混ぜる。
- 暗所で30分間室温でインキュベートする。
- EDCソリューション(ステップ1.6)破棄し(ステップ1.6)上記のように水に10 mg / mlのEDCの新鮮なサンプルを用意。
- 5秒のための微小球と渦に新鮮なEDCソリューションの別の2.5μlのを追加。
- 暗所で30分間室温でインキュベートする。
- 0.02パーセントのTween20 1mlを追加してビーズを洗浄する。ビーズを再懸濁させる渦(必要に応じて同様に20秒間超音波処理)。
- 14000 × gで1分間遠心します。削除し、上清を捨てる。
- 0.1%ドデシル硫酸ナトリウム(SDS)1mlを加えることによって再びビーズを洗浄する。ビーズを再懸濁させる渦(必要に応じて同様に20秒間超音波処理)。
- 14000 × gで1分間遠心します。削除し、上清を捨てる。
- [10 Mトリス- EDTA(TE)バッファー100μlでビーズを(25μl)を再懸濁します。Mトリス- Cl pH8.0の、1mMのEDTA、pH8.0の]。
- ストック濃度を決定するためにhaemocytometerまたはコールターカウンターでビーズを列挙する。
- TEバッファーで100ビーズ/μlの最終濃度に各ビーズを希釈することにより微小球マスターミックスを調製する。プールは、アッセイの所望のプレックス(例えば10プレックスアッセイのために、各ビーズの100/μlの最終濃度で10種類の結合ビーズをミックス)に対応するビーズを結合。
- 4でマイクロスフェアのマスターミックスを° Cで保存して暗所で。これらの条件下で保管した場合、混合物を数ヶ月間保存することができます。
2。シャペロニン60ユニバーサルターゲット(cpn60 UT)一本鎖のアンプリコンの生産と世代。
- 各サンプルのためのポリメラーゼ連鎖反応(PCR)の製品を生成します。ホスホロチオエートおよびビオチンで修飾された5'プライマーセット(表1)があります。混在させるボリュームと濃度については、表3を参照してください。
- PCRが完了した直後に、T7 exの2μlを(20ユニット)を追加各PCRチューブにonuclease(PCRバッファーは、T7反応に十分です)。 40分間室温で反応(〜22から25 ° C)をインキュベートする。
- このインキュベーションの終了時に、0.5 Mエチレンの12.5μlの酢酸(EDTA)pH8.0のとミックスをジアミン。これは一本鎖のPCR産物の〜64.5μlの合計になります。
3。オリゴヌクレオチド結合ポリスチレンビーズに一本鎖PCR産物のハイブリダイゼーション。
- 60〜Prewarm楽器° C分析中にハイブリダイゼーションの温度を維持する。測定器のソフトウェアを使用してプラットフォームのヒーターの電源をオンにしてハイブリダイズしたビーズ混合物を含むPCR -スタイルプレートに合った真鍮の加熱ブロックを使用してください。
- 再懸濁し、ピペットによる微小球のマスターミックス(ステップ1.20)、エッペンドルフチューブに適切な量を分注、キャップチューブ、そして2分間水浴ソニケーターで超音波処理。また、ビーズresuspeの絶対的な一貫性を確保するnsionは、ミクロスフェアマスターミックスは、ポリプロピレンエッペンドルフチューブに所望の量を調剤、上記のように超音波処理し、ボルテックス、ピペッティングにより再懸することができます。
- ロープロファイル96ウェルサーモウェルPCRプレート(表2)の適切なウェルに一本鎖のPCR産物17μlを(ステップ2.2)分注する。各ウェルに再懸濁した、sonciatedビーズ混合物の33μlを添加する。シリコンカバー(表2)で覆い、軽くタップします。
- 95℃で5分間、60℃で10分間、60℃保持、60℃で5分間、最後のCはCのためのC:のプログラムを使ってサーマルサイクラーにプレートを置く。プログラムを起動します。
- 新鮮なストレプトアビジン - フィコエリスリン(SA - PE)ソリューションを作る;するには(いくつかの井戸が余分なように)ウェルあたり25μlのが必要になります。 0.1%サルコシル; 50mMトリス- HCl、pH8.0の株式SA - PE(1 mg / ml)の1X塩化テトラメチルアンモニウム(TMAC)バッファ(3 M TMACと1:50〜で20μg/ mlを希釈することにより、SA - PEのソリューションを作る、4mMのEDTA、pH8.0)に。
- サーモサイクラーが60℃ホールドステップに到達すると、蓋を開くと、シリコンのカバーを取り外し、直接各ウエルにSA - PEのソリューションを(サーモサイクラーのプレートを取り出さないでください)に追加します。 、シリコンカバーを取り付けますクラーの蓋を閉じて、プログラムを再開する。
- プログラムが完了すると、プレートを取り出し、すぐに読みBioPlexマシンに転送します。プレートは10分以内に読み取る必要があります。 60 ° Cで読んでください。BioPlexがこの温度に加温されていることを確認してください。プローブの高さは使用する機器の取扱説明書で説明されているように、利用プレートを収容するために調整されていることを確認してください。
- 正確なビーズと信号検出のために、BioPlex上にゲートの設定が使用されている微小球のタイプに応じて設定する必要があります。磁性微小球は5,000-25,000の設定を必要としながらバイオラッドのポリスチレンビーズは4,335-10,000のゲートの設定が必要です。レポーターのゲイン値を増加させる高PMTの設定を使用してプレートを実行するオプションもあります。これは私がすることができますバックグラウンド信号をも増加されるようにncrease低い信号の強度がしかし、それが重要なのは、適切なネガティブコントロールが含まれています。
4。代表的な結果:
このアッセイの開発と実施における目標の一つは、できるだけシンプルで合理化されたとして、それを作ることだった。そこで、妥当な時間枠で完了することができるアッセイを開発するために、T7のエキソヌクレアーゼ処理の時間とハイブリダイゼーションの時間を含め、重要な増幅後のステップを最適化。図2Aに示すように、アンプリコンのT7の治療は、ほとんどのプローブが短い、あるいはまったくT7の治療とほとんど、あるいは全くシグナルを持っていたとして、信号の生成に不可欠です。信号は、信号の増加が鈍化している時点で、約40分まで直線的に増加した。信号の劣化は、プライマーのホスホロチオエート修飾はタージェを防ぐのに非常に有効であることを示す、T7の処理時間の2時間でも観察されなかった15を説明するとしてt鎖が劣化。我々は、全体的なプロトコルの時間を最小限に抑えるためにT7の処理時間は40分を選んだが、それはT7の治療がはるかに長いために行くことができることを図2Aから明らかである。我々はまた、信号の生成(図2B)上でのハイブリダイゼーションの時間の効果を決定し、10分が最大の信号のための十分であることがわかった、信号で、それ以上の増加としてであっても、ハイブリダイゼーションの4時間後に観察された。したがって、10分のハイブリダイゼーション工程は、全体のアッセイ時間を最小限に抑えるために、再度、選ばれた。念頭に置いて、そしてそのようなInstaGene(Bio - Rad社)などの迅速なDNA抽出技術を持つこれらの結果により、DNA抽出、PCR、およびルミネックスの分析を含む総合的なアッセイは、4〜5時間で完了することができます。
注意書に、ルミネックスまたはBioPlex実行中にポリスチレンビーズの凝集のレベルは、アッセイの効率に大きな影響を与える可能性があります。 BioPlexソフトウェアは、発生したビーズ集約のレベルを、表示されます。複数のビーズはレーザーのパスと集計からのハイブリダイゼーションシグナルの排除の結果で検出される。見かけのビーズ凝集はまた、単一のビーズの適切なサイズではない任意の粒子状物質によって引き起こされることができる、とさえ空気の気泡によって発生することができます。これらのイベントのいずれかで、ビーズ集合体、気泡、または粒子からの信号は破棄されます。ほとんどの場合、我々はビーズ凝集が最小限であることがわかります(図3A)と各ビーズを100カウント、イベントのターゲットレベルは容易に達成可能である。時折、しかし、ビーズは凝集の(図3B)、中等度または重度(図3C)のレベルを示しています。これらのケースでは、データのほとんどが破棄されるので、楽器は100ビーズタイプごとのイベントや結果に到達するトラブルが疑わしい可能性がある場合があります。超音波処理ステップ(ステップ3.2)ビーズの凝集を最小限に抑えることを目的としています。加えて、希薄なミクロスフェアのマスターミックス(ステップ1.20)として、ビーズを格納すると役立つ場合があります。我々はhybriからその除くTMACに気づいたdizationバッファ - (ステップ3.5)ではなく、SA - PEの希釈剤への追加は、 - ビーズの凝集を最小限に抑えることができます。また、我々はこれをテストしていない一方、ルミネックスまたはバイオラッドから入手可能な新しい磁気ビーズを凝集する傾向をより少なく表示するように考えられている。
G.をターゲットに 5プレックスのルミネックスの配列の応用の結果膣、A.膣、L. iners、L. crispatus、およびL.対応するグラム染色膣スワブの塗抹標本とともにgasseriを図4に示されています。これらのサンプルは、複数の時点で一人の個人から採取した。時間0で、個々が(図4A)グラム染色に基づくと、これと同じサンプル(図4B)からルミネックスの結果は、生物の配列で表されることがG.を示すBVと診断され、 A.しながら膣は 、最も流行していた膣とL. inersも陽性であった。 9日後に、個々はまだBV正とsとG.用ignal 膣は大幅に増加した一方、A.膣とL. inersは依然として陽性であった。 Gの信号間にグラム陽性桿菌が(図4A)塗抹標本で検出可能になったとして重要なのは、この時間後に個々には通常の細菌への移行を開始しました膣が薄れとL.のための信号inersは (図4B)増加した。グラムがG.を検出するために失敗した汚れが、この方法(G.の膣および/ またはAの鞘に陽性検体BVが正と考えられていた)13 BVの当社独自の定義では、この個々は、全ての時点で正のBVでした後者の二つの時点で膣 。ルミネックスのメソッドはここで説明すると、傾向が容易に順序付けベースの手法と比較することができます、そして生物のアイデンティティと豊かさについての追加情報を提供しながら、ルミネックスアッセイの結果は、通常、グラム染色は13確証。

図1複雑な臨床や環境試料中の細菌叢のプロファイルを決定するためのルミネックスプロトコルの模式図。プロトコルは、興味のサンプルから抽出されたテンプレートDNAから始まります。 (1)無修正のcpn60 UT PCRプライマー(表1)と結合した鎖特異的なビオチン化、ホスホロチオエート修飾cpn60 UT PCRプライマーを用いてテンプレートDNAからPCR産物を生成し、(2)これは、ビオチン-と細菌叢を示すPCR産物のプールを生成します。一本鎖上に修正をホスホロチオエート(4)カップル(3)ホスホロチオエート修飾鎖を分解するため、ビオチンと5'末端に変更される一本鎖DNAを生成することができないのT7エキソヌクレアーゼを持つ二本鎖PCR産物を、ダイジェスト種特異的cpn60 UTプローブへのポリスチレンビーズ-各ビーズは、ユニークなスペクトルアドレスを(ビーズの色で示される)があり、私ルミネックスまたはバイオプレックス楽器で識別できるのは、(5)関心のサンプルから種特異的オリゴヌクレオチド結合ビーズのスイートに生成された一本鎖のPCR産物をハイブリダイズ(6)に結合するストレプトアビジン - フィコエリトリン共役を追加します。ビオチン化一本鎖のPCR産物とハイブリダイゼーションの指標としての行為は、(7)ルミネックスまたはバイオプレックス楽器を使って、スペクトルのアドレス(ビーズアイデンティティ)とのハイブリダイゼーションシグナルの強度を決定します。少なくとも100ビーズは、各ビーズのアイデンティティのためにカウントされ、フィコエリス信号の中央値は蛍光強度(MFI)が出力として報告されます。までに100種類のビーズタイプを同時に評価することができますが、3つのビーズの種類の差別を示すアッセイが示されている。 PCRのMFIは、同じサンプルから生成された複製(8)指定されたビーズ(片側スチューデントt -検定、p <0.05)のためのネガティブコントロールよりも有意に大きい場合、サンプルはその生物のために陽性であると考えられている。
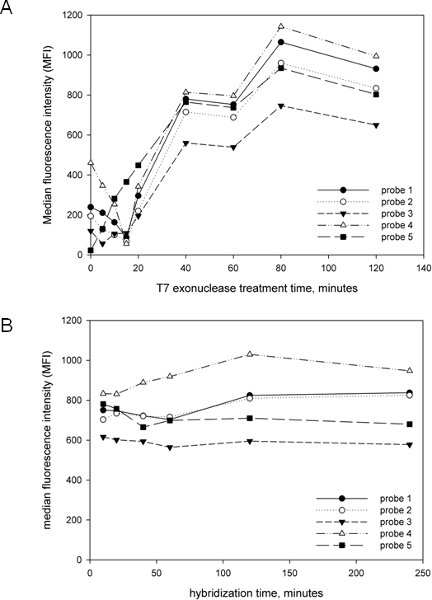
図2。ルミネックスアッセイパラメータの最適化。 ペプトストレプトコッカス属のanaerobiusをターゲットつの異なるプローブがP.を含む膣に関連付けられていることが知られている20の細菌のクローン化cpn60 UTを含むプラスミドを含む混合テンプレートから生成されるアンプリコン、一緒に使用されたanaerobius。 (A)。 T7のエキソヌクレアーゼ処理時間の効果。上記のプロトコールに従ったがT7エキソヌクレアーゼによる治療の時間は、ハイブリダイゼーションの前と中央値蛍光強度(MFI)すべてのプローブに決定されたに変化させた。 (B)。ハイブリダイゼーションの時間の効果。上記のプロトコルは、ハイブリダイゼーション時間の様々続いた。プローブの同じセットでは、同じテンプレートから生成されたアンプリコンで使用されていたし、中央値蛍光強度(MFI)はすべてのプローブに決定された。
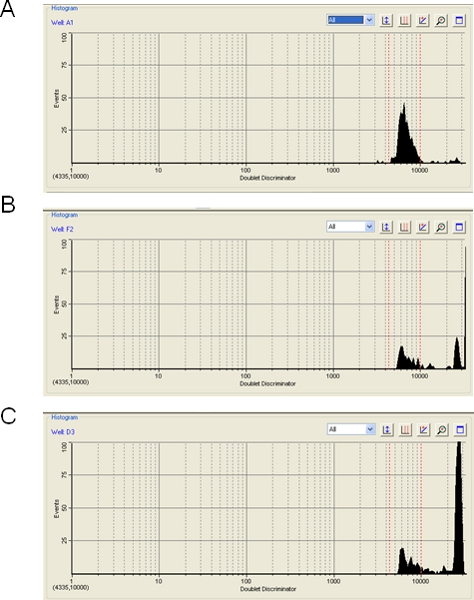
図3。BioPlexソフトウェアを使用して、ビーズの凝集の測定。三つの例は、ビーズの凝集のレベルが(5%)()許容されるBioPlex滑走から与えられている、(B)ボーダーライン(50%)、及び(C)容認できない(80%)。
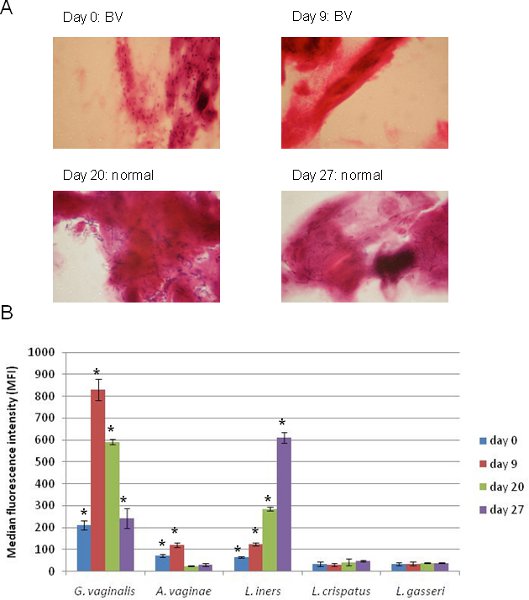
図4同一個体から採取したシーケンシャルサンプル中のBVの診断から5プレックスルミネックスの配列の応用。 (A)。 BVのために各サンプルを評価するために使用される伝統的な診断を示すグラム染色スライド。 (B)。 ()に示すように、同じ4つのサンプルには、このプロトコールに記載されるように調製され、実行5プレックスのルミネックスの配列のアプリケーション。そのMFI信号我々の定義(片側スチューデント t -検定、p <0.05)で有意に陽性細菌の目標は、アスタリスク(*)で示されます。
ディスカッション
信号発生の特異性は非常に重要であり、あなたが本当に観測される信号は、その生物から生成されたアンプリコンの検出を反映していることを確信している必要があります。このようなPrimerPlex(プレミアBiosoft)などのソフトウェアは、効率的にハイブリダイズするプローブを設計するために役立ちますが、非対象種にクロスハイブリダイズしない場合があります。このプロトコルで説明さ?...
開示事項
利害の衝突は宣言されません。
謝辞
我々は、アッセイの開発とこの原稿について批判的なコメントのヘルプはアルベルトセヴェリーニとヴァネッサGoleskiに感謝。この作品は、カナダの公衆衛生局と産業研究支援プログラム(カナダ国立研究評議会)によって賄われていた。追加のサポートは、サスカチュワン州の出版基金の大学から得た。
資料
| Name | Company | Catalog Number | Comments |
| オリゴヌクレオチド名 | 会社 | シーケンス1 | |
| H279BP | Invitrogen社、IDT、または他の | ビオチン- OEFO GAIIIIGCIGGIGAYGGIACIACIAC | |
| H280 | YKIYKITCICCRAAICCIGGIGCYTT | ||
| H1612BP | ビオチン- OEFO GAIIIIGCIGGYGACGGYACSACSAC | ||
| H1613 | CGRCGRTCRCCGAAGCCSGGIGCCTT | ||
| 1O、ホスホロチオエート- C、E、ホスホロチオエート- G、F、ホスホロチオエート- A、I、イノシン、Y、CまたはT、R、またはG、K、TまたはG、S、CまたはG | |||
ユニバーサルcpn60 PCRのための修飾オリゴヌクレオチドの表1。シーケンス。
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 1 - エチル-3 - (3 - dimethylamiopropyl)カルボジイミド塩酸(EDC) | ピアース | 22980 | |
| 蛍光ポリスチレンビーズ:MicroPlexミクロスフェア(ルミネックス)、またはバイオプレックスCOOHビーズ(Bio - Rad社) | ルミネックスまたはBio - Rad社 | Bio - Rad社:xxxはビーズ識別子に対応する171 - 506xxx | 磁気ビーズは、オリゴヌクレオチド結合のために利用可能になりつつあると特定の利点を提供することがあります。これらの著者が試行されていません。 |
| キャプチャーオリゴヌクレオチド(5'アミノC12改) | Invitrogen社、IDT、または他の | 様々な | 脱塩の純度レベルは許容範囲です。膣スワブを特徴付けるために使用される捕獲プローブの配列は、このプロトコルは13基となる原稿に記載されています。 |
| T7エクソヌクレアーゼ | ニューイングランドバイオラボ | M0263S | |
| ストレプトアビジン- R -フィコエリスリン(SA - PE) | インビトロジェン | S - 866 | 高純度SA - PEを取得するために注意が必要なのは、このカタログの数は推奨されます |
| サーモウェル、96ウェルPCRプレート | フィッシャー | CS006509 | 96ウェルサーモサイクラーとBioPlexマシンの両方に適合 |
| サーモシールマット | フィッシャー | CS006555 | 再使用することができます。石けん水で洗浄は、よくすすぎ、および乾燥 |
| 5M TMAC | シグマ | T3411 | |
| バイオプレックスまたはルミネックス楽器 | Bio - Rad社またはルミネックス | Bio - Rad社:171-000201 | |
| プローブ設計のためのPrimerPlexソフトウェア | プレミアBiosoft | www.premierbiosoft.com | ルミネックスプローブドのために提案他のソフトウェアプラットフォームを使用することができますが、署名 |
表2。特異的な試薬と装置。
| コンポーネントは | μL/アッセイ | μl/100アッセイ | 最終濃度 |
| 10 × PCR緩衝液(Invitrogen) | 5 | 500 | 1X |
| 50mMのMgCl 2の (Invitrogen社) | 2.5 | 250 | 2.5mMの |
| の10mMのdNTP | 1 | 100 | 0.2mMの各 |
| H279BP、25μM | 0.25 | 25 | 375 nMの |
| H1612BP、25μM | 0.75 | 75 | 125 nMの |
| H280、25μM | 0.25 | 25 | 375 nMの |
| H1613、25μM | 0.75 | 75 | 125 nMの |
| 水 | 34 | 3400 | --- |
| 合計 | 44.5 | 4450 |
表3。改良cpn60 UTプライマー(表1)を持つPCR用混合物を推奨。アッセイは、鋳型DNAとTaq DNAポリメラーゼ(インビトロジェン社)0.5μlの(2.5U)を5μl用に設定されています。通常、大容量を準備(100アッセイ用などに十分な)と-20℃で保存されています
参考文献
- Hale, L. P., Swidsinski, A., Mendling, W. Bacteria associated with bacterial vaginosis. N. Engl. J. Med. 354, 202-203 (2006).
- Hay, P. Life in the littoral zone: lactobacilli losing the plot. Sex. Transm. Infect. 81, 100-102 (2005).
- Morris, M., Nicoll, A., Simms, I., Wilson, J., Catchpole, M. Bacterial vaginosis: a public health review. Brit. J. Obstet. Gynecol. 108, 439-450 (2001).
- Myer, L., Kuhn, L., Stein, Z. A., Wright, T. C., Denny, L. Intravaginal practices, bacterial vaginosis, and women's susceptibility to HIV infection: epidemiological evidence and biological mechanisms. Lancet. Infect. Dis. 5, 786-794 (2005).
- Wilson, J. Managing recurrent bacterial vaginosis. Sex. Transm. Infect. 80, 8-11 (2004).
- Nugent, R. P., Krohn, M. A., Hillier, S. L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J. Clin. Microbiol. 29, 297-301 (1991).
- Ison, C. A., Hay, P. E. Validation of a simplified grading of Gram stained vaginal smears for use in genitourinary medicine clinics. Sex. Transm. Infect. 78, 413-415 (2002).
- Money, D. The laboratory diagnosis of bacterial vaginosis. Can. J. Infect. Dis. Med. Microbiol. 16, 77-79 (2005).
- Schellenberg, J. Pyrosequencing of the chaperonin-60 universal target as a tool for determining microbial community composition. Appl. Environ. Microbiol. 75, 2889-2898 (2009).
- Spear, G. T. Comparison of the diversity of the vaginal microbiota in HIV-infected and HIV-uninfected women with or without bacterial vaginosis. J. Infect. Dis. 198, 1131-1140 (2008).
- Brotman, R. M., Ravel, J. Ready or not: the molecular diagnosis of bacterial vaginosis. Clin. Infect. Dis. 47, 44-46 (2008).
- Fredricks, D. N., Fiedler, T. L., Marrazzo, J. M. Molecular identification of bacteria associated with bacterial vaginosis. N. Engl. J. Med. 353, 1899-1911 (2005).
- Dumonceaux, T. J. Multiplex detection of bacteria associated with normal microbiota and with bacterial vaginosis in vaginal swabs by use of oligonucleotide-coupled fluorescent microspheres. J. Clin. Microbiol. 47, 4067-4077 (2009).
- Molenkamp, R., van der Ham, A., Schinkel, J., Beld, M. Simultaneous detection of five different DNA targets by real-time Taqman PCR using the Roche LightCycler480: Application in viral molecular diagnostics. J. Virol. Meth. 141, 205-211 (2007).
- Nikiforov, T. T., Rendle, R. B., Kotewicz, M. L., Rogers, Y. H. The use of phosphorothioate primers and exonuclease hydrolysis for the preparation of single-stranded PCR products and their detection by solid-phase hybridization. PCR. Methods. Appl. 3, 285-291 (1994).
- Hill, J. E., Penny, S. L., Crowell, K. G., Goh, S. H., Hemmingsen, S. M. cpnDB: A Chaperonin Sequence Database. Genome. Res. 14, 1669-1675 (2004).
- Bradshaw, C. S. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy. J. Infect. Dis. 194, 828-836 (2006).
- Dumonceaux, T. J. Enumeration of specific bacterial populations in complex intestinal communities using quantitative PCR based on the chaperonin-60 target. J. Microbiol. Meth. 64, 46-62 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved