Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мультиплекс Обнаружение бактерий в сложных клинических и экологических пробах с использованием олигонуклеотидных связью Флуоресцентные Микросферы
В этой статье
Резюме
Мы описываем мультиплекс метод обнаружения микроорганизмов в образце с использованием олигонуклеотидных связью флуоресцентные бусы. Ампликона из всех организмов, в пределах образца гибридизации с панели зонда связью бисером. Luminex или Bio-Plex инструмент используется для запроса каждая бусинка для бортовых и гибридизации типа сигнала.
Аннотация
Бактериальный вагиноз (БВ) является периодическим полимикробная синдром, который характеризуется изменением в "нормальной" микрофлоры из Lactobacillus доминируют в микробиоты доминируют числа видов бактерий, в том числе Gardnerella влагалищной, Atopobium влагалища и другие 1-3. Это условие связано с целым рядом негативных последствий для здоровья, включая ВИЧ приобретение 4, и это может быть трудно управлять клинически 5. Кроме того, диагноз БВ опирается на использование Грам пятна тампоном влагалищных мазков, которые забили на различные численные критерии 6,7. Хотя эта диагностическая простой, недорогой и хорошо подходит для ограниченных ресурсов, он может страдать от проблем, связанных с субъективной интерпретации и это не дает подробный профиль состав вагинальной микрофлоры 8. Последние глубокие усилия секвенирования показали, богатой, разнообразной микрофлоры вагинального счеткие различия между образцов, взятых у людей, которые с диагнозом БВ по сравнению с теми лицами, которые считаются нормальными 9,10, что привело к выявлению ряда потенциальных мишеней для молекулярной диагностики BV 11,12. Эти исследования предоставили массу полезной информации, но в глубине секвенирования еще не практичен, как метод диагностики в клинической практике. Мы недавно описанный метод для быстрого профилирования вагинальной микрофлоры в мультиплексе формате с использованием олигонуклеотидных связью люминесцентные бусины с обнаружением на платформе Luminex 13. Этот метод, как и текущие Граму основе методов, является быстрым и простым, но добавляет дополнительные преимущества использования молекулярного знания, вытекающие из исследования в последовательности зонда дизайна. Этот метод, следовательно, обеспечивает путь к профилю основных микроорганизмов, которые присутствуют в вагинальных мазка, который может быть использован для диагностики БВ с высокой специфичностью и чувствительностью макетared к Граму, обеспечивая при этом дополнительную информацию о наличии видов и изобилие в полуколичественного и быстрым способом. Этот мультиплекс метод может быть расширен за пределы диапазона текущей количественной ПЦР для отдельных организмов, которые в настоящее время ограничивается 5 или 6 различных анализов в одном образце 14. Важно отметить, что метод не ограничивается обнаружение бактерий в мазках вагинального и может быть легко адаптирована к быстро профиля практически любого микробного сообщества, представляющих интерес. Например, недавно мы начали применять эту методологию для разработки диагностических инструментов для использования в очистных сооружениях.
протокол
Этот метод был использован в исследованиях сообщается в Dumonceaux и соавт. J. Clin. 47. Microbiol, 4067-4077, DOI: 10.1128/jcm.00112-09 (2009).
Схема изображением общей процедуры представлен на рисунке 1.
1. Бусы связи
Это описывает методы, которые будут использоваться для связи олигонуклеотидных зондов для полистирола Luminex бисером (см. таблицу 2). Объемы приспособлены немного для оценки новых зондов захвата на экспериментальной основе; эти объемы указаны в скобках.
- Удаление 1-этил-3-(3-dimethylamiopropyl) карбодиимида HCl (EDC) порошок от -20 ° C эксикаторе и тепло до комнатной температуры.
- Ресуспендируют микросфер sonciation в водяной бане sonicator в течение 20 секунд, то вортексе примерно 20 секунд.
- Передача 400 мкл (100 мкл) микросфер в трубке Эппендорф (это соответствует 5x10 6 или в 1,25 раза10 6 микросфер). Luminex предполагает использование низких связывания с белками труб микроцентрифужных (например, Eppendorf труб белка LoBind, каталожный номер 0030 108,094), чтобы предотвратить несвязанных бусы из придерживаясь труб и вмешательства с бисером восстановления. Мы не нашли, чтобы это было проблем с использованием стандартного полипропилена микроцентрифужных трубки, которые мы обычно используем (например, каталог VWR число 87003-298).
- Гранул на 14000 мкг на 1 минуту. Удаляют супернатант.
- Ресуспендируют микросфер в 50 мкл (12,5 мкл) при комнатной температуре 0,1 м 2 - (N-морфолино) этансульфоновая кислоты (MES), рН 4,5.
- Подготовка свежие решения EDC в дозе 10 мг / мл в воде.
- Подготовка менее 1 мл этого раствора путем взвешивания 5-10 мг EDC по аналитической масштабе, затем добавить воды до 10 мг / мл.
- Добавьте 1 нмоль 5'-амино-C12 изменение захвата олигонуклеотида (табл. 2) для микросфер и микс вортексе. 1 нмоль составляет 5 мкл 200 мкМ олигонуклеотида.
- Добавить 2,5 мкл свежим раствором EDC для микросфер и микс вортексе в течение 5 секунд.
- Инкубируйте при комнатной температуре в течение 30 минут в темноте.
- Отменить решение EDC (шаг 1,6) и готовить свежий образец 10 мг / мл EDC в воде, что и выше (шаг 1.6).
- Добавить еще 2,5 мкл свежим раствором EDC для микросфер и вихрь в течение 5 секунд.
- Инкубируйте при комнатной температуре в течение 30 минут в темноте.
- Вымойте бисером, добавляя 1 мл 0,02% Твин 20. Vortex (опционально разрушать ультразвуком в течение 20 секунд, а) для ресуспендирования бисером.
- Центрифуга 14000 мкг на 1 минуту. Удаляют супернатант.
- Вымойте бисером снова, добавляя 1 мл 0,1% додецилсульфата натрия (SDS). Vortex (опционально разрушать ультразвуком в течение 20 секунд, а) для ресуспендирования бисером.
- Центрифуга 14000 мкг на 1 минуту. Удаляют супернатант.
- Ресуспендируют бусин в 100 мкл (25 мкл) Трис-ЭДТА (TE) буфера [10 мМ Трис-Cl рН 8,0, 1 мМ ЭДТА, рН 8,0].
- Перечислять бусины гемоцитометра или Coulter счетчика, чтобы определить запас концентрации.
- Подготовка Микросфера Mix Master путем разбавления каждый шарик до конечной концентрации 100 бусин / мкл ТЕ-буфера. Бассейн связан бисером, соответствующую нужному сложных анализа (например, для 10-анализа сложных, смешайте 10 различных связанных бус на конечной концентрации 100/μl каждого шарика).
- Магазин Микросфера Mix Master при 4 ° С в темноте. Смесь может храниться в течение нескольких месяцев при хранении в этих условиях.
2. Шаперонина 60 универсальных цели (cpn60 UT) производства ампликона и генерации одной пряди.
- Создание полимеразной цепной реакции (ПЦР) продукт для каждого образца. Включите фосфоротиоатные и грунтовки набор биотин-модифицированный 5 '(табл. 1). См. в таблице 3 томах перемешать и концентрации.
- Сразу же после завершения ПЦР, добавьте 2 мкл (20 единиц) T7 бывшихonuclease в каждую пробирку ПЦР (ПЦР буфер будет достаточно для реакции T7). Инкубируйте реакции при комнатной температуре (~ 22-25 ° С) в течение 40 минут.
- В конце этой инкубации, добавьте 12,5 мкл 0,5 М этилен диамина tetraacetic кислоты (ЭДТА) рН 8,0 и перемешать. Это дает в общей сложности ~ 64.5μl одноцепочечных продуктов ПЦР.
3. Гибридизация одноцепочечных продуктов ПЦР с олигонуклеотидных связью бисера полистирола.
- Prewarm инструмент до 60 ° С для поддержания температуры при гибридизации анализа. Включите платформы нагреватель с помощью программного обеспечения прибора и убедитесь, что используете блок латунь отопления, которая соответствует ПЦР-стиль пластины, содержащей бусинку гибридизированных смеси.
- Ресуспендируют Микросфера Master Mix (шаг 1,20) с помощью пипетки, внесите соответствующие суммы в пробирку Эппендорфа, крышка трубки, и разрушать ультразвуком в водяной бане sonicator течение 2 минут. Кроме того, чтобы обеспечить абсолютную согласованность бусинка resuspension, смешивать микросферы мастер может быть ресуспендировали на вортексе и пипетки, затем ультразвуком, что и выше, то отпуск желаемую сумму в трубку полипропилена Эппендорф.
- Внесите 17 мкл одноцепочечных продуктов ПЦР (шаг 2.2) в соответствующие лунки в низкопрофильных 96-а гильза ПЦР пластины (табл. 2). Добавить 33 мкл ресуспендировали, sonciated шарик смеси в каждую лунку. Обложка с силиконовой крышкой (табл. 2) и нажмите мягко.
- Положите пластинку в Термоциклер с программой: 95 ° C в течение 5 мин, 60 ° С в течение 10 мин, 60 ° C удержание, 60 ° С в течение 5 мин, конец. Запустите программу.
- Сделайте свежие стрептавидином фикоэритрин (SA-PE) решения; вам необходимо 25 мкл на лунку (сделать несколько скважин дополнительную плату). Сделать SA-PE решение путем разбавления акции SA-PE (1 мг / мл) 1:50 до 20 мкг / мл с 1x тетраметиламмония хлорида (ТЦМВ) буфера (3 M ТЦМВ; 0,1% Sarkosyl, 50 мМ Трис-HCl, рН 8,0 , 4 мМ ЭДТА, рН 8,0).
- Когда амплификаторе добирается до 60 ° шагом держать С,откройте крышку, удалить силиконовые покрытия и добавить SA-PE решение непосредственно в каждую лунку (НЕ принимать пластины из амплификаторе). Замените силиконового покрытия, близкие амплификаторе крышкой и возобновить программу.
- Когда программа будет готова, возьмите пластину, и быстро перевести его на Биоплексы машины для чтения. Пластина должна проводиться в течение 10 минут. Прочитано при 60 ° С; обеспечить Биоплексы был предварительно нагретого до этой температуры. Будьте уверены, что зонд высота была скорректирована для размещения пластины используются, как описано в руководстве пользователя для инструмента используются.
- Для точного бисером и обнаружения сигнала, ворота параметры Биоплексы должны быть установлены в соответствии с типом микросферы используются. Бисером BioRad полистирола требует ворота установка 4,335-10,000 в то время как магнитные микросферы требует установки 5,000-25,000. Существует также возможность запускать пластины с использованием установок высокой PMT, который увеличивает стоимость репортер выгоды. Это может яncrease интенсивность ниже сигналы однако важно включать соответствующие отрицательного контроля в качестве фона сигнал будет также увеличен.
4. Представитель результаты:
Одна из наших целей при разработке и осуществлении этого анализа было сделать его максимально простым и обтекаемый, как это возможно. Поэтому мы оптимизировали критической после усиления мер, включая T7 экзонуклеазная время лечения и гибридизации время в целях развития анализа, которая может быть завершена в разумные сроки. Как показано на рисунке 2А, T7 лечения ампликона имеет важное значение для генерации сигналов, так как большинство зонды не имели практически никакой сигнал с короткими или отсутствием лечения Т7. Сигнал линейно возрастает примерно до 40 минут, после чего сигнал увеличения замедлились. Нет деградации сигнала наблюдался даже при 2-х часов времени лечения T7, указывая, что фосфоротиоатные модификации грунтовки является весьма эффективным в предотвращении маленький круглый щитт прядь деградации, как описано 15. Мы выбрали 40 минут на время лечения T7, чтобы минимизировать общее время протокола, но, как видно из рис 2А, что T7 лечение может продолжаться намного дольше. Мы также определили эффект гибридизации времени генерации сигнала (рис. 2В) и обнаружили, что 10 минут было достаточно для максимального сигнала, а не дальнейшего увеличения сигнала наблюдался даже после 4 часов гибридизации. Таким образом, в 10 минутах гибридизации шаг был выбран, опять же, чтобы минимизировать общее время анализа. С этими результатами в виду, и с быстрой экстракции ДНК методы, такие как InstaGene (Bio-Rad), общий анализ в том числе выделение ДНК, ПЦР и Luminex анализ может быть завершена в течение 4-5 часов.
На предупреждение, уровень агрегирования полистирола во время бега или Luminex Биоплексы может оказать существенное влияние на эффективность анализа. Биоплексы программное обеспечение будет отображать уровень агрегации бусинку, которая возникает, когдаболее одного борта обнаружены в пути лазерного и приводит к исключению гибридизации сигнал от агрегата. Видимое бусинка агрегации также может быть вызвано любое твердых частиц, не подходящего размера для одной бусинки, и даже может быть вызвано пузырьками воздуха. В любом из этих событий, сигнал с борта совокупности, пузырек воздуха или частица отбрасывается. В большинстве случаев мы находим, что шарик агрегации минимальна (рис. 3А) и целевого уровня 100 подсчета событий для каждого борта легко достижимо. Иногда, однако, показывают, бусин умеренную (рис. 3В) или тяжелой (рис. 3C) уровне агрегирования. В этих случаях, так как большая часть данных отбрасывается, прибор может быть проблема, достигая 100 случаев на шарик типа и результаты могут быть сомнительными. Ультразвуком шага (шаг 3.2) предназначен для минимизации бусинка агрегации. Кроме того, хранение бисера, как разбавлять смесь мастер микросфер (шаг 1.20) может помочь. Мы заметили, что исключение из ТЦМВ hybridization буфера - добавление его в С.-PE разбавитель вместо (шаг 3.5) - позволяет минимизировать бусинка агрегации. Более того, хотя мы еще не тестировали, новых магнитных шариков можно получить Luminex или BioRad, как полагают, дисплей меньше тенденция к агрегации.
Результаты применения 5-сложных Luminex массив ориентации Г. влагалищной, А. влагалища, Л. iners, Л. crispatus и Л. gasseri вместе с соответствующими грам окрашенных мазках вагинального мазка, показаны на рисунке 4. Эти образцы были взяты из одного лица в нескольких точках времени. В момент времени 0, человек был поставлен диагноз БВ основана на Граму (рис. 4а) и Luminex результаты этого же образца (рисунок 4B) показывают, что из организмов, представленных в массиве, Г. влагалищной наиболее распространена, а А. влагалища и L. iners были также положительными. Девять дней спустя, человек был еще BV положительной и сignal для G. влагалищной существенно возрос в то время как А. влагалища и L. iners по-прежнему положительный. Важно отметить, что по истечении этого времени человек начал переход к нормальной микрофлоры как грамположительных бактерий стал обнаруживаются в мазках (рис. 4а), а сигнал для G. влагалищной уменьшилась, и сигнал для L. iners увеличилась (рис. 4В). По нашему первоначальному определению Б. В. с помощью этого метода (образцы положительного для G. влагалищной и / или А. влагалища были рассмотрены положительные BV) 13, этот человек был Б. В. положительный во всех временных точках, хотя Граму не удалось обнаружить G. влагалищной в последних двух моментов времени. С помощью метода Luminex описанные здесь, тенденции могут быть легко по сравнению с секвенирования основе методов и результатов анализа Luminex обычно подтверждают Грам пятна 13, обеспечивая при этом дополнительную информацию о личности организма и изобилия.

Рисунок 1. Принципиальная схема протокола Luminex для определения микрофлоры профиля комплекс клинических и экологических образца. Протокол начинается с шаблона ДНК, который был извлечен из образцов, представляющих интерес. (1) Создание ПЦР-продукта из шаблона ДНК с использованием нитей конкретных биотинилированного, фосфоротиоатные модифицированных cpn60 UT ПЦР-праймеров в сочетании с неизмененной cpn60 UT ПЦР праймеров (табл. 1), (2) Это порождает ПЦР бассейн продукт представляющий микробиоты с биотином фосфоротиоатные модификации на одной нити, (3) Дайджест двухцепочечной ПЦР продукт с T7 экзонуклеазная, которые не могут ухудшать фосфоротиоатные модифицированных прядь и, следовательно, порождает одноцепочечной ДНК, которые изменяются на 5 'конце с биотином; (4) Пару полистирола к конкретным видам cpn60 UT зондов - каждая бусинка имеет уникальный спектральный адрес (указывается шарик цвета), что яс заметной на Luminex или Bio-Plex инструмента; (5) гибридизации одноцепочечной ПЦР-продукт, созданный из образца, представляющие интерес для набора видоспецифических олигонуклеотидных связью бусины; (6) Добавить стрептавидином фикоэритрин сопряженных, который связывается с биотинилированного одноцепочечной ПЦР-продукта и выступает в качестве индикатора гибридизации; (7) Определить спектральную адрес (шарик идентичности) и интенсивность сигнала с использованием гибридизации Luminex или Bio-Plex инструмента. По меньшей мере 100 бусин подсчитываются для каждой бусинки идентичности и средний интенсивности флуоресценции (MFI) из фикоэритрин сигнала сообщается как выход. До 100 различных типов шарик можно оценить одновременно, но анализ показывает дискриминации трех бусинка типов показано на рисунке. (8) Когда МФО ПЦР воспроизводит полученные от того же образца значительно больше, чем отрицательного контроля для данного бусинки (односторонний студента т-тест, р <0,05), образец считается положительным для этого организма.
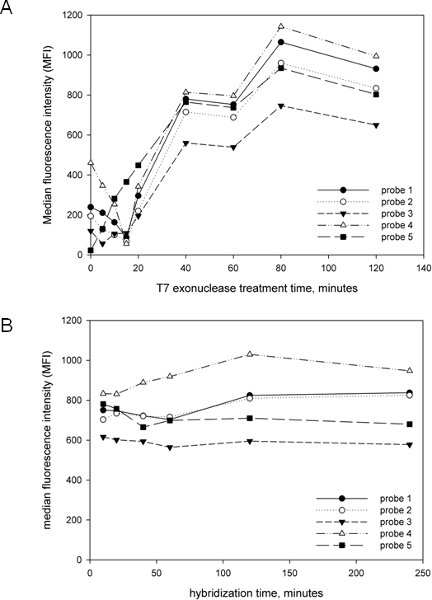
Рисунок 2. Оптимизация параметров Luminex анализа. Пять различных зондов, направленных на Peptostreptococcus anaerobius были использованы с ампликонов полученные от смешанных шаблон включает плазмид, содержащих клонированные cpn60 UT от 20 бактерий, как известно, связана с влагалищем, в том числе П. anaerobius. (А). Влияние T7 время лечения экзонуклеазная. Протокол, описанный выше, был приняты, однако время лечения с экзонуклеазная T7 варьировалась до гибридизации и средняя интенсивность флуоресценции (MFI) была определена для всех зондов. (B). Влияние гибридизации времени. Протокол, описанный выше, был следуют с различными гибридизации раз. Одинаковые наборы зондов были использованы с ампликона сгенерирован из того же шаблона, как в а средний интенсивности флуоресценции (MFI) была определена для всех зондов.
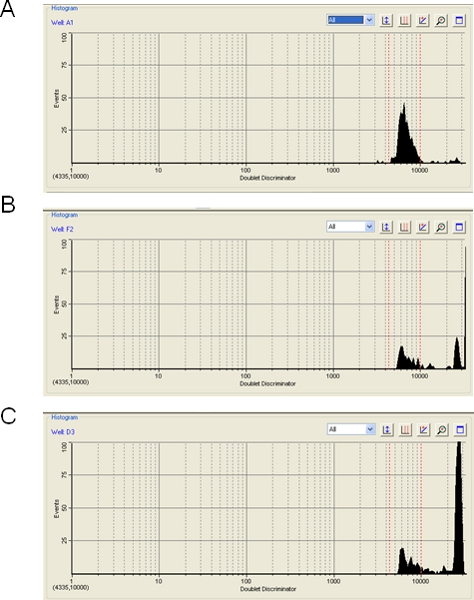
Рисунок 3. Определение бусинка агрегации использованием Биоплексы программного обеспечения. Три даны примеры Биоплексы работает, в которых уровень бусинка агрегации (А) приемлемый (5%), (B), пограничное (50%), и (C) неприемлемые (80%).
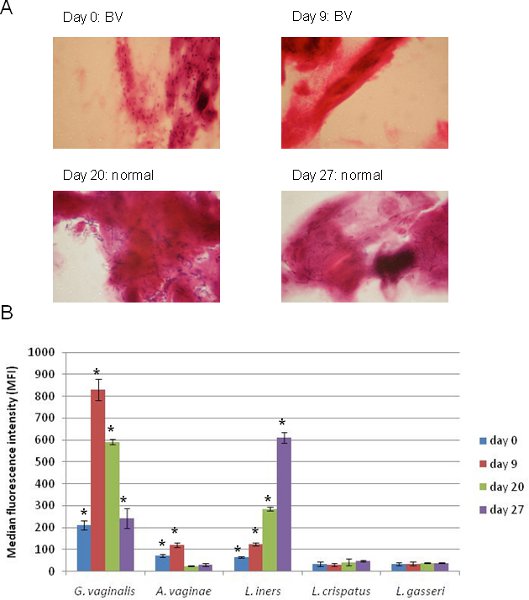
Рисунок 4. Применение 5-сложных Luminex массив BV диагноз в последовательных образцов, взятых у той же особи. (А). Грам-окрашенных слайдах показаны традиционные диагностические использовать для оценки каждого образца для BV. (B). Применение 5-сложных массивов Luminex подготовлены и выполнены, как описано в данном протоколе, к тому же четыре образца показано в (). Бактериальные цели которого МФО сигнал был значительно положительные по нашему определению (односторонний студента т-тест, р <0,05), обозначены звездочкой (*).
Обсуждение
Специфику генерации сигнала имеет решающее значение, вы должны быть уверены, что сигнал, наблюдаемый действительно отражает обнаружения ампликона генерируется из этого организма. Программное обеспечение таких как PrimerPlex (Премьер Biosoft) может помочь разработать зондов, которые будут ск?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Альберто Северини и Ванесса Goleski за помощь в развитии анализа и критических комментариев к этой рукописи. Эта работа была профинансирована Агентством общественного здравоохранения Канады и Промышленная программа содействия исследованиям (National Research Council Канады). Дополнительная поддержка была получена из Университета Фонда Публикации Саскачеван.
Материалы
| Name | Company | Catalog Number | Comments |
| Олигонуклеотидов имя | Компания | Последовательность 1 | |
| H279BP | Invitrogen, IDT, или другие | Биотин-OEFO GAIIIIGCIGGIGAYGGIACIACIAC | |
| H280 | YKIYKITCICCRAAICCIGGIGCYTT | ||
| H1612BP | Биотин-OEFO GAIIIIGCIGGYGACGGYACSACSAC | ||
| H1613 | CGRCGRTCRCCGAAGCCSGGIGCCTT | ||
| 1O, фосфоротиоатные-C, E, фосфоротиоатные-G, F, фосфоротиоатные-, я, инозин, Y, C или T, R, или G, K, T и G, S, C и G. | |||
Таблица 1. Последовательности модифицированных олигонуклеотидов для универсального cpn60 ПЦР.
| Название реагента | Компания | Номер по каталогу | Комментарии |
| 1-этил-3-(3-dimethylamiopropyl) карбодиимида HCl (EDC) | Прокалывать | 22980 | |
| Флуоресцентные бисера полистирола: MicroPlex микросфер (Luminex), или Bio-Plex COOH Бусы (Bio-Rad) | Luminex или Bio-Rad | Bio-Rad: 171-506xxx где ххх соответствует шарик идентификатор | Магнитные гранулы становятся доступными для олигонуклеотида связи и может предложить определенные преимущества. Не было осуждено этих авторов. |
| Захват олигонуклеотидов (5 'аминокислот С12 модифицированный) | Invitrogen, IDT, или другие | различный | Обессоленная уровня чистоты является приемлемым. Последовательности захвата зонда используется для характеристики мазки из влагалища, которые представлены в рукописи, на которых этот протокол основан 13. |
| T7экзонуклеазная | New England Biolabs | M0263S | |
| Стрептавидин-R-фикоэритрин (SA-PE) | Invitrogen | S-866 | Будьте осторожны, чтобы получить высокую чистоту SA-PE, это номер по каталогу рекомендуется |
| Гильзы 96-ПЦР пластины | Рыболов | CS006509 | вписывается в оба 96-луночного амплификаторе и Биоплексы машины |
| Гильза уплотнения мат | Рыболов | CS006555 | Может быть повторно использованы; промыть мыльной водой, хорошо промыть, и сухой |
| 5M ТЦМВ | Сигма | T3411 | |
| Bio-Plex или Luminex инструмент | Bio-Rad или Luminex | Bio-Rad: 171-000201 | |
| PrimerPlex программного обеспечения для проектирования зонд | Премьер Biosoft | www.premierbiosoft.com | Предлагаемые для Luminex зонд-де-знак, хотя и другие программные платформы могут быть использованы |
Таблица 2. Конкретные реактивов и оборудования.
| компонент | мкл / анализ | μl/100 анализов | Конечная концентрация |
| 10x ПЦР буфер (Invitrogen) | 5 | 500 | 1x |
| 50 мМ MgCl 2 (Invitrogen) | 2,5 | 250 | 2,5 мМ |
| 10 мМ дНТФ | 1 | 100 | 0,2 мМ каждого |
| H279BP, 25 мкМ | 0,25 | 25 | 375 нМ |
| H1612BP, 25 мкМ | 0,75 | 75 | 125 нМ |
| H280, 25 мкМ | 0,25 | 25 | 375 нМ |
| H1613,25 мкМ | 0,75 | 75 | 125 нМ |
| Воды | 34 | 3400 | --- |
| Итого | 44,5 | 4450 |
Таблица 3. Предлагаемые смеси для ПЦР с модифицированными cpn60 UT праймеров (табл. 1). Анализ настроен на 5 мкл ДНК-матрицы и 0,5 мкл (2.5U) из Taq ДНК-полимеразы (Invitrogen). Обычно большие объемы готовы (например, достаточном для 100 анализов) и хранили при температуре -20 ° C.
Ссылки
- Hale, L. P., Swidsinski, A., Mendling, W. Bacteria associated with bacterial vaginosis. N. Engl. J. Med. 354, 202-203 (2006).
- Hay, P. Life in the littoral zone: lactobacilli losing the plot. Sex. Transm. Infect. 81, 100-102 (2005).
- Morris, M., Nicoll, A., Simms, I., Wilson, J., Catchpole, M. Bacterial vaginosis: a public health review. Brit. J. Obstet. Gynecol. 108, 439-450 (2001).
- Myer, L., Kuhn, L., Stein, Z. A., Wright, T. C., Denny, L. Intravaginal practices, bacterial vaginosis, and women's susceptibility to HIV infection: epidemiological evidence and biological mechanisms. Lancet. Infect. Dis. 5, 786-794 (2005).
- Wilson, J. Managing recurrent bacterial vaginosis. Sex. Transm. Infect. 80, 8-11 (2004).
- Nugent, R. P., Krohn, M. A., Hillier, S. L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J. Clin. Microbiol. 29, 297-301 (1991).
- Ison, C. A., Hay, P. E. Validation of a simplified grading of Gram stained vaginal smears for use in genitourinary medicine clinics. Sex. Transm. Infect. 78, 413-415 (2002).
- Money, D. The laboratory diagnosis of bacterial vaginosis. Can. J. Infect. Dis. Med. Microbiol. 16, 77-79 (2005).
- Schellenberg, J. Pyrosequencing of the chaperonin-60 universal target as a tool for determining microbial community composition. Appl. Environ. Microbiol. 75, 2889-2898 (2009).
- Spear, G. T. Comparison of the diversity of the vaginal microbiota in HIV-infected and HIV-uninfected women with or without bacterial vaginosis. J. Infect. Dis. 198, 1131-1140 (2008).
- Brotman, R. M., Ravel, J. Ready or not: the molecular diagnosis of bacterial vaginosis. Clin. Infect. Dis. 47, 44-46 (2008).
- Fredricks, D. N., Fiedler, T. L., Marrazzo, J. M. Molecular identification of bacteria associated with bacterial vaginosis. N. Engl. J. Med. 353, 1899-1911 (2005).
- Dumonceaux, T. J. Multiplex detection of bacteria associated with normal microbiota and with bacterial vaginosis in vaginal swabs by use of oligonucleotide-coupled fluorescent microspheres. J. Clin. Microbiol. 47, 4067-4077 (2009).
- Molenkamp, R., van der Ham, A., Schinkel, J., Beld, M. Simultaneous detection of five different DNA targets by real-time Taqman PCR using the Roche LightCycler480: Application in viral molecular diagnostics. J. Virol. Meth. 141, 205-211 (2007).
- Nikiforov, T. T., Rendle, R. B., Kotewicz, M. L., Rogers, Y. H. The use of phosphorothioate primers and exonuclease hydrolysis for the preparation of single-stranded PCR products and their detection by solid-phase hybridization. PCR. Methods. Appl. 3, 285-291 (1994).
- Hill, J. E., Penny, S. L., Crowell, K. G., Goh, S. H., Hemmingsen, S. M. cpnDB: A Chaperonin Sequence Database. Genome. Res. 14, 1669-1675 (2004).
- Bradshaw, C. S. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy. J. Infect. Dis. 194, 828-836 (2006).
- Dumonceaux, T. J. Enumeration of specific bacterial populations in complex intestinal communities using quantitative PCR based on the chaperonin-60 target. J. Microbiol. Meth. 64, 46-62 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены