このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
遺伝的にコードされたカルシウムセンサーを発現する鋤鼻器のスライス標本のイメージング神経細胞応答
要約
The vomeronasal organ (VNO) detects intraspecies chemical signals that convey social and reproductive information. We have performed Ca2+ imaging experiments using transgenic mice expressing G-CaMP2 in VNO tissue. This approach allows us to analyze the complicated response patterns of the vomeronasal neurons to large numbers of pheromone stimuli.
要約
鋤鼻器官(VNO)は、同じ種の1,2内の個人の、社会的な性と生殖に関するステータスに関する情報を運ぶ化学的感覚信号を検出します。これらの種内の信号を、フェロモンだけでなく、いくつかの捕食者3からの信号は、特異性と感度4の高レベルの鋤鼻感覚ニューロンを(VSNを)活性化する。 G -タンパク質共役型受容体、V1R、V2RとFPR 5月14日 、の少なくとも三つの異なるファミリーは化学的感覚手がかりの検出を仲介するVNOニューロンに発現されています。フェロモン情報はVNOによってエンコードされている方法を理解するために、それは様々な刺激に個々のVSNの応答プロファイルを分析し、これらの応答を仲介する特異的な受容体を識別することが重要です。
VNOのneuroepitheliaは、鋤骨のペアで囲まれています。 VNOの半盲管状の構造は、接続する1つの開放端を(鋤鼻ダクト)がある鼻腔。 VSNをはフェロモン手がかりが樹状ノブで発現する受容体と接触しているVNO、の内腔部分にその樹状突起を延長する。 VSNの細胞体は、頂端及び基底層にそれぞれ6-8を発現しV1RとV2Rを持つ擬似成層を形成する。いくつかの技術が感覚刺激4,12,15-19へのVSNの応答を監視するために利用されている。これらの技術の中で、急性スライス標本では、いくつかの利点を提供しています。最初に、解離VSNを3,17と比較して、スライス標本は、それらのネイティブ形態の神経細胞と細胞の樹状突起が比較的そのまま滞在を維持。第二に、VSNの細胞体は、全体の上皮およびホールマウント標本12,20に比べて電気生理学的試験とイメージング実験を可能にするVNOの冠状スライスに簡単にアクセスできます。第三に、このメソッドは、受容体の同定を可能にするために、分子クローニング技術と組み合わせることができます。
感覚刺激が強いのCa 2受容体の活性化4,21の指標であるVSNをで+流入を誘発する。そこで我々は、トランスジェニックマウスを開発しているVSNを15,22を含む嗅覚ニューロンにおける発現するG - CaMP2。感度とプローブの遺伝的性質が大幅にCa 2 +動態のイメージング実験を促進する。このメソッドは、以前の研究4,21で使用される染料ロードプロセスを排除しています。我々はまた、VNOのスライスに様々な刺激の応用を可能にするリガンドの配信システムを採用しています。 2つの手法の組み合わせは、私たちは刺激の大きい数字に対応して同時に複数のニューロンを監視することができます。最後に、我々は画像処理を支援するための半自動解析パイプラインを確立している。
プロトコル
1。ソリューションの準備
- 表によると10倍、R1、R2 10Xと10X R3ソリューションを準備します。
R1化学物質 MW(g /モル) mMの(1X) 10X株式(G / L) NaClを 58.44 125 73.05 塩化カリウム 74.55 2.5 1.86 MgCl 2の 1Mストック 1 10ミリリットル のCaCl 2 · 2H 2 O 147.02 2 2.94 のNaH 2 PO 4 · H 2 O 137.99 1.25 1.72
R2化学 MW(g /モル) mMの(1X) 10X株式(G / L) 飽和NaHCO 3 84.01 25 21
R3化学物質 MW(g /モル) mMの(1X) 10X株式(G / L) NaClを 58.44 125 73.05 塩化カリウム 74.55 2.5 1.86 MgCl 2の 1Mストック 2 20ミリリットル のCaCl 2 · 2H 2 O 147.02 2 2.94 HEPES 1Mストック 5 50ミリリットル - 再蒸留水(DDW)と広告の10倍、R1とR2 10X 100mlの100mlを混合することによって、実験の日にマウスの人工脳脊髄液(mACSF)1リットルを作るデキストロースのD 1.8グラム(最後の10 mM)を。この調製法では高pHで炭酸カルシウムの沈殿を防ぐことができます。 mACSFの浸透圧は310から315 mOsm / L程度である必要に応じて、デキストロースまたは水で浸透圧を調整します。 7.2から7.4への溶液のpHを調整する前に少なくとも30分間Carboxygenガス(酸素95%、5%二酸化炭素)を備えたソリューションを通気する。
- 10X R2とDDWで10倍R3の100mlの100mlを混合することによって、実験の日にリンゲル溶液1リットルを作成し、ブドウ糖(10mM)を1.8 gを加える。リンゲル溶液の浸透圧とpHはmACSFのもののようになります。 Carboxygenガスとソリューションを通気する。
- mACSFまたはリンガー溶液のいずれかで4%低融点アガロース(LMA)を準備します。 4で注しエッペンドルフチューブに溶融アガロースと店舗℃の使用まで。多糖類を精製で構成されているLMAは、、° Cと25℃未満の温度で急速に固化、37℃で液体のままこれらのプロパティは、VNを埋め込むために最適ですOと生きている組織の生理機能。このような寒天のような他の不純物を含む材料、、未知成分が神経細胞の応答を妨げる可能性が生きている組織の実験のための選択肢であってはならない。
- リンゲル溶液にフェロモン刺激を準備する。マウスの尿の場合は、1:100希釈で堅牢な応答を生じさせる。
2。 VNOのスライスの準備
- 動物を犠牲にする前に、ヒートブロックでLMAの2つの管を配置し、℃でアガロースを融解するために> 60に温度を設定します。ゲルは液化すると、37℃のヒートブロックにチューブを移す。
- CO 2安楽死を、以下のG - CaMP2マウスを刎ねる。下顎を削除するには、ハサミで下顎の骨を切る。鼻腔( 図1A)を公開するリッジ上部の口蓋組織をはがし。 2つの前面切歯の間に外科ブレードを挿入してjawbonesを区切ります。慎重にVNOを公開するjawbonesを削除します。この時点で、全体のVNOがnから釣り上がることができる尾の骨( 図1B)に保持することによってasal空洞。すぐに冷たい酸素mACSFソリューションにVNOを転送する。
- 解剖のスコープ]で、ゆっくりと中隔の骨( 図1C)の壁に沿ってスライド#5鉗子の先端を使用して、2つのVNOsを区切ります。 VNOの組織を包む鋤骨の骨離れて皮をむき。ゆっくりと骨の空洞から全体VNOの組織を持ち上げます。細心の注意は神経上皮に損傷を与えないように、このステップで注意が必要です。組織表面に残された小さな骨片を埋め込む前に完全に削除する必要があります。組織に残された断片は、アガロースブロックの外組織を引っ張って切断刃によってキャッチされることがあります。
- 溶融アガロース( 図1D)に後部VNO組織の終わり、静かに浸し、それを保持するために鉗子を使用してください。すぐにアガロースを固めるために氷上でチューブを冷却します。埋め込みと冷却プロセスは2分未満を取る必要があります。
- VF300組織スライサー(Precisionary InStr関数uments、グリーンビル、ノースカロライナ州)は、セクションを作成するために使用されます。それはティッシュホルダー( 図1EおよびF)に形状や接着剤でVNOを含むアガロースブロックをカット。金属製の筒にティッシュホルダーを挿入し、追加のLMAと残りのチャンバーを埋める。 LMAは、氷の上で固化されたら、すぐに切片に進んでください。切片室に冷たい酸素mACSFを供給すると1スライス当たり180〜200μmの厚さでカット開始。組織は切片中に圧縮されていないとVNOがアガロースから落下しないように進歩の速度および振動周波数を調整します。収集とmACSFのインキュベーションチャンバー( 図2A)に区分されたスライスを転送する。スライスは、室温で酸素mACSFで6-8時間のために実行可能です。 図2B、Cはそれぞれ、G - CaMP2 VNOスライスのDICと2光子画像を示す。
3。イメージングチャンバーのセットアップ
- 灌流の途中でVNOのスライスを配置チャンバー(Siskiyou、グランツパス、OR)とスライスのアンカー(ワーナーインスツルメンツ、ハムデン、コネチカット州)( 図3A)とスライスを押したままにします。アンカーのスレッドはLMAのスライスの一部ではなく、VNOの組織に対して押してください。酸素mACSFは〜を100μl/秒の入口ポートを介して灌流チャンバーに配信され、液体は、新鮮なmACSF( 図3AとB)の連続的なフローを提供するために、出口ポートを介して吸引針を介して排出される。
- リンガー溶液と30 mlの注射器を記入し、シリンジポンプ(新時代のポンプシステム、ファーミングデール、ニューヨーク州)にクランプ。スライス上にリンゲル溶液( 図3C)の連続的なフローを提供するために、300〜600μL/ minのポンプ速度を設定します。
- リンゲルHPLCインジェクションループへ(Chromtech、アップルバレー、ミネソタ州)( 図3D)のコンセントを接続します。異なるループのサイズが配信されているボリュームの正確な制御のために選択することができます。我々はOで20μlのループを使用してくださいURの実験。注入ループの制御には2つの流れの経路( 図3E)を持っています。 "ロード"位置では、サンプルはハミルトンの精度のシリンジでサンプルループにロードすることができます。過剰なサンプルが終了する廃棄物のコンセントを介してサンプルループ。シリンジポンプで注入リンゲル溶液は、サンプルループをバイパスし、血流の先端( 図3AおよびE)に接続されているコンセントに直接行く。 "注射"の位置に、ポンプのソリューションは、サンプルループを通って流れ、出口( 図3E)に刺激を押してください。イメージング実験に先立って、気泡が灌流液の円滑な流れを確保するために外に追跡されることがあります。他の商用またはカスタムメイド噴射システムは、刺激の配信のために実装することができます。
- 先端が離れてVNOのスライスから約1 mmになるように5倍または10倍レンズの下の灌流先端を調整します。
- 新しい灌流システムのセットアップのときに、それはサンプルの遅延時間とdurを測定することをお勧めします蛍光色素とation。サンプルループに0.1%ローダミン6G色素をロードし、画像取得の開始( 図3F)の後に5秒で位置を注入するバルブを切り替える。蛍光シグナルは10〜30秒間に検出されます。蛍光シグナルの滑らかな曲線は、また酸素mACSFの浸レンズとその適切な灌流スライスに達するの下に生成された小さな乱流があることを示します。
4。タイムラプスイメージング
- 我々は、時間の経過のイメージングのための10倍または20倍の水浸レンズとツァイスAxioSkope FS2顕微鏡を使用してください。標準GFPバンドパスフィルタ(450 - 490nmのは)G - CaMP2信号に使用されます。落射蛍光画像は、1X1やG - CaMP2の発現レベルに応じて、2x2ビニングとCCDカメラ(ツァイスHRM)によって買収されています。
- 1秒あたり1フレームに取り込み速度を設定します。 G - CaMP2信号と細胞への写真の損傷の漂白最小限に抑えるために光の強度を調整します。各EX用periment、我々は通常、60フレームの画像のスタック(〜60から70秒)を取得。すべての試験で一貫性のある時間遅延を得るための実験の一組のための特定の時点(例えば、 図3Fに5秒)で注入位置にバルブを切り替えます。
- 刺激としてリンゲル液を使用してテスト実行を行います。動きのアーティファクトは、サンプルの注入時に導入されている場合の灌流セットアップを再調整します。
- リンゲル溶液で1:100に希釈したマウスの尿を使用して実行ポジティブコントロールを実行します。マウスの尿中にG - CaMP2応答の典型的な最大ΔF/ F値は20〜40%程度です。必要に応じて、1つは、実験の最後にスライスを刺激するためにリンゲルで10mMのKClを提供することで、スライスの生存を確認することができます。
- 少なくとも3回つの刺激をロードした後にリンゲル溶液でハミルトンシリンジを洗浄してください。少なくとも3回の異なる刺激間リンゲル溶液とサンプルループを洗浄してください。これらの手順は、differe間のクロスコンタミネーションを防ぐNTのサンプル。
- 次の刺激を適用する前に回復するVSN 4-10分間待ちます。
5。データ分析
- つのスライスから取得したすべての画像の画像レジストレーションを実行します。我々はこのプロセスを自動化するAxioVisionの(カールツァイス、北米)でカスタムで作成されたVBAスクリプトを使用してください。同じ実験内のすべての画像のフレームは弾性登録( 図4A)と共通の選択された参照フレームに対して登録されています。また、非線形登録として知られている弾性の登録は、、参照画像に非厳密ターゲットイメージの転換を強調する画像のレジストレーション技術のカテゴリです。ここではAxioVisionのからインプリメンテーションを使用していました。
このリファレンスフレームは、画像スタックから任意に選択されます。 - 応答する細胞を同定するために画像減算を行います。我々は(ImageJのv1.42にカスタム作成されたマクロを使用http://rsb.info.nih.gov/ij/ 、NIH、このプロセスを自動化するためにベセスダ、MD)。最小限の投影画像は、それぞれのスタック用に生成されます。最小限の投影は生のスタック( 図4B)から減算された後に応答する細胞が出現する。
- 減算スタックから関心領域(ROI)を特定すると、ImageJからプラグインのマルチ測定を使用してROI座標を取得する。一つの実験のためのすべてのスタックを処理し、すべてのROIを保存するには、ROIマスターリスト( 図4C)の座標。
- カスタムで作成されたマクロと、ImageJ( 図4D)からマルチメジャープラグインで生の画像スタックから細胞応答を測定するためにROIのマスターリストを使用してください。 Matlabのプロットの応答曲線とヒートマップ(MathWorks社、ネイティック、マサチューセッツ州)。
6。代表的な結果
4つの個々のマウスから採取した尿サンプルを使用してVNOイメージング実験の例を図5に示されています。スライスは、多様なpで尿の刺激に応答活性化のatterns。約80細胞は、値がヒートマップ( 図5A)にプロットされた尿の刺激とその応答ΔF/ Fの少なくともいずれかに応答を示す識別されます。セル1、2と3の応答トレースは、尿の刺激により、時間の経過の活性化を示す図5Bにプロットされます。セル1が両方とも女性の尿サンプルではなく、男性のサンプルに対する応答を表示するのに対し、セル2は、活性化の逆のパターンを示し、のみ、両方の男性のサンプルに応答します。セル3は、個々の男性と女性のサンプルの両方によって活性化される。セル1および尿中15性別特定の手がかりから2を表示特性応答。
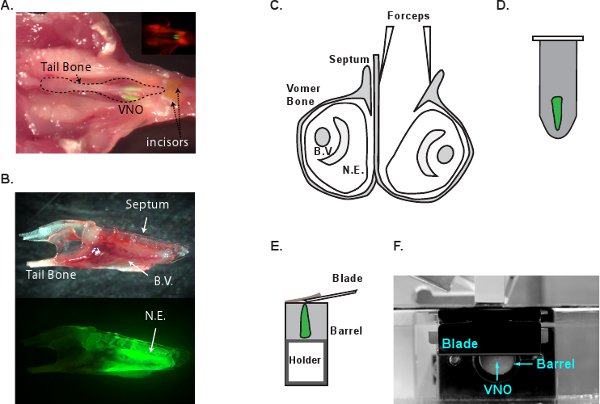
VNOの解剖のプロセスの図1の模式図。A.マウスの頭部のVNOの解剖学的位置。 G - CaMP2マウスの頭部を切除されており、ソフトなtを上下逆さまに配置されています問題は、VNOを公開するために口蓋から削除。入口には、同じ画像の蛍光像を示しています。 VNOのneuroepitheliaは明るい緑色です。B.は鋤骨の骨(上)と同じVNO(底)の蛍光像に囲まれて孤立VNOの側面図。C.は VNOと解剖の冠状ビュープロセス。一つは、VNO、セプタムから分離され、鋤骨の骨は、神経上皮を救出するために削除することができます。D. VNOはLMA。Eに埋め込 まれている埋め込 まれたブロックは切片のためのティッシュホルダーに接着されています。ティッシュホルダーは、切片のために金属バレルのアガロースブロックを押し出し、スライスごとに180から200μmで進められている。切断刃は金属のバレルに密接に配置されている。VF300組織スライサーのシステムのF.サイドビューは。 BV、血管。 NE、神経上皮。
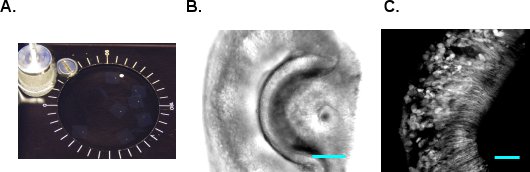
図2 VNOスライス。A. VNOスライスは、室温で酸素mACSFに維持されます。B.は VNOのスライスのDIC画像。C.は、G - CaMP2のマウスからVNOの2光子画像。スケールバーは50μm。
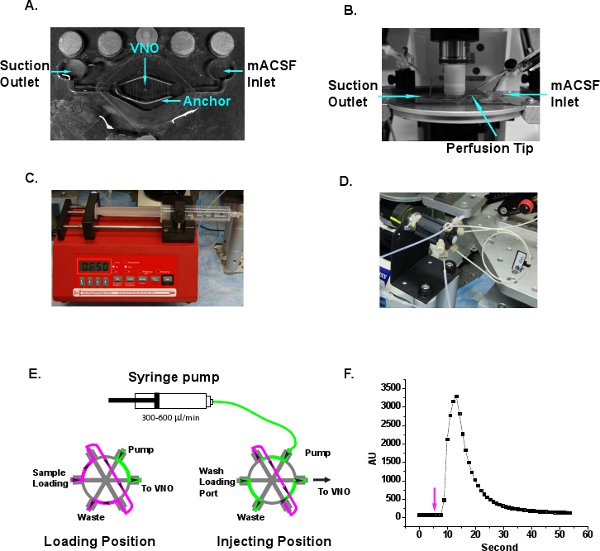
灌流システムのセットアップの図3イラスト。A.入口と出口を持つ典型的な灌流チャンバー。 VNOのスライスは、室の中央に位置し、組織のアンカーを押し下げている。 VNOの組織が 押されていないように真ん中のスレッドが組織のアンカーから削除されています。B.は灌流チャンバーは、浸漬の目的の下に、顕微鏡のステージ上に配置されます。 mACSF口、吸込口と灌流先端示されている。C.シングルバレルシリンジポンプは、灌流チップを通してリンゲルの連続的な流れを提供する。D. HPLC麟蹄ctionのループシステムは、便利な刺激のサンプルローディングと注射のために採用されています。フローの方向のE.の模式図は、ロードと注入位置に。リンゲル、緑。刺激のサンプル、マゼンタ。矢印は流れの方向を示している。F.が遅延し、灌流システムの時間測定を洗い落とす。ローダミン6G蛍光色素は、サンプルループにロードされ、バルブは矢印で示されている第五秒の射出位置に切り替えられます。蛍光シグナルの変化は、その後10〜30秒と減少の間に検出されます。

図4画像処理パイプライン。A.つのスライスのすべての画像のフレームは参照フレームに対して登録されています。その生フレームからスタックの最小限の投影のB.減算は。応答細胞は引き算。C. Rの後に顕著になるOISは、選択され、それらの座標は、マスターリストにコンパイルされます。生のスタックからROIのマスターリストを使用して応答する細胞のD.測定。

図5代表的なG - CaMP2 VNOイメージング実験。A.個々の男性と女性の尿で刺激したスライスからΔF/ Fレスポンスのヒートマップ。尿サンプルは、個々の雄と雌のマウスから収集されます。 X軸、スライスから同定された細胞を応答。 Y軸、実験に使用した尿サンプル。カラーバーは、ΔF/ F値を示している。Aの矢印でマークされた3代表的な細胞のB.の応答時間のコースは、刺激のアプリケーションの時間を示す。 F - FVB、女性FVB、F - CBA、雌CBA、M - FVB、男性FVB、M - BL6、オスのC57BL / 6。
特定の試薬と機器の表:
| の名前試薬 | 会社 | カタログ番号 | コメント(省略可能) |
| 灌流チャンバー | Siskiyou | PC - H | 水平 |
| ホールドダウンスライス | ワーナーインスツルメンツ | SHD - 22CL | |
| 灌流ポートホルダー | ALA科学的、社 | MPIOH - S | |
| 注射器ポンプ | 新時代のポンプシステム、(株) | NE - 300 | |
| 低圧噴射弁 | Chromtech | V - 451 | |
| PEEKチューブ | Chromtech | 1531 | 1 / 16"OD、0.25ミリメートルID |
| PEEK製サンプルループ | Chromtech | 1803 | 20μL |
| ハミルトンシリンジ | Chromtech | 80630 | 100μL |
ディスカッション
鋤鼻受容体(VRS)の大半は、デュラックとアクセル5で、その発見以来、オーファン受容体として残る。これらの化学感覚受容体と動物の行動を媒介に自らの役割のためのフェロモンリガンドについてはよくわかっていない。今までは、リガンド/受容体の1ペアのみ、ESP1ペプチドおよびその同族体、Vmn2r116(V2Rp5)は、識別し、特定の社会的な情報19,23を伝えることが示されて?...
開示事項
利害の衝突は宣言されません。
謝辞
We thank Andrea Moran together with members of Lab Animal Service Facility (LASF) at Stowers Institute for their excellent support on animal husbandry and technical services. This work is supported by funding from Stowers Institute and the NIH (NIDCD 008003) to CRY. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institute on Deafness and Other Communication Disorders or the National Institutes of Health. U.S. patent pending for the tetO-G-CaMP2 mice for Stowers Institute, CRY and LM.
参考文献
- Birch, M. C. . Pheromones. , (1974).
- Wyatt, T. D. Pheromones and animal behaviour : communication by smell and taste. , (2003).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141, 692-703 (2010).
- Leinders-Zufall, T. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405, 792-796 (2000).
- Dulac, C., Axel, R. A novel family of genes encoding putative pheromone receptors in mammals. Cell. 83, 195-206 (1995).
- Herrada, G., Dulac, C. A novel family of putative pheromone receptors in mammals with a topographically organized and sexually dimorphic distribution. Cell. 90, 763-773 (1997).
- Matsunami, H., Buck, L. B. A multigene family encoding a diverse array of putative pheromone receptors in mammals. Cell. 90, 775-784 (1997).
- Ryba, N. J., Tirindelli, R. A new multigene family of putative pheromone receptors. Neuron. 19, 371-379 (1997).
- Pantages, E., Dulac, C. A novel family of candidate pheromone receptors in mammals. Neuron. 28, 835-845 (2000).
- Zhang, X., Rodriguez, I., Mombaerts, P., Firestein, S. Odorant and vomeronasal receptor genes in two mouse genome assemblies. Genomics. 83, 802-811 (2004).
- Liberles, S. D. Formyl peptide receptors are candidate chemosensory receptors in the vomeronasal organ. Proc. Natl. Acad. Sci. U.S.A. 106, 9842-9847 (2009).
- Riviere, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459, 574-577 (2009).
- Yang, H., Shi, P., Zhang, Y. P., Zhang, J. Composition and evolution of the V2r vomeronasal receptor gene repertoire in mice and rats. Genomics. 86, 306-315 (2005).
- Rodriguez, I., Punta, D. e. l., Rothman, K., Ishii, A., T, ., Mombaerts, P. Multiple new and isolated families within the mouse superfamily of V1r vomeronasal receptors. Nat. Neurosci. 5, 134-140 (2002).
- He, J., Ma, L., Kim, S., Nakai, J., Yu, C. R. Encoding gender and individual information in the mouse vomeronasal organ. Science. 320, 535-538 (2008).
- Holy, T. E., Dulac, C., Meister, M. Responses of vomeronasal neurons to natural stimuli. Science. 289, 1569-1572 (2000).
- Chamero, P. Identification of protein pheromones that promote aggressive behaviour. Nature. 450, 899-902 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437, 898-901 (2005).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
- Leinders-Zufall, T. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306, 1033-1037 (2004).
- He, J. Distinct signals conveyed by pheromone concentrations to the mouse vomeronasal organ. J. Neurosci. 30, 7473-7483 (2010).
- Haga, S. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466, 118-122 (2010).
- Boschat, C. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5, 1261-1262 (2002).
- Hendel, T. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in. 28, 7399-7411 (2008).
- Pologruto, T. A., Yasuda, R., Svoboda, K. Monitoring neural activity and [Ca2+] with genetically encoded Ca2+ indicators. J. Neurosci. 24, 9572-9579 (2004).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front Neural Circuits. 1 (3), (2007).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved