É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Responses imagem Neuronal em Preparações Slice of Organ Vomeronasal Expressando um sensor de cálcio geneticamente codificado
Neste Artigo
Resumo
The vomeronasal organ (VNO) detects intraspecies chemical signals that convey social and reproductive information. We have performed Ca2+ imaging experiments using transgenic mice expressing G-CaMP2 in VNO tissue. This approach allows us to analyze the complicated response patterns of the vomeronasal neurons to large numbers of pheromone stimuli.
Resumo
The vomeronasal organ (VNO) detects chemosensory signals that carry information about the social, sexual and reproductive status of the individuals within the same species 1,2. These intraspecies signals, the pheromones, as well as signals from some predators 3, activate the vomeronasal sensory neurons (VSNs) with high levels of specificity and sensitivity 4. At least three distinct families of G-protein coupled receptors, V1R, V2R and FPR 5-14, are expressed in VNO neurons to mediate the detection of the chemosensory cues. To understand how pheromone information is encoded by the VNO, it is critical to analyze the response profiles of individual VSNs to various stimuli and identify the specific receptors that mediate these responses.
The neuroepithelia of VNO are enclosed in a pair of vomer bones. The semi-blind tubular structure of VNO has one open end (the vomeronasal duct) connecting to the nasal cavity. VSNs extend their dendrites to the lumen part of the VNO, where the pheromone cues are in contact with the receptors expressed at the dendritic knobs. The cell bodies of the VSNs form pseudo-stratified layers with V1R and V2R expressed in the apical and basal layers respectively 6-8. Several techniques have been utilized to monitor responses of VSNs to sensory stimuli 4,12,15-19. Among these techniques, acute slice preparation offers several advantages. First, compared to dissociated VSNs 3,17, slice preparations maintain the neurons in their native morphology and the dendrites of the cells stay relatively intact. Second, the cell bodies of the VSNs are easily accessible in coronal slice of the VNO to allow electrophysiology studies and imaging experiments as compared to whole epithelium and whole-mount preparations 12,20. Third, this method can be combined with molecular cloning techniques to allow receptor identification.
Sensory stimulation elicits strong Ca2+ influx in VSNs that is indicative of receptor activation 4,21. We thus develop transgenic mice that express G-CaMP2 in the olfactory sensory neurons, including the VSNs 15,22. The sensitivity and the genetic nature of the probe greatly facilitate Ca2+ imaging experiments. This method has eliminated the dye loading process used in previous studies 4,21. We also employ a ligand delivery system that enables application of various stimuli to the VNO slices. The combination of the two techniques allows us to monitor multiple neurons simultaneously in response to large numbers of stimuli. Finally, we have established a semi-automated analysis pipeline to assist image processing.
Protocolo
1. Preparação da solução
- Prepare 10X R1, R2 10X e 10X soluções R3 acordo com a tabela.
R1Produtos químicos MW (g / mol) mM (1X) Estoque de 10X (g / L) NaCl 58,44 125 73,05 KCl 74,55 2,5 1,86 MgCl 2 Um estoque M 1 10 ml CaCl 2 · 2H 2 O 147,02 2 2,94 NaH 2 PO 4 · H 2 O 137,99 1,25 1,72
R2Químico MW (g / mol) mM (1X) Estoque de 10X (g / L) NaHCO 3 84,01 25 21
R3Produtos químicos MW (g / mol) mM (1X) Estoque de 10X (g / L) NaCl 58,44 125 73,05 KCl 74,55 2,5 1,86 MgCl 2 Um estoque M 2 20 ml CaCl 2 · 2H 2 O 147,02 2 2,94 HEPES Um estoque M 5 50 ml - Fazer 1 litro do mouse fluido cérebro-espinhal artificial (mACSF) no dia do experimento, misturando 100 ml de R1 10X e 100 ml de R2 10X em água destilada duas vezes (DDW) e add 1,8 g de dextrose (final 10 mm). Este método de preparação impede a precipitação de carbonato de cálcio em pH elevado. A osmolaridade do mACSF é de cerca de 310-315 mOsm / L. Ajustar a osmolaridade com dextrose ou água se necessário. Aerar a solução com Carboxygen de gás (95% de oxigênio e dióxido de carbono 5%) para pelo menos 30 minutos antes de ajustar o pH da solução para 7,2-7,4.
- Fazer 1 litro de solução de Ringer no dia do experimento, misturando 100 ml de R2 10X e 100 ml de R3 10X no DDW e adicionar 1,8 g de dextrose (10 mM). A osmolaridade e pH da solução de Ringer devem ser semelhantes aos do mACSF. Aerar a solução com gás Carboxygen.
- Prepare 4% baixa temperatura de fusão de agarose (LMA) em qualquer mACSF ou solução de Ringer. Alíquota a agarose derretida em tubos eppendorf e armazenar a 4 ° C até o uso. LMA, que é composto de polissacarídeo purificado, permanece fluido a 37 ° C e solidifica rapidamente em temperatura abaixo de 25 ° C. Estas propriedades o tornam ideal para a incorporação de VNO e fisiologia do tecido vivo. Materiais impuros, tais como agar, não deve ser a escolha para o experimento tecido vivo como componentes descaracterizados pode interferir com a resposta neuronal.
- Prepare estímulos feromônio em solução de Ringer. Para a urina do rato, diluição 1:100 dar origem a respostas robusto.
2. Preparação de fatia VNO
- Antes de sacrificar o animal, colocar dois tubos de LMA em um bloco de aquecimento e ajuste a temperatura> 60 ° C para derreter a agarose. Uma vez que o gel se liquefaz, os tubos de transferência para um bloco de aquecimento 37 ° C.
- Decapitar um rato G-CaMP2 seguintes CO 2 a eutanásia. Cortar os ossos da mandíbula com uma tesoura para retirar o maxilar inferior. Descolar o tecido palato ridged superior para expor a cavidade nasal (Figura 1A). Separar os maxilares através da inserção de uma lâmina cirúrgica entre os dois incisivos da frente. Remova cuidadosamente os maxilares para expor VNO. Neste ponto, o VNO todo pode ser levantado da ncavidade Asal, segurando no osso da cauda (Figura 1B). Transferir o VNO ao frio solução mACSF oxigenado imediatamente.
- Em âmbito dissecção, separar os dois VNOs usando a ponta do # 5 fórceps deslize suavemente ao longo da parede septal do osso (Figura 1C). Descascar o osso vômer que envolve o tecido VNO. Levantar delicadamente o tecido VNO inteiro a partir da cavidade óssea. Extremo cuidado deve ser tomado nesta etapa para não danificar o neuroepitélio. Pequenos fragmentos ósseos deixados na superfície do tecido deve ser removido completamente antes de incorporação. Fragmentos deixados no tecido pode ser capturado pela lâmina de corte para puxar o tecido fora do bloco de agarose.
- Use a pinça para segurar a extremidade posterior do tecido VNO e delicadamente mergulhe-a na agarose derretida (Figura 1D). Rapidamente esfriar o tubo em gelo para solidificar a agarose. O processo de incorporação e de refrigeração deve demorar menos de 2 minutos.
- VF300 slicer tecido (Instr Precisionarytos, Greenville, NC) é usado para fazer seções. Cortar o bloco de agarose contendo o VNO em forma e cola-lo ao titular do tecido (Figura 1E e F). Insira o suporte de tecido para dentro do cilindro de metal e encha a câmara restante com LMA adicionais. Uma vez que a LMA solidifica em gelo, vá para a secção imediatamente. Fornecimento mACSF oxigenado frio na câmara de corte e começar a cortar na espessura de 180-200 mM por fatia. Ajustar a velocidade de avanço e freqüência de vibração, para que o tecido não é comprimida durante o corte e VNO não cair da agarose. Coletar e transferir as fatias seccionadas para mACSF câmara de incubação (Figura 2A). As fatias são viáveis por 6-8 horas em mACSF oxigenada em temperatura ambiente. Figura 2B e C mostram imagens DIC e 2-fótons de uma fatia VNO G-CaMP2, respectivamente.
3. Imagens da câmara configurado
- Coloque a fatia VNO no meio da perfusãocâmara (Siskiyou, Grants Pass, OR) e segure a fatia para baixo com uma âncora fatia (Warner Instruments, Hamden, CT) (Figura 3A). Os fios da âncora só deve pressionar contra a parte da fatia de LMA, mas não o tecido VNO. Oxigenado mACSF é entregue à câmara de perfusão através da porta de entrada em ~ 100 l / seg eo líquido é drenado através de uma agulha de sucção através da porta de saída para fornecer um fluxo contínuo de mACSF fresco (Figura 3A e B).
- Encher uma seringa de 30 ml com solução de Ringer e apertá-lo para a bomba de seringa (Sistemas Bomba New Era, Farmingdale, NY). Definir a velocidade da bomba de 300-600 mL / min para fornecer um fluxo contínuo de solução de Ringer sobre a fatia (Figura 3C).
- Conecte a saída do da campainha para uma injeção HPLC loop (Chromtech, Apple Valley, MN) (Figura 3D). Tamanho do loop diferentes podem ser selecionados para controle preciso do volume a ser entregue. Usamos um loop 20 l em oexperimentos ur. O controle de loop de injeção possui duas rotas de fluxo (Figura 3E). No "load" de posição, as amostras podem ser carregados para o loop de amostra com uma seringa de precisão Hamilton. Excesso de saídas de amostra do loop de amostra através da saída de resíduos. Solução de Ringer injetada pela bomba de seringa ignora o circuito de amostra e vai diretamente à tomada, que é conectado à ponta de perfusão (Figura 3A e E). Em "injeção" de posição, a solução da bomba flui através do circuito de amostra e empurre os estímulos à tomada (Figura 3E). Antes do experimento de imagem, bolhas de ar devem ser expulsos para garantir fluidez do líquido de perfusão. Outros comerciais ou de sistemas de injeção personalizado feito também pode ser implementado para entrega de estímulo.
- Ajuste a ponta de perfusão sob uma lente de 5x ou 10x de modo que a ponta é cerca de 1 mm de distância da fatia VNO.
- Quando um sistema de perfusão nova configuração, é aconselhável para medir o tempo de atraso de amostra e durração com corante fluorescente. Carga corante rodamina 6G 0,1% para o loop de amostra e mudar a válvula para injetar posição menos 5 segundos após o início da aquisição da imagem (Figura 3F). O sinal fluorescente é detectado entre 10-30 segundos. A curva de sinal fluorescente também indica que há pouca turbulência gerada sob a lente de imersão e que a perfusão adequada dos mACSF oxigenado atinge a fatia.
4. Lapso de tempo de imagem
- Nós usamos o microscópio Zeiss AxioSkope FS2 com uma lente de 10X ou 20X de água-dipping para imagens lapso de tempo. Padrão bandpass GFP filtro (450-490nm) é usado para G-CaMP2 sinais. As imagens de epifluorescência são adquiridas por uma câmera CCD (Zeiss HRM) com 1X1 ou 2x2 binning dependendo do nível de expressão de G-CaMP2.
- Definir a velocidade de aquisição de 1 frame por segundo. Ajustar a intensidade da luz para minimizar os sinais de branqueamento de G-CaMP2 foto e danos às células. Para cada exmentam, que normalmente adquirem uma pilha de imagens de 60 quadros (~ 60-70 segundos). Interruptor da válvula para a posição de injeção em um ponto de tempo específico (por exemplo, 5 segundo na Figura 3F) para um conjunto de experiência para obter tempo de atraso consistente em todos os ensaios.
- Realizar um ensaio utilizando solução de Ringer como o estímulo. Re-ajustar a configuração de perfusão se artefato movimento é introduzido durante a injeção da amostra.
- Realizar um controlo positivo correr com urina do rato diluído a 1:100 em solução de Ringer. O típico valor de ΔF / F máximo de G-CaMP2 resposta a urina do rato é de cerca de 20-40%. Se necessário, pode-se confirmar a viabilidade da fatia, oferecendo 10 mM KCl em solução de Ringer para estimular as fatias no final dos experimentos.
- Lavar a seringa Hamilton em solução de Ringer com pelo menos três vezes depois de carregar um estímulo. Lavar o circuito da amostra com solução de Ringer, pelo menos, três vezes entre diferentes estímulos. Estes passos evitar a contaminação cruzada entre os difereamostras nt.
- Espere por 40-10 min para o VSNs para recuperar antes de aplicar o estímulo seguinte.
5. A análise dos dados
- Realizar o registro de imagem de todas as imagens adquiridas a partir de uma fatia. Nós usamos uma custom-script VBA escrito em AxioVision (Carl Zeiss, América do Norte) para automatizar esse processo. Todos os quadros de imagem dentro do mesmo experimento são registradas contra um quadro de referência comum escolhido com elástico registo (Figura 4A). Elástica de registro, também conhecido como registro não-linear, é uma categoria de técnica de registro de imagem com ênfase na transformação de uma imagem-alvo não rigidamente a uma imagem de referência. Aqui usamos a implementação de AxioVision.
Este quadro de referência é escolhido arbitrariamente das pilhas de imagem. - Executar a subtração de imagem para identificar as células responder. Nós usamos macros personalizadas escrito em ImageJ v1.42 ( http://rsb.info.nih.gov/ij/ , NIH, Bethesda, MD) para automatizar esse processo. A imagem de projeção mínima é gerado para cada pilha. Células que respondem surgir após a projeção mínima é subtraído do stacks-primas (Figura 4B).
- Identificar regiões de interesse (ROI) das pilhas subtraído e obter o ROI utilizando coordenadas Multi-Measure plugin de ImageJ. Processo de todas as pilhas de um experimento e salvar todos os ROI coordenadas em uma lista mestra ROI (Figura 4C).
- Use a lista principal ROI para medir as respostas de células a partir de pilhas de imagens brutas com custom-written macro e Multi-Measure plugin do ImageJ (Figura 4D). Plot curvas de resposta e heatmap em Matlab (Mathworks Inc., Natick, MA).
6. Resultados representante
Um exemplo da experiência de imagem VNO utilizando amostras de urina coletadas de quatro camundongos indivíduo é mostrado na Figura 5. A fatia responde à estimulação de urina com diversas patterns de ativação. Cerca de 80 células são identificadas mostrando resposta a pelo menos um dos estímulos de urina e sua resposta ΔF / F valores são plotados no mapa de calor (Figura 5A). Os traços resposta das células 1, 2 e 3 são plotados em Figura 5B mostra a ativação curso de tempo por estímulos urina. Célula 1 exibe resposta a ambas as amostras de urina feminina, mas não as amostras do sexo masculino, enquanto célula 2 mostra os padrões de ativação oposto e responde a ambas as amostras do sexo masculino. Célula 3 é ativado por ambas as amostras individuais masculino e feminino. Células 1 e 2 mostram resposta característica ao sexo sugestões específicas na urina 15.
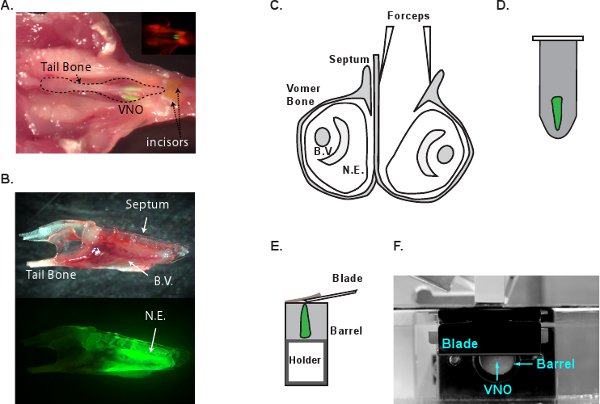
Figura 1 Ilustração esquemática da VNO processo de dissecação. A. A localização anatômica do VNO na cabeça de rato. A cabeça de um rato G-CaMP2 foi dissecado e é colocada de cabeça para baixo com o t molesquestão removido do palato para expor o VNO. De entrada mostra uma imagem fluorescente do mesmo quadro. O neuroepithelia do VNO são verdes brilhantes. B. A vista lateral do VNO isolado que é fechado no osso vômer (em cima) ea imagem fluorescente do VNO mesmo (baixo). C. Uma visão coronal do VNO e dissecção processo. Um VNO é separada do septo eo osso vômer pode então ser removido para livrar o neuroepitélio. D. VNO é incorporado LMA. E. O bloco embutido é colado ao titular de tecido para corte. O titular tecido é avançada no 180-200 mM por fatia empurrando o bloco de agarose para fora do cano de metal para corte. A lâmina de corte é posicionada perto do barril de metal. F. Vista lateral do sistema slicer VF300 tecido. BV, dos vasos sanguíneos. NE, neuroepitélio.
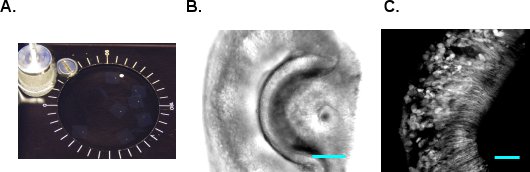
Figura 2 fatias VNO. fatias A. VNO são mantidos em mACSF oxigenada em temperatura ambiente. B. Uma imagem DIC da fatia VNO. C. A imagem 2-fótons do VNO de G-CaMP2 mouse. Barra de escala, 50 mm.
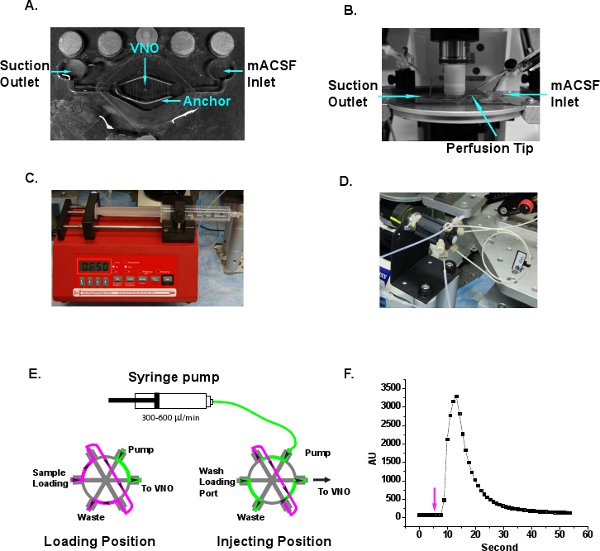
Figura 3 Ilustração da configuração do sistema de perfusão. A. A câmara de perfusão típico, com entrada e saída. Fatia VNO é posicionado no centro da câmara e pressionou para baixo com uma âncora de tecido. Os fios são removidos do meio da âncora do tecido de modo que o tecido VNO não está pressionado. B. A câmara de perfusão é colocado no palco microscópio no âmbito do objectivo de imersão. A entrada mACSF tomada de aspiração, e ponta de perfusão são indicados. C. A bomba de seringa barril proporciona um fluxo contínuo de Ringer com a ponta de perfusão. D. A inje HPLCsistema de circuito ction é adotada para carregamento conveniente estímulo modelo e injeção. E. Ilustração esquemática das direções de fluxo em carga e posições de injeção. Ringer, verde. Amostra de estímulo, magenta. Setas indicam o sentido do fluxo. F. Delay e lave medição do tempo do sistema de perfusão. Rodamina 6G corante fluorescente é carregado para o loop de amostra ea válvula é comutada para a posição de injeção na segunda 5, que é indicado com uma seta. A mudança de sinal fluorescente é detectado entre 10-30 segundos e diminui depois.

Figura 4 pipeline de processamento de imagem. A. Todos os quadros de imagem de uma fatia são registradas contra um quadro de referência. B. A subtração da projeção mínima de uma pilha de seus quadros-primas. Responder células tornam-se proeminentes após a subtração. C. ROIs são selecionados e suas coordenadas são compilados em lista principal. D. Medição de células que respondem usando ROI lista mestra da pilha-primas.

Figura 5 Um representante do G-CaMP2 VNO experiência de imagem. A. O heatmap resposta ΔF / F de uma fatia estimulado com urina masculino e feminino individual. Amostras de urina são coletadas de indivíduo camundongos machos e fêmeas. Eixo X, respondendo as células identificadas a partir da fatia. Y-eixo, amostras de urina utilizadas no experimento. Barra de cores indica o valor de ΔF / F. B. claro Tempo de resposta de 3 células representante marcado na Arrows A. indicam o tempo de aplicação do estímulo. F-FVB, fêmea FVB; F-CBA, do sexo feminino CBA; M-FVB, do sexo masculino FVB; M-BL6, do sexo masculino C57BL / 6.
Tabela de reagentes e equipamentos específicos:
| Nome doreagente | Companhia | Número de catálogo | Comments (opcional) |
| câmara de perfusão | Siskiyou | PC-H | horizontal |
| fatia de fixação | Warner Instruments | SHD-22CL | |
| titular porta perfusão | ALA científica, Inc. | MPIOH-S | |
| bomba de seringa | Sistemas de bomba New Era, Inc. | NE-300 | |
| válvula de injeção de baixa pressão | Chromtech | V-451 | |
| Tubulação PEEK | Chromtech | 1531 | 1 / 16 "OD, 0,25 milímetros ID |
| PEEK loop de amostra | Chromtech | 1803 | 20 mL |
| Hamilton seringa | Chromtech | 80630 | 100 L |
Discussão
The majority of the vomeronasal receptors (VRs) remain as orphan receptors since their discovery by Dulac and Axel 5. The pheromone ligands for these chemosensory receptors and their roles in mediating animal behaviors are not well understood. Until now, only one pair of ligand/receptor, the ESP1 peptide and its cognate receptor, Vmn2r116 (V2Rp5), has been identified and shown to convey specific social information 19,23. Another receptor, V1rb2, has been shown to respond to 2-heptanone, which presum...
Divulgações
No conflicts of interest declared.
Agradecimentos
We thank Andrea Moran together with members of Lab Animal Service Facility (LASF) at Stowers Institute for their excellent support on animal husbandry and technical services. This work is supported by funding from Stowers Institute and the NIH (NIDCD 008003) to CRY. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institute on Deafness and Other Communication Disorders or the National Institutes of Health. U.S. patent pending for the tetO-G-CaMP2 mice for Stowers Institute, CRY and LM.
Referências
- Birch, M. C. . Pheromones. , (1974).
- Wyatt, T. D. Pheromones and animal behaviour : communication by smell and taste. , (2003).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141, 692-703 (2010).
- Leinders-Zufall, T. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405, 792-796 (2000).
- Dulac, C., Axel, R. A novel family of genes encoding putative pheromone receptors in mammals. Cell. 83, 195-206 (1995).
- Herrada, G., Dulac, C. A novel family of putative pheromone receptors in mammals with a topographically organized and sexually dimorphic distribution. Cell. 90, 763-773 (1997).
- Matsunami, H., Buck, L. B. A multigene family encoding a diverse array of putative pheromone receptors in mammals. Cell. 90, 775-784 (1997).
- Ryba, N. J., Tirindelli, R. A new multigene family of putative pheromone receptors. Neuron. 19, 371-379 (1997).
- Pantages, E., Dulac, C. A novel family of candidate pheromone receptors in mammals. Neuron. 28, 835-845 (2000).
- Zhang, X., Rodriguez, I., Mombaerts, P., Firestein, S. Odorant and vomeronasal receptor genes in two mouse genome assemblies. Genomics. 83, 802-811 (2004).
- Liberles, S. D. Formyl peptide receptors are candidate chemosensory receptors in the vomeronasal organ. Proc. Natl. Acad. Sci. U.S.A. 106, 9842-9847 (2009).
- Riviere, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459, 574-577 (2009).
- Yang, H., Shi, P., Zhang, Y. P., Zhang, J. Composition and evolution of the V2r vomeronasal receptor gene repertoire in mice and rats. Genomics. 86, 306-315 (2005).
- Rodriguez, I., Punta, D. e. l., Rothman, K., Ishii, A., T, ., Mombaerts, P. Multiple new and isolated families within the mouse superfamily of V1r vomeronasal receptors. Nat. Neurosci. 5, 134-140 (2002).
- He, J., Ma, L., Kim, S., Nakai, J., Yu, C. R. Encoding gender and individual information in the mouse vomeronasal organ. Science. 320, 535-538 (2008).
- Holy, T. E., Dulac, C., Meister, M. Responses of vomeronasal neurons to natural stimuli. Science. 289, 1569-1572 (2000).
- Chamero, P. Identification of protein pheromones that promote aggressive behaviour. Nature. 450, 899-902 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437, 898-901 (2005).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
- Leinders-Zufall, T. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306, 1033-1037 (2004).
- He, J. Distinct signals conveyed by pheromone concentrations to the mouse vomeronasal organ. J. Neurosci. 30, 7473-7483 (2010).
- Haga, S. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466, 118-122 (2010).
- Boschat, C. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5, 1261-1262 (2002).
- Hendel, T. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in. 28, 7399-7411 (2008).
- Pologruto, T. A., Yasuda, R., Svoboda, K. Monitoring neural activity and [Ca2+] with genetically encoded Ca2+ indicators. J. Neurosci. 24, 9572-9579 (2004).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front Neural Circuits. 1 (3), (2007).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados