Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Réponses d'imagerie neuronale dans les préparations d'organe voméronasal Slice Exprimant un capteur de calcium codées génétiquement
Dans cet article
Résumé
The vomeronasal organ (VNO) detects intraspecies chemical signals that convey social and reproductive information. We have performed Ca2+ imaging experiments using transgenic mice expressing G-CaMP2 in VNO tissue. This approach allows us to analyze the complicated response patterns of the vomeronasal neurons to large numbers of pheromone stimuli.
Résumé
L'organe voméronasal (VNO) détecte les signaux chimiosensoriels qui transportent l'information sur le statut social, sexuel et de reproduction des individus au sein des mêmes espèces 1,2. Ces signaux intraspécifiques, les phéromones, ainsi que les signaux de certains prédateurs 3, activer les neurones sensoriels voméronasal (VSN), avec des niveaux élevés de spécificité et de sensibilité 4. Au moins trois familles distinctes de récepteurs couplés aux protéines G, V1R, V2R et FPR 5-14, sont exprimés dans les neurones VNO à la médiation de la détection des indices chimiosensoriels. Pour comprendre comment l'information phéromone est codée par le VNO, il est essentiel d'analyser les profils de réponse du VSN individu à différents stimuli et identifier les récepteurs spécifiques qui interviennent dans ces réponses.
Le neuroepithelia de VNO sont enfermés dans une paire d'os vomer. La structure semi-aveugle tubulaire du VNO a une extrémité ouverte (le conduit voméronasal) la connexion àla cavité nasale. VSN étendre leurs dendrites à la partie lumen du VNO, où les indices phéromones sont en contact avec les récepteurs exprimés à des boutons dendritiques. Les corps cellulaires des VSN forme pseudo-stratifié avec couches V1R et V2R exprimé dans les couches apicales et basales, respectivement 6-8. Plusieurs techniques ont été utilisés pour surveiller les réactions des VSN aux stimuli sensoriels 4,12,15-19. Parmi ces techniques, préparation de tranches aiguës offre plusieurs avantages. Tout d'abord, par rapport à 3,17 VSN dissocié, préparations tranche de maintenir les neurones dans leur morphologie natif et les dendrites des cellules restent relativement intactes. Deuxièmement, les corps cellulaires des VSN sont facilement accessibles en tranche coronaire du VNO pour permettre des études d'électrophysiologie et des expériences d'imagerie par rapport à l'épithélium entier et l'ensemble de montage des préparations 12,20. Troisièmement, cette méthode peut être combinée avec les techniques de clonage moléculaire pour permettre l'identification du récepteur.
La stimulation sensorielle provoque une forte affluence de Ca 2 + dans VSN qui est indicatif de 4,21 activation du récepteur. Nous avons donc développer des souris transgéniques qui expriment G-camp2 dans les neurones olfactifs sensoriels, y compris le VSN 15,22. La sensibilité et la nature génétique de la sonde facilitent grandement Ca 2 + des expériences d'imagerie. Cette méthode a permis d'éliminer le processus de chargement colorant utilisé dans les études précédentes 4,21. Nous employons également un système de livraison ligand qui permet l'application de divers stimuli pour les tranches de VNO. La combinaison des deux techniques nous permet de suivre simultanément plusieurs neurones en réponse à un grand nombre de stimuli. Enfin, nous avons établi un pipeline d'analyse semi-automatique pour faciliter le traitement de l'image.
Protocole
1. Préparation de la solution
- Préparer R1 10X, 10X et 10X R2 R3 solutions en fonction de la table.
R1Produits chimiques MW (g / mol) mM (1X) Stock 10X (g / L) NaCl 58,44 125 73,05 KCl 74,55 2.5 1,86 MgCl 2 1 M d'actions 1 10 ml CaCl 2 · 2H 2 O 147,02 2 2,94 NaH 2 PO 4 · H 2 O 137,99 1,25 1,72
R2Chimique MW (g / mol) mM (1X) Stock 10X (g / L) NaHCO 3 84,01 25 21
R3Produits chimiques MW (g / mol) mM (1X) Stock 10X (g / L) NaCl 58,44 125 73,05 KCl 74,55 2.5 1,86 MgCl 2 1 M d'actions 2 20 ml CaCl 2 · 2H 2 O 147,02 2 2,94 HEPES 1 M d'actions 5 50 ml - Faire 1 litre de la souris artificielle liquide céphalo-rachidien (MACSF) le jour de l'expérience en mélangeant 100 ml de R1 10X et 100 ml de R2 10X à l'eau bidistillée (DDW) et add 1,8 g de dextrose (finale 10 mM). Cette méthode de préparation empêche la précipitation du carbonate de calcium à pH élevé. L'osmolarité de la MACSF est autour de 310-315 mOsm / L. Ajustez l'osmolarité de dextrose ou de l'eau si nécessaire. Aérer la solution avec Carboxygen de gaz (95% d'oxygène et de dioxyde de carbone de 5%) pour au moins 30 minutes avant d'ajuster le pH de la solution à 7,2-7,4.
- Faire 1 litre de solution de Ringer, le jour de l'expérience en mélangeant 100 ml de R2 10X et 100 ml de R3 10X dans DDW et ajouter 1,8 g de dextrose (10 mM). L'osmolarité et le pH de la solution de Ringer devrait être similaire à ceux de la MACSF. Aérer la solution avec du gaz Carboxygen.
- Préparer 4% d'agarose de fusion bas (LMA), soit dans la MACSF ou de solution de Ringer. Aliquoter la fondue d'agarose dans des tubes Eppendorf et stocker à 4 ° C jusqu'à utilisation. LMA, qui est composé de polysaccharide purifié, reste fluide à 37 ° C et se solidifie rapidement à température inférieure à 25 ° C. Ces propriétés rendent idéal pour l'intégration VNO et la physiologie des tissus vivants. Autres matériaux impurs, tels que l'agar, ne devrait pas être le choix pour expérimenter les tissus vivants en tant que composants non caractérisés peuvent interférer avec la réponse neuronale.
- Préparer des stimuli phéromone dans la solution de Ringer. Pour l'urine de souris, dilution 1:100 donner lieu à des réponses robustes.
2. Préparation de la tranche VNO
- Avant de sacrifier l'animal, mettre deux tubes de LMA sur un bloc thermique et régler la température à> 60 ° C pour faire fondre l'agarose. Une fois que le gel se liquéfie, le transfert des tubes à un bloc de 37 ° C chaleur.
- Décapitez une souris G-camp2 suivants CO 2 euthanasie. Couper les os mandibulaire avec des ciseaux pour enlever la mâchoire inférieure. Décollez le tissu palatin striée supérieure pour exposer la cavité nasale (figure 1A). Séparez les mâchoires en insérant une lame de bistouri entre les deux incisives. Retirez délicatement les mâchoires d'exposer VNO. À ce stade, le VNO entier peut être enlevé de ncavité ASAL en appuyant sur l'os de la queue (figure 1B). Transférer le VNO au froid MACSF solution oxygénée immédiatement.
- Sous champ de dissection, séparer les deux VNOs en utilisant la pointe d'une pince # 5 glisser doucement le long du mur d'os septale (figure 1C). Peler l'os vomer qui enveloppe le tissu VNO. Soulevez doucement le tissu entier VNO de la cavité osseuse. Un soin extrême doit être pris dans cette étape de ne pas endommager le neuroépithélium. Petits fragments d'os à gauche sur la surface du tissu doit être enlevé complètement avant incorporation. Fragments à gauche sur le tissu peut être attrapé par la lame de coupe pour tirer le tissu hors du bloc d'agarose.
- Utilisez la pince pour tenir l'extrémité postérieure du tissu VNO et doucement submerger dans l'agarose fondu (figure 1D). Refroidir rapidement le tube sur la glace pour solidifier l'agarose. Le processus d'enrobage et de refroidissement devrait prendre moins de 2 minutes.
- VF300 trancheuse tissus (Precisionary Instrments, Greenville, Caroline du Nord) est utilisé pour faire des sections. Couper le bloc d'agarose contenant le VNO en forme et coller sur le support papier (figure 1E et F). Insérez le support de tissu dans le cylindre de métal et remplir la chambre restant avec LMA supplémentaires. Une fois que le LMA se solidifie sur la glace, procéder à sectionner immédiatement. Alimentation froide MACSF oxygénée dans la chambre de sectionnement et de commencer à couper à 180-200 um d'épaisseur par tranche. Réglez la vitesse d'avancement et de la fréquence de vibration de sorte que le tissu n'est pas compressé pendant la coupe et VNO ne tombe pas de l'agarose. Recueillir et transférer les tranches sectionné pour chambre d'incubation MACSF (figure 2A). Les tranches sont viables pendant 6-8 heures dans la MACSF oxygénée à la température ambiante. Figure 2B et C montrent des images DIC et deux photons d'une tranche G-camp2 VNO, respectivement.
3. Imagerie chambre de mise en place
- Placez la tranche de VNO dans le milieu de la perfusionchambre (Siskiyou, Grants Pass, OR) et maintenez la tranche vers le bas avec un point d'ancrage tranche (Warner Instruments, Hamden, CT) (figure 3A). Les fils de l'ancre ne doit appuyer contre la partie de la tranche de LMA, mais pas le tissu VNO. Oxygénés MACSF est livré à la chambre de perfusion à travers le port d'entrée à ~ 100 l / sec et le liquide est drainé par une aiguille d'aspiration via le port de sortie pour fournir un flux continu de nouvelles MACSF (figure 3A et B).
- Remplir une seringue de 30 ml avec une solution de Ringer et le serrer à la pompe seringue (New Era Pump Systems, Farmingdale, NY). Réglez la vitesse de la pompe à 300-600 l / min pour fournir un flux continu de solution de Ringer sur la tranche (figure 3C).
- Connectez la sortie de la sonnerie des à une injection HPLC boucle (Chromtech, Apple Valley, MN) (figure 3D). Taille de la boucle différentes peuvent être sélectionnées pour un contrôle précis du volume livré. Nous utilisons une boucle de 20 pl dans our des expériences. Le contrôle en boucle d'injection a deux voies d'écoulement (figure 3F). Lors de la "charge" de position, des échantillons peuvent être chargés dans la boucle d'échantillonnage avec une seringue de précision Hamilton. Sorties de l'échantillon en excès de la boucle d'échantillonnage par la sortie des déchets. La solution de Ringer injecté par la pompe à seringue contourne la boucle d'échantillonnage et va directement à la sortie, qui est relié à la pointe de perfusion (figure 3A et E). Au «injection» de position, la solution de la pompe traverse la boucle d'échantillonnage et de pousser les stimuli dans la prise (figure 3F). Avant l'expérience d'imagerie, des bulles d'air doit être chassé pour assurer la fluidité du liquide de perfusion. Autres commerciales ou personnalisées de systèmes d'injection faite peut aussi être mis en œuvre pour la livraison de relance.
- Ajuster la pointe de perfusion sous une lentille 5X ou 10X pour que la pointe est d'environ 1 mm de distance de la tranche VNO.
- Quand un système de perfusion nouvelle configuration, il est conseillé de mesurer le temps de retard d'échantillon et duranttion avec un colorant fluorescent. Charge colorant rhodamine 6G 0,1% dans la boucle d'échantillon et placez la vanne d'injecter position à 5 secondes après le début de l'acquisition des images (figure 3F). Le signal fluorescent est détecté entre 10-30 secondes. La courbe lisse du signal fluorescent indique également qu'il ya peu de turbulence généré sous la lentille de trempage et que la perfusion adéquate de la MACSF oxygénée atteint la tranche.
4. Laps de temps d'imagerie
- Nous utilisons le Zeiss AxioSkope FS2 microscope avec un 10x ou 20x eau plongeant lentilles pour l'imagerie laps de temps. Passe-bande standard GFP filtre (450-490nm) est utilisé pour le G-camp2 signaux. Les images épifluorescence sont acquises par une caméra CCD (GRH Zeiss) avec 1x1 ou 2x2 binning selon les niveaux d'expression de G-camp2.
- Réglez la vitesse d'acquisition d'une image par seconde. Réglez l'intensité de la lumière afin de minimiser le blanchiment des signaux G-camp2 et des dommages aux cellules photo. Pour chaque expérience, nous normalement acquérir une pile d'images 60-cadre (~ 60-70 secondes). Placez la vanne à la position d'injection à un point de temps spécifique (par exemple, 5 secondes dans la figure 3F) pour un ensemble d'expérience pour obtenir un délai de temps cohérente dans tous les essais.
- Effectuer un essai au moyen d'une solution de Ringer comme stimulus. Réajuster la configuration de perfusion si le mouvement d'artefact est introduit lors de l'injection de l'échantillon.
- Effectuer un contrôle positif courir avec l'urine de souris dilué à 1:100 dans une solution de Ringer. Le typique maximale AF / F valeur de G-camp2 réponse à l'urine de souris se situe autour de 20-40%. Si nécessaire, on peut confirmer la viabilité de la tranche en livrant 10 mM de KCl dans le Ringer pour stimuler les tranches à la fin de l'expérimentation.
- Laver la seringue Hamilton dans la solution de Ringer au moins trois fois après le chargement d'un stimulus. Laver la boucle d'échantillonnage avec une solution de Ringer au moins trois fois entre les différents stimuli. Ces étapes de prévenir la contamination croisée entre différeéchantillons NT.
- Attendre de 4-10 min pour le VSN à récupérer avant d'appliquer le stimulus suivant.
5. L'analyse des données
- Effectuer l'enregistrement d'images de toutes les images acquises à partir d'une tranche. Nous utilisons un script personnalisé écrit VBA dans AxioVision (Carl Zeiss, l'Amérique du Nord) pour automatiser ce processus. Toutes les trames d'image au sein de la même expérience sont enregistrées contre un cadre de référence choisi commune avec élastique d'inscription (figure 4A). Elastique d'inscription, également connu comme l'enregistrement non linéaire, est une catégorie de la technique de recalage d'images soulignant la transformation d'une image cible non rigidement à une image de référence. Ici nous avons utilisé la mise en œuvre du AxioVision.
Ce cadre de référence est choisie de façon arbitraire par les cheminées de l'image. - Effectuer la soustraction d'image pour identifier les cellules qui répondent. Nous utilisons personnalisée macros écrites en ImageJ v1.42 ( http://rsb.info.nih.gov/ij/ , NIH, Bethesda, MD) pour automatiser ce processus. Une image de projection minimale est généré pour chaque pile. Répondant cellules émerger après la projection minimale est soustraite de la première pile (figure 4B).
- Identifier région d'intérêt (ROI) des piles de soustraire et d'obtenir les coordonnées en utilisant le ROI Multi-mesures plugin de ImageJ. Traiter toutes les piles pour une expérience et enregistrer toutes les coordonnées dans le ROI une liste maîtresse ROI (figure 4C).
- Utilisez la liste principale ROI pour mesurer les réponses cellulaires à partir des piles d'images brutes avec la coutume écrit macro et le plugin Multi-mesures d'ImageJ (figure 4D). Courbes de réponse des parcelles et heatmap en Matlab (Mathworks Inc, Natick, MA).
6. Les résultats représentatifs
Un exemple de l'expérience d'imagerie utilisant VNO échantillons d'urine recueillis à partir de quatre souris individu est montré dans la figure 5. La tranche répond à la stimulation d'urine avec p diversifiéeConstantes de l'activation. Environ 80 cellules sont identifiées montrant réponse à au moins l'un des stimuli d'urine et de leur réponse AF / F valeurs sont tracées dans le heatmap (figure 5A). Les traces de réponse des cellules 1, 2 et 3 sont tracées dans la figure 5B montrant l'activation cours du temps par des stimuli d'urine. Cellule 1 affiche la réponse à la fois des échantillons d'urine des femmes, mais pas les échantillons masculin, tandis que la cellule 2 montre les tendances opposées de l'activation et répond aux deux échantillons mâles seulement. Cellule 3 est activé par les deux échantillons individuels masculins et féminins. Les cellules 1 et 2 montrent la réponse caractéristique du sexe des indices spécifiques dans l'urine 15.
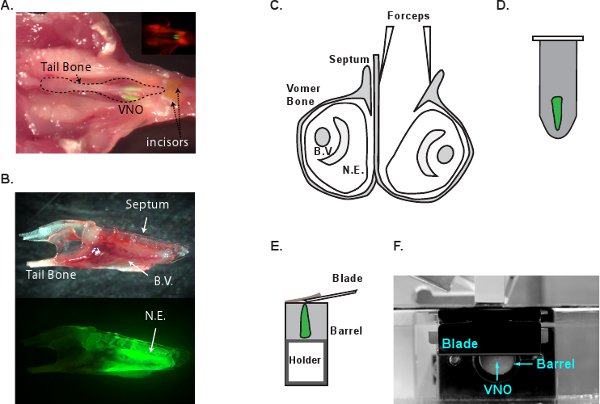
Illustration schématique figure 1 du processus de dissection VNO. A. La localisation anatomique de VNO dans la tête de la souris. La tête d'une souris G-camp2 a été disséqué et est mis à l'envers avec le t molleémission retirée de la bouche, pour exposer le VNO. Inlet montre une image de fluorescence de la même image. Le neuroepithelia du VNO sont vert clair. B. Une vue latérale de la VNO isolé qui est enfermé dans l'os vomer (en haut) et l'image fluorescente de la même VNO (en bas). C. Une vue coronale du VNO et la dissection processus. Un VNO est séparé du septum et l'os vomer peut alors être enlevé pour sortir le neuroépithélium. D. VNO est intégré dans l'EMT. E. Le bloc intégré est collé à la porte de tissu pour la coupe. Le titulaire du tissu est avancé à 180-200 um par tranche poussant le bloc d'agarose hors du canon en métal pour la coupe. La lame de coupe est placé près du fût métallique. Vue latérale du système F. VF300 tissus trancheuse. BV, des vaisseaux sanguins. NE, neuroépithélium.
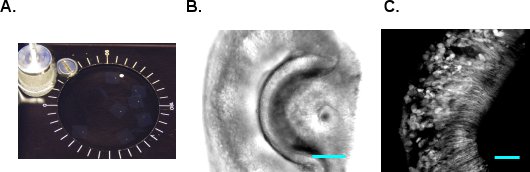
Figure 2 tranches de VNO. A. tranches VNO sont maintenus dans la MACSF oxygénée à la température ambiante. B. Une image DIC de la tranche de VNO. C. Une image 2-photon de la VNO du G-camp2 souris. La barre d'échelle, 50 um.
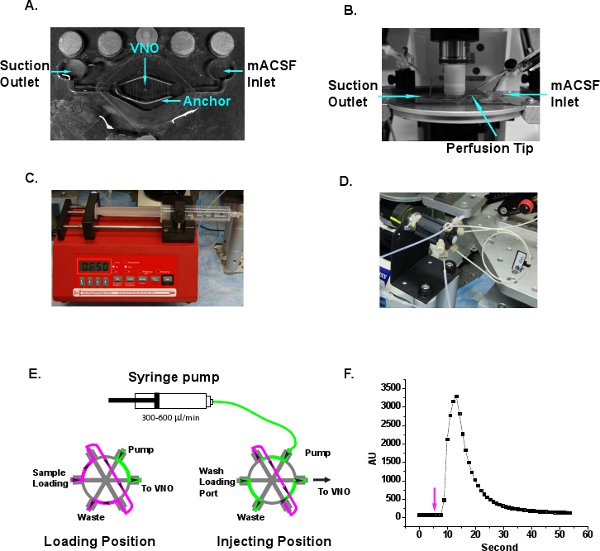
Figure 3 Illustration de configuration du système de perfusion. A. Une chambre de perfusion typiques avec entrée et sortie. Tranche de VNO est positionné au centre de la chambre et enfoncé avec un point d'ancrage des tissus. Les fils sont retirés du milieu de l'ancre le tissu de sorte que le tissu VNO n'est pas pressé. B. La chambre de perfusion est placée sur la scène sous l'objectif de microscope trempage. L'entrée MACSF, l'aspiration de sortie et la pointe de perfusion sont indiqués. C. La pompe seringue seul baril fournit flux continu de Ringer à la pointe de perfusion. D. Le Inje HPLCsystème en boucle ction est adoptée pour le chargement de relance de l'échantillon pratique et d'injection. E. Schéma illustration du sens d'écoulement de chargement et de postes d'injection. Ringer, vert. L'échantillon de stimulation, magenta. Les flèches indiquent la direction du flux. F. Delay et laver la mesure du temps du système de perfusion. Rhodamine 6G colorant fluorescent est chargé à la boucle d'échantillonnage et la vanne est passé à la position d'injection de seconde 5, ce qui est indiqué par une flèche. Le changement de signal fluorescent est détecté entre 10-30 secondes et diminue ensuite.

Figure 4 pipelines de traitement d'image. A. Toutes les trames d'image pour une tranche sont enregistrées contre un cadre de référence. B. Soustraction de projection minimale d'une pile de ses images brutes. Répondant cellules deviennent importants après soustraction. C. RIO sont sélectionnés et leurs coordonnées sont regroupées dans la liste principale. D. Mesure des cellules répondant à l'aide liste principale ROI de pile premières.

Figure 5 Un représentant du G-camp2 VNO imagerie expérience. A. La réponse heatmap AF / F à partir d'une tranche stimulées par l'urine masculine et féminine individuelle. Les échantillons d'urine sont prélevés chaque souris mâles et femelles. Axe X, répondant cellules identifiés à partir de la tranche. L'axe Y, des échantillons d'urine utilisés dans l'expérience. Barre de couleur indique la valeur AF / F. Sûr B. Le temps de réponse de 3 cellules représentant marquée flèches indiquent A. moment de l'application de relance. F-FVB, femelle FVB; F-ABC, ABC femmes; M-FVB, mâle FVB; M-BL6, mâle C57BL / 6.
Table des réactifs spécifiques et des équipements:
| Nom de laréactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| chambre de perfusion | Siskiyou | PC-H | horizontale |
| tranche de retenue | Warner Instruments | SHD-22cl | |
| détenteur de ports perfusion | ALA Scientific, Inc | MPIOH-S | |
| pompe à seringue | New Era Pump Systems, Inc | NE-300 | |
| Robinet basse pression d'injection | Chromtech | V-451 | |
| Tube en PEEK | Chromtech | 1531 | 1 / 16 "OD, ID 0.25mm |
| Boucle d'échantillon PEEK | Chromtech | 1803 | 20 pl |
| Seringue Hamilton | Chromtech | 80630 | 100 uL |
Discussion
La majorité des récepteurs voméronasal (VRS) restent comme des récepteurs orphelins depuis leur découverte par Dulac et Axel 5. Les ligands de ces récepteurs de phéromones chimiosensoriels et leurs rôles dans la médiation de comportements animaux ne sont pas bien comprises. Jusqu'à présent, une seule paire de ligand / récepteur, le peptide ESP1 et son récepteur correspondant, Vmn2r116 (V2Rp5), a été identifié et démontré pour transmettre des informations spécifiques à 19,23 ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
We thank Andrea Moran together with members of Lab Animal Service Facility (LASF) at Stowers Institute for their excellent support on animal husbandry and technical services. This work is supported by funding from Stowers Institute and the NIH (NIDCD 008003) to CRY. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institute on Deafness and Other Communication Disorders or the National Institutes of Health. U.S. patent pending for the tetO-G-CaMP2 mice for Stowers Institute, CRY and LM.
Références
- Birch, M. C. . Pheromones. , (1974).
- Wyatt, T. D. Pheromones and animal behaviour : communication by smell and taste. , (2003).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141, 692-703 (2010).
- Leinders-Zufall, T. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405, 792-796 (2000).
- Dulac, C., Axel, R. A novel family of genes encoding putative pheromone receptors in mammals. Cell. 83, 195-206 (1995).
- Herrada, G., Dulac, C. A novel family of putative pheromone receptors in mammals with a topographically organized and sexually dimorphic distribution. Cell. 90, 763-773 (1997).
- Matsunami, H., Buck, L. B. A multigene family encoding a diverse array of putative pheromone receptors in mammals. Cell. 90, 775-784 (1997).
- Ryba, N. J., Tirindelli, R. A new multigene family of putative pheromone receptors. Neuron. 19, 371-379 (1997).
- Pantages, E., Dulac, C. A novel family of candidate pheromone receptors in mammals. Neuron. 28, 835-845 (2000).
- Zhang, X., Rodriguez, I., Mombaerts, P., Firestein, S. Odorant and vomeronasal receptor genes in two mouse genome assemblies. Genomics. 83, 802-811 (2004).
- Liberles, S. D. Formyl peptide receptors are candidate chemosensory receptors in the vomeronasal organ. Proc. Natl. Acad. Sci. U.S.A. 106, 9842-9847 (2009).
- Riviere, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459, 574-577 (2009).
- Yang, H., Shi, P., Zhang, Y. P., Zhang, J. Composition and evolution of the V2r vomeronasal receptor gene repertoire in mice and rats. Genomics. 86, 306-315 (2005).
- Rodriguez, I., Punta, D. e. l., Rothman, K., Ishii, A., T, ., Mombaerts, P. Multiple new and isolated families within the mouse superfamily of V1r vomeronasal receptors. Nat. Neurosci. 5, 134-140 (2002).
- He, J., Ma, L., Kim, S., Nakai, J., Yu, C. R. Encoding gender and individual information in the mouse vomeronasal organ. Science. 320, 535-538 (2008).
- Holy, T. E., Dulac, C., Meister, M. Responses of vomeronasal neurons to natural stimuli. Science. 289, 1569-1572 (2000).
- Chamero, P. Identification of protein pheromones that promote aggressive behaviour. Nature. 450, 899-902 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437, 898-901 (2005).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
- Leinders-Zufall, T. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306, 1033-1037 (2004).
- He, J. Distinct signals conveyed by pheromone concentrations to the mouse vomeronasal organ. J. Neurosci. 30, 7473-7483 (2010).
- Haga, S. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466, 118-122 (2010).
- Boschat, C. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5, 1261-1262 (2002).
- Hendel, T. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in. 28, 7399-7411 (2008).
- Pologruto, T. A., Yasuda, R., Svoboda, K. Monitoring neural activity and [Ca2+] with genetically encoded Ca2+ indicators. J. Neurosci. 24, 9572-9579 (2004).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front Neural Circuits. 1 (3), (2007).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon