Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Imaging neuronalen Antworten in Scheiben Zubereitungen von Vomeronasalorgan Ausdruck eines genetisch kodierte Kalzium-Sensor
In diesem Artikel
Zusammenfassung
Die Vomeronasalorgan (VNO) erkennt Intraspezies chemischen Signalen, die sozialen und reproduktiven Informationen zu vermitteln. Wir haben Ca2 +-Imaging durchgeführt Experimente mit transgenen Mäusen, die G-camp2 in VNO Gewebe. Dieser Ansatz erlaubt es uns, die komplizierten Reaktionsmuster des vomeronasalen Neuronen eine große Anzahl von Pheromon-Stimuli zu analysieren.
Zusammenfassung
Die Vomeronasalorgan (VNO) erkennt chemosensorischen Signale, die Informationen über die sozialen, sexuellen und reproduktiven Status der Individuen innerhalb der gleichen Spezies 1,2 tragen. Diese innerartliche Signale, die Pheromone, sowie Signale von einigen Räubern 3, aktivieren Sie die vomeronasalen sensorischen Neuronen (VSNs) mit hoher Spezifität und Empfindlichkeit 4. Mindestens drei verschiedene Familien von G-Protein-gekoppelte Rezeptoren, V1R, V2R und FPR 5-14, sind in VNO Neuronen exprimiert, um den Nachweis der chemosensorischen Cues zu vermitteln. Um zu verstehen, wie Pheromone Informationen des VNO codiert ist, ist es entscheidend, um die Antwort Profile einzelner VSNs auf verschiedene Reize zu analysieren und die spezifischen Rezeptoren, die diese Reaktionen zu vermitteln.
Die neuroepithelia des VNO sind in ein Paar Vomer Knochen umschlossen. Die halb-blind röhrenförmige Struktur des VNO hat ein offenes Ende (das vomeronasale Kanal) eine Verbindung zuder Nasenhöhle. VSNs erweitern ihre Dendriten zum Lumen Teil des VNO, wo die Pheromon-Signale sind in Kontakt mit den Rezeptoren auf der dendritischen Knöpfen zum Ausdruck gebracht. Die Zellkörper der VSNs Form pseudo-geschichteten Lagen mit V1R und V2R in den apikalen und basalen Schichten jeweils 6-8 ausgedrückt. Verschiedene Techniken wurden verwendet, um Antworten VSNs auf Sinnesreize 4,12,15-19 überwachen. Unter diesen Techniken bietet akuten Scheibe Vorbereitung mehrere Vorteile. Erstens, im Vergleich zu trennen VSNs 3,17 pflegen Scheibe Vorbereitungen der Neuronen in ihrem nativen Morphologie und die Dendriten der Zellen bleiben relativ intakt. Zweitens sind die Zellkörper der VSNs leicht zugänglich in koronare Schicht des VNO zu elektrophysiologischen Studien-und Imaging-Experimente ermöglichen, um die ganze Epithel-und Ganzkörper-Mount-Präparaten 12,20 verglichen. Drittens kann diese Methode mit molekularen Klonierungstechniken kombiniert werden, um Rezeptor-Identifizierung zu ermöglichen.
Sensorische Stimulation löst starke Ca 2 +-Einstrom in VSNs, die indikativ für Rezeptor-Aktivierung 4,21 ist. Wir entwickeln so transgene Mäuse, die zum Ausdruck G-camp2 in den Riechzellen, einschließlich der VSNs 15,22. Die Empfindlichkeit und der genetischen Beschaffenheit der Sonde erheblich erleichtern Ca 2 +-Imaging Experimente. Diese Methode hat den Farbstoff Ladevorgang in früheren Studien 4,21 verwendet eliminiert. Darüber hinaus setzen wir ein Ligand Delivery System, Anwendung verschiedener Reize ermöglicht, die VNO Scheiben schneiden. Die Kombination der beiden Techniken ermöglicht es uns, mehrere Neurone gleichzeitig überwachen in Reaktion auf eine große Anzahl von Reizen. Schließlich haben wir eine semi-automatisierte Analyse-Pipeline für die Bildverarbeitung unterstützen soll.
Protokoll
1. Zubereitung der Lösung
- Bereiten 10X R1, R2 10X und 10X R3 Lösungen entsprechend der Tabelle.
R1Chemicals MW (g / mol) mm (1x) 10fach (g / L) NaCl 58,44 125 73,05 KCl 74,55 2,5 1,86 MgCl 2 1 M lieferbar 1 10 ml CaCl 2 · 2H 2 O 147,02 2 2,94 NaH 2 PO 4 · H 2 O 137,99 1,25 1,72
R2Chemikalie MW (g / mol) mm (1x) 10fach (g / L) NaHCO 3 84,01 25 21
R3Chemicals MW (g / mol) mm (1x) 10fach (g / L) NaCl 58,44 125 73,05 KCl 74,55 2,5 1,86 MgCl 2 1 M lieferbar 2 20 ml CaCl 2 · 2H 2 O 147,02 2 2,94 HEPES 1 M lieferbar 5 50 ml - Machen Sie 1 Liter Maus künstliche Cerebrospinalflüssigkeit (MACSF) am Tag des Experiments durch Mischen von 100 ml 10X R1 und 100 ml 10X R2 in doppelt destilliertem Wasser (DDW) und Ad-d 1,8 g Dextrose (final 10 mM). Diese Herstellungsmethode verhindert Calciumcarbonat Niederschläge bei hohen pH-Wert. Die Osmolarität MACSF ist etwa 310-315 mOsm / L. Passen Sie die Osmolarität mit Dextrose oder Wasser, wenn nötig. Aerate die Lösung mit Carboxygen Gas (95% Sauerstoff und 5% Kohlendioxid) für mindestens 30 Minuten vor der pH-Wert der Lösung auf 7,2-7,4.
- Machen Sie 1 Liter Ringer-Lösung auf den Tag des Experiments durch Mischen von 100 ml 10X R2 und 100 ml 10X R3 in DDW und fügen 1,8 g Dextrose (10 mM). Die Osmolarität und pH-Wert von Ringer-Lösung sollte so ähnlich wie die des MACSF. Aerate die Lösung mit Carboxygen Gas.
- Bereiten Sie 4% niedrig schmelzender Agarose (LMA) in entweder MACSF oder Ringer-Lösung. Aliquot der geschmolzenen Agarose in Eppendorf-Röhrchen und lagern bei 4 ° C bis verwenden. LMA, die von gereinigtem Polysaccharid besteht, bleibt flüssig bei 37 ° C und erstarrt schnell bei Temperaturen unter 25 ° C. Diese Eigenschaften machen es ideal für die Einbettung von VNO und lebendem Gewebe Physiologie. Andere unreine Materialien, wie Agar, sollte nicht die erste Wahl für lebendes Gewebe Experiment als charakterisierte Komponenten können mit neuronalen Reaktion stören.
- Bereiten Pheromon Reize in Ringerlösung. Für Maus Urin, geben 1:100 Verdünnung entstehen robuste Antworten.
2. Vorbereitung der VNO Scheibe
- Bevor das Tier zu opfern, legte zwei Röhren von LMA auf einem Heizblock und die Temperatur auf> 60 ° C, um die Agarose zu schmelzen. Sobald das Gel verflüssigt, übertragen Sie die Rohre zu einem 37 ° C Hitze zu blockieren.
- Enthaupten einen G-camp2 Maus folgende CO 2 Euthanasie. Schneiden Sie den Unterkiefer Knochen mit einer Schere, um den Unterkiefer zu entfernen. Ziehen Sie die ridged oberen Gaumen Gewebe zu entlarven die Nasenhöhle (Abbildung 1A). Trennen Sie die Kieferknochen durch das Einfügen eines Skalpells zwischen den beiden vorderen Schneidezähne. Entfernen Sie vorsichtig die Kieferknochen zu VNO aussetzen. An dieser Stelle kann die gesamte VNO aus dem n angehoben werdenasal Hohlraum, indem auf dem Steißbein (Abbildung 1B). Übertragen Sie die VNO zu kalt Sauerstoff MACSF Lösung sofort.
- Unter Dissektion Umfang, trennen die beiden VNOs mit der Spitze # 5 Pinzette vorsichtig entlang der Wand des Septum Knochen (Abbildung 1C) schieben. Lösen Sie den Vomers, dass die VNO Gewebe ummantelt. Heben Sie den gesamten VNO Gewebe aus der Knochenhöhle. Extreme Vorsicht ist bei diesem Schritt werden nicht auf die Neuroepithel Schäden. Kleine Knochenfragmente auf der Gewebeoberfläche links muss vollständig vor dem Einbetten entfernt werden. Fragments auf das Gewebe nach links durch das Schneidmesser gefangen werden, um das Gewebe zu ziehen aus dem Agarose-Block.
- Verwenden Sie die Pinzette, um das hintere Ende des VNO Gewebe und sanft tauchen Sie es in das geschmolzene Agarose (Abbildung 1D) zu halten. Rasche Abkühlung der Röhrchen auf Eis, um die Agarose zu festigen. Die Einbettung und Kühlung sollte weniger als 2 Minuten.
- VF300 Gewebe Allesschneider (Precisionary Instruments, Greenville, NC) wird verwendet, um Abschnitte zu machen. Schneiden Sie die Agarose Block mit dem VNO in Form und kleben Sie es auf das Gewebe Halter (Abb. 1E und F). Legen Sie die Papierrollenhalter in den Metallzylinder und füllen die restlichen Raum mit zusätzlichen LMA. Sobald die LMA erstarrt auf dem Eis, um sofort Schneiden fortzufahren. Versorgung kalte Sauerstoff MACSF in die Schnitte Kammer und fang an zu schneiden bei 180-200 mu m Dicke pro Scheibe. Passen Sie die Vorschubgeschwindigkeit und Schwingungsfrequenz, so dass das Gewebe nicht während des Schneidens und VNO fällt nicht aus dem Agarose komprimiert. Sammeln Sie und übertragen Sie die geschnittenen Scheiben zu MACSF Inkubationskammer (Abbildung 2A). Die Scheiben sind für 6-8 Stunden in Sauerstoff MACSF bei Raumtemperatur lebensfähig. 2B und C zeigen, DIC und 2-Photonen-Bilder von einem G-camp2 VNO Scheibe bzw..
3. Imaging Kammer eingerichtet
- Legen Sie die VNO Scheibe in der Mitte der PerfusionKammer (Siskiyou, Grants Pass, OR) und halten Sie die Scheibe nach unten mit einer Scheibe Anker (Warner Instruments, Hamden, CT) (Abbildung 3A). Die Gewinde der Anker sollte nur gegen die LMA Teil der Scheibe, nicht aber die VNO Gewebe drücken. Oxygeniertes MACSF ist es, die Perfusionskammer durch die Einlassöffnung bei ~ 100 ul / sec geliefert und die Flüssigkeit wird durch eine Saug-Nadel über die Auslaßöffnung abgelassen werden, um einen kontinuierlichen Fluss von frischen MACSF (Abbildung 3A und B) sind.
- Füllen Sie eine 30 ml Spritze mit Ringer-Lösung und klemmen Sie die Spritzenpumpe (New Era Pump Systems, Farmingdale, NY). Stellen Sie die Drehzahl der Pumpe auf 300-600 ml / min zu einem kontinuierlichen Fluss von Ringer-Lösung über die Scheibe (Abbildung 3C) bieten.
- Verbinden Sie den Ausgang der Ringer zu einem HPLC Injektionsschleife (Chromtech, Apple Valley, MN) (Abbildung 3D). Verschiedene Schleife Größe kann für eine präzise Steuerung des Volumens der Auslieferung ausgewählt werden. Wir verwenden ein 20 ul-Schleife in our Experimente. Die Injektion Steuerung verfügt über zwei Strecken fließen (Abbildung 3E). An der "load"-Position, können die Proben in die Probenschleife mit einer Hamilton Präzisionsspritze geladen werden. Überschüssige Probe verlässt die Probenschleife durch Schmutzablass. Ringer-Lösung durch die Spritzenpumpe injiziert umgeht die Probenschleife und geht direkt an die Steckdose, die auf die Perfusion Spitze (Abbildung 3A und E) angeschlossen ist. Bei "injection"-Position, fließt der Pumpe Lösung durch die Probenschleife und drücken Sie die Reize in die Steckdose (Abbildung 3E). Vor der Imaging Experiment sollte Luftblasen verjagt werden, um den reibungslosen Ablauf der Perfusionsflüssigkeit gewährleisten. Andere kommerzielle oder custom made-Einspritzsystemen kann auch für Impulse Lieferung umgesetzt werden.
- Passen Sie die Perfusion Spitze unter einem 5x oder 10x Objektiv, so dass die Spitze etwa 1 mm entfernt von der VNO in Scheiben schneiden.
- Wenn eine neue Perfusion System-Setup, ist es ratsam, die Probe Verzögerungszeit und dur messenarbeit mit Fluoreszenzfarbstoff. Legen Sie 0,1% Rhodamin 6G Farbstoff in die Probenschleife und schalten das Ventil auf Position bei 5 Sekunden spritzen nach dem Start der Bildaufnahme (Abbildung 3F). Das Fluoreszenzsignal ist zwischen 10-30 Sekunden erkannt. Die glatte Kurve der Fluoreszenz-Signal zeigt auch, dass es wenig Turbulenzen unter dem Eintauchen Objektiv und eine ausreichende Perfusion von mit Sauerstoff angereichertem MACSF erreicht die Scheibe erzeugt.
4. Zeitraffer-Aufnahme
- Wir nutzen die Zeiss AxioSkope FS2 Mikroskop mit einem 10x-oder 20x Wasser-Tauchen-Objektiv für Zeitraffer-Bildgebung. Standard-GFP Bandpassfilter (450-490nm) ist für die G-camp2 Signale verwendet. Die epifluoreszenten Bilder werden von einer CCD-Kamera (Zeiss HRM) mit 1x1 oder 2x2 Binning abhängig von der Expression von G-camp2 erworben.
- Stellen Sie die Aufnahmegeschwindigkeit auf 1 Frame pro Sekunde. Passen Sie die Intensität des Lichtes zu minimieren Ausbleichen der G-camp2 Signale und Foto-Schäden an den Zellen. Für jedes abperiment, die wir normalerweise gewinnen ein 60-Frame-Bildstapel (~ 60-70 Sekunden). Schalten Sie das Ventil der Injektion Position zu einem bestimmten Zeitpunkt (z. B. 5 Sekunden in Abbildung 3F) für eine Gruppe von Experiment, um konsistente zeitliche Verzögerung in allen Studien zu erhalten.
- Führen Sie einen Testlauf mit Ringer-Lösung als Stimulus. Re: Passen Sie die Perfusion Setup, wenn Bewegung Artefakt während der Probenaufgabe eingeführt wird.
- Führen Sie eine positive Kontrolle mit Maus Urin bei 1:100 in Ringer-Lösung verdünnt laufen. Die typische maximale &Dgr; F / F-Wert von G-camp2 Reaktion auf Maus Urin ist um 20-40%. Bei Bedarf kann man die Lebensfähigkeit der Scheibe durch Abgabe von 10 mM KCl in Ringer auf die Scheiben am Ende der Experimente stimulieren bestätigen.
- Waschen Sie die Hamilton-Spritze in Ringer-Lösung mindestens drei Mal nach dem Laden ein Stimulus. Waschen Sie die Probenschleife mit Ringer-Lösung mindestens dreimal zwischen verschiedenen Reizen. Diese Schritte verhindern Kreuzkontamination zwischen different Proben.
- Warten Sie für 4-10 min für die VSNs auf, bevor der nächste Reiz zu erholen.
5. Datenanalyse
- Führen Bildregistrierung aller Bilder aus einem Stück erworben. Wir verwenden eine speziell geschriebenen VBA-Skript in AxioVision (Carl Zeiss, Nordamerika), um diesen Prozess zu automatisieren. Alle Einzelbilder innerhalb des gleichen Experiments sind gegen einen gemeinsamen Bezugsrahmen gewählt mit elastischen Registrierung (Abbildung 4A) registriert. Elastic-Registrierung, die auch als nichtlineare Registrierung bekannt, ist eine Kategorie der Bildregistrierung Technik betont die Transformation von einem Zielbild nicht starr an einem Referenzbild. Hier haben wir die Umsetzung von AxioVision.
Dieses Bezugssystem wird willkürlich aus dem Bildstapel gewählt. - Führen Bildsubtraktion der reagierenden Zellen zu identifizieren. Wir verwenden eigens geschriebenen Makros in ImageJ v1.42 ( http://rsb.info.nih.gov/ij/ , NIH, Bethesda, MD), um diesen Prozess zu automatisieren. Eine minimale Projektion Bild ist für jeden Stapel erzeugt. Reagierenden Zellen entstehen nach dem minimalen Vorsprung von der Roh-Stacks (Abbildung 4B) subtrahiert wird.
- Identifizieren region of interest (ROI) aus dem Stapel abgezogen und erhalten die ROI-Koordinaten mit Multi-Measure-Plugin von ImageJ. Bearbeiten Sie alle Stacks für ein Experiment, und speichern Sie alle ROI-Koordinaten in einer ROI-Master-Liste (Abbildung 4C).
- Verwenden Sie die ROI-Master-Liste zu-Zell-Antworten von Roh-Image-Stacks mit speziell geschriebenen Makro-und Multi-Measure-Plugin von ImageJ (Abbildung 4D) zu messen. Plot-Wirkungs-Kurven und Heatmap in Matlab (Mathworks Inc., Natick, MA).
6. Repräsentative Ergebnisse
Ein Beispiel für die VNO Imaging Experiment mit Urinproben von vier einzelnen Mäusen gesammelt ist in Abbildung 5 dargestellt. Die Scheibe reagiert auf Urin Stimulation mit unterschiedlichen patterns der Aktivierung. Über 80 Zellen identifiziert, welche Antwort auf mindestens eine der Urin Reize und ihre Reaktion &Dgr; F / F-Werte in der Heatmap (Abbildung 5A) aufgetragen sind. Die Antwort Spuren von Zellen 1, 2 und 3 sind in Abbildung 5B zeigt den zeitlichen Verlauf Aktivierung durch Urin Reize aufgezeichnet. Cell 1 zeigt als Reaktion auf weibliche Urinproben, nicht aber die männlichen Proben, während die Zelle 2 zeigt das Gegenteil Muster der Aktivierung und reagiert sowohl auf männliche Proben. Cell 3 wird sowohl von einzelnen männlichen und weiblichen Muster aktiviert. Zellen 1 und 2 zeigen typische Reaktion auf geschlechtsspezifische Hinweise in den Urin 15.
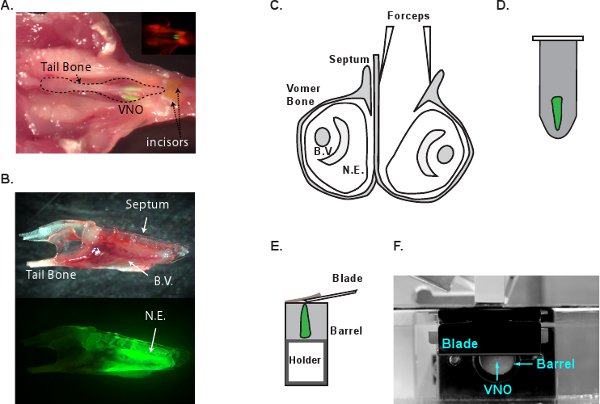
Abbildung 1 Schematische Darstellung des VNO Dissektion Prozess. A. Die anatomische Lage des VNO in der Maus den Kopf. Der Kopf eines G-camp2 Maus wurde seziert und auf den Kopf mit dem weichen t gelegtFrage aus dem Gaumen des VNO freizulegen. Inlet zeigt ein fluoreszierendes Bild das gleiche Bild. Die neuroepithelia des VNO sind leuchtend grün. B. eine Seitenansicht des isolierten VNO, dass in der Vomers (oben) und die Fluoreszenz-Bild der gleichen VNO (unten) umschlossen ist. C. A koronale Ansicht der VNO und Dissektion Prozess. Ein VNO ist von der Scheidewand getrennt und die Vomers kann dann entfernt werden, um die Neuroepithel zu befreien. D. VNO ist in LMA. E. embedded Der Embedded-Block, um das Gewebe Halter ist für das Schneiden geklebt. Der Papierrollenhalter ist bei 180-200 um pro Stück schieben die Agarose Block aus der Metall-Fass zum Schneiden fortgeschritten. Die Schneide ist eng mit dem Metallschaft positioniert. F. Seitenansicht des VF300 Gewebe Hobel-System. BV, Blutgefäß. NE, Neuroepithel.
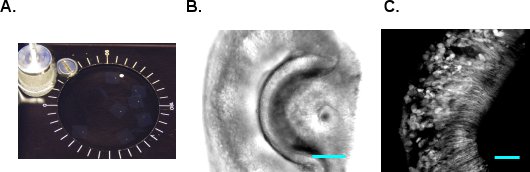
Abbildung 2 VNO Scheiben schneiden. A. VNO Scheiben sind in Sauerstoff MACSF bei Raumtemperatur gehalten. B. A DIC Bild von der VNO in Scheiben schneiden. C. A 2-Photonen-Bild des VNO von G-camp2 Maus. Scale-bar, 50 um.
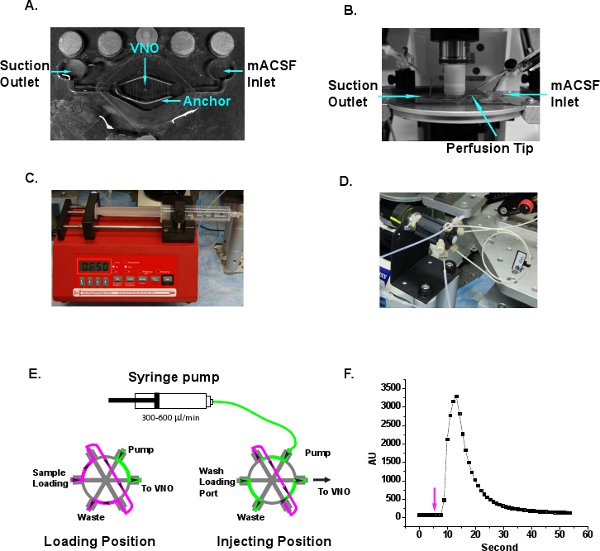
Abbildung 3 Illustration der Perfusion System-Setup. A. Eine typische Perfusionskammer mit Ein-und Auslass. VNO Scheibe befindet sich im Zentrum der Kammer positioniert und drückte sich mit einem Gewebe zu verankern. Die mittlere Gewinde sind aus dem Gewebe Anker entfernt, so dass das VNO Gewebe nicht gedrückt wird. B. Die Perfusionskammer auf Mikroskoptisch unter dem Eintauchen Ziel gesetzt. Die MACSF Einlass-, Saug-Steckdose und Perfusion Spitze angezeigt. C. Die Single Barrel Spritzenpumpe bietet kontinuierlichen Ringer durch die Perfusion Spitze. D. Die HPLC injection-Loop-System ist für die bequeme Stimulus Probe Be-und Injektion angenommen. E. Schematische Darstellung der Fließrichtung beim Be-und Injektion Positionen. Ringer, grün. Stimulus Probe, magenta. Die Pfeile zeigen die Richtung des Flusses. F. Delay und abwaschen Zeitmessung der Perfusion System. Rhodamin 6G Fluoreszenzfarbstoff ist es, die Probenschleife geladen und das Ventil ist, um die Injektion Position bei der 5. Sekunde, die mit einem Pfeil gekennzeichnet ist eingeschaltet. Das Fluoreszenzsignal Änderung wird zwischen 10-30 Sekunden und nimmt danach erkannt.

Abbildung 4 Bild-Verarbeitungs-Pipeline. A. Alle Bildrahmen für eine Scheibe gegen einen Bezugsrahmen registriert. B. Subtraktion der minimalen Vorsprung von einem Stapel von seiner rohen Frames. Reagierenden Zellen werden prominente nach Abzug. C. ROIs werden ausgewählt und ihre Koordinaten werden in Master-Liste zusammengestellt. D. Messung der reagierenden Zellen mit ROI-Master-Liste aus rohen Stapel.

Abbildung 5 Ein Vertreter G-camp2 VNO Imaging Experiment. A. Die AF / F Antwort Heatmap aus einer Scheibe mit einzelnen männlichen und weiblichen Urin angeregt. Urinproben sind von einzelnen männlichen und weiblichen Mäusen gesammelt. X-Achse, reagiert Zellen aus dem Stück identifiziert. Y-Achse, Urinproben in dem Experiment verwendet. Farbbalken zeigt die AF / F-Wert. B. Reaktionszeit innerhalb von 3 repräsentativen Zellen in A. Pfeilen markiert zeigen die Zeit der Reiz-Anwendung. F-FVB, weibliche FVB; F-CBA, weibliche CBA; M-FVB, männlichen FVB; M-BL6, männlichen C57BL / 6.
Tabelle der spezifischen Reagenzien und Geräte:
| Name derReagens | Firma | Katalog-Nummer | Kommentare (optional) |
| Perfusionskammer | Siskiyou | PC-H | horizontal |
| slice Niederhalter | Warner Instruments | SHD-22CL | |
| Perfusion Port Halterung | ALA wissenschaftlichen, Inc. | MPIOH-S | |
| Spritzenpumpe | New Era Pump Systems, Inc. | NE-300 | |
| Niederdruck-Einspritzventil | Chromtech | V-451 | |
| PEEK-Schlauch | Chromtech | 1531 | 1 / 16 "OD, 0,25 mm ID |
| PEEK-Probenschleife | Chromtech | 1803 | 20 ul |
| Hamilton-Spritze | Chromtech | 80630 | 100 ul |
Diskussion
Die Mehrheit der vomeronasalen Rezeptoren (VRS) bleiben als Orphan-Rezeptoren seit ihrer Entdeckung durch Dulac und Axel 5. Die Pheromon-Liganden für diese Chemosensoren und ihre Rollen bei der Vermittlung von Tieren Verhaltensweisen sind nicht gut verstanden. Bis jetzt hat nur ein Paar von Ligand / Rezeptor, der ESP1 Peptid und seinem verwandten Rezeptor, Vmn2r116 (V2Rp5), wurden identifiziert und gezeigt, dass bestimmte soziale Informationen 19,23 vermitteln. Ein weiterer Rezeptor, V1rb2, hat si...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Andrea Moran zusammen mit Mitgliedern der Lab Tier-Service Facility (LaSF) bei Stowers Institute für ihre hervorragende Unterstützung bei der Tierhaltung und technische Dienstleistungen. Diese Arbeit wird durch Mittel aus Stowers Institute und die NIH (NIDCD 008003) zu CRY unterstützt. Der Inhalt ist ausschließlich in der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung des National Institute on Taubheit und andere Kommunikationsstörungen oder die National Institutes of Health. US patent pending für die tetO-G-camp2 Mäuse für Stowers Institute, CRY und LM.
Referenzen
- Birch, M. C. . Pheromones. , (1974).
- Wyatt, T. D. Pheromones and animal behaviour : communication by smell and taste. , (2003).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141, 692-703 (2010).
- Leinders-Zufall, T. Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature. 405, 792-796 (2000).
- Dulac, C., Axel, R. A novel family of genes encoding putative pheromone receptors in mammals. Cell. 83, 195-206 (1995).
- Herrada, G., Dulac, C. A novel family of putative pheromone receptors in mammals with a topographically organized and sexually dimorphic distribution. Cell. 90, 763-773 (1997).
- Matsunami, H., Buck, L. B. A multigene family encoding a diverse array of putative pheromone receptors in mammals. Cell. 90, 775-784 (1997).
- Ryba, N. J., Tirindelli, R. A new multigene family of putative pheromone receptors. Neuron. 19, 371-379 (1997).
- Pantages, E., Dulac, C. A novel family of candidate pheromone receptors in mammals. Neuron. 28, 835-845 (2000).
- Zhang, X., Rodriguez, I., Mombaerts, P., Firestein, S. Odorant and vomeronasal receptor genes in two mouse genome assemblies. Genomics. 83, 802-811 (2004).
- Liberles, S. D. Formyl peptide receptors are candidate chemosensory receptors in the vomeronasal organ. Proc. Natl. Acad. Sci. U.S.A. 106, 9842-9847 (2009).
- Riviere, S., Challet, L., Fluegge, D., Spehr, M., Rodriguez, I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. 459, 574-577 (2009).
- Yang, H., Shi, P., Zhang, Y. P., Zhang, J. Composition and evolution of the V2r vomeronasal receptor gene repertoire in mice and rats. Genomics. 86, 306-315 (2005).
- Rodriguez, I., Punta, D. e. l., Rothman, K., Ishii, A., T, ., Mombaerts, P. Multiple new and isolated families within the mouse superfamily of V1r vomeronasal receptors. Nat. Neurosci. 5, 134-140 (2002).
- He, J., Ma, L., Kim, S., Nakai, J., Yu, C. R. Encoding gender and individual information in the mouse vomeronasal organ. Science. 320, 535-538 (2008).
- Holy, T. E., Dulac, C., Meister, M. Responses of vomeronasal neurons to natural stimuli. Science. 289, 1569-1572 (2000).
- Chamero, P. Identification of protein pheromones that promote aggressive behaviour. Nature. 450, 899-902 (2007).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Kimoto, H., Haga, S., Sato, K., Touhara, K. Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature. 437, 898-901 (2005).
- Holekamp, T. F., Turaga, D., Holy, T. E. Fast three-dimensional fluorescence imaging of activity in neural populations by objective-coupled planar illumination microscopy. Neuron. 57, 661-672 (2008).
- Leinders-Zufall, T. MHC class I peptides as chemosensory signals in the vomeronasal organ. Science. 306, 1033-1037 (2004).
- He, J. Distinct signals conveyed by pheromone concentrations to the mouse vomeronasal organ. J. Neurosci. 30, 7473-7483 (2010).
- Haga, S. The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature. 466, 118-122 (2010).
- Boschat, C. Pheromone detection mediated by a V1r vomeronasal receptor. Nat. Neurosci. 5, 1261-1262 (2002).
- Hendel, T. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in. 28, 7399-7411 (2008).
- Pologruto, T. A., Yasuda, R., Svoboda, K. Monitoring neural activity and [Ca2+] with genetically encoded Ca2+ indicators. J. Neurosci. 24, 9572-9579 (2004).
- Jayaraman, V., Laurent, G. Evaluating a genetically encoded optical sensor of neural activity using electrophysiology in intact adult fruit flies. Front Neural Circuits. 1 (3), (2007).
- Tian, L. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten