このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
器官切片培養におけるプルキンエ細胞の樹状突起の形態分析
要約
私たちは、器官小脳スライス培養で増殖させ、個々のプルキンエ細胞の樹状突起の形態を表示して、定量的にロバにすることを可能にするプロトコルを提示。このプロトコルは、プルキンエ細胞の樹状突起の発達のメカニズムに関する研究を推進することを意図している。
要約
彼らは矢状面で厳密に指向していて、小型げっ歯類で生後3期間で主に開発して印象的な樹の木を持っているので、プルキンエ細胞は、樹状突起発達を研究するための魅力的なモデル系である。さらに、いくつかの抗体が選択的かつ集中的に抗カルビンジンD28Kは、最も広く使用されている状態で、すべてのプロセスを含むプルキンエ細胞を標識が利用可能である。生きた細胞内で樹状突起の閲覧については、プルキンエ細胞11に選択的にEGFPを発現するマウスはジャクソンラボを介して利用できます。プルキンエ細胞の樹状ツリーの樹拡大のほとんどが実際に培養期間4中に行われているため器官小脳スライス培養細胞はプルキンエ細胞の樹状突起の開発を容易に実験的な操作を可能にする。我々はここでorganotypiで栽培プルキンエ細胞の樹状形態を表示および分析するための短い、確実かつ簡便なプロトコルを提示C小脳スライス培養。多くの目的のために、プルキンエ細胞の樹状ツリーの定量的な評価が望ましい。私たちは迅速かつ容易に抗カルビンジンステンド小脳スライス培養から決定することができる2つのパラメータ、樹状突起の大きさと分岐点の番号、に焦点を絞ります。これらの2つのパラメータは、プルキンエ細胞の樹状ツリーの変化の信頼性と敏感な指標を得ることができます。プロテインキナーゼC(PKC)活性PMAおよび代謝型グルタミン酸受容体1(mGluR1)と治療法の例を用いて、我々は樹状突起発達の違いを可視化し、定量的に評価される方法を示しています。豊富な樹木の存在の組み合わせ、選択的かつ強烈な免疫染色法、樹枝状のメカニズムを明らかにするためのプルキンエ細胞を作る強力なモデルシステムプルキンエ細胞特異的にEGFP発現と樹枝状成長とマウスモデルの期間をカバーする器官切片培養発展。
プロトコル
1。器官小脳スライス培養をセットアップする
小脳スライス培養を静的インキュベーション法10を用いて、生後8日目P(8)仔マウスから調製される。私たちの研究室では、B6CF1マウスを使用しています。いくつかの実験では、トランスジェニックマウスは、プルキンエ細胞で選択的にEGFPを発現するために使用された。スライス培養物の調製は、6仔マウスのくずのためにマウス子犬、すなわち3時間ごとに約30分かかります。すべての手順は、滅菌手術器械を持つ層流ベンチで無菌条件下で行われる。
- P8の仔マウスの小脳は実体顕微鏡を用いて氷冷調製培地(グルタ1:100含むMEM(Gibco社製商品番号11012)は、pH 7.3)中に脳から解剖されています。
- 小脳はマッキルウェーン組織チョッパーを用いて矢状方向に350μmの厚さのスライスにカットされます。
- スライスは、ミリポア細胞培養インサート(approx.6スライスに配置されている挿入、ミリポアPICM03050当たりs)と0.75ミリリットルウェルあたりのインキュベーション培地(48.35ミリリットル、MEM、25ミリリットルイーグル培地、25ミリリットルウマ血清、1ミリリットルグルタ私、滅菌10%グルコース、0.65 mlで6ウェルプレート中でインキュベートされる37℃、5%CO 2の加湿雰囲気下で溶液、pH 7.3)℃すべての組織培養試薬は、Gibco、Invitrogen社からのものであった。
- 薬理学的治療は、通常、培地に所望の濃度で薬剤を追加することにより、in vitroでの3日間(DIV3)で開始されます。ホルボール12 - ミリステート13 - アセテート(PMA)および(RS)-3,5 - ジヒドロキシ(DHPG)はTocris、英国からのものであった。多くの薬は、原液を調製するためのDMSOまたはエタノールの使用を必要とするので(例えばPMA)の世話を培養培地に添加し、溶媒の合計量(ウェルあたり7.5μl)の1%を超えないように注意する必要があります。薬は、培地ごとに2 回または3日目の変化と一緒に更新されます。
2。固定とImmunos器官小脳スライス培養の寧
小脳の重要な利点は、抗体が特異的にかつ明るく校長小脳ニューロン、すなわちプルキンエ細胞と顆粒細胞を染色することが可能であることです。プルキンエ細胞の樹枝状形態は、抗カルビンジンD28Kを用いた免疫染色によって明らかにすることができる。
- 文化の定着のために、培地を除去し、0.1Mリン酸緩衝液(pH7.4)中冷4%パラホルムアルデヒド3mlをよく膜に付着した小脳スライスでMillicell挿入物を含むにつき慎重に追加されます。次に、培養物を固定液を除去し、培養物はリン酸緩衝液ですすぎ、一晩固定されています。
- 以下の抗体を免疫染色に使用されます:選択してプルキンエ細胞とモノクローナル抗NeuNを可視化するための1:1000でウサギ抗カルビンジンD-28K(Swant、ベリンツォーナ、スイス)(ケミコン、Millipore)を1:500に選択的granuを可視化するためのル·セル12。ウサギ抗GFPはアブカム、英国からのものであった。蛍光二次抗体Alexaのは、Molecular Probes、Invitrogen社からのものであった。
- 培養物は、0.1 Mリン酸緩衝液(ブロッキング溶液)で3%正常ヤギ血清+0.3%トライトンX100を追加することで、透過処理とブロックされます。抗カルビンジンD28Kと抗NeuNをブロッキング溶液で希釈し、培養物をわずかに攪拌下で一晩4℃の抗体を含むブロッキング溶液でインキュベートする。全ての希釈は、%(v / v)のように示されており、トリトンX100、ピペッティングを容易にするために、10%の原液から取られます。
- 培養物を、0.1 Mリン酸緩衝液で3回リンスしてから、適切な二次抗体、例えばヤギ抗ウサギアレクサ568およびヤギ抗マウスアレクサ488とインキュベートすると、+0.1%トライトンX100で2時間0.1Mリン酸緩衝液で1:500に希釈室温。次に、培養物を0.1Mリン酸緩衝液で3回洗浄する。
- 染色された切片を培養物から除去されよく絵筆ととSuperfrostプラスガラススライド上にマウントされており、適切な取り付け媒体、例えばMOWIOLで封入。文化は今落射蛍光装置との定期的な顕微鏡や共焦点顕微鏡を使用して確認できます。
3。器官スライス培養における個々のプルキンエ細胞の観察
- カルビンジンD28Kで免疫染色した後、プルキンエ細胞の完全な細胞質が明るく樹状突起と軸索を含む染色される。プルキンエ細胞層のプルキンエ細胞の高密度配置のために、ほとんどのプルキンエ細胞の樹状アーバーは、それが困難な1個々のセルの完全なあずまやを勉強することがオーバーラップしています。しかし、準備プロセス中にいくつかのプルキンエ細胞の細胞死が原因で、多くの文化で、一部の地域では、プルキンエ細胞の減少した密度で存在している。そのような地域では、他のCと重ならない完全な樹状あずまやとプルキンエ細胞を見つけることが可能ですells。これらの細胞は、樹状アーバはゴルジ染色に匹敵する品質で表示および分析することができます。小脳プルキンエ細胞はカルビンジンD28Kを表現する唯一の細胞型であるため、細胞はまた、プルキンエ細胞として同定されています。
- 代替方法はB6由来培養を使用することです。FVB-TG(Pcp2-EGFP)146.244Yuza / Jマウス(ここPcp2-EGFPマウスと呼ばれる、ジャクソン研究所から入手可能)は、プルキンエ細胞特異的L7プロモーター11の下でEGFPを発現する。プルキンエ細胞を生きたような切片培養におけるEGFPの発現によって可視化することができる。それは時間をかけて、単一細胞の樹枝状形態をフォローすることも可能です。あるいは、固定後、EGFP発現プルキンエ細胞は抗GFP抗体を用いて免疫染色することができます。どちらの方法でも、器官培養ではプルキンエ細胞の樹状突起、細胞体と軸索を染色するのに適しています。 Pcp2-EGFPマウスのL7プロモーターはすべてのプルキンエ細胞で発現し、vがありますされていないため、マウス(Kapfhammer、データは示さず)との間のプルキンエ細胞を発現の頻度でariationsは、これらのマウス由来の文化は、簡単に他のプルキンエ細胞の樹状突起の木と重なって樹木を持ってプルキンエ細胞を可視化し、測定するために作るスライス。樹木をオーバーラップさせて、隣接するプルキンエ細胞がGFPを発現する( 図1A、B)がいないとき、そのような樹の木は、個別に表示することができます。
4。プルキンエ細胞の樹状ツリーのサイズと分岐点の測定
- 樹状突起の大きさ。木は他の細胞と重複されていない場合はプルキンエ細胞の蛍光標識で指定された細胞の樹状突起の大きさを容易に測定することができます。カルビンジン免疫染色のラベルすべてのプルキンエ細胞なので、非重複樹木と細胞を同定することは困難である。この場合Pcp2-EGFPの使用は十分プルキンエ細胞の識別を簡単にすることをお勧めします非重複樹木とsである。非重複樹状突起とのプルキンエ細胞が同定されれば、20倍レンズを使用して表示され、画像は、デジタルカメラで記録されます。この画像は、画像解析プログラムを用いて解析することができます。我々は、モード( 図2A)を測定することで、魔法の杖ツールを使用して、マウスのシングルクリックでセルの樹状突起の輪郭を描くことができますイメージプロプラスを使用しています。次に、プログラムは、樹状突起で覆われた領域を計算して、MS Excelにエクスポートします。データの統計解析は、GraphPad Prismソフトウェア(下記参照)を使って行われます。
- 分岐点の数。プルキンエ細胞樹状突起の分岐点の高度に分岐したと微細形態学のために手動でカウントする必要があります。プルキンエ細胞の20倍の画像ファイルは、Adobe Photoshopを使用して画面の大部分を覆うように拡大表示されます。その後、すべての分岐点を数え、明るいドット( 図2B)が付いています。
5。代表的な結果
培養期間中にプルキンエ細胞の樹状ツリーの開発を監視
プルキンエ細胞に特異的にEGFPを発現するPcp2-EGFPマウス由来の器官切片培養は、培養中の数日間の間に個々の細胞の形態を検討することができます。この方法では培養期間中に樹状突起の成長と発展はうまく文書化することができます。リビング同定プルキンエ細胞が10倍を目的とした培養期間中のすべての2 番目または3日目を撮影した。この低消費電力の目標は蛍光灯の照明に起因する細胞への光毒性のダメージを回避し、最小化するために選ばれました。 図3は、生活文化で撮影プルキンエ細胞の2つの例を示します。最初のセルは、 インビトロ ( 図3、AC) で 7日まで、in vitroでの2日前から続いていた。ことは明らかであるdendritiこの期間中にこのセルのcのツリーには、いくつかの新しい枝を成長さや大きさが拡大します。二番目の例では、プルキンエ細胞は 、in vitro で 4から11日間( 図3、DF)から続いていた。 DIV4に存在小さな樹の木は、この期間中に大幅に拡大します。どちらの例でも、培養期間の終わりに存在するプルキンエ細胞の樹状突起のほとんどは確かに文化の中で成長しましたことを示している。
プルキンエ細胞の樹状ツリーの開発はPKCかmGluR1刺激によって抑制される
器官小脳スライス培養を11日間培養した。文化が固定されるまで、in vitroでの2日目から開始して、文化の一部をPMA(50 nM)を、PKCまたはDHPG(10μM)、mGluR1アゴニストを刺 激ホルボールエステルのいずれかで処理した。両方の化合物は、プルキンエ細胞の樹状突起の成長7,8,9、5を阻害したり、制限することが以前に示されている。未処理の対照でスライスプルキンエ細胞は抗GFP( 図4D)を用いた免疫染色により、抗カルビンジン免疫染色( 図4A)またはEGFP発現プルキンエ細胞と培養液のいずれかで可視化した典型的な大規模かつ高度に分岐した樹状突起を開発しました。 PMAで処理した培養では樹状突起の形態が大いに変化した。樹状突起は肥厚登場し、ほんの短い側枝を持っていた。多くのプルキンエ細胞は、対照培養物とは異なり、1つの一次樹状突起は、細胞体から発せられると、もはやユニポーラなかったが、2つあるいはそれ以上の一次樹状突起( 図4B、E)を開発しました。樹状突起で覆われて領土は著しく(下記参照)を削減しました。同様の状況がDHPG処理培養物中に存在していた。プルキンエ細胞の樹状突起が大幅にサイズが縮小され、分岐が著しく( 図4C、F)は減少した。しかし、いくつかのqualitatもあったアイブの違いは、PMA処理した培養物と比較した。そこに樹枝状のない肥厚がありませんでしたが、一次樹状突起は、シグナリングイベントは似ていますが、まったく同じではないかもしれませんPMAとDHPG処理したプルキンエ細胞で起こっていることを示唆している( 図4C、F)は、多くの非常に短い二次樹状突起を運んだ。
上記のように定量的に評価するプルキンエ細胞樹状突起の大きさや分岐点の定量的評価は 、プルキンエ細胞の樹状ツリーとプルキンエ細胞当たりの分岐点の数の大きさを測定する。少なくとも3つの独立した実験の結果は、一緒にプールし、20セルの最小値は、分析する必要がありますされています。対照実験のために樹の木々に覆われた面積の平均を求め、100%として設定し、他の実験の値はそれに応じてパーセント値として表現されています。データの統計解析は、GraphPad Prismソフトウェアを使用して行われます。我々にはありませんので決定されたすべての値がガウス分布の一部であることを前提として、我々は、測定値のような分布を仮定しない統計的検定を使用しています。統計的有意性のために複数の条件やテストを比較するために、我々はをGraphPad Prismでダンのポストテストで実装され、例えば、としてランクベースの統計のための事後テストのための適切な手順に続いてKruskal-Wallis検定を使用しています。結果は通常、棒グラフとして表示しております。このような統計的評価の例を図5に示されている。樹状突起の大きさを分析した( 図5A)とプルキンエ細胞あたりの分岐点( 図5B)の数の両方が制御条件とDHPGまたはPMA治療の間に明確な違いを示しています。両方のパラメータは、Kruskal-Wallis検定によるp <0.001の有意に異なっていた。
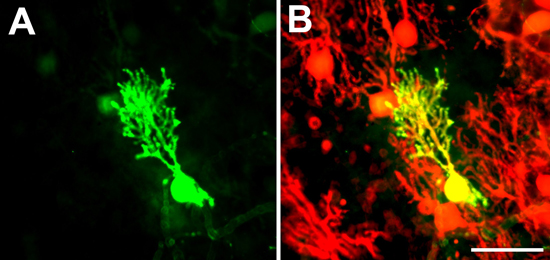
ふぃぎゅRE 1。プルキンエ細胞のEGFP標識。 Pcp2-EGFPマウスではないすべてのプルキンエ細胞がEGFP。したがって、一部のプルキンエ細胞の樹状突起の木が(正、に示すようにEGFPチャンネルに負の示す抗カルビンジン染色で、彼らは急行EGFP(におけるEGFPチャネル)と樹木が重なっている隣接するプルキンエ細胞にはないときに個別に表示することができますBの赤のチャネル)。スケールバー=50μmである。
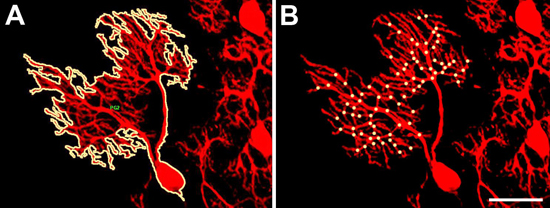
図2。プルキンエ細胞の樹状パラメータの測定。()。樹状突起の大きさは、簡単に画像解析ソフトウェアイメージProでマウスのシングルクリックでプルキンエ細胞の輪郭をトレースに加えて、魔法の杖ツールを用いて測定することができる。魔法の杖ツールは細胞体と樹状突起の枝すべてを含む全体の樹状突起が完全に線で囲っていることなどのために使用されます。 (B)である。分岐点の数は、カップですプルキンエ細胞の画像を手動でnted。すべての分岐点は、黄色のドットが付いています。スケールバー=50μmである。
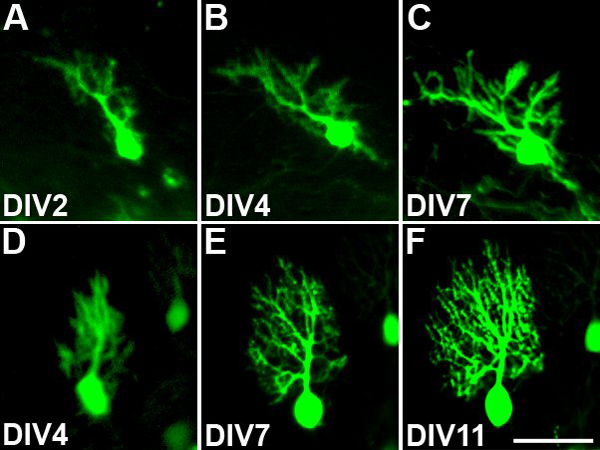
図3モニタリングプルキンエ細胞の樹状ツリーの開発。識別プルキンエ細胞は、樹状突起の成長を監視するために繰り返し撮影した。 (AC):DIV7まで試験管 (DIV)の2日目からの成長と発展プルキンエ細胞の樹状突起。この培養期間中の樹状突起の持続的な成長と分岐があります。 (DF):プルキンエ細胞の樹状突起がDIV11までDIV4から成長と発展。樹状突起は、この培養期間中に大幅に拡大します。スケールバー=50μmである。
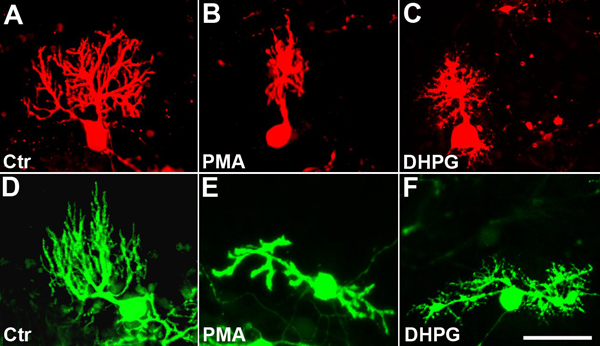
図4。プルキンエ細胞の樹状ツリーの開発はPKCかmGluR1 stimulatiによって阻害される上の()、(D)。よく発達した樹状ツリーで処理されていないコントロール細胞。 (B)、(E):PMA処理デンドライトの9日後肥厚表示され、樹状突起が強く大きさが小さくなる。細胞は、しばしば、その偏光を失い、バイポーラ(E)になります。 (C)、(F):DHPG治療の9日後に樹状突起を大幅にサイズが小さくなる。 PMA処理とは異なり、多くの非常に微細で短い側枝は、プライマリとセカンダリの樹状突起上に存在している。細胞は、しばしば、その偏光を失い、バイポーラ(F)になります。 (F - D)にPcp2-EGFPマウス由来の培養物中の - (C)とEGFPの発現によってプルキンエ細胞は、中の抗カルビンジン免疫染色により可視化した。スケールバー=50μmである。
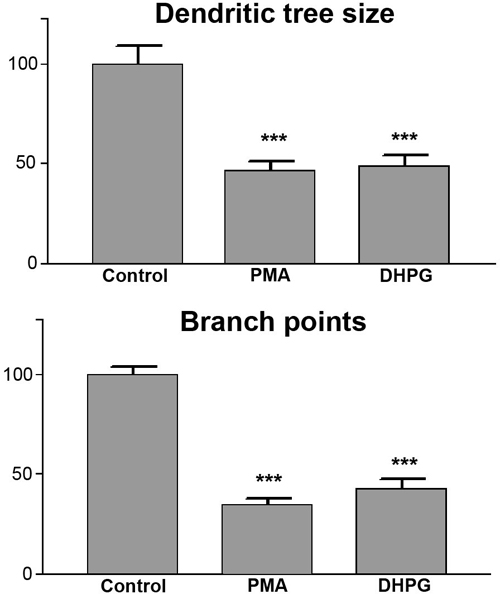
図5。プルキンエ細胞の樹状ツリーのサイズと分岐。定量測定をの定量的な評価を見ると、樹状突起の大きさ(上部のバーグラフ)とnumbe両方分岐点(下の棒グラフ)のrは大きくPMAまたはDHPG治療後に減少しています。処理された培養物から制御樹の木とプルキンエ細胞の樹状ツリー間の相違は、p <0.001と有意であった。
ディスカッション
方法は器官小脳スライス培養におけるプルキンエ細胞樹状突起の発達を研究するためにかつ定量的に樹状突起の大きさや樹状分岐点の数を測定することにより、プルキンエ細胞の樹状突起の拡大を評価することを可能にするここで提示。もちろん、プルキンエ細胞の樹状突起のより広範かつ洗練された定量的な分析は、総樹枝の長さを決定するSholl分析を実行したり、樹状突起のフラクタル?...
開示事項
動物実験は、1986年11月24日の欧州共同体理事会指令(86/609/EEC)に準拠して実施された、スイス当局が検討し、許可された。著者らは、開示することは何もない。
謝辞
この作品は、バーゼル大学、生物医学科、スイス国立科学財団(31003A-116624)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| 組織培養インサート | ミリポア | PICM 03050 PICM ORG50 | PICMORG50インサートは低いリムを持ち、顕微鏡でライブ文化の閲覧を許可 |
| MEM | Gibco社、Invitrogen社 | 11012044 | |
| グルタマックス1 | Gibco社、Invitrogen社 | 35050038 | |
| 基底Medumイーグル | Gibco社、Invitrogen社 | 41010026 | |
| ウマ血清 | Gibco社、Invitrogen社 | 26050070 | |
| ホルボール12 - myristaTE 13 - アセテート(PMA) | Tocris | 1201 | |
| (RS)-3,5 - ジヒドロキシフェニルグリシン(DHPG) | Tocris | 0342 | |
| ウサギ抗カルビンジンD-28K | Swant | CB38 | |
| 抗NeuN、クローンA60 | ケミコン、ミリポア | MAB377 | |
| ウサギ抗GFP | アブカム | Ab290 |
参考文献
- Bosman, L. W., Hartmann, J., Barski, J. J., Lepier, A., Noll-Hussong, M., Reichardt, L. F., Konnerth, A. Requirement of TrkB for synapse elimination in developing cerebellar Purkinje cells. Brain Cell Biol. 35, 87-101 (2006).
- Boukhtouche, F., Janmaat, S., Vodjdani, G., Gautheron, V., Mallet, J., Dusart, I., Mariani, J. Retinoid-related orphan receptor alpha controls the early steps of Purkinje cell dendritic differentiation. J. Neurosci. 26, 1531-1538 (2006).
- Kapfhammer, J. P. Cellular and molecular control of dendritic growth and development of cerebellar Purkinje cells. Prog. Histochem. Cytochem. 39, 131-182 (2004).
- Kapfhammer, L. C., Doering, J. P. Cerebellar slice cultures. Protocols for Neural cell culture. , 285-298 (2010).
- Gugger, O. S., Kapfhammer, J. P. Reduced size of the dendritic tree does not protect Purkinje cells from excitotoxic death. J. Neurosci. Res. 88, 774-783 (2010).
- Li, J., Gu, X., Ma, Y., Calicchio, M. L., Kong, D., Teng, Y. D., Yu, L., Crain, A. M., Vartanian, T. K., Pasqualini, R., Arap, W., Libermann, T. A., Snyder, E. Y., Sidman, R. L. mediates Purkinje cell dendritic development via lysyl oxidase propeptide and NF-κB signaling. Neuron. 68, 45-60 (2010).
- Metzger, F., Kapfhammer, J. P. Protein kinase C activity modulates dendritic differentiation of rat Purkinje cells in cerebellar slice cultures. Eur. J. Neurosci. 12, 1993-2005 (2000).
- Schrenk, K., Kapfhammer, J. P., Metzger, F. Altered dendritic development of cerebellar Purkinje cells in slice cultures from protein kinase C?-deficient mice. Neuroscience. 110, 675-689 (2002).
- Sirzen-Zelenskaya, A., Zeyse, J., Kapfhammer, J. P. Activation of class I metabotropic glutamate receptors limits dendritic growth of Purkinje cells in organotypic slice cultures. Eur. J. Neurosci. 24, 2978-2986 (2006).
- Stoppini, L., Buchs, P. -. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Tomomura, M., Rice, D. S., Morgan, J. I., Yuzaki, M. Purification of Purkinje cells by fluorescence-activated cell sorting from transgenic mice that express green fluorescent protein. Eur. J. Neurosci. 14, 57-63 (2001).
- Weyer, A., Schilling, K. Developmental and cell type-specific expression of the neuronal marker NeuN in the murine cerebellum. J. Neurosci. Res. 73, 400-409 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved