Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'analyse de la morphologie de Purkinje cellules dendritiques dans les cultures organotypique
Dans cet article
Résumé
Nous présentons un protocole qui permet de visualiser et d'évaluer quantitativement la morphologie de l'arbre dendritique des cellules de Purkinje individuelles cultivées en culture organotypique de tranche de cervelet. Ce protocole a pour but de promouvoir les études sur les mécanismes de développement de Purkinje cellules dendritiques.
Résumé
Cellules de Purkinje sont un système modèle intéressant pour l'étude du développement dendritique, parce qu'ils ont un arbre dendritique impressionnante qui est strictement orienté dans le plan sagittal et se développe surtout dans la période post-natale chez les petits rongeurs 3. En outre, plusieurs anticorps qui sont disponibles marquer les cellules de Purkinje sélective et intensive, y compris tous les processus, avec des anti-calbindine D28K étant le plus largement utilisé. Pour l'affichage de dendrites dans les cellules vivantes, des souris exprimant l'EGFP de manière sélective dans les cellules de Purkinje 11 sont disponibles auprès des laboratoires Jackson. Organotypiques cérébelleuse cultures tranche cellules permettent facilement manipulation expérimentale du développement de Purkinje cellules dendritiques parce que la plupart de l'expansion de l'arbre dendritique Purkinje cellules dendritiques qui se passe réellement pendant la période de culture 4. Nous présentons ici un bref protocole fiable et facile pour la visualisation et l'analyse de la morphologie dendritique des cellules de Purkinje cultivé dans organotypic cultures tranche de cervelet. Pour de nombreuses raisons, une évaluation quantitative de l'arbre de Purkinje cellules dendritiques est souhaitable. Nous nous concentrons ici sur deux paramètres, la taille des arbres dendritiques et les numéros de point de branchement, qui peuvent être rapidement et facilement déterminées à partir anti-calbindine tachées cultures tranche de cervelet. Ces deux paramètres donnent une mesure fiable et sensible des variations de l'arbre dendritique des cellules de Purkinje. En utilisant l'exemple des traitements avec la protéine kinase C PMA (PKC) et l'activateur de récepteurs métabotropiques du glutamate 1 (mGluR1), nous montrons comment les différences dans le développement dendritique sont visualisés et évalués quantitativement. La combinaison de la présence d'un arbre dendritique étendues, les méthodes sélectives et immunomarquage intense, aux cultures organotypiques de tranches qui couvrent la période de croissance dendritique et d'un modèle de souris avec des cellules de Purkinje EGFP expression spécifique des cellules de Purkinje faire un modèle de système puissant pour révéler les mécanismes de dendritique développement.
Protocole
1. La mise en place des cultures organotypiques cérébelleuse Slice
Cultures tranche de cervelet sont préparés dès le premier jour post-natal 8 chiots P souris (8) en utilisant la méthode d'incubation statique 10. Dans notre laboratoire, nous utilisons B6CF1 souris. Dans certaines expériences souris transgéniques ont été utilisés aussi qui expriment l'EGFP sélectivement dans les cellules de Purkinje. La préparation des cultures tranche dure environ 30 minutes par chiot de souris, soit 3 heures pour une portée de 6 chiots souris. Toutes les étapes sont réalisées dans des conditions stériles dans un plan de travail à écoulement laminaire avec des instruments chirurgicaux stérilisés.
- Le cervelet des souriceaux P8 est disséqué par le cerveau en milieu de préparation glacée (MEM (Gibco Catalog No. 11012) avec glutamax 1:100, pH 7,3) en utilisant un stéréomicroscope.
- Le cervelet est coupé en tranches épaisses 350 um dans l'orientation sagittale en utilisant un tissue chopper McIlwain.
- Les tranches sont placées sur Millipore inserts de culture cellulaire (env.6 tranches par insertion, Millipore PICM03050) et sont incubés dans des plaques 6 puits avec 0,75 ml par puits de milieu d'incubation (48,35 ml de MEM, 25 ml Eagle Medium, 25 ml de sérum de cheval, 1ml glutamax I, 0,65 ml d'une solution de glucose stérile à 10% solution, pH 7,3) dans une atmosphère humidifiée à 5% de CO 2 à 37 ° C. Tous les réactifs de culture de tissus provenaient de Gibco, Invitrogen.
- Traitements pharmacologiques sont généralement démarrées à 3 jours in vitro (DIV3) en ajoutant le médicament dans la concentration désirée dans le milieu de culture. Phorbol 12-myristate 13-acétate (PMA) et (RS) -3,5-dihydroxyphénylglycine (DHPG) provenaient Tocris, Royaume-Uni. Comme de nombreux médicaments nécessitent l'utilisation de DMSO ou de l'éthanol pour préparer une solution stock (par exemple PMA) il faut veiller à ce que la quantité totale de solvant ajouté au milieu de culture ne dépasse pas 1% (7,5 pi par puits). Les médicaments sont renouvelés en même temps que le changement du milieu de culture tous les 2 ème ou 3 ème jour.
2. Fixation et Immunoscontenant des cultures organotypiques cérébelleuse Slice
Un avantage important du cervelet est que les anticorps sont disponibles spécifiquement et joliment colorer les neurones cérébelleux principaux, à savoir les cellules de Purkinje et les cellules granulaires. La morphologie dendritique des cellules de Purkinje peut être révélée par immunomarquage avec des anticorps anti-calbindine D28K.
- Pour la fixation des cultures, le milieu de culture est éliminé et 3 ml de paraformaldéhyde 4% à froid dans du tampon phosphate 0,1 M (pH 7,4) sont ajoutés avec précaution par puits contenant l'insert Millicell avec les tranches de cervelet fixées à la membrane. Cultures sont fixées pendant une nuit, puis le fixateur est éliminé et les cultures sont rincées avec du tampon phosphate.
- Pour immunologique des anticorps suivants sont utilisés: anticorps de lapin anti-calbindine D-28K (Swant, Bellinzona, Suisse) à 1:1000 pour visualiser sélectivement les cellules de Purkinje et les anticorps monoclonaux anti-neun (Chemicon, Millipore) à 1:500 pour visualiser sélectivement granuLe 12 cellules. Lapin anti-GFP était de Abcam, Royaume-Uni. Anticorps secondaires fluorescents Alexa étaient de Molecular Probes, Invitrogen.
- Les cultures sont perméabilisées et bloquée par addition de 3% de sérum de chèvre normal + 0,3% TritonX100 dans un tampon phosphate 0,1 M (solution de blocage). Anti-calbindine D28K et anti-NeuN sont dilués dans une solution de blocage et les cultures sont incubées avec la solution de blocage contenant les anticorps nuit à 4 ° C sous légère agitation. Toutes les dilutions sont indiquées en% (v / v), du Triton X100 est prise à partir d'une solution mère à 10% afin de faciliter le pipetage.
- Les cultures sont rincées 3 fois avec du tampon phosphate 0,1 M et sont ensuite incubées avec des anticorps secondaires appropriés, par exemple, de chèvre anti-lapin Alexa 568 et chèvre anti-souris Alexa 488 dilué à 1:500 dans 0,1 M de tampon phosphate + 0,1% TritonX100 pendant 2 heures à la température ambiante. Les cultures sont ensuite rincés 3 fois avec du tampon phosphate 0,1 M.
- Les coupes colorées sont supprimées de la culturebien avec un pinceau et sont montées sur des lames de verre SuperFrost Plus et recouvertes avec un milieu de montage approprié, par exemple Mowiol. Les cultures peuvent maintenant être visionnées sur un microscope à épifluorescence régulière avec un équipement ou avec un microscope confocal.
3. Visualisation des cellules de Purkinje individuels dans les cultures organotypique
- Après immunomarquage avec calbindine D28k le cytoplasme des cellules de Purkinje complète est brillamment colorés dont les dendrites et l'axone. En raison de l'alignement dense de cellules de Purkinje dans la couche des cellules de Purkinje, les arbres dendritiques des cellules de Purkinje la plupart se chevauchent ce qui rend difficile d'étudier la tonnelle complète d'une cellule individuelle. Toutefois, en raison de la mort cellulaire de certaines cellules de Purkinje au cours du processus de préparation, dans de nombreuses cultures certaines zones sont présents avec une densité réduite des cellules de Purkinje. Dans ces zones, il est possible de trouver des cellules de Purkinje avec un arbre dendritique complet qui ne se chevauchent pas avec les autres caunes. Dans ces cellules, l'arbre dendritique peuvent être visualisés et analysés dans une qualité comparable à une coloration de Golgi. Parce que dans le cervelet des cellules de Purkinje sont le seul type cellulaire exprimant calbindine D28K les cellules sont également identifiés comme les cellules de Purkinje.
- Une autre méthode consiste à utiliser des cultures dérivées de B6; FVB-Tg (PCP2-EGFP) 146.244Yuza / J souris (appelé ici PCP2-EGFP souris, disponibles auprès de Jackson laboratoires) qui expriment l'EGFP sous la cellule de Purkinje spécifique L7 promoteur 11. Dans les cultures tranche de vie de ces cellules de Purkinje peuvent être visualisées par l'expression de l'EGFP. Il est également possible de suivre la morphologie dendritique d'une cellule unique au fil du temps. Sinon, après fixation, exprimant l'EGFP-cellules de Purkinje peut être immunocolorées avec un anticorps anti-GFP. Les deux méthodes peuvent être utilisées pour la coloration des dendrites, les organismes cellulaires et des axones des cellules de Purkinje dans des cultures organotypiques. Parce que le promoteur L7 chez les souris PCP2-EGFP n'est pas exprimé dans toutes les cellules de Purkinje et il ya des variations de la fréquence d'exprimer les cellules de Purkinje entre les souris (Kapfhammer, données non présentées) trancher cultures dérivées de ces souris rendre plus facile à visualiser et mesurer les cellules de Purkinje qui ont des arbres dendritiques qui se chevauchent avec des arbres de Purkinje autres cellules dendritiques. Ces arbres dendritiques peuvent être consultés individuellement les cellules de Purkinje voisines se chevauchent arbres dendritiques ne expriment la GFP (figure 1A, B).
4. Mesure de la cellule de Purkinje dendritiques Taille des arbres et des points de branchement
- La taille des arbres dendritiques. Avec le marquage fluorescent des cellules de Purkinje la taille de l'arbre dendritique d'une cellule donnée peut être facilement mesurée, si l'arbre n'est pas de chevauchement avec d'autres cellules. Parce que les étiquettes immunomarquage calbindine toutes les cellules de Purkinje, il peut être difficile d'identifier les cellules avec des non-chevauchement des arbres dendritiques. Dans ce cas, l'utilisation de la PCP2-EGFP est recommandé de simplifier l'identification des cellules de Purkinje suffisantes avec des non-chevauchement des arbres dendritiques. Une fois une cellule de Purkinje avec un arbre sans chevauchement dendritique est identifiée, elle est considérée avec l'objectif 20x et une image est enregistrée avec un appareil photo numérique. Cette image peut ensuite être analysées avec un logiciel d'analyse d'image. Nous utilisons Image Pro Plus, qui permet décrivant l'arbre dendritique de la cellule avec un simple clic de souris à l'aide de l'outil baguette magique en mode de mesure (figure 2A). Le programme calcule ensuite la zone couverte par l'arbre dendritique et l'exporte vers MS Excel. L'analyse statistique des données est réalisée avec le logiciel GraphPad Prism (voir ci-dessous).
- Nombre de points de ramification. En raison de la morphologie très ramifié et bien des points de Purkinje dendritiques branches d'arbres cellulaires doivent être comptés manuellement. Le fichier 20x image des cellules de Purkinje est agrandie de sorte qu'il couvre la plupart de l'écran en utilisant Adobe Photoshop. Ensuite, chaque point de ramification est compté et marqué par un vif point (figure 2B).
5. Les résultats représentatifs
Suivi du développement de l'arbre de Purkinje cellules dendritiques au cours de la période de culture
Cultures organotypique dérivés de PCP2-EGFP souris qui expriment l'EGFP spécifiquement dans les cellules de Purkinje permet d'étudier la morphologie des cellules individuelles pendant plusieurs jours en culture. De cette façon, la croissance et le développement de l'arbre dendritique au cours de la période de culture peut très bien être documentées. Vivant identifiés cellules de Purkinje ont été photographiés chaque jour 2 ème ou 3 ème cours de la période de culture avec l'objectif 10x. Cet objectif de faible puissance a été choisi pour éviter et minimiser les dommages phototoxique pour les cellules en raison de l'éclairage avec une lumière fluorescente. Figure 3 montre deux exemples de cellules de Purkinje photographiés dans des cultures vivantes. La première cellule a été suivie à partir de 2 jours in vitro jusqu'à 7 jours in vitro (figure 3, AC). Il est évident que le dendritic arbre de cette cellule au cours de cette période de temps augmente plusieurs nouvelles branches et prend de l'ampleur. Dans le second exemple, une cellule de Purkinje a été suivie de 4 à 11 jours in vitro (figure 3, DF). L'arbre dendritique petit présent à DIV4 étend considérablement au cours de cette période. Ces deux exemples montrent que la plupart de l'arbre dendritique des cellules de Purkinje présenter à la fin de la période de culture a bel et bien se développer dans la culture.
Le développement de l'arbre dendritique des cellules de Purkinje est inhibée par la PKC ou la stimulation mGluR1
Culture organotypique de tranche de cervelet ont été cultivées pendant 11 jours. À partir de la 2 ème journée in vitro, quelques-uns des cultures ont été traitées soit avec du PMA (50 nM), un ester de phorbol stimuler la PKC ou DHPG (10 uM), un agoniste mGluR1, jusqu'à ce que les cultures ont été fixées. Les deux composés ont été montré précédemment pour empêcher et limiter la croissance de Purkinje cellules dendritiques 7, 8, 9, 5.Dans le témoin non traité tranches de cellules de Purkinje développé un grand arbre typique et très ramifié dendritique qui a été visualisé soit par immunomarquage anti-calbindine (figure 4A) ou dans les cultures avec EGFP exprimant les cellules de Purkinje, par immunomarquage avec des anticorps anti-GFP (figure 4D). Dans les cultures traitées avec du PMA de la morphologie de l'arbre dendritique a été profondément modifié. Les dendrites semblait épaissi et avait seulement quelques courtes branches latérales. De nombreuses cellules de Purkinje, à la différence dans les cultures témoins, n'étaient plus unipolaire, avec un dendrite primaire émanant du corps cellulaire, mais a développé deux ou même plusieurs dendrites primaires (figure 4B, E). Le territoire couvert par l'arbre dendritique a été considérablement réduite (voir ci-dessous). Une situation similaire est présente dans DHPG les cultures traitées. L'arbre dendritique des cellules de Purkinje a été considérablement réduit en taille et la ramification est fortement réduite (figure 4C, F). Cependant, il y avait aussi quelques qualitative différences par rapport aux PMA les cultures traitées. Il n'y avait pas d'épaississement des branches dendritiques, et les dendrites primaires effectué de nombreuses dendrites secondaires très courts (figure 4C, F), suggérant que les événements de signalisation passe au PMA et DHPG traités par les cellules de Purkinje peuvent être similaires, mais pas identiques.
Évaluation quantitative de la cellule de Purkinje dendritique taille de l'arbre et les points de branchement pour l'évaluation quantitative, la taille de l'arbre de Purkinje cellules dendritiques et le nombre de points de ramification par cellule de Purkinje est mesurée comme décrit ci-dessus. Résultats d'au moins trois expériences indépendantes sont regroupés, et un minimum de 20 cellules doivent être analysés. La moyenne de la zone couverte par les arbres dendritiques pour les expériences de contrôle est déterminée et fixée à 100%, et les valeurs pour les autres expériences sont exprimés en valeurs de pourcentage en conséquence. L'analyse statistique des données est réalisée avec le logiciel GraphPad Prism. Parce que nous ne sommes passupposer que toutes les valeurs déterminées font partie d'une distribution gaussienne, nous utilisons des tests statistiques qui ne supposent pas une telle distribution des valeurs mesurées. Pour comparer de multiples conditions et les tests de signification statistique, nous utilisons test Kruskal-Wallis suivi d'une procédure appropriée pour les tests post hoc pour le rang de statistiques basées, comme, par exemple, mis en œuvre dans le post-test de Dunn dans GraphPad Prism. Les résultats sont généralement présentés sous forme de graphiques à barres. Un exemple d'une telle évaluation statistique est donnée à la figure 5. Tant l'analyse de la taille de l'arbre dendritique (figure 5A) et le nombre de points de branchement par des cellules de Purkinje (figure 5B) montrent des différences claires entre la condition contrôle et le traitement DHPG ou PMA. Ces deux paramètres sont différents avec une signification statistique de p <0,001 selon le test de Kruskal-Wallis.
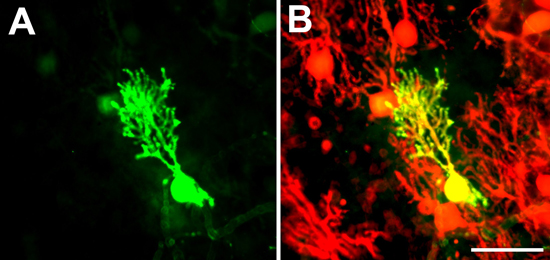
Figure 1. EGFP-marqué cellule de Purkinje. En PCP2-EGFP souris ne sont pas toutes les cellules de Purkinje expresse EGFP. Par conséquent, les arbres dendritiques des cellules de Purkinje certains peuvent être consultés individuellement quand ils expriment l'EGFP (EGFP canal A) et les cellules de Purkinje voisines se chevauchent arbres dendritiques ne sont pas (négatif dans le canal EGFP montré en A, positif dans la coloration anti-calbindine montré dans le canal rouge en B). Barre d'échelle = 50 um.
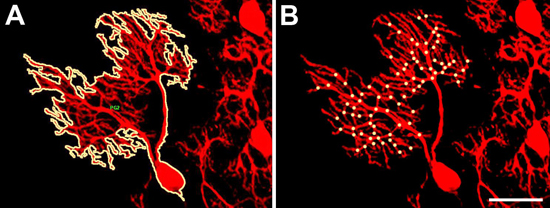
Figure 2. Mesure des paramètres dendritiques des cellules de Purkinje. (A). La taille de l'arbre dendritique peut être facilement mesurée en traçant le contour de la cellule de Purkinje avec un simple clic de souris dans le Image Pro analyse d'images ainsi que le logiciel en utilisant l'outil baguette magique. L'outil Baguette magique est utilisé de telle sorte que l'arbre dendritique entier, y compris le corps cellulaire et toutes les branches dendritiques sont complètement encerclée par la ligne. (B). Le nombre de points de branchement est counted manuellement dans les images des cellules de Purkinje. Chaque point de dérivation est marqué d'un point jaune. Barre d'échelle = 50 um.
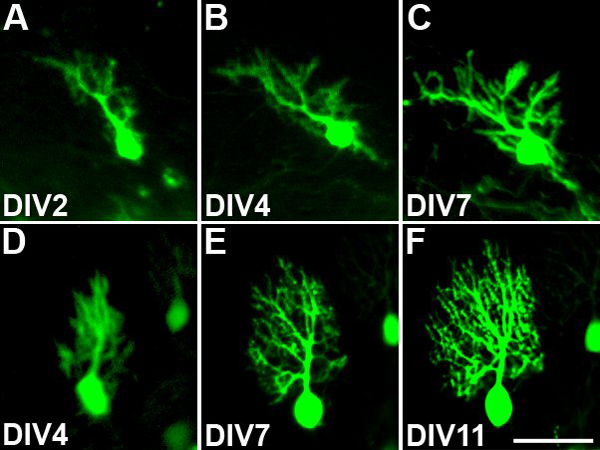
Figure 3. Suivre l'évolution de l'arbre dendritique des cellules de Purkinje. Identifiés cellules de Purkinje ont été photographiés à plusieurs reprises pour suivre la croissance de l'arbre dendritique. (AC): arbre dendritique d'une cellule de Purkinje croissance et le développement au jour in vitro (DIV) 2 jusqu'à ce que DIV7. Il ya une croissance continue et la ramification des dendrites au cours de cette période de culture. (DF): arbre dendritique d'une cellule de Purkinje croissance et le développement de DIV4 jusqu'à DIV11. L'arbre dendritique augmente considérablement au cours de cette période de culture. Barre d'échelle = 50 um.
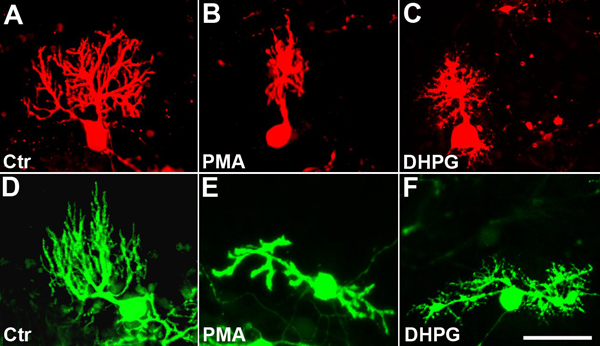
Figure 4. Le développement de l'arbre dendritique des cellules de Purkinje est inhibée par la PKC ou mGluR1 stimulatià (A), (D):. cellules témoins non traitées avec un arbre dendritique bien développé. (B), (E): Après 9 jours de traitement dendrites PMA semblent épaissies et l'arbre dendritique est fortement réduite en taille. Les cellules perdent souvent leur polarisation et de devenir bipolaire (E). (C), (F): Après 9 jours de traitement DHPG l'arbre dendritique est fortement réduite en taille. Contrairement au traitement du PMA, de nombreuses branches latérales très fines et courtes sont présentes sur les dendrites primaires et secondaires. Les cellules perdent souvent leur polarisation et de devenir bipolaire (F). Cellules de Purkinje ont été visualisées par immunocoloration anti-calbindine en (A - C) et par EGFP-expression dans les cultures dérivées de PCP2-EGFP dans des souris (D - F). Barre d'échelle = 50 um.
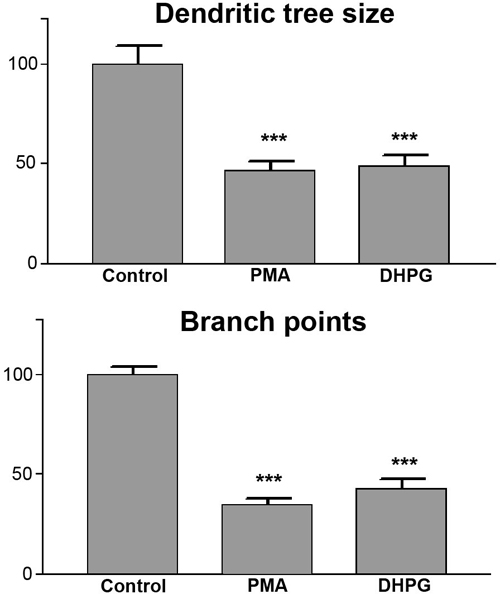
Figure 5. L'évaluation quantitative des cellules de Purkinje dendritique taille des arbres et la ramification. Mesures quantitatives montrent que la taille arbre dendritique (graphique à barres en haut) et la number de points de branchement (indicateur du bas) sont fortement réduites après traitement au PMA ou DHPG. Les différences entre les arbres dendritiques de contrôle et d'arbres dendritiques des cellules de Purkinje de cultures traitées sont significatives avec p <0,001.
Discussion
Les méthodes présentées ici permettent d'étudier le développement de cellules dendritiques Purkinje en culture organotypique de tranche de cervelet et d'évaluer quantitativement l'expansion Purkinje cellules dendritiques en mesurant la dimension des arbres dendritique et le nombre de points de ramification dendritique. Bien sûr, une analyse plus approfondie et quantitatif sophistiqué des dendrites des cellules de Purkinje est possible, par exemple en déterminant la longueur totale dendritique, effec...
Déclarations de divulgation
Expériences sur les animaux ont été effectuées en conformité avec la Directive européenne du Conseil du 24 Novembre 1986 (86/609/CEE) et ont été examinés et autorisés par les autorités suisses. Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par l'Université de Bâle, Département de la biomédecine, et le Fonds national suisse (31003A-116 624).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Inserts de culture de tissus | Millipore | PICM 03050 PICM ORG50 | Les PICMORG50 inserts ont une jante basse et permettre la visualisation des cultures vivantes au microscope |
| MEM | Gibco, Invitrogen | 11012044 | |
| Glutamax 1 | Gibco, Invitrogen | 35050038 | |
| Basale Medum Aigle | Gibco, Invitrogen | 41010026 | |
| Sérum de cheval | Gibco, Invitrogen | 26050070 | |
| Phorbol 12-myristate 13-acétate (PMA) | Tocris | 1201 | |
| (RS) -3,5-dihydroxy-phénylglycine (DHPG) | Tocris | 0342 | |
| Lapin anti-calbindine D-28K | Swant | CB38 | |
| Anti NeuN, clone A60 | Chemicon, Millipore | MAB377 | |
| Lapin anti-GFP | Abcam | Ab290 |
Références
- Bosman, L. W., Hartmann, J., Barski, J. J., Lepier, A., Noll-Hussong, M., Reichardt, L. F., Konnerth, A. Requirement of TrkB for synapse elimination in developing cerebellar Purkinje cells. Brain Cell Biol. 35, 87-101 (2006).
- Boukhtouche, F., Janmaat, S., Vodjdani, G., Gautheron, V., Mallet, J., Dusart, I., Mariani, J. Retinoid-related orphan receptor alpha controls the early steps of Purkinje cell dendritic differentiation. J. Neurosci. 26, 1531-1538 (2006).
- Kapfhammer, J. P. Cellular and molecular control of dendritic growth and development of cerebellar Purkinje cells. Prog. Histochem. Cytochem. 39, 131-182 (2004).
- Kapfhammer, L. C., Doering, J. P. Cerebellar slice cultures. Protocols for Neural cell culture. , 285-298 (2010).
- Gugger, O. S., Kapfhammer, J. P. Reduced size of the dendritic tree does not protect Purkinje cells from excitotoxic death. J. Neurosci. Res. 88, 774-783 (2010).
- Li, J., Gu, X., Ma, Y., Calicchio, M. L., Kong, D., Teng, Y. D., Yu, L., Crain, A. M., Vartanian, T. K., Pasqualini, R., Arap, W., Libermann, T. A., Snyder, E. Y., Sidman, R. L. mediates Purkinje cell dendritic development via lysyl oxidase propeptide and NF-κB signaling. Neuron. 68, 45-60 (2010).
- Metzger, F., Kapfhammer, J. P. Protein kinase C activity modulates dendritic differentiation of rat Purkinje cells in cerebellar slice cultures. Eur. J. Neurosci. 12, 1993-2005 (2000).
- Schrenk, K., Kapfhammer, J. P., Metzger, F. Altered dendritic development of cerebellar Purkinje cells in slice cultures from protein kinase C?-deficient mice. Neuroscience. 110, 675-689 (2002).
- Sirzen-Zelenskaya, A., Zeyse, J., Kapfhammer, J. P. Activation of class I metabotropic glutamate receptors limits dendritic growth of Purkinje cells in organotypic slice cultures. Eur. J. Neurosci. 24, 2978-2986 (2006).
- Stoppini, L., Buchs, P. -. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Tomomura, M., Rice, D. S., Morgan, J. I., Yuzaki, M. Purification of Purkinje cells by fluorescence-activated cell sorting from transgenic mice that express green fluorescent protein. Eur. J. Neurosci. 14, 57-63 (2001).
- Weyer, A., Schilling, K. Developmental and cell type-specific expression of the neuronal marker NeuN in the murine cerebellum. J. Neurosci. Res. 73, 400-409 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon