È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'analisi di morfologia dendritica delle cellule di Purkinje in Culture Slice organotipiche
In questo articolo
Riepilogo
Presentiamo un protocollo che permette di visualizzare e valutare quantitativamente la morfologia dell'albero dendritico delle cellule di Purkinje singole coltivate in culture fetta organotipiche cerebellari. Questo protocollo ha lo scopo di promuovere gli studi sui meccanismi di sviluppo dendritiche delle cellule di Purkinje.
Abstract
Cellule di Purkinje sono un sistema modello attraente per studiare lo sviluppo dendritico, perché hanno un albero impressionante dendritica strettamente orientato nel piano sagittale e si sviluppa prevalentemente nel periodo postnatale nei piccoli roditori 3. Inoltre, gli anticorpi sono disponibili diverse etichette che le cellule di Purkinje selettivamente e intensamente tra cui tutti i processi, con anti-Calbindin D28K essere il più utilizzato. Per la visualizzazione dei dendriti nelle cellule viventi, topi che esprimono EGFP selettivamente nelle cellule di Purkinje 11 sono disponibili attraverso laboratori Jackson. Organotipiche cerebellari culture fetta cellule permettono con facilità di manipolazione sperimentale di sviluppo dendritiche delle cellule di Purkinje perché la maggior parte dell'espansione dendritica della struttura dendritica delle cellule di Purkinje è effettivamente in atto durante il periodo di coltura 4. Vi presentiamo qui una breve, protocollo affidabile e semplice per la visualizzazione e l'analisi della morfologia dendritica delle cellule del Purkinje coltivate in organotypic culture fetta cerebellari. Per molti scopi, una valutazione quantitativa dell'albero dendritico delle cellule di Purkinje è auspicabile. Ci concentriamo qui su due parametri, le dimensioni dell'albero dendritico e numeri in virgola filiali, che possono essere rapidamente e facilmente determinabili da colture tinte anti-calbindina fetta cerebellari. Questi due parametri danno una misura affidabile e sensibile dei cambiamenti della struttura di Purkinje cellule dendritiche. Utilizzando l'esempio di trattamenti con la proteina chinasi C (PKC) attivatore PMA e il recettore metabotropici del glutammato 1 (mGluR1) si dimostra come le differenze nello sviluppo dendritico sono visualizzati e valutati quantitativamente. La combinazione della presenza di un albero dendritico ampio, metodi immunostaining selettivi ed intenso, culture fetta organotipiche che coprono il periodo di crescita dendritica e un modello di topo con cellule EGFP Purkinje espressione specifica marca cellule di Purkinje un sistema modello potente per rivelare i meccanismi di dendritico sviluppo.
Protocollo
1. Impostazione organotipiche Culture Slice cerebellari
Culture fetta cerebellari sono preparati sin dal primo giorno dopo la nascita 8 p (8) cuccioli di topo usando il metodo statico di incubazione 10. Nel nostro laboratorio, usiamo B6CF1 topi. In alcuni esperimenti topi transgenici sono stati usati anche che esprimono EGFP selettivamente nelle cellule di Purkinje. La preparazione delle culture fetta dura circa 30 minuti per il mouse cucciolo, vale a dire 3 ore per una cucciolata di 6 cuccioli di topo. Tutte le fasi vengono eseguite in condizioni sterili in un banco di lavoro a flusso laminare con strumenti chirurgici sterilizzati.
- Il cervelletto di P8 cuccioli di topo si scolla dal cervello di ghiaccio freddo medio di preparazione (MEM (Gibco Catalog No. 11012) con glutamax 1:100, pH 7,3) utilizzando uno stereomicroscopio.
- Il cervelletto è tagliato in fette 350 micron di spessore con l'orientamento sagittale con un elicottero McIlwain tessuto.
- Le fette sono immessi sul inserti Millipore colture cellulari (approssimativamente 6 slices per inserto, PICM03050 Millipore) e vengono incubati in piastre da 6 pozzetti con 0,75 ml per pozzetto di terreno di incubazione (48,35 ml MEM, 25 ml Medio Aquila, 25 ml di siero di cavallo, 1ml glutamax I, 0,65 ml di glucosio sterile 10% soluzione, pH 7,3) in atmosfera umidificata con 5% di CO 2 a 37 ° C. Tutti i reagenti sono stati coltura tissutale da Gibco, Invitrogen.
- Trattamenti farmacologici in genere vengono avviate a 3 giorni in vitro (DIV3) aggiungendo il farmaco alla concentrazione desiderata al mezzo di coltura. Forbolo 12-miristato 13-acetato (PMA) e (RS) -3,5-Dihydroxyphenylglycine (DHPG) erano da Tocris, UK. Poiché molti farmaci richiedono l'uso di DMSO o etanolo per preparare una soluzione madre (ad es PMA) occorre considerare che la quantità totale di solvente aggiunto al mezzo di coltura non supera 1% (7,5 microlitri per pozzetto). I farmaci vengono rinnovati insieme al cambiamento del mezzo di coltura ogni 2 ° o 3 ° giorno.
2. Fissazione e Immunoscontenente di organotipiche Culture Slice cerebellari
Un importante vantaggio del cervelletto è che gli anticorpi che specificamente sono disponibili e brillantemente macchiare i neuroni cerebellari principali, cioè cellule di Purkinje e granuli. La morfologia dendritica delle cellule di Purkinje può essere rivelato mediante immunocolorazione con anti-calbindina D28K.
- Per il fissaggio delle colture, il terreno di coltura viene rimosso e 3 ml di freddo paraformaldeide 4% in tampone fosfato 0,1 M (pH 7,4) vengono aggiunti attentamente per pozzetto contenente l'inserto Millicell con le fettine cerebellari attaccate alla membrana. Culture sono fissati notte, poi il fissativo viene rimosso e le colture sono sciacquate con tampone fosfato.
- Per immunocolorazione gli anticorpi vengono utilizzati i seguenti: coniglio anti-calbindina D-28K (Swant, Bellinzona, Svizzera) a 1:1000 per visualizzare selettivamente le cellule di Purkinje e anticorpo monoclonale anti-neun (Chemicon, Millipore) a 1:500 per visualizzare selettivamente GranuLe 12 celle. Coniglio anti-GFP era da Abcam, Regno Unito. Anticorpi secondari fluorescenti Alexa erano di Molecular Probes, Invitrogen.
- Le colture vengono permeabilizzate e bloccati aggiungendo 3% di siero di capra normale + 0,3% TritonX100 in tampone fosfato 0,1 M (soluzione di blocco). Anti-calbindin D28K e anti-NeuN sono diluiti in soluzione di blocco e le colture vengono incubate con la soluzione bloccante contenente gli anticorpi notte a 4 ° C sotto agitazione leggera. Tutte le diluizioni vengono indicate come% (v / v), Triton X100 è preso da una soluzione stock 10% per facilitare pipettamento.
- Le colture sono sciacquate 3x con tampone fosfato 0,1 M e vengono poi incubate con appropriati anticorpi secondo, per esempio capra anti-coniglio Alexa 568 e di capra anti-topo Alexa 488 diluito 1:500 in tampone fosfato 0,1 M + 0,1% TritonX100 per 2 ore a temperatura ambiente. Le colture vengono quindi risciacquati 3x con tampone fosfato 0.1M.
- Le fette colorate vengono rimossi dalla colturabene con un pennello e sono montati su vetrini SuperFrost Plus e coperti con un mezzo di montaggio appropriata, ad esempio Mowiol. Le colture possono essere visualizzati su un microscopio normale con attrezzature epifluorescenza o con un microscopio confocale.
3. Visualizzazione delle cellule di Purkinje individuali in Culture Slice organotipiche
- Dopo immunocolorazione con Calbindin D28k il citoplasma completa delle cellule del Purkinje è vivacemente colorato compresi i dendriti e l'assone. Dovuta all'allineamento densa di Purkinje cellule nello strato delle cellule di Purkinje, i pergolati dendritiche della maggior parte delle cellule di Purkinje sono sovrapposte rendendo difficile studiare il pergolato completo di una singola cella. Tuttavia, a causa della morte cellulare di alcune cellule di Purkinje durante il processo di preparazione, in molte culture alcune zone sono presenti con una ridotta densità di cellule di Purkinje. In tali aree si possono trovare cellule di Purkinje con un pergolato dendritica completo che non si sovrappongono con altri cells. In queste cellule, la pergola dendritico possono essere visualizzati e analizzati in qualità comparabile a una colorazione di Golgi. Perché nel cervelletto le cellule di Purkinje sono il tipo cellulare solo esprimendo Calbindin D28K le celle sono anche identificate come cellule di Purkinje.
- Un metodo alternativo è quello di utilizzare colture derivate da B6; FVB-Tg (Pcp2-EGFP) 146.244Yuza / J mice (qui chiamato Pcp2-EGFP topi, disponibile da Jackson laboratori) che esprimono EGFP sotto la cellula di Purkinje promotore specifico L7 11. Nelle culture fetta di vita tali cellule di Purkinje può essere visualizzato espressione di EGFP. È anche possibile seguire la morfologia dendritica di una singola cella nel tempo. In alternativa, dopo la fissazione, che esprimono EGFP-cellule di Purkinje può essere immunostained con un anticorpo anti-GFP. Entrambi i metodi sono adatti per la colorazione, dendriti e degli assoni corpi cellulari di cellule di Purkinje nel colture organotipiche. Poiché il promotore L7 nei Pcp2-EGFP topi non è espresso in tutte le cellule di Purkinje e ci sono variations nella frequenza di esprimere cellule di Purkinje tra topo (Kapfhammer, dati non mostrati) fetta colture derivate da questi topi rendere più facile visualizzare e misurare le cellule di Purkinje che hanno gli alberi dendritiche che si sovrappongono ad altri alberi dendritiche delle cellule di Purkinje. Tali alberi dendritiche possono essere viste individualmente quando le cellule di Purkinje vicini con sovrapposizione alberi dendritiche non esprimono GFP (Figura 1A, B).
4. Misurazione della Dimensione cella albero dendritiche Purkinje e punti di diramazione
- Albero di dimensioni dendritiche. Con la marcatura fluorescente di cellule di Purkinje la dimensione dell'albero dendritico di una data cellula può essere facilmente misurata se l'albero non si sovrappone con altre cellule. Poiché le etichette Calbindin immunostaining tutte le cellule di Purkinje, può essere difficile identificare con cellule non sovrapposte alberi dendritiche. In questo caso l'uso del Pcp2-EGFP è raccomandato per semplificare l'identificazione di cellule di Purkinje sufficientes con non sovrapposti alberi dendritiche. Una volta che una cellula di Purkinje con un non-sovrapposizione albero dendritico viene identificato, viene visualizzato con la lente 20x e un'immagine viene registrata con una fotocamera digitale. L'immagine può quindi essere analizzati con un programma di analisi di immagine. Usiamo Image Pro Plus, che permette di delineare la struttura dendritica della cellula con un solo clic del mouse con lo strumento bacchetta magica nel modo di misura (Figura 2A). Il programma calcola quindi l'area coperta dalla dell'albero dendritico e lo esporta in MS Excel. L'analisi statistica dei dati è effettuata con il software GraphPad Prism (vedi sotto).
- Numero di punti di ramificazione. A causa della morfologia altamente ramificata e fine dei punti di albero di Purkinje cellule dendritiche ramo devono essere contati manualmente. Il 20x file di immagine delle cellule di Purkinje è ingrandita in modo tale che copre la maggior parte dello schermo utilizzando Adobe Photoshop. Allora ogni punto di diramazione viene contato e contrassegnato con un puntino luminoso (Figura 2B).
5. Risultati rappresentativi
Monitorare lo sviluppo dell'albero dendritico delle cellule di Purkinje durante il periodo di coltura
Culture fetta organotipiche derivate da Pcp2-EGFP topi che esprimono EGFP specificamente in cellule di Purkinje permettono di studiare la morfologia delle singole cellule per parecchi giorni in coltura. In questo modo la crescita e lo sviluppo dell'albero dendritico durante il periodo di coltura può essere ben documentato. Living celle identificate Purkinje sono stati fotografati ogni 2 ° o 3 ° giorno durante il periodo di coltura con l'obiettivo 10x. Questo obiettivo a basso è stato scelto al fine di evitare e ridurre al minimo i danni fototossica per le cellule a causa della illuminazione con luce fluorescente. Figura 3 mostra due esempi di cellule di Purkinje fotografati nelle culture viventi. La prima cella è stata seguita da 2 giorni in vitro fino a 7 giorni in vitro (Figura 3, AC). È evidente che il dendritialbero c di questo cellulare durante questo periodo di tempo si sviluppa diverse nuove filiali e si espande in dimensioni. Nel secondo esempio, una cellula di Purkinje venne seguito da 4 a 11 giorni in vitro (Figura 3, DF). L'albero dendritico piccolo presente a DIV4 espande notevolmente durante questo periodo di tempo. Entrambi gli esempi mostrano che la maggior parte dell'albero dendritico delle cellule di Purkinje presentare alla fine del periodo di coltura ha effettivamente sviluppano nella cultura.
Sviluppo della struttura ad albero di Purkinje cellule dendritiche è inibita da PKC o mGluR1 stimolazione
Organotipiche culture fetta cerebellari sono state coltivate per 11 giorni. Partendo dal giorno 2 ° in vitro, alcune delle colture sono stati trattati con PMA (50 nM), un estere del forbolo stimolare PKC o DHPG (10 pM), un agonista mGluR1, fino a quando le colture sono state fissate. Entrambi i composti sono stati precedentemente dimostrato di inibire la crescita cellulare e limitare Purkinje dendritica 7, 8, 9, 5.Nel controllo non trattato fette cellule di Purkinje sviluppato un tipico grande albero e altamente ramificato dendritica che è stata visualizzata mediante anti-Calbindin immunostaining (Figura 4A) o in colture con cellule che esprimono EGFP Purkinje, mediante immunocolorazione con anti-GFP (Figura 4D). In colture trattate con PMA la morfologia dell'albero dendritico profondamente rimaneggiato. I dendriti apparso ispessita e aveva solo pochi rami laterali corti. Cellule di Purkinje molti, a differenza nelle colture di controllo, non erano più unipolare, con un dendrite primaria proveniente dal corpo cellulare, ma sviluppato due o anche più dendriti primarie (Figura 4B, E). Il territorio interessato dai dell'albero dendritico è stato notevolmente ridotto (vedi sotto). Una situazione simile era presente in DHPG trattati culture. L'albero dendritico delle cellule di Purkinje stata notevolmente ridotte e la ramificazione era marcatamente ridotta (Figura 4C, F). Tuttavia, ci sono stati anche alcuni qualitative differenze rispetto al PMA trattati culture. Non c'era ispessimento dei rami dendritici, e dendriti primarie effettuati molti dendriti molto brevi secondari (Figura 4C, F), suggerendo che gli eventi di segnalazione in corso in PMA e DHPG cellule trattate Purkinje possono essere simili, ma non identici.
Valutazione quantitativa della dimensione cellulare dell'albero dendritico Purkinje e punti di diramazione per la valutazione quantitativa, la dimensione dell'albero dendritico delle cellule di Purkinje e il numero di punti di ramificazione per cella Purkinje è misurata come descritto sopra. Risultati di almeno tre esperimenti indipendenti sono raggruppate, e un minimo di 20 celle devono essere analizzati. La media della superficie coperta dagli alberi dendritiche per gli esperimenti di controllo viene determinata e impostata come 100%, ed i valori per gli altri esperimenti sono espressi come valori percentuali di conseguenza. L'analisi statistica dei dati è effettuata con il software GraphPad Prism. Perché non lo facciamoassumere che tutti i valori determinati sono parte di una distribuzione gaussiana, usiamo test statistici che non assumono una tale distribuzione dei valori misurati. Per confrontare più condizioni e test per la significatività statistica, usiamo Kruskal-Wallis seguito da una procedura adeguata per il test post hoc per rango statistiche basate, come, ad esempio, realizzato in post-test del Dunn in Prism GraphPad. I risultati sono in genere presentati come grafici a barre. Un esempio di una tale valutazione statistica è data in Figura 5. Sia l'analisi delle dimensioni dell'albero dendritico (Figura 5A) e il numero di punti di ramificazione per cella Purkinje (Figura 5B) mostrano chiare differenze tra la condizione di controllo e trattamento DHPG o PMA. Entrambi i parametri erano differenti con una significatività statistica di p <0,001 secondo il test di Kruskal-Wallis.
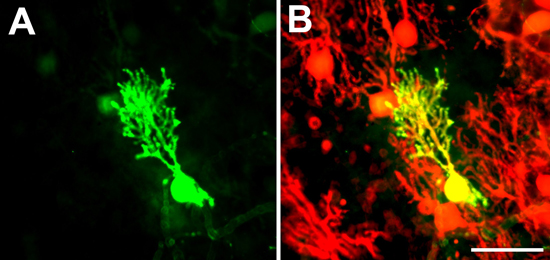
Figure 1. EGFP marcato delle cellule di Purkinje. In Pcp2-EGFP topi non tutte le cellule di Purkinje esprimono EGFP. Pertanto, alberi dendritiche di alcune cellule di Purkinje possono essere viste individualmente quando esprimono EGFP (EGFP canale in A) e le cellule di Purkinje confinanti con sovrapposti alberi dendritiche non (negativo nel canale EGFP mostrato in A, positivo anti-Calbindin colorazione mostrato nel canale rosso in B). Barra della scala = 50 micron.
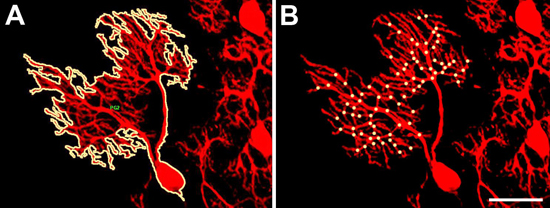
Figura 2. Misurazione di parametri dendritiche delle cellule di Purkinje. (A). La dimensione dell'albero dendritico può essere facilmente misurata tracciando il contorno della cellula di Purkinje con un singolo click del mouse nella Pro Immagine software di analisi più con lo strumento bacchetta magica. Lo strumento bacchetta magica viene utilizzata in modo tale che l'albero dendritico intero compreso il soma cellulare e tutti i rami dendritici sono completamente circondata dalla linea. (B). Il numero di punti di ramificazione è counted manualmente in immagini di cellule di Purkinje. Ogni punto di diramazione è contrassegnata da un punto giallo. Barra della scala = 50 micron.
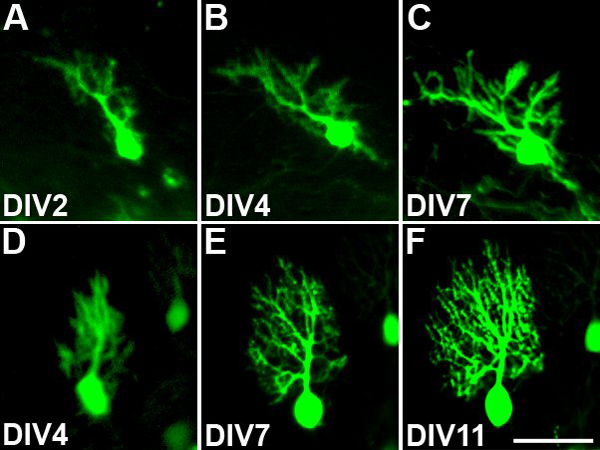
Figura 3. Controllo sviluppo dell'albero Purkinje cellule dendritiche. Identificati Purkinje cellule sono state fotografate ripetutamente per monitorare la crescita dell'albero dendritico. (AC): albero dendritiche di una cellula di Purkinje cresce e si sviluppa di giorno in vitro (DIV) 2 fino DIV7. Vi è una crescita continua e la ramificazione dei dendriti durante questo periodo la cultura. (DF): albero dendritiche di una cellula di Purkinje cresce e si sviluppa da DIV4 fino DIV11. L'albero dendritico si espande notevolmente in questo periodo la cultura. Barra della scala = 50 micron.
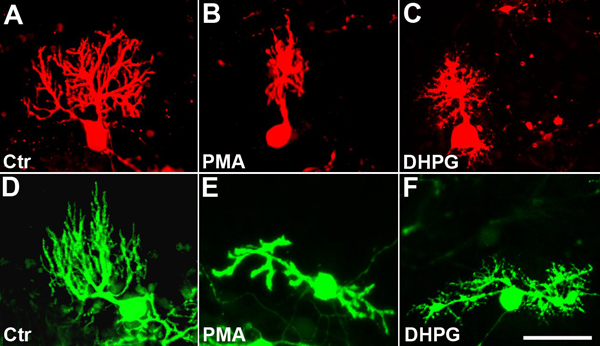
Figura 4. Sviluppo della struttura ad albero di Purkinje cellule dendritiche è inibita da PKC o mGluR1 stimulatia (A), (D):. cellule di controllo non trattate con un albero dendritico ben sviluppato. (B), (E): Dopo 9 giorni di trattamento con PMA dendriti appare ispessita e dell'albero dendritico è molto ridotto in dimensioni. Le cellule spesso perdono la loro polarizzazione e diventare bipolare (E). (C), (F): Dopo 9 giorni di trattamento DHPG dell'albero dendritico è molto ridotte. Differenza nel trattamento PMA, molti rami laterali molto sottili e corti sono presenti sui dendriti primarie e secondarie. Cellule spesso perdono la loro polarizzazione e diventare bipolare (F). Cellule di Purkinje sono stati visualizzati da anti-Calbindin immunocolorazione in (A - C) e da EGFP-espressione in colture derivate da Pcp2-EGFP topi in (D - F). Barra della scala = 50 micron.
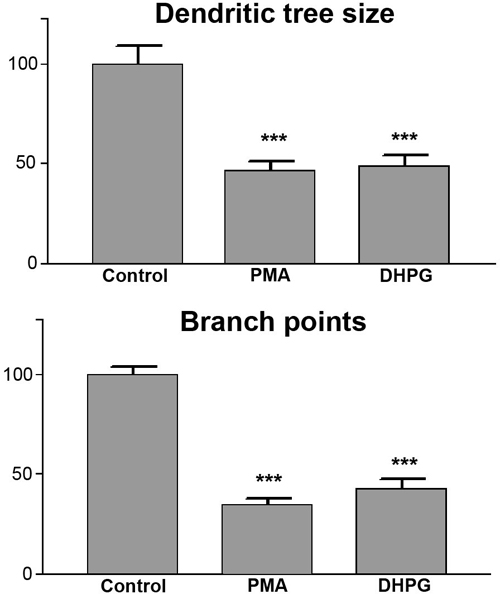
Figura 5. Valutazione quantitativa delle dimensioni cellulari albero dendritiche Purkinje e la ramificazione. Misurazioni quantitative mostrano che sia la dimensione dell'albero dendritico (grafico a barre in alto) e il number di nodi (grafico a barre inferiore) vengono notevolmente ridotti dopo il trattamento PMA o DHPG. Le differenze tra gli alberi dendritiche di controllo e alberi dendritiche delle cellule di Purkinje da colture trattate sono state significative con p <0,001.
Access restricted. Please log in or start a trial to view this content.
Discussione
I metodi qui presentati permettono di studiare lo sviluppo delle cellule di Purkinje dendritiche in colture organotipiche cerebellari fetta e valutare quantitativamente espansione Purkinje cellule dendritiche misurando dimensioni dendritiche albero e il numero di punti di ramificazione dendritiche. Naturalmente, un'analisi più ampia e sofisticata quantitativa dei dendriti delle cellule di Purkinje è possibile, ad esempio determinando lunghezza totale dendritiche, l'esecuzione di un'analisi Sholl o determin...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli esperimenti sugli animali sono stati eseguiti in conformità alla Direttiva Europea Comunità del Consiglio, del 24 novembre 1986 (86/609/CEE) e sono stati rivisti e consentito dalle autorità svizzere. Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal l'Università di Basilea, Dipartimento di Biomedicina, e il Fondo nazionale svizzero (31003A-116624).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Inserti di coltura | Millipore | PICM 03050 PICM ORG50 | I PICMORG50 inserti hanno un bordo basso e consentire la visualizzazione di fermenti vivi al microscopio |
| MEM | Gibco, Invitrogen | 11012044 | |
| Glutamax 1 | Gibco, Invitrogen | 35050038 | |
| Basale Medum Aquila | Gibco, Invitrogen | 41010026 | |
| Siero di cavallo | Gibco, Invitrogen | 26050070 | |
| Forbolo 12-myristaTE 13-acetato (PMA) | Tocris | 1201 | |
| (RS) -3,5-diidrossi-fenilglicina (DHPG) | Tocris | 0342 | |
| Coniglio anti-calbindina D-28K | Swant | CB38 | |
| Anti NeuN, clone A60 | Chemicon, Millipore | MAB377 | |
| Coniglio anti-GFP | Abcam | Ab290 |
Riferimenti
- Bosman, L. W., Hartmann, J., Barski, J. J., Lepier, A., Noll-Hussong, M., Reichardt, L. F., Konnerth, A. Requirement of TrkB for synapse elimination in developing cerebellar Purkinje cells. Brain Cell Biol. 35, 87-101 (2006).
- Boukhtouche, F., Janmaat, S., Vodjdani, G., Gautheron, V., Mallet, J., Dusart, I., Mariani, J. Retinoid-related orphan receptor alpha controls the early steps of Purkinje cell dendritic differentiation. J. Neurosci. 26, 1531-1538 (2006).
- Kapfhammer, J. P. Cellular and molecular control of dendritic growth and development of cerebellar Purkinje cells. Prog. Histochem. Cytochem. 39, 131-182 (2004).
- Kapfhammer, L. C. Cerebellar slice cultures. Protocols for Neural cell culture. Doering, J. P. , 4th edition, Springer Protocols Handbooks. 285-298 (2010).
- Gugger, O. S., Kapfhammer, J. P. Reduced size of the dendritic tree does not protect Purkinje cells from excitotoxic death. J. Neurosci. Res. 88, 774-783 (2010).
- Li, J., Gu, X., Ma, Y., Calicchio, M. L., Kong, D., Teng, Y. D., Yu, L., Crain, A. M., Vartanian, T. K., Pasqualini, R., Arap, W., Libermann, T. A., Snyder, E. Y., Sidman, R. L. mediates Purkinje cell dendritic development via lysyl oxidase propeptide and NF-κB signaling. Neuron. 68, 45-60 (2010).
- Metzger, F., Kapfhammer, J. P. Protein kinase C activity modulates dendritic differentiation of rat Purkinje cells in cerebellar slice cultures. Eur. J. Neurosci. 12, 1993-2005 (2000).
- Schrenk, K., Kapfhammer, J. P., Metzger, F. Altered dendritic development of cerebellar Purkinje cells in slice cultures from protein kinase C?-deficient mice. Neuroscience. 110, 675-689 (2002).
- Sirzen-Zelenskaya, A., Zeyse, J., Kapfhammer, J. P. Activation of class I metabotropic glutamate receptors limits dendritic growth of Purkinje cells in organotypic slice cultures. Eur. J. Neurosci. 24, 2978-2986 (2006).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Tomomura, M., Rice, D. S., Morgan, J. I., Yuzaki, M. Purification of Purkinje cells by fluorescence-activated cell sorting from transgenic mice that express green fluorescent protein. Eur. J. Neurosci. 14, 57-63 (2001).
- Weyer, A., Schilling, K. Developmental and cell type-specific expression of the neuronal marker NeuN in the murine cerebellum. J. Neurosci. Res. 73, 400-409 (2003).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon