このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
三次元コラーゲンマトリックスアッセイにおけるマウスのドーパミンと線条体片の解剖と文化
要約
中脳ドーパミン系と線条体からの外植片は、のためにコラーゲンマトリックスアッセイで使用されている in vitroで分析。このアッセイでは軸索伸長やガイダンスを操作して定量することができる。また、他の地域や分子手がかりを評価するために変更することができます。
要約
線条体1を含む終脳のいくつかの分野に向かって内側前脳束を経由して中脳ドーパミン(mdDA)ニューロンのプロジェクト。相互に、線条体黒質(直接)経路を生み出す線条体の中型有棘ニューロンは黒質2を支配する。これらの軸索路の開発は、神経突起によって、または(中間)のターゲット領域3,4から放出される分子を含む軸索成長とガイダンスの手がかりの茄多の組合せの行動に依存しています。これらの可溶性因子は、細胞外環境を模倣した軸索の三次元基板を提供するコラーゲンマトリックスで培養mdDA、そして/または、線条体の外植片によって in vitro で検討することができます。さらに、コラーゲンマトリックス(例えば、参考文献5および6を参照)近傍に配置された他の外植片または細胞から放出されるタンパク質の比較的安定した勾配の形成が可能になります。ここでは、PUR用のメソッドを記述するコラーゲンゲルとその後の免疫組織化学的および定量分析でラット尾コラーゲン、ドーパミンと線条体の外植片の顕微解剖、自分たちの文化のification。最初に、E14.5マウス胚の脳は、絶縁されており、ドーパミンと線条体の外植片は、マイクロダイセクションされています。これらの外植片は、その後の(共)、in vitroで 48から72時間のカバースリップ上にコラーゲンゲル内で培養されています。その後、軸索突起が定量化されるニューロンマーカー(例えば、チロシンヒドロキシラーゼ、DARPP32、またはβIIIチューブリン)と、軸索の成長と魅力的または反発軸索応答を用いて可視化されています。この神経細胞の調製は、開発時にmesostriatalと線条体黒質軸索成長とガイダンスの細胞および分子メカニズムのin vitro試験のための便利なツールです。このアッセイを使用して、それがドーパミンと線条体軸索のために他の(中間)の目標を評価するために、または特定の分子の手がかりをテストすることも可能です。
プロトコル
1。ラット尾コラーゲンの調製
- 6月10日成体ラットの尾(それは使用するまで-20℃で尻尾を格納することが可能です)を収集。
- 室温(RT)で一晩、95%エタノール中で尾を浸します。
ラットの尾の解剖(組織培養フード内):
(それらを使用していない場合、70%エタノールでツールを保持し、この手順全体を通して使用されるすべてのソリューション、ツール、ガラス製品は、無菌であることを確認してください)
- 尾から腱を収集するには、尾の先端を切り落とした。鉗子のペアで尾の大きい方の端を保持します。ホールド、曲げや他の鉗子に近い尾を破るために鉗子の別のペアを使用しています。引き離すと腱が取り残される( 図1A、B)。
- 滅菌H 2 Oの腱を収集し、すべての腱を採取した後、滅菌H 2 Oを使用して新しいペトリ皿に移動します
- 2から3腱を取るために2組を使用してそれらを細断処理滅菌H 2 Oを使用して新しいペトリ皿でCEPSこのような静脈(; 図1C腱組織は光沢のある反射である)などの非腱組織を除去する。すべての非腱組織を除去した後、それぞれの尾は腱の約100から150 mgを得られます。
- 滅菌3%酢酸300mlに腱を転送し、4℃で一晩ゆっくりかき混ぜる℃、
- 滅菌3%酢酸の追加200ミリリットルを追加し、4℃で一晩ゆっくりかき混ぜる℃、
- 4で120分間〜2700×gで腱を含む酢酸溶液を遠心°Cペレットの非溶解腱および非腱組織へ。
- 遠心分離中に透析チューブを準備します。
- 40cmの部分をカット
- 5分間500μMEDTAで沸騰
- 滅菌H 2 Oでクール
- 透析チューブの一方の端に結び目を作ると自動pipettを使用して組織培養フード内で氷上で遠心腱液の上清をチューブを埋めるeと25mlのピペット。気泡を生成することは避けてください。結び目は、チューブのすべての部分が( 図1D)氷の上で無菌アルミ箔上にチューブや店舗チューブのもう一方の端を、いっぱいになるまで。
- 組織培養フード内で無菌0.1X MEMは、pH 4.0の10リットルを準備します。チューブの部分にフローターを追加し、10リットルのビーカーにあらかじめ冷却0.1X MEM液にこれらを追加します。 4℃で一晩透析°Cをゆっくり撹拌しながら。 pHが低く維持しながら、この透析は、過剰な酸を削除します。
- 新しい事前水冷10リットル0.1X MEMと交換して、4℃で一晩攪拌℃、
- 新しい事前水冷10リットル0.1X MEMで置き換えて、前述の手順を繰り返して、4℃で一晩攪拌℃、
- 滅菌した50mlチューブにアリコートコラーゲン溶液。 4℃で保存のアリコート6-12ヶ月保つ、唯一の組織培養フード内でコラーゲンの在庫を処理します。
- それは精製されたコラーゲンはコラーゲンMATRで最適な結果を得るために(0.1×MEM)で希釈する必要があるかどうかをテストすることが重要です。IXアッセイ。したがって、コラーゲン希釈系列を生成します(原液コラーゲン、1:1、1:2と1:5希釈)を、最適なコラーゲン希釈を決定するために下記のようにコラーゲンマトリックスアッセイを実行します。
2。ドーパミン作動性中脳7,8の解剖
- 母親の子宮からE14.5マウス胚を分析し、必要になるまで氷の上でL15培地中に保持します。
後続のすべての解剖の手順は、氷の上でL15培地中で行われています。
- 脳を解剖する。
- それぞれの終脳胞の内側の部分(線条体の外植片のための終脳胞を使用)に沿って切断することによって終脳を削除します。
- 髄鞘を削除します。
- 脳たわみのちょうど吻側腹カットを行います。
- 脳たわみのちょうど尾別の腹のカットを行います。
- microdissectioを使用して、背側正中線に沿ってrostrocaudalカットを行う基礎となる腹側中脳組織を露出するn個のナイフ。それはドーパミン作動性ニューロン( 図2)が含まれていると腹側中脳組織をヒットしないように注意してください。
- 2 rostrocaudalカットは横方向と背側中脳組織を削除する腹側正中線と平行にしてください。
- 顕微解剖ナイフを使用して、外植片に、残りの腹側中脳組織を分割します。
- 使用時まで氷中に5%FBSを含むL15培地に外植片を格納します。
3。線条体の解剖
すべての解剖の手順は、氷の上でL15培地中で行われています。
- 脳の解剖時に解剖し終脳胞を使用しています。
- 視床と鉗子を用いて線条体の間に切断することにより視床を削除します。
- そのような嗅球など吻側構造を削除する線条体への吻側中外カットを行います。線条体に尾側に位置し、組織に対して、この手順を繰り返します。
- 位置線条体のコロナのビューを取得するために、残りのスライス( 図2)。
- 線条体は、組織のやや密(より透明)の一部として認識することができます。顕微解剖ナイフを使用して、外植片に線条体およびカットを分析する。外側と内側神経節隆起の移行ニューロンを含む正中線に近く、やや暗い組織を避けることができます。
- 使用時まで氷中に5%FBSを含むL15培地に外植片を格納します。
4。アセンブリコラーゲンマトリックスアッセイ
コラーゲンの調製(氷上ですべてのステップを冷却し、ピペットチップを使用します)
- 10倍MEMを100μlと1M重炭酸ナトリウム40μlの(NaHCO 3水溶液 )で希釈し、コラーゲンの860μlを混合し、氷上に置きます。この時点で、コラーゲンが温まるなら、それは強固なものになります。
- 4よくヌンク皿のウェルにカバースリップに準備されたコラーゲンの20μlのドロップ(直径約5 mm)を追加するそれは30分(周囲のO 2濃度が十分である)のため°C、5%CO 2、37 CO 2インキュベーターに放置。このインキュベーションの間にコラーゲンがゼラチン化します。
コラーゲンゲルのセットアップ共培養
- コラーゲンはゼラチン化した後、コラーゲンにドーパミンや線条体の外植片を転送するために200μlの先端にピペットを使用しています。
- 針を使用して相互に近接して外植片を移動します。 1片(〜200から300μm)を( 図2)の約直径の距離で、それらを離れてください。
- 余分な培地を除去し、外植片の上に準備されたコラーゲンの20μlを加える。これは多くの場合、外植片が移動するようになります。 4.4で説明されるように針を用いて外植片の位置を変更します。
- コラーゲンは37℃、5%CO 2で30分間、続いて室温で15分間固化しましょう。
- コラーゲンが設定した後、電子の400μlを加えるxplant媒体と37℃CO 2インキュベーター内で2〜3日間成長℃、5%CO 2。
5。免疫組織化学と定量化による解析
免疫組織化学
- 外植片を修正するには、静かに培地400μlの(これにより、4%PFAを希釈)をPBSで8%のパラホルムアルデヒド(PFA)400μlを加え、室温で1時間放置してみましょう。
- 室温でPBSで3倍の15分間洗浄します。
- ブロッキングバッファー中でインキュベートする(BB、PBS + 1%FBS + 0.1%トリトンX-100)で2時間。
- 4℃でBBで一次抗体で一晩インキュベートドーパミン作動性の軸索は、線条体軸索抗DARPP32抗体(1:500)9およびすべての軸索抗βIIIチューブリン(1:3000)7を可視化するための抗チロシン水酸化酵素抗体(1:1000)7を使用してください。
- 室温でPBSで5倍の1時間洗浄します。
- 一晩4 BBの適切なフルオロフォア(1:500)にコンジュゲート二次抗体でインキュベート℃のこのステップからの光(例えば、アルミ箔でそれらをカバーする)への外植片の曝露を最小限に抑えます。
- 4℃でPBSで一晩洗浄°C次の日の間に数回の洗浄が続く。
- 退色防止剤封入剤を長く使用してスライドを顕微鏡で外植片をマウントします。ガラス顕微鏡スライド上で〜10μlのドロップを追加します。カバースリップを取るとそっと下向きに植側に取り付け培地のドロップの上に置きます。非常に穏やかに取り付け培地のドロップでそれを下げることによって、デ·カバースリップの下に空気が入らないようにします。
P / D比を計算することによって定量化
- 落射蛍光顕微鏡( 図3)を使用して、外植片のデジタル画像を取得します。
- これらの画像を使用して、近象限(隣接する植に最も近い植すなわち一部)と遠位象限(隣接explaから最も遠い片の一部を生成するために象限にそれぞれ植を分割NTの場合)( 図2、4)。
- 外植片からの両方の近位および遠位の象限における新興20長い神経突起の長さを測定します。
- 個々の外植のためにP / D比を計算するために20の最長神経突起の平均長を使用しています。比<1は、軸索反発を示しながら、AP / D比> 1は、軸索の魅力を示しています。
- いくつかのケースでは、神経突起の密な成長は、個々の神経突起の長さの評価を防ぐことができます。このような状況では、定量化は、植の端と近位および遠位象限の軸索の成長をリードするフロント間の距離を測定することによって行うことができます。
6。代表的な画像
ドーパミンと線条体の外植片の成功培養した後の軸索の多数(図示せず)は明視野顕微鏡を用いて、可視または抗βIIIチューブリンの免疫細胞化学などによって可視化しています。これらの軸索のサブセットは、ドーパミン作動性またはsになります可視化を使用して免疫細胞としてtriatal軸索( 図3)。説明したように象限に外植片を分割し、P / D比を決定することにより、推定される軸索の魅力や反発効果が( 図3E)を定量することができる。

図1:ラット尾の腱からコラーゲンの調製を示す写真。ラットの尾を離れて引っ張る)は腱を公開しています。 B)腱は、ロープ状のバンドルとして表示されます。 C)腱は、光沢のある白い外観によって静脈から区別することは簡単です。 D)酢酸に腱を溶解後、溶液を透析チューブに転送されます。溶存コラーゲンの寒さを保つために、チューブを氷上に滅菌したアルミ箔上に配置されます。
E 2 "SRC =" / files/ftp_upload/3691/3691fig2.jpg "/>
図2。手続きの異なる段階を示す模式図。適切な脳の領域は、解剖し、外植片を生成するためにカットされています。単一の脳と線条体の外植片は、コラーゲンマトリックスに近接して配置され、37℃で48〜72時間のために成長して残っている軸索は、蛍光免疫組織化学によって可視化しており、P / D比はchemotropic応答を定量化するために計算されます。
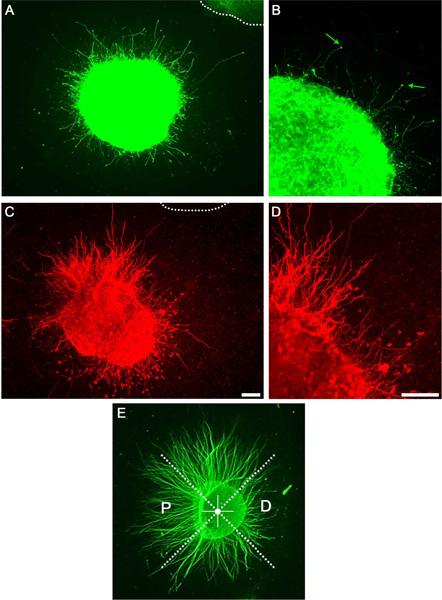
図3。コラーゲンマトリックス培養で軸索成長を示す代表的な結果。軸索伸長を明らかにし、抗チロシンヒドロキシラーゼ抗体で染色したA)中脳片。点線は、隣接した外植片を示します。表示個々の神経突起と成長円錐のB)倍率(矢印)。 C)線条体片は抗DARPP32で染色した。 D)Cの倍率は、個々の神経突起を示す。 E)の例P / D比の定量。外植片は、同じ象限に分かれています。遠象限は、それから離れに直面している間に近象限は、隣接する外植片に直面している。スケールバーは100μmを示す。
ディスカッション
コラーゲンマトリックスアッセイは、ここで説明する(例えば、参照する5-8を参照)軸索ガイダンス分子と神経系の様々を調査するために過去数十年の多くの異なるラボで使用され、改善されました。これらの研究は、このアッセイは、効果と異なる(中間)の標的組織から分泌される軸索ガイダンス分子の調節を研究するための強力なツールであることが示されている。
開示事項
我々は、開示することは何もありません。
謝辞
コラーゲンマトリックスのアッセイは、過去二から三十年の間に多くの異なった研究グループの作業によって開発され、改善されました。ドーパミンと線条体の外植片のためにここで説明するアプローチは非常にこれらの研究から恩恵を受ける。さらに、著者らは、線条体の外植片培養を設定する際に彼女の助けをAsheetaプラサドに感謝します。ラボでの作業は、ヒューマン·フロンティア·サイエンス·プログラム推進機構(キャリア開発賞)によって資金を供給され、健康の研究開発のオランダ機構(ZonMW-ビディとZonMW-TOP)、Europanian連合(mdDA-NeuroDev、FP7/2007-2011 、グラント222999)(RJPに)、および科学研究費オランダ機構(TopTalent、ERESに)。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ウシ胎仔血清 | BioWhittaker | 14-801f未 | |
| グルタミン(200mMの) | PAA | M11-004 | |
| HEPES | VWRインターナショナル | 441476L | |
| β-メルカプトエタノール | メルク | 444203 | |
| 最小必須培地(MEM) | ギブコ | 61100-087 | |
| Neurobasal | ギブコ | 21103-049 | |
| B27 | ギブコ | 17504-044 | |
| リーボビッツのL-15培地 | ギブコ | 11415-049 | |
| ペニシリン - ストレプトマイシン | ギブコ | 15070-063 | |
| Gold褪色防止試薬を延長 | インビトロジェン | P36930 | |
| 透析チューブ | スペクトラムラボ | 132660 | |
| ウサギ抗チロシンヒドロキシラーゼ | PEL-FREEZ | P40101-0 | |
| ウサギ抗DARPP32(H-62) | サンタクルス | SC-11365 | |
| マウス抗βIIIチューブリン | シグマ | T8660 | |
| のAlexa Fluor®は、二次抗体を標識した | インビトロジェン |
参考文献
- van den Heuvel, D. M., Pasterkamp, R. J. Getting connected in the dopamine system. Prog. Neurobiol. 85, 75-93 (2008).
- Lobo, M. K. Molecular profiling of striatonigral and striatopallidal medium spiny neurons past, present, and future. Int. Rev. Neurobiol. 89, 1-35 (2009).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298, 1959-1964 (2002).
- Chilton, J. K. Molecules mechanisms of axon guidance. Dev. Biol. 292, 13-24 (2006).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Tessier-Lavigne, M., Placzek, M., Lumsden, A. G., Dodd, J., Jessel, T. M. Chemotropic guidance of developing axons in the mammalian central nervous system. Nature. 336, 775-778 (1988).
- Kolk, S. M., Gunput, R. A., Tran, T. S., van den Heuvel, D. M., Prasad, A. A., Hellemons, A. J., Adolfs, Y., Ginty, D. D., Kolodkin, A. L., Burbach, J. P., Smidt, M. P., Pasterkamp, R. J. Semaphorin 3F is a bifunctional guidance cue for dopaminergic axons and controls their fasciculation, channeling, rostral growth, and intracortical targeting. J. Neurosci. 29, 12542-12557 (2009).
- Fenstermaker, A. G., Prasad, A. A., Bechara, A., Adolfs, Y., Tissir, F., Goffinet, A., Zou, Y., Pasterkamp, R. J. Wnt/planar cell polarity signaling controls the anterior-posterior organization of monoaminergic axons in the brainstem. J. Neurosci. 30, 16053-16064 (2010).
- Arlotta, P., Molyneaux, B. J., Jabaudon, D., Yoshida, Y., Macklis, J. D. Ctip2 controls the differentiation of medium spiny neurons and the establishment of the cellular architecture of the striatum. J. Neurosci. 28, 622-632 (2008).
- De Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
- Gähwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends Neurosci. 20, 471-477 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved