É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dissecção e Cultura do mouse e dopaminérgico do estriado explantes em três dimensões Ensaios matriz de colágeno
Neste Artigo
Resumo
Explantes a partir do sistema de dopamina mesencéfalo e corpo estriado são utilizados num ensaio de matriz de colagénio para o In vitro Análise do desenvolvimento via mesostriatal e estriatal. Neste ensaio crescimento axonal e orientação podem ser manipulados e quantificado. Ele também pode ser modificado para avaliar outras regiões ou pistas moleculares.
Resumo
Mesencéfalo a dopamina (mdDA) projeto neurônios através do feixe medial do prosencéfalo para diversas áreas do telencéfalo, incluindo o 1 striatum. Reciprocamente, médio neurónios espinais no estriado que dão origem à via (directo) Estriatonigral inervam a substantia nigra 2. O desenvolvimento desses setores axônio é dependente das ações combinatória de uma infinidade de crescimento do axônio e pistas de orientação, incluindo as moléculas que são liberadas por neurites ou por regiões (Intermediário)-alvo 3,4. Estes factores solúveis podem ser estudada in vitro por mdDA cultura e / ou explantes do estriado em uma matriz de colagénio que proporciona um substrato tridimensional para os axónios que imitam o ambiente extracelular. Além disso, a matriz de colagénio permite a formação de gradientes relativamente estáveis de proteínas libertadas por explantes outros ou células colocadas na proximidade (por exemplo, ver as referências 5 e 6). Aqui descrevemos métodos para os finsificação de colágeno da cauda de rato, microdissecção de explantes e dopaminérgicos no estriado, a sua cultura em géis de colágeno e análise imuno-histoquímica e quantitativa posterior. Primeiro, o cérebro de embriões de camundongos E14.5 são isoladas e dopaminérgicos estriatais e explantes são microdissectados. Estes explantes são, em seguida, (co) cultivados em géis de colagénio em lamelas durante 48 a 72 horas in vitro. Posteriormente, as projeções axonais são visualizados por meio de marcadores neuronais (eg tirosina hidroxilase, DARPP32, ou tubulina βIII) e crescimento do axônio e respostas axônio atrativas ou repulsivas são quantificados. Esta preparação neuronal é uma ferramenta útil para estudos in vitro dos mecanismos celulares e moleculares do crescimento do axônio mesostriatal e estriatal e orientação durante o desenvolvimento. Utilizando este ensaio, também é possível avaliar outros (Intermediário) alvos para axônios dopaminérgicos e estriado ou para testar específicos pistas moleculares.
Protocolo
1. Preparação de Colágeno da cauda de rato
- Collect 6-10 caudas de ratos adultos (é possível armazenar as caudas a -20 ° C até à sua utilização).
- Embeber as caudas em etanol a 95% durante a noite à temperatura ambiente (RT).
Dissecção de caudas de rato (em capuz de cultura de tecido):
(Manter as ferramentas em etanol a 70% quando não usá-los e se certificar de que todas as soluções, ferramentas e utensílios de vidro usados em todo este procedimento são estéreis)
- Para a coleta de tendões da cauda, corte a ponta da cauda. Mantenha extremidade grande da cauda com um par de pinças. Use um par de pinças para segurar, dobrar e quebrar o rabo perto de pinça outros. Separar e os tendões será deixado para trás (Figura 1A, B).
- Colete os tendões em estéril H 2 O e depois de coletar todos os tendões movê-los para um novo com petridish estéril H 2 O.
- Tome 2-3 tendões e retalhar-los usando 2 pares de paraceps em uma nova petridish com estéril H 2 O. Remover não-tecido do tendão, como veias (tecido do tendão é brilhante e reflexiva; Figura 1C). Após a remoção de todo o tecido não-tendão, cada cauda produz aproximadamente 100-150 mg de tendões.
- Transfira os tendões a 300 ml de ácido acético a 3% estéril e agita-se lentamente durante a noite a 4 ° C.
- Adicionar uma de 200 ml adicionais de ácido 3% estéril acético e agita-se lentamente durante a noite a 4 ° C.
- Centrifugar a uma solução de ácido acético contendo os tendões a ~ xg 2700 durante 120 min a 4 ° C a pelota não dissolvidas tendões e não-tecidos do tendão.
- Durante a centrifugação preparar tubo de diálise:
- cortar pedaços de 40 cm
- ferver em 500 mM de EDTA durante 5 min
- legal em estéril H 2 O
- Amarrá um nó em uma extremidade do tubo de diálise e encher o tubo com o sobrenadante da solução tendão centrifugada em gelo no capuz de cultura de tecido usando um pipetar automáticoE e uma pipeta 25 ml. Evitar a produção de bolhas. Nó a outra extremidade do tubo eo tubo loja em folha de alumínio estéril em gelo até que todos os pedaços de tubo são preenchidos (Figura 1D).
- Preparar 10 litros de estéril 0,1 X MEM, pH 4,0, no capuz de cultura de tecidos. Adicionar flutuador para peças de tubagem e adicioná-los à solução pré-arrefecida MEM 0,1 X num copo de 10 l. Dializar durante a noite a 4 ° C enquanto lentamente sob agitação. Este diálise remove o excesso de ácido, mantendo o pH baixo.
- Substitua por uma nova pré-arrefecido 10 l 0,1 X MEM e agitar a noite a 4 ° C.
- Repetir o passo anterior, substituindo com o novo pré-arrefecida de 10 l 0,1 X MEM e agita-se durante a noite a 4 ° C.
- Solução alíquota de colagénio em tubos de 50 ml estéreis. Loja alíquotas a 4 ° C. Mantenha 6-12 meses, apenas lidar com o estoque de colágeno na capa cultura de tecidos.
- É importante para testar se o colagénio purificado precisa de ser diluído (em 0,1 x MEM) para se obter resultados óptimos na MATR colagénioensaio ix. Portanto, gerar uma série de diluições de colagénio (colagénio não diluído, 1:1, 1:2 e 1:5 diluído) e realizar ensaios de matriz de colagénio, tal como descrito abaixo para determinar a diluição de colagénio óptima.
2. Dissecção do mesencéfalo dopaminérgico 7,8
- Dissecar E14.5 embriões de camundongos do útero da mãe e se manter em meio L15 no gelo até ser necessário.
Todos os passos de dissecção subsequentes são realizados em meio L15 em gelo.
- Dissecar o cérebro.
- Retire o telencéfalo cortando ao longo da parte medial de cada vesícula telencefálico (use as vesículas telencefálicos para explantes estriado).
- Remover a bainha das meninges.
- Faça um corte dorsoventral apenas rostral da flexura mesencefálica.
- Faça outro corte dorsoventral apenas caudal da flexura mesencefálica.
- Fazer um corte rostrocaudal ao longo da linha média dorsal usando um microdissection faca para expor o tecido do mesencéfalo ventral subjacente. Tenha cuidado para não bater o tecido mesencéfalo ventral, já que contém os neurônios dopaminérgicos (Figura 2).
- Fazer dois cortes rostrocaudal lateral e paralelamente à linha média ventral para remover o tecido do mesencéfalo dorsal.
- Divida o tecido mesencéfalo ventral restante em explantes usando uma faca microdissecção.
- Armazenar os explantes em L15 meio contendo FBS a 5% em gelo até à utilização.
3. Dissecção do estriado
Todos os passos são realizados em dissecação L15 médio em gelo.
- Use vesículas telencefálicos dissecados durante o esvaziamento do mesencéfalo.
- Remover o tálamo cortando entre o tálamo e corpo estriado utilizando fórceps.
- Faça um corte médio-lateral rostral para o estriado para remover estruturas rostrais como o bulbo olfativo. Repetir este passo para o tecido localizado caudalmente ao corpo estriado.
- Posiçãoa fatia remanescente para se obter uma vista coronal do estriado (Figura 2).
- O corpo estriado pode ser reconhecida como uma parte ligeiramente menos densa (mais transparente) de tecido. Dissecar para fora do corpo estriado e corte em explantes utilizando uma faca microdissecação. Evite o tecido um pouco mais escura perto da linha média, que contém neurônios que migram da eminência lateral e medial ganglionar.
- Armazenar os explantes em L15 meio contendo FBS a 5% em gelo até à utilização.
4. Assembléia de colágeno Ensaios Matrix
Preparação do colágeno (todos os passos sobre o gelo, use a ponteira resfriada)
- Misturar 860 uL de colagénio diluída com 100 ul de MEM de 10x e 40 ul de bicarbonato de sódio 1M (NaHCO3) e manter em gelo. Se neste momento o colágeno aquece vai solidificar.
- Adicionar uma gota de 20 ul (cerca de 5 mm de diâmetro) de colagénio preparada para uma lamela em um poço de um prato 4-bem Nunce deixar repousar num incubador de CO2 a 37 ° C e 5% de CO2 durante 30 min (ambiente concentração de O 2 é suficiente). Durante esta incubação o colagénio será gelatinizar.
Instalação de co-cultura em gel de colágeno
- Após o colagénio tem gelatinizado, utilizar uma pipeta com uma ponta 200 uL de transferir um explante dopaminérgico ou estriado para o colagénio.
- Mover os explantes em estreita proximidade entre si, utilizando uma agulha. Afastá-los a uma distância de aproximadamente o diâmetro de um explante (~ de 200-300 uM) (Figura 2).
- Remover o excesso de médio e adicionar 20 uL de colagénio preparada em cima dos explantes. Isso muitas vezes fazer com que os explantes para se mover. Reposicionar os explantes utilizando uma agulha, tal como descrito em 4.4.
- Deixe a colagénio solidificar durante 15 min a RT seguido por 30 min a 37 ° C e 5% de CO 2.
- Depois que o colágeno tem definido, adicionar 400 ul de emédio xplant e crescer durante 2-3 dias num incubador de CO2 a 37 ° C e 5% de CO 2.
5. Análise por imuno-histoquímica e Quantificação
Imunohistoquímica
- Para corrigir explantes, suavemente adicionar 400 uL de paraformaldeído 8% (PFA) em PBS a 400 uL de meio (diluindo o PFA a 4%) e deixar repousar durante 1 hora à RT.
- Lavar 15 min 3x em PBS à temperatura ambiente.
- Incubar em tampão de bloqueio (BB; PBS + 1% de FBS + Triton 0,1% X-100) durante 2 horas.
- Incubar durante uma noite com o anticorpo primário em APA a 4 ° C. Para axônios dopaminérgicos usar anti-tirosina hidroxilase anticorpos (1:1000) 7, para os axônios estriatais anti-DARPP32 anticorpos (1:500) e 9 para visualizar todos os axônios anti-βIII tubulina (1:3000) 7.
- Lavar horas uma 5x em PBS à temperatura ambiente.
- Incubar com anticorpo secundário conjugado com o fluoróforo adequado (1:500) em APA durante a noite a 4° C. A partir deste passo em minimizar a exposição dos explantes à luz (por exemplo, os cobrir com folha de alumínio).
- Lavar durante a noite em PBS a 4 ° C, seguida por várias lavagens durante o dia seguinte.
- Monte explantes em microscópio lâminas usando Prolongar reagente Antifade meio de montagem. Adicionar uma gota de ~ 10 ul numa lâmina de microscópio de vidro. Pegue a lamela e gentilmente coloque-o sobre a queda de meio de montagem com o lado explante voltado para baixo. Evite prender o ar sob a lamela de por muito suavemente baixá-lo sobre a queda de meio de montagem.
Quantificação por meio do cálculo P / D rácio
- Aquisição de imagens digitais dos explantes utilizando um microscópio de epifluorescência (Figura 3).
- Usando essas imagens, dividir cada explante em quadrantes para gerar um quadrante proximal (isto é, parte do explante mais próximo do explante adjacente) e um quadrante distai (parte do explante mais distante da explicação adjacentent) (Figura 2, 4).
- Medir o comprimento de 20 mais longos neurites que emergem do explante tanto nos quadrantes proximais e distais.
- Use o comprimento médio das neurites mais longas 20 para calcular a relação P / D para cada explante individual. AP / D relação> 1 indica atração axônio, enquanto uma proporção <1 indica repulsão axônio.
- Em alguns casos, o crescimento de neurites densa impede a avaliação da duração de neurites individual. Nestas situações, a quantificação pode ser realizada através da medição da distância entre a borda do explante e da frente principal do crescimento axonal nos quadrantes proximais e distais.
6. Imagens representativas
Após cultura de sucesso de explantes dopaminérgicos e estriatal um grande número de axónios são visíveis por microscopia de campo brilhante ou como visualizado por anti-tubulina βIII imunocitoquímica (não mostrado). Um subconjunto destes axónios será dopaminérgico ou s axónios triatal como imunocitoquímica utilizando visualizada (Figura 3). Dividindo os explantes em quadrantes, tal como descrito e determinando P / D rácios, um efeito axónio putativo atraente ou repulsivo pode ser quantificada (Figura 3E).

Figura 1. Fotos ilustram a preparação de colagénio a partir de tendões da cauda de rato. A) separando a cauda de rato expõe os tendões. B) Os tendões são visíveis como corda-como feixes. C) Os tendões são fáceis de distinguir de veias por sua aparência brilhante branco. D) Depois de se dissolver os tendões em ácido acético, a solução é transferida para tubo de diálise. Para manter a frio colagénio dissolvido, os tubos são colocados em folha de alumínio estéril em gelo.
e 2 "src =" files/ftp_upload/3691/3691fig2.jpg / "/>
Figura 2. Esquemático indicando as diferentes etapas do processo. Regiões do cérebro adequadas são dissecados e cortados para gerar explantes. Um único e mesencéfalo explante estriatal estão posicionados na proximidade de uma matriz de colagénio e deixada crescer durante 48-72 horas a 37 ° C. Axónios são visualizados por imuno-histoquímica de fluorescência e uma relação de P / D é calculado para quantificar as respostas quimiotrópicos.
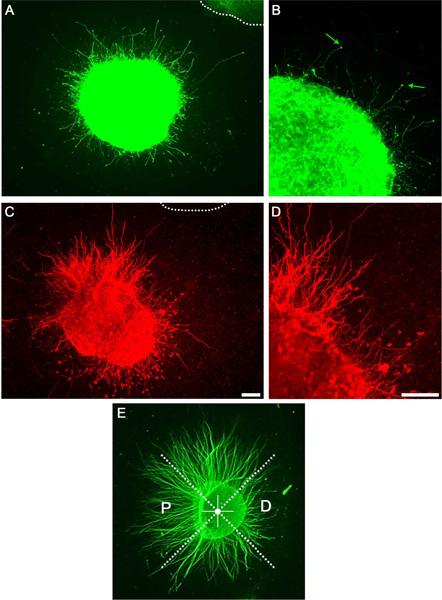
Figura 3. Os resultados representativos que mostram o crescimento axonal em uma cultura matriz de colagénio. A) explante Midbrain corados com anticorpo anti-tirosina hidroxilase revelando o crescimento axonal. A linha pontilhada indica explante adjacente. B) ampliação de um neurites mostram individuais e cones de crescimento (setas). C) explante estriatal corados com anti-DARPP32. D) Ampliação de C mostrando neurites individuais. Exemplo E) doP / D quantificação proporção. Explantes são divididos em quadrantes iguais. O quadrante proximal está voltada para o explante adjacente enquanto o quadrante distai está virada para fora dele. Barras de escala indicam 100 mm.
Discussão
O ensaio de matriz de colagénio aqui descrita foi usada e melhorado por muitos laboratórios diferentes nas últimas décadas para investigar uma variedade de moléculas de direccionamento axonal e sistemas neuronais (por exemplo, ver as referências 5-8). Estes estudos demonstraram que este ensaio é uma ferramenta poderosa para estudar os efeitos de regulação e de moléculas de direccionamento axonal secretadas por diferentes tecidos (Intermediário) alvo.
No entanto, deve notar-se que ...
Divulgações
Não temos nada a divulgar.
Agradecimentos
O ensaio de matriz de colágeno foi desenvolvido e aperfeiçoado pelo trabalho de muitos diferentes grupos de pesquisa durante os últimos dois a três décadas. As abordagens descritas aqui para explantes e dopaminérgicos estriatais se beneficiar imensamente com esses estudos. Além disso, os autores gostariam de agradecer Asheeta Prasad por sua ajuda na criação de culturas de explante estriado. O trabalho no laboratório foi financiada pela Organização Human Programa de fronteira da Ciência (Prêmio de Desenvolvimento de Carreira), a Organização Neerlandesa de Pesquisa em Saúde e Desenvolvimento (ZonMW-VIDI e ZonMW-TOP), a União Europanian (mdDA-NeuroDev, FP7/2007-2011 , Grant 222999) (a RJP), e da Organização Holandesa para Pesquisa Científica (TopTalent; para ERES).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Soro fetal de vitelo | BioWhittaker | 14-801F | |
| Glutamina (200mm) | PAA | M11-004 | |
| Hepes | VWR International | 441476L | |
| β-mercaptoetanol | Merck | 444203 | |
| Mínimo de mídia Essenciais (MEM) | Gibco | 61100-087 | |
| Neurobasal | Gibco | 21103-049 | |
| B27 | Gibco | 17504-044 | |
| L-15 de Leibovitz Médio | Gibco | 11415-049 | |
| Penicilina-Estreptomicina | Gibco | 15070-063 | |
| Prolongar Reagente Antifade Ouro | Invitrogen | P36930 | |
| Tubo de diálise | Espectro Labs | 132660 | |
| Hidroxilase anti-tirosina Coelho | Pel-Freez | P40101-0 | |
| De coelho anti-Darpp32 (H-62) | Santa-Cruz | Sc-11365 | |
| Rato tubulina anti-βIII | Sigma | T8660 | |
| Alexa Fluor rotulado anticorpos secundários | Invitrogen |
Referências
- van den Heuvel, D. M., Pasterkamp, R. J. Getting connected in the dopamine system. Prog. Neurobiol. 85, 75-93 (2008).
- Lobo, M. K. Molecular profiling of striatonigral and striatopallidal medium spiny neurons past, present, and future. Int. Rev. Neurobiol. 89, 1-35 (2009).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298, 1959-1964 (2002).
- Chilton, J. K. Molecules mechanisms of axon guidance. Dev. Biol. 292, 13-24 (2006).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Tessier-Lavigne, M., Placzek, M., Lumsden, A. G., Dodd, J., Jessel, T. M. Chemotropic guidance of developing axons in the mammalian central nervous system. Nature. 336, 775-778 (1988).
- Kolk, S. M., Gunput, R. A., Tran, T. S., van den Heuvel, D. M., Prasad, A. A., Hellemons, A. J., Adolfs, Y., Ginty, D. D., Kolodkin, A. L., Burbach, J. P., Smidt, M. P., Pasterkamp, R. J. Semaphorin 3F is a bifunctional guidance cue for dopaminergic axons and controls their fasciculation, channeling, rostral growth, and intracortical targeting. J. Neurosci. 29, 12542-12557 (2009).
- Fenstermaker, A. G., Prasad, A. A., Bechara, A., Adolfs, Y., Tissir, F., Goffinet, A., Zou, Y., Pasterkamp, R. J. Wnt/planar cell polarity signaling controls the anterior-posterior organization of monoaminergic axons in the brainstem. J. Neurosci. 30, 16053-16064 (2010).
- Arlotta, P., Molyneaux, B. J., Jabaudon, D., Yoshida, Y., Macklis, J. D. Ctip2 controls the differentiation of medium spiny neurons and the establishment of the cellular architecture of the striatum. J. Neurosci. 28, 622-632 (2008).
- De Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
- Gähwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends Neurosci. 20, 471-477 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados