Method Article
ラテラルフロー技術を用いた血液学的悪性腫瘍患者における侵襲性肺アスペルギルス症の検出
要約
侵襲性肺アスペルギルス症に対する迅速かつ正確なポイント·オブ·ケアテストが提示されます。それはに結合する特異的なモノクローナル抗体を使用して、横フロー技術を利用していますアスペルギルス抗原は肺感染症時に分泌される。アッセイは、血清およびbrochoalveolar洗浄と互換性があり、病気の診断のための新たな補助試験を表しています。
要約
侵襲性肺アスペルギルス症(IPA)は、罹患率および血液悪性腫瘍患者と造血幹細胞移植レシピエント1の死亡率の主要な原因です。 IPAの検出は手ごわい診断上の困難を表しており、 "ゴールドスタンダード"が存在しない場合に、臨床データと微生物学、病理組織学的実現可能との組み合わせに依存しています。 IPAの診断2 "可能性"と"可能性"侵襲性真菌疾患、研究と治療がんのと"実績" を定義アレルギー感染症真菌研究グループ(EORTC / MSG)コンセンサスの国立研究所のための欧州機関に準拠している必要があります。現時点では、核酸ベースのテストは、外部IPA検出のために検証されていないので、ポリメラーゼ連鎖反応(PCR)は、現在のEORTC / MSG診断基準に含まれていません。
組織切片におけるアスペルギルス症の同定のためシミの問題がある他の侵襲性真菌病原体3と、実績のあるIDを持つ菌糸の形態でlaritiesは、純粋培養で病原体の分離を必要とします。文化ベースのアプローチは、生検試料の可用性に依存しているが、これらは常に病気の患者ではアクセスできませんし、得られたときは、常に文化のための現実的な繁殖を生むとは限らない。
アスペルギルスの発症に重要な特徴は、血管浸潤免疫血清および気管支肺胞洗浄(BAL)液中で特徴的な抗原の署名分子を検出するテストを使用して菌を追跡する機会を提供して形質である。これはアスペルギルスガラクトマンナンと保存された真菌細胞壁成分を検出(1→3)-β-D-"パン真菌'アッセイ(Fungitellテスト)を検出Platelia酵素免疫測定法の開発(GM-EIA)につながっているグルカンではなく、それらの細胞壁1,4は、このコンポーネントを欠いているケカビ目インチです。これらのテスト1,4-6の精度を周囲の提訴は、次世代のモノクローナル抗体(MAb)ベースの感染症1,5のサロゲートマーカーを検出するアッセイの最近の発展につながっている。
ソーントン5は最近IPAのポイントオブケア(POC)診断のための免疫クロマトグラフの横フローデバイス(LFD)を開発するハイブリドーマ技術とその使用方法を使用して、 アスペルギルス特異的モノクローナル抗体(JF5)の生成を説明します。 LFDの主な利点は、MAb JF5は、真菌のみ5の活発な成長の間に分泌される細胞外の糖タンパク質抗原に結合するためのアクティビティを検出する能力である。これはアスペルギルス胞子が吸入空気の共通コンポーネントであるため、IPAを診断するため、肺のBALなどの流体を使用して、重要な考慮事項です。 IPAを診断する装置の有用性はLFDが改善感度と仕様を表示し、感染の動物モデルを使用して、実証されているificityはPlatelia GMとFungitell(1→3)-β-D-グルカンアッセイ7に比較されます。
ここでは、ヒト血清およびBAL液中にアスペルギルス抗原を検出するためのシンプルなLFD手順を提示します。そのスピードと精度は、血液悪性腫瘍患者におけるIPAの診断のための新たな補助ポイントオブケアテストを提供します。
プロトコル
1。収集、保管および血清および気管支肺胞洗浄液の調製
- 4℃で凝固するために使用する℃、-20℃でアリコートとして店舗血清°Cの前に血液を可能にすることにより、未処理の血液サンプルから血清を収集。気管支肺胞洗浄液(BAL)も、-20℃でアリコートとして格納する必要があります注:分注し、血清及びBALの記憶域が繰り返し繰り返しテスト中にサンプルの凍結融解することによって、標的抗原の分解の可能性を制限します。
- 雪解けサンプルと14,000 rpmで1分間ボルテックスし、遠心分離によって徹底的に血清およびBAL試料を混ぜ合わせる。
- ヒト血清サンプルのルーチンテストのために、組織培養培地(TCM)と血清1:1(v / v)を希釈します。 TCMは、RPMI-1640培地、10%(v / v)のウシ胎児血清、200mMのL-グルタミン溶液の1%(v / v)の、そして防腐剤としてアジ化ナトリウム(0.02%w / v)で構成されています。培地は事前に準備されており、数ヶ月間、4℃で保存することができます。 dilutの100μlを適用するLFDにED血清。
- 人間BAL流体、および動物モデルからBAL流体には、無治療前に、LFDにきちんとしたサンプル100μlを適用します。
- 動物モデルからの血清のために、リン酸塩は沸騰水浴、14,000 rpmで5分間遠心し、適用される100で4%(w / v)のEDTA、3分の熱を含む緩衝生理食塩水で血清1:2(v / v)を希釈するLFDデバイスへのきちんとした上清の添加。
2。ラテラルフローデバイスへの血清およびBALのアプリケーション
- 室温(23℃)で横方向のフローデバイスを格納します。この温度では、これらのデバイスは12ヶ月間安定しています。レベルの表面にその袋と場所からデバイスを削除します。
- 滅菌したピペットチップを使用して、デバイスのリリースポートに前処理した血清またはきちんとしたBAL試料100μlを適用します。
- アッセイは、テストの結果が記録されるべき時に室温で15分間、実行することができます。注:秒以内に流体がSEになるenは、観測窓のニトロセルロース膜に沿って毛管作用によって移行することができます。
3。 LFD結果を記録するとの解釈
- LFDは、内部制御ライン(プラスチックハウジング上に文字Cで示される)とテストライン(文字Tで示される)で構成されています。コントロールラインは常に血清またはBAL試料中にアスペルギルス抗原にかかわらず表示されます。これは、アッセイが正しく実行されたことを示しています。
- アスペルギルス抗原は、血清またはBAL試料中に存在する場合は、テストラインは、サンプル·アプリケーションの15分内に表示されます。試験線の強度は、試料中のアスペルギルス抗原の存在量に比例するので、テストラインが(+)弱い陽性として表示されることが、中等度陽性(+ +)または強い正(+ + +) 。しかし、任意の正のテストラインは関係なく、強度、試料中のアスペルギルス抗原の存在を示すことになる。番目のアスペルギルス抗原の電子の不在は、全くテストラインが表示されません、結果は負の値として記録されます( - )。
4。代表的な結果
BALと血清サンプルと負の、弱い陽性、中等度陽性、強陽性のLFD結果の代表例を図1に示されています。
抗原陽性LFDテスト(弱いものと強いもの)や急性骨髄性白血病(AML)患者からBAL流体を用いた負LFDテストの結果を表1に示されているEORTC / MSG診断基準に従って診断した。このテーブルに含まれる、対応する臨床的および菌(ラクトマンナンと文化)データであり、 アスペルギルス特異的PCR検査の結果は、各患者のために、セントBartholomews病院8で開発しました。病気の診断は、宿主因子(好中球減少症、コルチコステロイドの長期使用、他の認識T細胞immunos治療に基づいていたuppressants)、臨床的基準とBALのためにGM陽性(ここではGMのインデックス値> 0.8として定義されます)。 2002 EORTC / MSGのガイドライン10の下に、患者12、13および16は、宿主因子と臨床的基準またはGM陽性に基づいて'可能' IAと診断された。それぞれの臨床データおよび真菌学からの証拠をサポートすることで、同行しない限り、改訂された(2008年)EORTC / MSGのガイドライン2、宿主因子とGM陽性単独で、あるいは宿主因子単独で臨床的基準によれば、 "可能性"侵襲性真菌感染症を示しませんでした。患者6はために宿主因子、メジャーとマイナーの臨床的特徴とGM陽性の両方の2002年から2008年のガイドラインの下にある "可能性" IAと診断されました。 LFDやPCRアッセイのどちらも現在はEORTC / MSGのガイドラインに含まれていながら、2アッセイおよびBAL試料におけるアスペルギルス抗原、核酸の存在を示す商業ガラクトマンナンのテストの間に強い合意があるに注意し、患者の6〜12の秒。 IPAを診断するLFDやPCRアッセイの有効性を実証する臨床試験の追加の結果は、Johnson ら 8に記載されています。
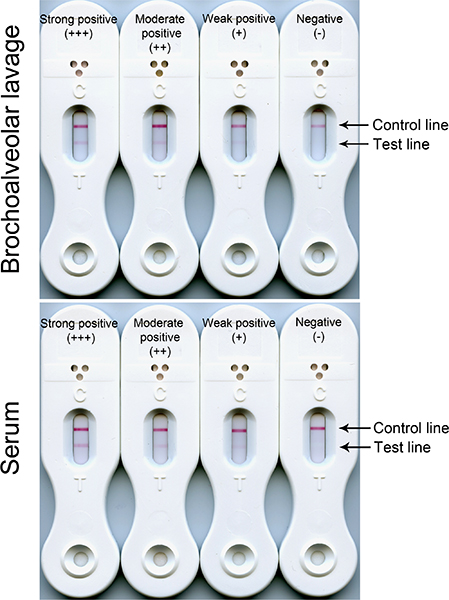
図1血清およびBALを使用してLFDテスト(コントロール及びテストライン)負(コントロールラインのみ)と肯定的な結果。テストライン反応の強度は、血清およびBALサンプル中の標的抗原の濃度に比例します。反応は一般的に範囲から弱(+)中等度から(+ +)への強い(+ + +)。かかわらず、試験線の強度の、すべての3つの血清陽性反応が血流中にアスペルギルス抗原を循環の存在に起因する侵襲性肺アスペルギルス症を示すことになる。正のBAL反応(弱、中程度または強い)は、胞子や肺の潜在的に病原性の菌糸の開発の発芽を示すであろう。
| 患者ません。 | PatiENT情報 | 臨床基準1 | BAL文化2 | GM EIAインデックス3 | EORTC / MSG(2002)4 | EORTC / MSG(2008年)5 | アスペルギルス PCRの結果 | LFD結果 |
| 6 | - | 主要なCT記号(結節とハロ)とマイナー1 | 負 | 0.9(正) | 考えられる | 考えられる | 正の | プラス(+)弱い |
| 12 | 推定される以前の真菌感染症 | 主要ないいえ、マイナー1 | カンジダglabrata | 6.43(正強) | 可能 | なし | 正の | 強い陽性(+ + +) |
| 13 | コアグラーゼ陰性ブドウ球菌ylococcusとE.血液中の大腸菌 | 大きな、二つのマイナーません | 負 | 0.25(負) | 可能 | なし | 負 | マイナス( - ) |
| 16 | 肺感染症 | 潜入し新たに加え、複数の胸水を含む3つのマイナーの基準 | 負 | 0.16(負) | 可能 | なし | 負 | マイナス( - ) |
CTスキャンで1結節またはハローは、真菌感染症を示唆する
それはヒトの正常細菌叢の一部として単離された9番目の最も一般的な酵母であるとして、BAL液中の2 カンジダglabrataは、汚染物質と見なされる
BALのGM EIA試験で> 0.8の3指数は、 アスペルギルス感染症の指標である
4 'possibl 2002 EORTC / MSG診断基準に基づいて、E '、'可能性'や'実績のある侵襲性真菌症10
5 '可能性'の改訂(2008)EORTC / MSG診断基準、 '可能性'や'実績'侵襲性真菌症2に基づく
表1。可能性IPAを伴う急性骨髄性白血病の患者から、制御AML患者(感染の証拠なし)、および感染のEORTC / MSG診断からBAL試料のLFD試験の結果。
ディスカッション
IPAの決定的な同定は、唯一の真の生検試料から病原体の分離によって達成されるが、適切なサンプルの回復は非常に病気の患者ではしばしば不可能であり、 アスペルギルス属は血液からまれに回復可能であることができます。大きな進歩は、IPAの診断で、胸部のスキャンコンピュータ断層撮影の使用で行われているが、そのような "ハロ"または "空気三日月"の兆候として肺IPAを示唆している特性は、どちらか一時的なものや呼吸のアーチファクトに起因することができますまたは他の真菌感染症11,12。このようなデータは、したがって、患者の血清中に循環しているか、BAL液、喀痰や尿サンプル13に存在している菌類から署名分子を(GMとβ-グルカン)を識別することを目的と血清学的手法で補完しています。これらのテストは十分な感度が表示されますが、それらは一定の条件1,6の下に十分な特異性を欠いている、または干渉に苦しむ。
ここで紹介するIPAを検出するためのLFDテストでは、ウイルス、細菌、寄生虫や毒素14から19と、最も有名な、検出のためのテストでこれまでに使用されているIPAや攻撃技術の"ポイント·オブ·ケア"の診断を可能にする1988年にUnipathによって導入された家庭用妊娠検査のために。ここで説明したアスペルギルス LFDは、 アスペルギルス特異的mAb JF5は、多孔性ニトロセルロース膜上に捕捉ゾーン(テストライン)に固定されています。独立したゾーン内の膜に固定化した抗マウス免疫グロブリンは、内部統制(コントロールライン)を務めていました。リリースポートに血清又はBAL液を添加すると、リリースパッドのMAb JF5-金コロイド複合体は、標的抗原に結合し、複合体は、その後、毛管現象によって多孔質膜に沿って渡します。捕捉ゾーンで固定化モノクローナル抗体JF5は、赤色のテストラインでの結果JF5-金コロイド - 抗原複合体に結合する。すべてのバインドされていないJF5-金コロイドコンジュゲートは、アッセイが正しく実行されていることを示す内部コントロールにバインドします。赤色の制御ラインでこの結果。
テストは短時間で実行するために、わずか15分を取って、血清およびBAL GMに基づいたテストとβ-グルカンの検出に比べて安価であり、実行するために高価な機器や大規模な実験施設を必要としません。さらに、モノクローナル抗体JF5は、GMとβ-グルカンテスト1,4,6の偽陽性反応を引き起こすことが示されている薬や汚染物質とは交差しません。現在の診断テスト以上の追加の主な利点は、 アスペルギルス種の浸潤性増殖の指標である活動を検出するLFDs能力である。
LFD手続きにおける重要なステップは、デバイスへの血清またはBALサンプルの適用後に結果の15分を読むために必要です。テストは、今年5月バイアス結果interpretatiとして、結果を記録する前に、より長い15分間放置すべきではありませんで。弱い反応は、潜伏期間を拡張することによって強化されることはありません。感染症の動物モデルからの血清の熱処理は、アッセイの感度を向上させるために発見されました。テストの制限は、定性的なことですし、陽性の主観的な評価を行うための演算子に依存しています。試験線の強度は、血清及びBAL試料( 図1)抗原の内容に応じて異なります。しかし、任意の正の反応は(知られているネガの比較により決定) アスペルギルス抗原、したがって、感染の有無を示しています。 LFDアッセイの主観性を制限するには、ハンドヘルドデバイスは、LFDテストライン強度の定量化が可能となり、抗原検出20のしきい値の設定を有効にされご利用いただけます。
LFDの将来の発展は、その商業化や他の侵襲性真菌病原体の同時検出を可能にする多重LFDの開発を含む非常に特異的なモノクローナル抗体3を使用して 。
開示事項
我々は、開示することは何もありません。
謝辞
ファイザー株式会社から博士ソーントンへの資金は感謝して承諾されています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| アスペルギルス LFD | エクセター大学 | リクエストに応じて対応する著者から入手できます | |
| RPMI-1640 | シグマ | R0883 | |
| L-グルタミン | シグマ | G7513 | |
| ウシ胎仔血清 | Biosera | S9100 | ウシ胎児血清の他の情報源は、TCMの調製に使用することができます |
| EDTA | フィッシャー·サイエンティフィック | BPE120-1 |
参考文献
- Thornton, C. R. Detection of invasive aspergillosis. Adv. Appl. Microbiol. 70, 187-216 (2010).
- De Pauw, B., Walsh, T. J., Donnelly, J. P. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycology Study Group (EORTC/MSG) concensus group. Clin. Infect. Dis. 46, 1813-1821 (2008).
- Thornton, C. R. Tracking the emerging human pathogen Pseudallescheria boydii by using highly specific monoclonal antibodies. Clin. Vacc. Immunol. 16, 756-764 (2009).
- Pickering, J. W. Evaluation of a (1 -> 3)-β-D-glucan assay for diagnosis of invasive fungal infections. J. Clin. Microbiol. 43, 5957-5962 (2005).
- Thornton, C. R. Development of an immunochromatographic lateral-flow device for rapid serodiagnosis of invasive aspergillosis. Clin. Vacc. Immunol. 15, 1095-1105 (2008).
- Verweij, P. E., Mennink-Kersten, M. A. S. H. Issues with galactomannan testing. Med. Mycol. 44, 179-183 (2006).
- Wiederhold, N. P. Comparison of lateral flow technology and galactomannan and (1 -> 3)-β-D-glucan assays for detection of invasive pulmonary aspergillosis. Clin. Vacc. Immunol. 16, 1844-1846 (2009).
- Johnson, G. L., Bibby, D., Bustin, S. Detection of Aspergillus in broncho-alveolar lavage fluid using two biological assays; evidence of active infection. Mycoses. 54, 130-131 (2011).
- Malani, A. Candida glabrata fungemia: experience in a tertiary care centre. Clin. Infect. Dis. 41, 975-981 (2005).
- Ascioglu, S. Defining opportunistic invasive fungal infection in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international concensus. Clin. Infect. Dis. 34, 71-74 (2002).
- Denning, D. Early diagnosis of invasive aspergillosis. Lancet. 355, 423-424 (2000).
- Greene, R., Shibuya, K., Ando, T., Latge, J. -. P., Steinbach, W. J. . Aspergillus fumigatus and Aspergillosis. , 353-363 (2009).
- Klont, R. R., Mennink-Kersten, M. A. S. H., Verweij, P. E. Utility of Aspergillus antigen detection in specimens other than serum samples. Clin. Infect. Dis. 39, 1467-1474 (2004).
- Iweala, O. I. HIV diagnostic tests: an overview. Contraception. 70, 141-147 (2004).
- Ketema, F., Zeh, C., Edelman, D. C. Assessment of the performance of a rapid, lateral flow assay for the detection of antibodies to HIV. J. Acquir. Immune Defic. Syndr. 27, 63-70 (2001).
- Moody, A. Rapid diagnostic tests for malaria parasites. Clin. Microbiol. Rev. 15, 66-78 (2002).
- Parkash, O. Performance of a lateral flow test for the detection of leprosy patients in India. J. Med. Microbiol. 57, 130-132 (2008).
- Sharma, S. K. Evaluation of lateral-flow Clostridium botulinum neurotoxin detection kits for food analysis. Appl. Environ. Microbiol. 71, 3935-3941 (2005).
- Smits, H. L. Lateral-flow assay for rapid serodiagnosis of human leptospirosis. Clin. Diagn. Lab. Immunol. 8, 166-169 (2001).
- Faulstich, K., Wong, R., Tse, H. . Lateral Flow Immunoassay. , 157-185 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved