Method Article
放射性その場でハイブリダイゼーション
要約
このプロトコルが正常に定量的な脊椎動物種間で複数の組織の種類のレベルとmRNA発現の空間パターンを検出するために使用されています。メソッドは、低濃度の転写物を検出すると同時にスライドの何百もの処理を可能にすることができます。我々は、例として、鳥類の胚の脳形成の発現プロファイリングを使用して、このプロトコルを提示します。
要約
遺伝子は、遺伝子の機能の理解に貢献するで表現されているタイミング、レベル、細胞内局在、細胞の種類を知っている。これらの各機能は、細胞内のmRNAのin situハイブリダイゼーションを行うことができます。ここでは、クレイトンら (1988)1特に大人の脊椎動物の脳2-5、長年にわたって私たちのラボで正常に働いているから修正in situハイブリダイゼーション法で放射性を提示する。標的配列への長い相補的RNA(cRNA)をプローブは、低濃度の転写産物6,7の検出を可能にします。 cRNAプローブに放射性ヌクレオチドの取り込みのいずれかの組織の上にコーティングされた光に敏感なX線フィルム又はエマルジョンにより、低濃度の転写産物と定量分析の更なる検出感度を可能にします。これらの検出方法は、標的遺伝子の発現の長期的な記録を提供しています。非放射性プローブをメタに比べてそのようなDIG標識としてODS、放射性プローブのハイブリダイゼーション法は、低濃度の転写産物を検出するためにHRP-抗体および/またはTSAキットを使用して複数の増幅工程を必要としません。したがって、このメソッドは、定量分析のための信号強度と標的mRNAの量の間の線形関係を提供しています。それは同時に100から200までのスライドを処理することができます。それは胚の発達段階の異なるにも適しています。胚組織は、それが困難な組織切片を持つ細胞集団間の境界を確認しながら、細胞間の少ない凝集して、成体組織よりも脆弱であるため、ほとんどの遺伝子発現の発達研究では、全体の胚および一部の非放射性のアプローチ8,9を使用しています 。対照的に、感度のより広い範囲のために私たちの放射性アプローチは、それが簡単に集団間の境界を見て作り、組織領域間の遺伝子発現の解像度で高コントラストを得ることができる。この方法を使用して、研究者は明らかにすることができ新たに同定された遺伝子の可能性の意義、さらに興味のある遺伝子の機能を予測する。
プロトコル
1。組織標本
- 新鮮な組織を採取する。鳥類の胚については、慎重に卵を開いて、1xPBS、2回と皿の中で胚を洗浄してください。成人の脳には、速やかに脳を除去し、穏やかに1×PBSで洗浄する。
- 切片の必要に応じて組織を配向、OCT組織のTEKの完全埋め込み型に胚や成体脳に埋め込むと、すぐに、ブロックの内部に混合物を取得しないように注意しながら、エタノールとドライアイスの混合物にそれを置くことによって、ブロックを凍結。
- 10から12ミクロン厚の切片にクライオスタットに凍結サンプルをスライスします。脳や胚組織のために、最高のカッティング温帯では、-20℃まで-18°Cの範囲内である
- スーパープラススライドガラス上の凍結切片をマウントします。
- -80℃でスライドボックスのセクションを保存する
2。放射性リボプローブの生成(貴機関の放射線安全手順を使用)
- 精製された線形DNを生成します。酵素のいずれかによって、目的のcDNAの鋳型は、プラスミドDNAから、またはRNAポリメラーゼのプロモーター結合部位に接続されたインサートのPCRによるRNAポリメラーゼのプロモーター部位に囲まれたクローン化断片のダイジェストを制限されます。それは、3 'および5' PCRプライマーの一環として、RNAポリメラーゼプロモーターを用いたPCR断片を生成することも可能です。ゲルは、GENECLEANゲル精製キットを使用して、制限またはPCR生成された断片を精製。
- 0.5ミリリットルのエッペンドルフチューブに、所望の量にボリュームを起動するには直鎖状DNAテンプレート、転写バッファー、DTT、RNasin、AGCヌクレオチド混合溶液、RNaseフリー水を精製した0.5〜1μgを追加します。その後S 35-UTPおよびアンチセンスまたはセンスリボプローブのいずれかを行うための適切なRNAポリメラーゼを追加します。
- 37°Cの水浴で1時間混合物をインキュベートします。 RNAポリメラーゼの別のアリコートを加え、さらに1時間インキュベートします。
- 3M酢酸ナトリウム溶液(総量の0.1倍)、100%エタノール(2.5 foを追加するエッペンドルフチューブに全体積のld)が合成されたRNAのリボプローブを沈殿させる。
- ドライアイスまたは-80℃で15分間または3時間以上の降水を支援するためにインキュベートします。
- 4℃、30分間テーブルトップエッペンドルフ遠心機で15,000 rpmでの遠心分離によってペレットRNA。
- 上清を除去し、70%エタノールでペレットを洗浄し、よくペレットを混ぜて指でタップします。
- 再びペレットRNAで30分間4℃、15000rpmで遠心分離することによって。
- ピペッティングで完全に上清を除去し、40μlのハイブリダイゼーション溶液を追加します。 inとoutペッティングでよく混ぜる。
- シンチレーションバイアル中3ミリリットル安全解決溶液中に溶液1μlを入れ、よく混合し、シンチレーションカウンターでカウントを測定します。
- 一週間以内に使用するために-20℃でリボプローブとエッペンドルフを配置します。
3。組織の治療
- フードは、新鮮なPBSで4%paraformaldehyのバッファの準備まで約3〜5℃の室温上記デ·ソリューションを提供します。 -80〜場所スライドは°Cストレージドライアイス上に金属製のラックに、ボンネットの下に作業スペースを運ぶし、4%パラホルムアルデヒド溶液中にラックを配置し、室温で5分間インキュベートする。
- 15ディップ、各(ディップ当たり約1秒)約1×PBSで3回洗浄する。
- フード内で、アセチル化バッファを作成し、10秒以内に精力的にそれを振る。直ちにスライドラックを含むトレイに注ぎ、10分間インキュベートし、リボプローブの結合バックグラウンドを低減します。
- 15ディップ用に、2×SSPEで3回すすいでください。
- 各ステップで2分(フードである必要はありません)を70%、95%と100%EtOHをシリアルで脱水する。
- 少なくとも10〜15分間、ボンネットの下にスライドを乾燥させます。
4。ハイブリダイゼーション
- リボプローブの量(スライド当たり0.5〜1×10 6 cpm)を、全てのスライドに必要なハイブリダイゼーション溶液(スライド当たり100μl)を計算します。 Prewa65〜RMリボプローブハイブリダイゼーションミックス℃で5分間リボプローブを変性させます。
- リボプローブハイブリダイゼーション、スライド全体のラインのソリューションは、組織およびカバースリップ上に均等にそれを広めるためにカバーガラスを使用してのピペットで100μlの。場所は4時間と16時間の最大値の最小値65°Cの油浴にゆっくりと直立直立メタルラックと場所ラックに直面して、水平にスライドします。オイルはカバースリップの周り気密シールを作成します。
- 油浴から金属製のラックを外し、ティッシュペーパーでラックの周りに余分な油を拭き取ってください。
- クロロホルム、2回を含むガラスまたは金属製のトレイに覆われたスライドやメタルラックからオイルを洗い流してください。第2クロロホルム洗浄については、次の実験のための最初として使用することができます。
- 0.1%β-メルカプトエタノール+ 2×SSPE溶液とトレイに覆われたスライドを使ってラックを転送し、カバースリップを緩め、過剰なハイブリダイゼーションの解決法を溶解するためにいくつかのディップ用とを上下に移動するる。
- 0.1パーセントβ-メルカプトエタノール+ 2×SSPEの新鮮な溶液で覆われたスライドを使ってラックを転送し、組織切片を傷つけないように溶液中でRNaseフリーの鉗子でカバースリップを取り除きます。 2×SSPE、0.1%β-メルカプトエタノールの溶液中に、トレイの水平スライドラックホルダーに新鮮なラックに発見されたスライドを転送します。
- 過剰の未結合のRNAプローブを削除するには、1時間室温で新鮮な0.1パーセントβ-メルカプトエタノール+ 2×SSPE溶液中でのスライドラックをインキュベートします。放射性廃棄物として、これと以前の水性洗浄溶液と同様に、カバースリップを破棄します。
- 、65℃で温め倍SSPEソリューション°Cにスライド付きのラックを転送し、0.1%濃度の最終的にβ-メルカプトエタノールを追加し、1時間65℃でインキュベートする。放射性廃棄物として廃棄してください。
- 転送すると30分ごとに65℃温めておいた0.1×SPPEのスライドの2倍のラック℃でインキュベートします。で取り外した放射能の量このステップは非常に小さいと、もはやこのステップの後に過度の放射性廃棄物と考えられません。
- ラックとスライド70%、95%、2分ごとに100%エタノールを脱水。
- 少なくとも30分間フード内でスライドを乾燥させます。
5。放射信号の可視化
- フィルムカセットに乾燥したスライドを配置し、暗い部屋で、スライド上のX線フィルム(コダックバイオマックスMR膜)を配置して、カセットを閉じます。スライドは、X線フィルムの乳剤面に直面していることを確認してください。転写産物の予想される豊富に応じて〜1-7日間のスライドを公開します。
- 標準現像液と定着におけるX線フィルムを開発しています。ハイブリダイゼーションシグナルは、フィルム上に黒(エマルジ ョンに銀粒を露出した)( 図1)として表示されます。
- (省略可能)携帯電話の解像度を決定し、組織上の信号を表示するには、スライドは写真乳剤中に浸漬し、対比する必要があります。あなたが最終的にはクレシルバイオレットで対比染色しようとしている場合は、その倍、100%、100%、95%、95%、70%、50%EtOHにそれぞれ1分水分補給を室温で5分間、キシレンでインキュベートすることにより、セクションをdelipidizeその後脱イオン水インチあなたがdelipidizationを必要としない染料で染色しようとしていない場合、delipidizationは必要ありません。よく、少なくとも2-3時間のためにフードの下で乾燥したスライド。
- 安全な光を利用して暗い部屋で、20〜30分間42℃の水浴で融解してガラス浸容器に縦半分のスライド(すなわち組織)をカバーするのに十分なコダックNTBエマルジョンをえぐり出す、と。その後1:1の比率に蒸留水で希釈する。エマルジョンのレベルは、現在のスライドがその中に浸漬され、スライド上のすべてのセクションをカバーする必要があります。あなたはスライドの多くを持っていれば、余分なエマルジョンを調製する必要があります。
- 42℃の水浴と閉じた光気密容器に乾燥した浸漬スライドovernigで希釈したエマルジョンにディップスライド暗い部屋で、または消灯の2〜3時間、37℃でオーブンのHT。
- お互いの身体に触れるため、成果物を作成しないようにスライドのように注意しながら、デシケータを含むブラックボックス内のラックのスロットにスライドを移します。静的誘起光の火花を防止して、アルミホイルでボックスをラップするために徐々に黒い電気テープで箱の端をシールします。 4でボックスを格納℃で数日間から数週間に(X線フィルム上の1日からの信号は、エマルジョンの下で5日間に似ています)。
- 1時間室温にスライドボックスを温める。
- 暗室では、スライドラックを削除(または金属製のラック内の場所のスライドとスライドスロットにボックスを使用)ボックスから、3.5分間16℃でKodak D-19の開発者にそれらを開発しています。
- 1分間、室温での水道水で開発したスライドを洗浄します。
- 6分ごとに19°Cでフィクサーで二度スライドをインキュベートします。ライトは、第フィクサーのインキュベーション中にオンにすることができます。
- 少なくとも30分間室温で流水中でスライドを洗浄し、カミソリの刃で 'ウェット'はガラスを傷つけないようにしながらスライドの裏側からエマルジョンを落とす。
- 5分間水道水で0.3%クレシルバイオレットで組織を染色します。
- 〜15ディップ新鮮な水道水の余分なクレシルバイオレット溶液を洗浄します。
- 50%、70%、95%、95%、100%および100%エタノール:〜15それぞれのアルコール溶液にディップするためのスライドを脱水する。
- 二回、室温で5分間、キシレンのスライドをインキュベートします。
- Permountスライドの培地で一晩フード(> 16時間)で覆われたスライドを乾燥させるとカバースリップ、接着剤は、さらにスライドをきれいにするのに十分頑丈である前に、それは数日かかります。
6。暗視野カラー画像を生成する
- 水で濡らすとカミソリの刃で掻き取りによってスライドの背面(組織のない非coversliped側)必要に応じて、さらにクリーンな過剰なエマルジョン。
- 80%エタノール溶液を用いてスライドをすすぎ、埃やゴミを取り除くために軽く1-2回拭いてください。
- 暗視野または明視野照明の下で写真を撮る。ステップ6.2と6.3は簡単に解剖顕微鏡下で暗視野で見られているダスト粒子なしで良好な画像を得るために2-3回繰り返すことが必要になることがあります。
7。代表的な結果
1)スライドまたは2の上に配置されたX線フィルム)乳剤スライド上に塗布した:35 S放射性プローブとハイブリダイズ組織切片上でin situハイブリダイゼーションの結果での表示の2つの主要な方法があります。第三のアプローチは、スライド上に配置ホス画面を使用していますが、我々はこのアプローチの解像度に満足されていない。 X線フィルムは、迅速な結果およびハイブリダイゼーションの全体的な状態の分析を提供しています。 X線フィルムのデータは、広範な解剖学的分解能を明らかにし、定量的なanalysに使用することができます10です。 FOXP1とCoupTF2遺伝子発現をアンチセンスプローブとハイブリダイズ遅く鳥類胚の頭部のX線フィルム画像の例は、 図1AおよびBにあります。両方の遺伝子が特定の脳の分割に非常に豊富です。質の良いX線フィルムの結果はシャープになる(ぼやけていない)と、高い信号対バックグラウンド比を持つ必要があります。ぼやけた画像は、X線フィルムとハイブリダイズした組織とスライドガラスの間に不均一な接触に起因することができます。
乳剤浸漬したスライドでは、エマルジョンは、X線フィルムのプラスチックであることに並置として組織上に塗布し、感光性銀塩を含んでいます。開発中に、S 35露出銀塩は非常にX線フィルムのように、銀粒子を金属に変換されます。しかし、銀の預金は、顕微鏡下で観察し、定性的に測定することができ、遺伝子発現を示す細胞上に直接表示されます。金属銀粒子が通過直接光を遮断すると明視野·ビューの下に黒いドットとして表示されます。クレシルバイオレットの対比は、色の紫色が表示されます( 図3A、3C、および図4)。暗視野では、銀粒子は、サイドからの光を反映して、白のドット( 図1C、1D、3Bおよび3D)として表示されます。このような状況では、クレシルバイオレット染色の色は赤色で表示されます。暗視野で、それに加えて、ハイブリダイゼーションシグナルは全体組織上の低倍率で見ることができるのに対し、明視野では、ハイブリダイゼーションシグナルは、細胞の解像度で高倍率で表示する方が簡単です。暗視野ビューには、我々は一般的に全体的な遺伝子発現パターンを示すために使用するアプローチです。しかし、X線フィルムから得られる迅速な結果に比べて、乳剤浸漬したスライドは、長い時間がかかる(数週間に1つ)と背景を得ることにもっと敏感である。
強力なバックグラウンドの4つの一般的なソースがあります。1)すべてのX線フィルム上の背景には、通常に実行されてい開発者やフィクサー、または部分的に露出したフィルムの問題、2)ガラススライドの背景は、通常、商業的供給源や自己準備からスライドの不適切なsilinationとして洗浄やガラススライドの準備、の問題が原因である、3)エマルジョン露光、現像の背景、4)ハイブリダイゼーション温度が低すぎると慎重に、ハイブリダイゼーション後の洗浄ステップの欠如のいずれかにより、セクションの背景、ハイブリダイゼーション溶液の質の悪さ、プローブは恒久的にリンクを横断する原因となってお皿を洗うのホルムアルデヒド汚染組織にジ-硫化物国債のS 35-RNAプローブのリンク、およびアセチル化のためにあまりに長い間待っているクロスの結果、組織非特異的に、非アクティブDTTまたはβ-メルカプトエタノールを標識する小分子につながる組織、リボプローブの劣化に。それは無水酢酸とトリエタノールアミンを混合して数秒以内にアセチル化溶液中でのスライドを持っていることが重要です。数分withouを渡した場合tはアセチル基を効率よく除去し、非特異的RNAに結合されることはありませんし、スライドにソリューションを追加します。他の要因は、信号の強すぎるが生成されることがあり、20時間以上ハイブリダイゼーション、および組織に放射性スポットで、その結果、水性洗液中にスライド上にハイブリダイゼーション溶液を隔離スライド上の余分な油滴が含まれており、暗い背景の信号を与えてスライドします。多くのスライド(100種類以上のスライス)を扱う場合は、第3 回クロロホルム洗浄を追加したり、スライド上に残っているから余分な油の粒子を防ぐために、クロロホルム洗浄を変更します。不注意な組織治療、すなわち十分な速凍結(郭清後の5〜10分以内)または融解と再凍結しないでも劣化のmRNAに起因するバックグラウンドを増加させます。露出オーバーの背景を間違えないように注意してください。
それは敏感な非常に軽く、暗い場所で長時間露光を必要とするため、浸漬し、スライド上の乳剤の背景が可能です。 COM月の背景の問題は、現像液と定着の温度が高すぎるなどがあります。温度は、C°19以上に近いまたは室温より暖かい場合には、多くの銀粒子のバックグラウンドが得られる。暗室に漏れ光の低レベルへの暴露は、エマルションの背景の原因になります。 (流水で少なくとも30分間)に十分な長さ定着を洗浄しないし、エマルジョン全体に褐色の沈殿物を生成するためにクレシルバイオレットと反応して定着を残すだろう。スライドはクレシルバイオレット染色前に固定した後90分以上水で洗浄されている場合ただし、これは不十分な染色するためにルーズになるためのエマルジョンとセクションを引き起こす可能性があります。固定および洗浄後30から90分のウィンドウ内でスライドを染色するのに十分な時間がない場合は、30分間洗浄した後、一晩スライドを乾燥させ、翌日染色クレシルバイオレットで進みます。バックグラウンドシグナルがより均一であるのに対し、一般的に、ほとんどのmRNAは、特定の遺伝子発現パターンを持っています。
e_content ">二つ折り組織は、暗い信号と地域につながる、X線フィルム上での遺伝子発現結果を得るために、誤解を招くおそれがあります。判別するには組織が折り畳まれている場合は、暗視野または明視野下のクレシルバイオレット染色した切片の下に、非染色した切片を調べます。クレ紫色の対比は、組織の状態を調べるためのより良い方法を提供します。プローブの特異性の優れた解釈については、コントロールのセンスプローブは、隣接する複数のセクションに適用する必要があります。最もセンスプローブは、信号が表示されませんが、いくつかの操作を行い、彼らが行うときに、我々はそれが頻繁にアンチセンス信号とは異なることがわかります。我々は、これが合成やゲノムのアンチセンス鎖上の別の遺伝子をアンチセンスに関連することができることと信じています。我々は、例Pax6のセンス及びアンチセンスプローブ( 図2AおよびB)を提示します。アンチセンス鎖は、予想されるように前脳、小脳、眼( 図2A)の脳室帯に沿ってラベルを明らかにしたが、感覚はラを明らかに網膜色素上皮層( 図2B)にbeling。
プローブの大きさのために、私達は300から5000 bpsの範囲内の任意の場所にcDNAプローブを使用しています。プローブ未満300 bpsの仕事が、信号は通常弱い。我々は、5000 bpsより大きなプローブを試していません。可能であれば、同じ種から組織上のプローブを使用することをお勧めします。他の種のセクションではなく、我々はクロスハイブリダイズするプローブの場合と3-5でハイブリダイゼーション及び洗浄の温度を低下させる配列の相同性に基づいて°C刻み、知られている場合。知られていないなら、私たちは、試行錯誤のハイブリダイゼーション及び洗浄の温度を実行します。温度があまりにも低くされている場合は、cDNAプローブは、種間または同じ種11の類似した配列の他のmRNAと交差ハイブリダイズすることができる。実際に、我々は組織中のmRNAをターゲットに〜95%同一であるか大きいcDNAは、ストリンジェントなハイブリダイゼーションおよび洗浄温度(65℃)の条件がうまく動作することを見つける。鳴ったのである配列のために同じ〜85から94パーセントのES、ハイブリダイゼーション及び洗浄の温度は約50〜60℃の範囲で削減する必要があるかもしれません
手順のほとんどの金属ラックを使用する理由は、クロロホルムの洗浄及びキシレンの使用があります。両方の有機物は、プラスチックの多くの種類を溶かす。ガラスとプラスチックの種類によっては、これらの有機物に耐性がある。しかし、ガラスは壊れやすくなり、最初に耐性があるいくつかのプラスチックは、有機物への曝露の長期にわたって溶けてしまいます。
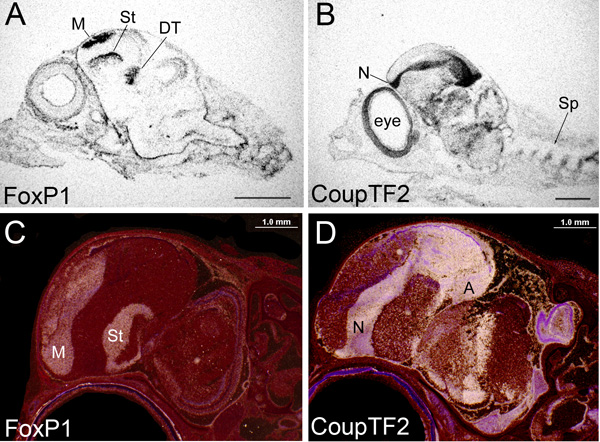
図1 X線フィルムや乳剤浸漬スライドからのin-situハイブリダイゼーション画像のオートラジオグラフィー。 ()FOXP1または解剖顕微鏡下で明視野照明で撮影した(B)CoupTF2へのアンチセンスリボプローブとハイブリダイズ胚10日目でキンカチョウ小鳥の矢頭全体セクションの(AB)X線フィルム画像を、。 mRNAの急行を示すフィルムの黒、露出された粒イオン。スケールバー= 500μmである。キンカチョウの矢頭全体セクションの(CD)エマルジョンに浸漬スライド画像解剖顕微鏡下で暗視野照明で撮影された(C)FOXP1と(D)CoupTF2へのアンチセンスリボプローブとハイブリダイズ後のハッチ6日、で。白、mRNAの発現を示す組織上記エマルジョンに銀粒を露呈した。レッド、クレシルバイオレット染色。スケールバー= 200μmである。すべての画像については、くちばしには、左に吻側である。 X線フィルム画像は、3日間一日、浸したスライドのために公開されました。 FOXP1プローブはmRNAの1544から1711 bpの部分に178 bpsです。CoupTF2は、mRNAの1から545 bpの部分に545 bpsです。 CoupTF2がnidopallium(N)、arcopallium()、および、より腹側視床に富んでいるのに対し、脳FOXP1 mRNAは、mesopallium(M)、線条体(ST)と背側視床(DT)に富んでいる内に、見られるように。露出タイプ(と年齢)の間には、式の一貫性があります。浸したスライドでは、しかし、より高い解像度の標識は、見られているD組織の境界と分割が直接識別されます。これらと紙に示すように、他のすべての画像は、標準の65°C高いストリンジェンシーハイブリダイゼーションを使用してセクションからです。
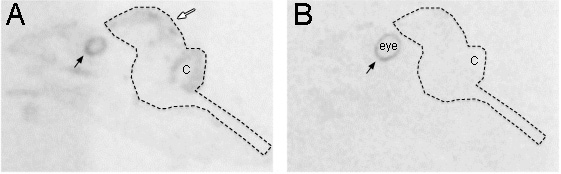
異なるパターンを示しています。アンチセンス及びセンス標識の図2の比較。 (A)Pax6のアンチセンス鎖は、脳、特に脳室帯(白矢印)で発現させた。胚12日目キンカチョウから採取した矢頭全体スライスのX線フィルム上でオートラジオグラフィーが示されている。 (B)Pax6のセンス鎖とハイブリダイズした隣接するセクションでは、胚の頭部全体にバックグラウンドの発現を明らかにしませんが、アンチセンス鎖として網膜色素上皮層で明らかに式(黒い矢印)。破線は、脳全体の輪郭を示しています。 C:小脳。
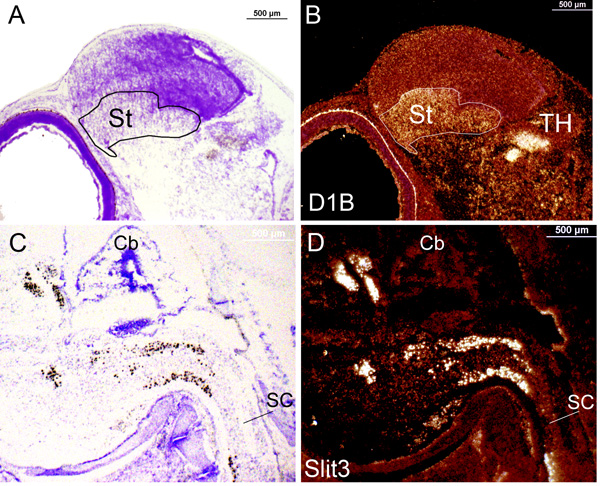
ロン>図3。エマルジ ョン中の遺伝子発現の in situのシグナルでは明視野と暗視野のビューの下に後期胚の段階ではキンカチョウの脳から採取したスライドを浸した。エマルジョンへの通常の曝露から胚日10時D1B式の(A)明視野像。ラベルは、(黒)やっとこの倍率で見ることができます。プローブはmRNAの1から625 bpの部分に625 bpsです。 (B)()のように同一セクションと倍率が線条体(ST)と視床(TH)にラベル(白)を示す暗視野ビューに切り替えました。エマルジョンに上の暴露から胚日12時Slit3式の(C)明視野像。ラベルは、(黒)を簡単に見ることができます。プローブはmRNAの1243年から2021年の部分に779 bpsです。 (B)(A)のように、同一セクションと倍率明視野画像と一致して脊髄(SC)に暗視野のビューを示すラベル(白)に切り替えました。吻側では、左に指向です。 CB:小脳。
/ 3764/3764fig4.jpgの "alt ="図4 "/>
図4。細胞レベルで銀粒の解像度。示すように、図1Aおよび1Cの低消費電力の画像と比較して異なる脳領域と年齢のセル(クレシルバイオレット)上記銀粒子(黒い斑点)とキンカチョウの前脳におけるFOXP1 mRNAのラベルです。大人のキンカチョウmesopallium内の個々のセル上に()ハイ豊富式(黒い矢印)。 (B)は、同じセクションの隣接nidopallium内の個々のセル上に低濃度の式(黒矢頭)。胚12日mesopalliumの細胞上の(C)高FOXP1 mRNA発現(黒矢印)。同じセクションの隣接nidopalliumの細胞(黒矢印)の上(D)低濃度の式です。例セルは黄色の線で丸で囲まれています。胚細胞は、(CとD)より小さく、より緊密に成体細胞(AとB)と比較してパックされた。細胞とエマルジョンの間にいくつかのスペースがあるので、露出したSiのエリアS 35プローブからlver粒子は細胞体の面積よりもわずかに大きいです。スケールバー=10μmである。
ディスカッション
mRNA発現のin situハイブリダイゼーション放射性は広く、地域組織の組織、細胞の種類、脳機能活性2-5,10,12-14を研究するためなど、複数の目的に使用されています。後で使用するためには、そのmRNA発現、脳内の神経活動の増加、頻繁に呼び出さ活動依存的遺伝子または即時早期遺伝子に依存している遺伝子にあります。孵化/新生児、少年を含む、複数の年齢、複数の組織で、脳、皮膚、筋肉を含む。これらの用途で、我々の方法は、哺乳動物(例えばヒト)、魚、両生類、鳥類を含め、複数種を越えて適用されています、成人、ここで全体の胚セクションの2,3,5,15-17。我々のプロトコルの特殊な機能が含まれます:(1)は、解剖学的特異性と定量的な特異性のバランスを生成します。 X線フィルム上に遺伝子発現を定量化するために、我々は画像のデジタル写真を撮ること(例:図1Aおよび1B)、フォーを使用しtoshop(アドビシステムズ社)の関心領域内のピクセル密度を測定し、組織の外膜の上にバックグラウンドレベルを減算するヒストグラム機能はまだスライドガラス2,4に。細胞レベルでの発現を定量するために、我々は高倍率下での細胞( 図4】40-100X)を介して銀粒子の画像を撮影する。我々は、その後スライドガラス上の細胞なしで同じような領域でのバックグラウンドのカウントを減算し、画像内の銀粒子の数をカウントするためにNIHでのWayne Rasbandによる画像Jのしきい値および測定機能を使用して、セルの数で割るセル当たりの式の値。4,18を取得する(2)が原因鉱物油浴によって作成されたタイトなカバースリップのシールに、同時に100から200スライドの処理を可能にする、相対的に高いスループットをすることができます。標準のin-situハイブリダイゼーション法では、パラフィルム、マニキュア、スライドは多くのスペースを取る他の手段で、スライドを封止するために時間がかかる、(3)これは非常にあるデキストラン硫酸とハイブリダイゼーション緩衝液2,13でデンハルト溶液による低濃度の転写産物の高感度(4)暗視野の撮像手法は、4,5解剖顕微鏡に暗視野照明の下で写真を撮るために、コントラストの高い画像が得られます。さらに、このような活動依存的遺伝子発現のように、遺伝子発現の小さな変化の高感度な検出が特定の行動を19の知覚と生成の間にアクティブに特定の脳領域を識別することができます。非放射性プロトコルへの相対的な制限が、後者は携帯電話の解像度と、細胞内のmRNAの場所に明確であることであり、エマルジョンでの作業は、操作や光に対して非常に敏感です。同じ組織10,17,20で複数の遺伝子のmRNA発現にラベルを付けるためにin situハイブリダイゼーションなどの非放射性として、他の方法と手法を組み合わせることができます。それは免疫細胞化学と組み合わせることができます特定の細胞型10との共局在mRNAにために、同じサンプルにRNAとタンパク質の発現の両方にラベルを付けます。このような二重標識実験のために必要なプロトコルの変更は、引用文献に記載されています。
要約すると、我々のアプローチは、地域組織、組織の機能活性、遺伝子機能を理解するためにタイミングと遺伝子発現の細胞の位置の理解を容易にします。
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、年間でプロトコルを改善し、すべてのジャーヴィスラボのメンバーに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 無水酢酸 | VWR | MK242002 | |
| クロロホルム | VWR | BDH1109 | |
| クレシルバイオレット酢酸 | シグマ | C5042 | |
| クライオスタット | サーモフィッシャーサイエンティフィック | マイクロモルHM550 | |
| 脱イオン化ホルムアミド | シグマ | F9037 | |
| DTT | プロメガ | P1171 | 100mMの |
| EDTA | シグマ | ED | |
| 埋め込み型 | VWR | 15160-215 | |
| フィッシャーブランドSuperfrostプラススライド | フィッシャー·サイエンティフィック | 22-034-979 | |
| ホルムアルデヒド | VWR | BDH0506-4LP | |
| ホルムアミド | シグマ | F7508 | |
| GENECLEANキット | Q-バイオ遺伝子 | 1001-200 | |
| コダックバイオマックスMRフィルム | シグマ | Z350370 | |
| コダックNTBエマルジョン | ケアストリームヘルス社 | 8895666 | |
| コダックプロフェッショナル開発者D19 | コダック | 1462593 | |
| コダックプロフェッショナルフィクサー | コダック | 1971746 | |
| β-メルカプトエタノール | カルビオケム | 444203 | |
| 鉱油 | VWR | IC15169491 | |
| NaOHで | VWR | SX0600-1 | |
| パラホルムアルデヒド | シグマ | 76240 | |
| ポリ | インビトロジェン | POLYA.GF | |
| RATP | プロメガ | P1132 | 10mMの |
| rCTP | プロメガ | P1142 | 10mMの |
| rGTP | プロメガ | P1152 | 10mMの |
| RNasin | プロメガ | N2111 | 40Units/μl |
| S 35 UTP | パーキンエルマー | NEG039C001MC | |
| 安全解決ソリューション | 安全性は、研究プロダクツ国際を解決する | 111177 | |
| 酢酸ナトリウム | シグマ | S7899 | 3M |
| リン酸ナトリウム二塩基 | シグマ | S3264 | |
| ナトリウム一塩基性リン | シグマ | S3139 | |
| SP6RNAポリメラーゼ | プロメガ | P1085 | |
| メタルラックを染色 | 電子顕微鏡学 | 70312から54 | |
| T7 RNAポリメラーゼ | プロメガ | P2075 | |
| 組織テック10月 | 桜 | 4583 | |
| 5倍の転写バッファー | プロメガ | P1181 | |
| トリエタノールアミン | VWR | IC15216391 | |
| トリス-HCl(1M、pH8.0)に | VWR | 101449-446 | |
| tRNAの | ロシュ社 | 10109509001 |
ソリューション:
- リボプローブを作るための試薬:1.5μlのDNAテンプレート(0.2から0.3μg/μLの)、5最適化された転写緩衝液2μl、100mMのDTT 1μlの(Promegaからポリメラーゼが付属しており、ミックスよく室温)、RNasin(40ユニット/μl)、AGCリボヌクレオチド混合液を、S 35 UTPの3.5μlを、1μlのRNAポリメラーゼ1.5μlを0.3μL。ヌクレアーゼ·フリー水10μlに起動します。
- AGCリボヌクレオチド混合液:ミックス一緒に10mMのATP、GTPとCTPの等量。
- フリーS 35 UTPを削除するエタノール沈殿用酢酸ナトリウム溶液:40μlのRNaseおよびDNaseフリー水、3M酢酸ナトリウム5μlの、100%エタノール125μlの。
- ハイブリダイゼーション緩衝液(10ミリリットル株):100%脱イオンホルムアミド5mlの、5M NaClを600μlの、1Mトリス塩酸液(pH = 8.0)、0.5M EDTA 240液(pH = 8.0)、100×デンハルトの溶液100μl、 1M DTT 100μlの、20mg/ml tRNAの250μlの20 mg / mlのポリと、デキストラン硫酸ナトリウム1gを125μlの。 10ミリリットルの合計体積をもたらすためにDEPC処理水を追加します。激しく振とうして、すべてのデキストラン硫酸ナトリウムが溶解するまで55℃でインキュベートする。にハイブリダイゼーションバッファーを格納する〜6ヶ月に適しています-20°C、。
- 4%パラホルムアルデヒド緩衝溶液:ホルムアルデヒド用に指定され、50〜ヒート°Cのホットプレート上で撹拌しながらフラスコ内で760ミリリットルの蒸留水にホルムアルデヒドの40グラムを追加します。パラホルムアルデヒドを溶解するのを助けるために10NのNaOH 320μlを添加します。 (〜10分)に溶解した後、10倍のPBS 100ミリリットルを追加し、1リットルになるまで蒸留水を使用してボリュームを起動します。ホルムアルデヒドが溶解するまで溶液を攪拌し、加熱する。 pHは7.4でなければなりません。
- アセチル化バッファー:トリエタノールアミン13.6ミリリットルを加え、蒸留水1リットル中の無水酢酸の2.52ミリリットル。
- 20×SSPE溶液:3MのNaCl、200mMののNaH 2 PO 4-H 2 O、および蒸留水で200 mMのEDTA。 10N NaOHでpH7.4に解決策を調整します。
- 10×PBS緩衝液:蒸留水のKH 2 PO 4のNaClの80グラム、KClの2.0グラム、14.4グラムのNa 2 HPO 4、2.4グラム。 pHを7.0にソリューションを調整し、1 Liteに総量をもたらすR。
- 第二洗浄液:0.1%β-メルカプトエタノールおよび2x SSPEで50%のホルムアミド
- クレシルバイオレット酢酸溶液:水道水の3%クレシルバイオレット酢酸(蒸留水が良い染色を防ぎます)、室温でフラスコ内を撹拌しながら一晩溶解した。 1ミリメートルワットマン濾紙とブフナー漏斗を介して真空吸引してフィルタリングします。
参考文献
- Clayton, D. F., Huecas, M. E., Sinclair-Thompson, E. Y., Nastiuk, K. L., Nottebohm, F. Probes for rare mRNAs reveal distributed cell subsets in canary brain. Neuron. 1, 249-261 (1988).
- Wada, K., Sakaguchi, H., Jarvis, E. D., Hagiwara, M. Differential expression of glutamate receptors in avian neural pathways for learned vocalization. J. Comp. Neurol. 476, 44-64 (2004).
- Haesler, S. FoxP2 expression in avian vocal learners and non-learners. J. Neurosci. 24, 3164-3175 (2004).
- Jarvis, E. D., Nottebohm, F. Motor-driven gene expression. Proc. Natl. Acad. Sci. U.S.A. 94, 4097-4102 (1997).
- Holzenberger, M. Selective expression of insulin-like growth factor II in the songbird brain. J. Neurosci. 17, 6974-6987 (1997).
- Mahmood, R., Mason, I. In-situ hybridization of radioactive riboprobes to RNA in tissue sections. Methods Mol. Biol. 461, 675-686 (2008).
- Wilkinson, D. G., Nieto, M. A. Detection of messenger RNA by in situ hybridization to tissue sections and whole mounts. Methods Enzymol. 225, 361-373 (1993).
- Acloque, H., Wilkinson, D. G., Nieto, M. A. In situ hybridization analysis of chick embryos in whole-mount and tissue sections. Methods Cell Biol. 87, 169-185 (2008).
- Moorman, A. F., Houweling, A. C., de Boer, P. A., Christoffels, V. M. Sensitive nonradioactive detection of mRNA in tissue sections: novel application of the whole-mount in situ hybridization protocol. J. Histochem. Cytochem. 49, 1-8 (2001).
- Horita, H., Wada, K., Rivas, M. V., Hara, E., Jarvis, E. D. The dusp1 immediate early gene is regulated by natural stimuli predominantly in sensory input neurons. J. Comp. Neurol. 518, 2873-2901 (2010).
- Braissant, O., Wahli, W. A simplified in situ hybridization protocol using non-radioactively labelled probes to detect abundant and rare mRNAs on tissue sections. Biochemica. 1, 10-16 (1998).
- Kubikova, L., Wada, K., Jarvis, E. D. Dopamine receptors in a songbird brain. J. Comp. Neurol. 518, 741-769 (2010).
- Wada, K. A molecular neuroethological approach for identifying and characterizing a cascade of behaviorally regulated genes. Proc. Natl. Acad. Sci. U.S.A. 103, 15212-15217 (2006).
- Jarvis, E. D. Avian brains and a new understanding of vertebrate brain evolution. Nat. Rev. Neurosci. 6, 151-159 (2005).
- Hoke, K. L., Ryan, M. J., Wilczynski, W. Social cues shift functional connectivity in the hypothalamus. Proc. Natl. Acad. Sci. U.S.A. 102, 10712-10717 (2005).
- Burmeister, S. S., Jarvis, E. D., Fernald, R. D. Rapid behavioral and genomic responses to social opportunity. PLoS. Biol. 3, e363 (2005).
- Jarvis, E. D., Schwabl, H., Ribeiro, S., Mello, C. V. Brain gene regulation by territorial singing behavior in freely ranging songbirds. Neuroreport. 8, 2073-2077 (1997).
- Jarvis, E. D., Scharff, C., Grossman, M. R., Ramos, J. A., Nottebohm, F. For whom the bird sings: context-dependent gene expression. Neuron. 21, 775-788 (1998).
- Feenders, G. Molecular mapping of movement-associated areas in the avian brain: a motor theory for vocal learning origin. PLoS One. 3, e1768 (2008).
- Chen, C. C., Fernald, R. D. Distributions of two gonadotropin-releasing hormone receptor types in a cichlid fish suggest functional specialization. J. Comp. Neurol. 495, 314-323 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved