Method Article
RIP-チップを用いた細胞抽出物からmRNAを、マイクロRNAとリボ核タンパク質複合体のタンパク質成分の分離と同定するための方法
要約
RIP-チップを介したRNA関連した複合体を単離および同定するためのステップバイステップのプロトコル。
要約
ハイスループットシーケンシングおよび効率的なマイクロアレイ解析の開発の結果として、全体的な遺伝子発現解析は、データの収集を簡単かつ容易に利用できる形になっています。しかし、多くの研究や疾患モデルでは、標的遺伝子のmRNAの定常状態レベルは常に直接定常状態タンパク質レベルと相関しない。転写後の遺伝子発現制御には、2つの間の相違の可能性のある説明です。 RNA結合タンパク質(RBP)に結合することによって駆動され、転写後調節は、標的mRNAとリボ(RNP)複合体を形成することによりmRNA局在、安定性や翻訳に影響を与えます。 RNP複合体中の細胞抽出物からこれらの未知のde novo mRNA標的を同定することはご理解のメカニズムとRBPの機能とタンパク質の出力にそれらの結果として得られた効果に極めて重要である。このプロトコルは、sの識別を可能にRNPを免疫沈降マイクロアレイRIP(チップ)と呼ばれる方法を概説さらに、個々の研究者のための実験を最適化するためのオプションと共にpecific mRNAは、変化の実験条件下で、リボ核タンパク質複合体に関連する。この重要な実験的なツールを使用すると、研究者らは、転写後遺伝子調節だけでなく、他のリボ核相互作用に関連する複雑なメカニズムを探索することができます。
プロトコル
実験の準備
実験を開始する前に、それはすべての試薬、容器や調理器具RNaseフリーを持っていることが重要です。 DEPC処理水ですすぎ、続いてRNaseインヒビター(RNaseZAP、Ambion社)を用いてガラス器具を扱う。すべての試薬はRNaseフリーであることが確認されていることを確認します。
1。 mRNPライセートを調製
- 成長し、各RIPの総タンパク質の2-5 mgの間に生成するために指数関数的に成長している組織細胞を収穫します。
- 二つP150の培養皿で十分です。
- 調査されて各RBPは、総細胞数と蛋白質の量は、適切な標的mRNAとRBPの相互作用を最大化するために最適化する必要があります。
- 定量RT-PCR分析のために、RIPは、特に、HuRの、AUF1、TIARとして高いアバンダンスRBPs向けの増幅及び検出方法によるより少ない細胞溶解物(約400μgの総タンパク質)が必要な場合があります。
- 4 8〜10分間、200×gで℃で遠心分離によって細胞をペレット化し、次に、氷冷PBSで3回洗浄する。
- 最後の洗浄の後、静かにRNaseおよびプロテアーゼ阻害剤を用いてプリペアドポリソーム溶解バッファー(PLB)の等量チューブの底を再懸濁し、細胞ペレットをはじく。
- それは、細胞ペレットの正確な体積を測定することをお勧めします。
- 氷上で5分間インキュベートした細胞溶解物の塊を分解するために静かにピペット混合(ボルテックスしないでください)。
- 4℃で20分間13000×gで遠心℃の破片のライセートをクリアする。
- 直ちに予冷微量遠心チューブに上清クリア移す。
- -80℃で氷とストアを続ける℃まで
- 即時凍結は細胞の適切な溶解が完了し、不要な結合を防ぐことができます。 RIPは直ちに次のサンプル雪解けを進め、RNAの分解を避けるために、サンプルを氷上で保管してください。
- この溶解物を、-80℃で最大6ヶ月間℃に保存することができるこれはタンパク質および/またはmRNAの分解につながることができるように繰り返し凍結融解の繰り返しは避けてください。
- 標準Bradfordタンパク質アッセイを用いてライセート中のタンパク質濃度を定量する。
2。抗体およびウォッシュ付きコートタンパク質は、セファロースビーズ
- 5%BSAでNT2バッファー(3-4巻)中で一晩プレうねりプロテインAセファロース(PAS)をビーズ。 4℃で保存する
- 4℃で数ヶ月までの長期貯蔵℃の0.1%アジ化ナトリウムを補充した場合に可能です。
- プロテインAセファロースビーズをターゲットRBP抗体のアイソタイプに基づいて選択されるべきである。タンパク質は、GおよびA / Gは、すべての特定のアイソタイプの目標を持ち、目標親和性が異なります。プロテインAセファロースビーズをHuRのタンパク質抗体のアイソタイプ特異性と親和性に基づいて使用されていました。
- ご使用の前に、そう、過剰NT2バッファを削除バッファーの比率への最終的なビーズは1:1である。
- 1.5ミリリットルRNaseフリーのマイクロチューブを使用して、PASスラリー液100μlを削除して、個々のIP反応( すなわち 、特定のRBPとアイソタイプコントロール)に対する抗体の30μgを追加します。
- 抗体ビーズミックスにNT2バッファ100〜200μlを添加する。
- 混合物を4℃で数週間保存可能℃の0.1%アジ化ナトリウムを補充したとき。
- 同じ種からのアイソタイプをマッチさせた抗体または全部正常血清は、バックグラウンド·RNAに対する抗体対照として並行して使用されるべきである。
- ビーズミックスに適切な抗体を加え、一晩インキュベートし、4℃で端の上の端を、タンブリング℃に
- (抗体の1、5、10または30μgの通常十分です)を調べている特定のタンパク質に対する抗体価を最適化します。
- 1mlで洗浄することにより、使用直前に抗体被覆ビーズを準備氷冷NT2バッファー5回。
- 4℃で1〜2分℃、13,000 xgで遠心分離することによりビーズミックスを洗う
- 慎重に手ピペッターまたはアスピレーターでsupernantantの最大量を削除するが、ペレットの中断を回避するように注意してください。
- 洗濯は、抗体混合物から未結合の抗体と同様のRNase汚染物質を除去するのに役立ちます。
- 最後の洗浄が完了した後、氷冷NT2バッファは100mMの10μlを、40 U /μLでRNaseを10μlの外を含む、標的mRNAを保護するためのさまざまなRNase阻害剤を用いた治療が続くの700μlのビーズを再懸濁DTTおよび15μlのEDTA(15 mM)を。 NT2のバッファーで1,000μlにボリュームを持ってきて。
- バナジルリボヌクレオシド複合体は、EDTAの抑制効果があるため、使用されていません。
3。免疫沈降およびRNA沈殿
- オプションのプリ·クリアーの手順:
- バックグラウンドを低減するために、ビーズとコントロール抗体を事前クリアライセートに使用されるかもしれません。これにより、出力の信号を減少させることができる。
- このステップでは、マイクロアレイに続くIPを実行するときにバックグラウンドを低減する必要があるかもしれません。これは、一般的に定量RT-PCRに続いてIPアドレスは必要ありません。
- 末に比べ30分/ 4℃タンブリングエンドのアイソタイプコントロール15μgの持つプリ·クリアー。
- ステップ2.1から抗体と非被覆予め膨潤PASビーズの50μlを添加する。
- 末に比べ30分/ 4℃で回転端とをインキュベート
- 4℃、10,000×gで遠心分離しますIPのための上澄み保存します。
- 調製した抗体ミックスに隔離された清澄化ライセート(約2〜5 mg)の100μlを添加する。
- ライセートを希釈して、バックグラウンドや非特異的結合を低減するのに役立ちます。
- ライセート入力の量は検出方法及びRBP oの豊富さによって異なりますステップ1.1.c.で述べたように、RBP抗体のr効率
- (オプション)直ちに静かに4℃、10,000×gで短時間の遠心分離に続いて数回タッピングしてチューブを混ぜ℃でペレットビーズへと直ちに標準RNA単離技術を用いた定量PCR解析のための総入力mRNAの表現として100μlの上清を除去します。
- このステップでは、入力ライセートRNAがIPのための最適であり、唯一のチェックステップとして、または貧しいRNAの結果でRIPは、次のトラブルシューティングの手順として実行する必要があることを確認するためのものである。
- パラフィルムでラップ管端の上の端を、タンブリング、2から4時間、4℃で密封し、インキュベート℃を確保する。
- インキュベーション上のタイミングは、ターゲット豊富に基づいて最適化されるべきであり、複雑な転位または分解を避けるために、最小化されるべきである。一部RBPsに短いインキュベーションは、より最適かもしれません。
- 5000 XGFでペレットビーズまたは4°Cで5分とウェスタンブロット法によって潜在的な分析のために上澄み保存。 -80℃でアリコート℃で保存し
- 残留標的タンパク質の多量と上清のアリコートは、セファロースビーズにより沈殿するタンパク質の障害を示すことがあります。
- 前述したように、氷冷NT2バッファと遠心分離(4℃で5分間5000 xgで℃)1mlのビーズを5回洗い、次にハンドピペッターまたはアスピレーターで上清を除去します。
- より厳格な洗浄方法はデオキシコール酸ナトリウム、尿素やSDSとNT2のバッファを補充することにより、バックグラウンドを低減するために使用されるかもしれません。
- できるだけサンプルを氷上で維持し、標的mRNAの分解を最小限に抑えるために迅速に作業。
- オプション:ウェスタンブロット解析を用いた標的タンパク質のIP効率を確認するためのビーズミックスの少量(10%)を保存したり並列に追加のサンプルを実行します。
4。 DNaseおよびプロテイナーゼKトリートメント
- RNaseフリーのDNase 1(2 U /μl)を5μlのを補足したNT2の100μlの緩衝液で洗浄した後、再懸濁したビーズ。
- 5〜10分間37℃で保管してください。 NT2緩衝液1mlを加え、室温で1分間5000 xgで遠心分離します。
- ビーズの小(〜10%)のアリコートをSDS-PAGE分析することによって、IP効率を確認するために用いることができる。
- 100μlのNT2バッファーに再懸濁し、PASペレットを、5μlのプロテイナーゼK(10 mg / ml)を、および1μlの10%SDS。
- 穏やかに10分ごとにフリック、55℃の水浴中で30分間再懸濁したビーズ混合物をインキュベートする。
- プロテイナーゼKは、RNPの成分の放出に役立ちます。
- ペレットは、室温で5分間5000 xgで(RT)でビーズと(〜100μl)の上清を回収する。
- 遠心、ビーズに200μlのNT2のバッファを追加室温で2分間フーガ5000 XGは、上清(約200μl)を、廃棄ビーズを収集します。
- 上清(100μlと200μl)を組み合わせると酸フェノール- CHCl 3を 300μlの下位層を追加します。
- 渦、1分間RT(または37℃シェーカーのC)と1分間室温で16000×gで遠心分離してください。
- 上位層250μlの(インターフェイスを妨害することはありません)を採取し、pHは5.2、625μlの100%エタノールおよび5μlのglycoblueで25μlの酢酸ナトリウムを加え、よく混ぜる。
- -20℃で一晩保存する
- RNAの適切な復旧を保証するために、glycoblueの添加は担体分子として作用することにより、RNAペレットの視認性を向上します。
- 反転による翌日、混合管3-5回、4で12,000 xgでスピン℃で30分間、上清を捨てる。
- 青いペレットと反転またはボルテックスに70%エタノール1 mlを加える。
- 2分間4℃で12,000×gで遠心します。
- D上清をiscardと4℃で1分間、12,000×gで遠心する℃、
- 室温で5分間ピペットて空気乾燥してペレットと残留し、70%EtOHを削除します。
- のRNase / DNaseフリー水または必要に応じて他の適切な体積の20〜40μlに再懸濁する。
- サンプルは現在、そのような定量RT-PCRやマイクロアレイなどのさらに下流のアプリケーションの準備ができています。
- 光度計分光光度計は、試料濃度を評価する際に使用されるかもしれませんが、貴重なサンプルと、それはそれは無駄が多く、相対的に不正確になることができるようnanodroppingサンプルを回避するために有益であるかもしれません。我々は貴重なまたは低収量サンプルの純度およびIP効率を評価するために、ハウスキーピング遺伝子の転写産物に正規化サンプルを示唆している。
5。代表的な結果
手順が最適化され、正しく実行されている場合は、免疫沈降は、標的mRNAの有意な富が得られるはずです。一般的に定量RT-PCRによって評価した場合、50倍に - 、RBPとそのmRNA標的(複数可)に応じて、我々は、約10の濃縮を参照してください。 RBPsの多くのターゲットは、マイクロアレイ解析を用いて一斉に発見することができます。しかし、この方法は、定量RT-PCRに比べて劣化の影響を受けやすくなります。 RBPは、ターゲットの数と反応の効率に応じて、マイクロアレイは、新規ターゲットの数百人を明らかにすることができ、または任意の場合にのみ、いくつかが明らかになることがあります。例えば、より良い特徴RNA結合タンパク質HuRのの一つは、転写後に多くの重要な生理的遺伝子1,2の発現および翻訳を調節する。乳癌細胞株において、RIP-チップ経由HuRの-ribonucleo複合体の分離は、例えば、 図1に示すように、定量RT-PCRを用いたβ-アクチンを含むいくつかの重要な既知のHuRのターゲット、の富を明らかにした。癌細胞株のβ-アクチンの両方に12を豊かにします - 15倍に。一般的に、適切に実行したとき、我々はかなりのENRを参照してください細胞株の様々なβ-アクチンのichment。 RIPは、β-アクチンの任意の有意な富を明らかにしない場合は、これは、RIPの問題を示していると手順を繰り返す必要があります。 図2 1に示されるように、さらに、これらの細胞株からの免疫沈降サンプルのマイクロアレイ解析は、異なるエストロゲン受容体におけるHuRのターゲット(ER)陽性のMCF-7癌細胞に対するER陰性のMB-231乳癌細胞株の異なる表現のサブセットを明らかにした。どちら関連や癌に関連付けられていない既知および未知のHuRのターゲット:これらのターゲットは、いくつかのカテゴリに分類されます。たとえば、CALM2とCD9は以前HuRのターゲットとして同定されなかった両方の癌遺伝子である。 HuRのタンパク質およびこれらの標的遺伝子との間に顕著な相互作用を示すHuRのペレットに富んで180倍に - マイクロアレイを使用しており、定量RT-PCRで確認し、CALM2とCD9は5であることがわかった。
図1。免疫沈降およびMB-231でRIP(ER)およびMCF-7(ER +)乳癌細胞。免疫沈降は抗HuRのモノクローナル抗体(3A2)とIgG1アイソタイプコントロールを使用して、MB-231またはMCF-7細胞ライセートから行った。 3A2によって検出されるようなフルのA. IPウエスタン予想されるサイズのバンドを明らかにした。右側のパネルには、ローディングコントロールとして、β-チューブリンと、両細胞株から使用ライセート入力でHuRの量を明らかにする。定量的RT-PCR法によるBの検証はそれぞれMB-231およびMCF-7、3A2からIPSで、β-アクチンの15と11倍濃縮、既知HuRの目標を示した。すべてΔΔCT値をGAPDHに対して標準化した。実験は(n = 2)を二重に行った。
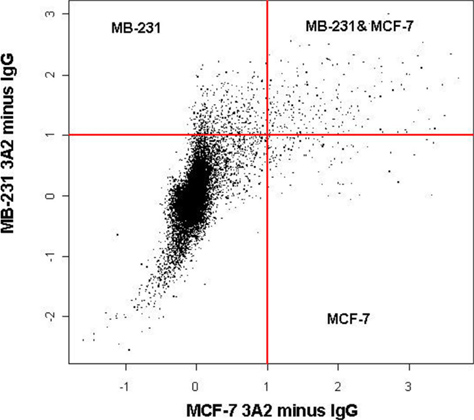
図2。 HuRのRIP-CHIPはER +とER-乳癌細胞内での個別の遺伝的プロファイルを識別します。HuRのの免疫沈降は、MB-231またはHuRの抗体とイルミナSentrixアレイ(47000遺伝子)にハイブリダイズしたIgG1アイソタイプコントロールを使用して、MCF-7細胞ライセートから行った。制御信号は差し引いた。結果は、12の異なるアレイからの累積データを表します。実験が一致するコントロールと各セルラインの三連(n = 3)の中で行った。スケールは、log2です。
ディスカッション
この実験では、最適化と経験の性質のために正常意図した結果を取得するための唯一の保証された方法になります。この手順の多くの手順では、温度及び試薬や製品の効率的な処理が非常に重要です。適切な計画と技術の実行は、実験が推奨される最適な温度で適切な時間枠内で行われたことを保証するのに役立ちます。 RNA分離実験との大きな問題は、RNアーゼによる分解に対するRNAの感度である。全ての試薬は、RNaseフリー、RNaseフリーのコンテナで保管または使用する必要があります。これはあなたのmRNAサンプルの完全性を確保する上で重要なステップです。実験が適切に行われている場合であっても、しかし、望ましい結果はRBPとその標的mRNA間の相互作用の性質によって達成されない場合があります。
一つの潜在的な問題は、RIP-チップによって単離されたRNAからの低あるいは無信号を抱えている。全RNAからの信号があるかもしれませんが、これはビーズでプルダウンされている不適切な結合タンパク質の結果であるかもしれません。トラブルシューティングの最初のステップは、使用されている細胞溶解物は、特定のRBPの適切な表現を持っていることを確認することです。確認後、タンパク質は最終NT2洗浄後に単離することができるとLaemmli緩衝液または他の適当な変性緩衝液に再懸濁し、95℃で加熱し5分間インキュベートする。ウェスタンブロット分析を十分に関与するタンパク質のプルダウンを保証するために、入力ライセートならびに陰性コントロールと連携してこれらのサンプルで使用されるかもしれません。
さらに、細胞を溶解すると、これらのコンポーネントにアクセスする必要があるため、通常は分離されたタンパク質とmRNAの間の異常や望ましくない相互作用の可能性を導入することができる。これらの相互作用は、潜在的に結合し、非特異的な相互作用を介して標的mRNAまたは結合タンパク質を "吸い取る"ことができる。これらの様々な共同でさらに、タンパク質nditionsは、複数のバリエーションで折り畳むことができ、それらの結合モチーフは、それらの相互作用を防止し、それらの標的mRNAへアクセスできなくなる場合があります。これらの両方が効率的に働くだけでなく、これらの不要な相互作用を制限することが記載されている最適な温度を利用することの重要性を強化する。さらに、それぞれの特定の標的タンパク質のための条件を洗浄の最適化は、相互作用の純度を最大化するために重要になるでしょう。より厳格な洗浄条件が必要になることがあります。例えば、洗浄緩衝液を、SDSまたはあなたの信号出力に非特異的な相互作用およびバックグラウンドを低減する尿素の適切な量を補充することができる。これは、実験者のターゲットRBPと同様、独自の生理的条件下で標的mRNAに完全に依存するようになるでしょう。いくつかの条件は、試料の調製に留意すべきである特定のmRNA解析ツールには適していないでしょう。
最後に、RIPは、RNAの濃縮に成功しているものの-RBPの相互作用は、RIP(CHIP)メソッドを使用してよく知られている問題は、一時的なmRNA標的にRBPの特異的結合ドメインを同定することができないことである。いくつかの架橋技術はユニーク配列ターゲットを隔離するためにRIPに続いて使用することができるが、短波長紫外線の使用は、核酸の損傷につながる傾向があります。 PAR-CLIPとして知られている新しいメソッド、または光活性リボ架橋およびimmuoprecipitationは、安定性と過渡両方RNA相互作用からのユニークな結合部位の同定を可能にする新生RNAにチオウリジンを組み込むために長波紫外線を採用しています。
全体的に、RIP-Chipは私たちのグループだけでなく、他の多くの研究グループによってRNA結合タンパク質とその標的mRNAとの間の相互作用を分離して研究するために使用される優れたツールとして確立されている。自然と実際に敏感ですが、この手順を適切に実行するには、最近まで、inaccされているこれらのRNP複合体の単離を、得られます発見と分析のためのessible。
開示事項
著者らは、彼らが競合する利益を持っていないことを宣言します。
謝辞
国防総省(アイデア賞W81XWH-07-0406) - ウルスAtasoyへ
NIHのRO1 A1080870 - ウルスAtasoyへ
NIHのR21はA1079341 - ウルスAtasoyへ
インスティテューショナル·ファンドミズーリ大学 - ウルスAtasoyへ
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| 1 Mジチオスレイトール | フィッシャー | BP172-5 | DTT |
| DNaseを1 | アンビオン | 2235 | RNaseフリー |
| Tetraccetic酸をエチレンジアミン | フィッシャー | BP118-500 | EDTAを |
| グリコーゲン | アンビオン | 9516 | |
| 1 HEPES | シグマ | H3375-100G | pH 7.0の |
| IGEPALノニデットP-40 | USB | 78641 | NP40 |
| 1 M KClを | フィッシャー | BP366-500 | |
| 1 M MgCl 2を | フィッシャー | BP214-500 | |
| NT2のバッファ | *下記を参照 | ||
| ポリソーム溶解バッファー | *下記を参照 | ||
| プロテアーゼ阻害剤カクテル錠 | ロッシュ | 11873580001 | |
| プロテインAセファロースビーズ | シグマ | P3391 | |
| プロテイナーゼK | フィッシャー | BP1700-100 | |
| RNase阻害剤RNaseのアウト | インビトロジェン | 10777-019 | 40 U /μlの |
| 1MのNaCl | フィッシャー | BP358-212 | |
| ドデシル硫酸ナトリウム | フィッシャー | BP166-500 | SDS |
| の1M Tris-HCl | フィッシャー | BP153-500 | pH7.4の |
| トリゾール | インビトロジェン | 15596-026 | |
| リボバナジル錯体 | ニューイングランド研究所 | S1402S | VRC |
| 試薬精査 |
| のRNase / DNaseフリー、DEPC処理したガラス製品の試薬を準備 |
| ポリソーム溶解バッファー |
| 100mMのKCl |
| 5mMのMgCl 2 |
| 10mMのHEPES(pH7.0)を |
| 0.5%NP40 |
| 1mMのDTT |
| 100単位/ mlのRNaseアウト |
| 400μMのVRC |
| プロテアーゼ阻害剤カクテル錠 |
| ポリソーム溶解バッファー5mlの |
| 1MのHEPES緩衝液(pH7.0)50μlを追加 |
| 1 M KClの500μlの |
| 1 M MgCl 2を 25μlの |
| NP40の25μl |
| 4.7ミリリットルのRNase DNaseフリーH 2 O |
| 1 MのDTTを50μl |
| 100 U / mlのRNase12.5μlのアウト |
| 200μlのプロテアーゼ阻害剤カクテル(メーカーによると溶解) |
| 10μlの200mMのVRC(使用時) |
| NT2のバッファ |
| 50mMのトリス-HCl(pH7.4) |
| 150mMのNaCl |
| 1mMのMgCl 2 |
| 0.05パーセントのNP40 |
| NT2緩衝液1L |
| 50ミリリットルトリス(pH 7.4) |
| 30ミリリットルの5 M NaCl |
| 1ミリリットルの1M塩化マグネシウムの2 |
| 500μlのNP40 |
| 820ミリリットルのRNase DNaseフリーH 2 O |
参考文献
- Calaluce, R., Gubin, M. M., Davis, J. W., Magee, J. D., Chen, J., Kuwano, Y., Gorospe, M., Atasoy, U. The RNA binding protein HuR differentially regulates unique subsets of mRNAs in estrogen receptor negative and estrogen receptor positive breast cancer. BMC Cancer. 10, 126-140 (2010).
- Gubin, M. M., Calaluce, R., Davis, J. W., Magee, J. D., Strouse, C. S., Shaw, D. P., Ma, L., Brown, A., Hoffman, T., Rold, T. L., Ulus Atasoy, U. Overexpression of the RNA binding protein HuR impairs tumor growth in triple negative breast cancer associated with deficient angiogenesis. Cell Cycle. 9, 3337-3346 (2010).
- Keene, J. D., Komisarow, J. M., Friedersdorf, M. B. RIP-Chip: the isolation and identification of mRNAs, microRNAs and protein components of ribonucleoprotein complexes from cell extracts. Nature Protocols. 1, 302-307 (2006).
- Tenenbaum, S. A., Lager, P. J., Carson, C. C., Keene, J. D. Ribonomics: identifying mRNA subsets in mRNP complexes using antibodies to RNA-binding proteins and genomic arrays. Methods. 26, 191-198 (2002).
- Tenenbaum, S. A., Carson, C. C., Atasoy, U., Keene, J. D. Genome-wide regulatory analysis using en masse nuclear run-ons and ribonomic profiling with autoimmune sera. Gene. 317, 79-87 (2003).
- Tenenbaum, S. A., Carson, C. C., Lager, P. J., Keene, J. D. Identifying mRNA subsets in messenger ribonucleoprotein complexes by using cDNA arrays. Proc. Natl. Acad. Sci. U.S.A. 97, 14085-14090 (2000).
- Baroni, T. E., Chittur, S. V., George, A. D., Tennebaum, S. A. Advances in RIP-Chip Analysis. Methods in Molecular Biology. 419, 93-108 (2008).
- de Silanes Lopez, I., Zhan, M., Lal, A., Yang, X., Gorospe, M. Identification of a target RNA motif for RNA-binding protein HuR. Proc. Natl. Acad. Sci. U.S.A. 101, 2987-2992 (2004).
- de Silanes Lopez, I., Lal, A., Gorospe, M. HuR: post-transcriptional paths to malignancy. RNA Biol. 2, 11-13 (2005).
- Grigull, J., Mnaimneh, S., Pootoolal, J., Robinson, M. D., Hughes, T. R. Genome-wide analysis of mRNA stability using transcription inhibitors and microarrays reveals posttranscriptional control of ribosome biogenesis factors. Mol. Cell Biol. 24, 5534-5547 (2004).
- Hieronymus, H., Silver, P. A. Genome-wide analysis of RNA-protein interactions illustrates specificity of the mRNA export machinery. Nat. Genet. 33, 155-161 (2003).
- Hieronymus, H., Yu, M. C., Silver, P. A. Genome-wide mRNA surveillance is coupled to mRNA export. Genes Dev. 18, 2652-2662 (2004).
- Mukherjee, N., Corcoran, D. L., Nusbaum, J. D. Integrative Regulatory Mapping Indicates that the RNA-Binding Protein HuR Couples Pre-mRNA Processing and mRNA Stability. Molecular Cell. 43, 1-13 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved