Method Article
Метод выделения и идентификации мРНК, микроРНК и белковых компонентов рибонуклеопротеидных комплексы из клеточных экстрактов использованием RIP-Chip
В этой статье
Резюме
Шаг за шагом протокол выделения и идентификации РНК связаны комплексов через RIP-Chip.
Аннотация
В результате развития высокой пропускной последовательности и эффективного анализа микрочипов, глобальный анализ экспрессии гена стала простой и доступной форме сбора данных. Во многих исследованиях и моделях болезни, однако, устойчивые уровни состояния целевой мРНК гена не всегда напрямую коррелирует с устойчивым уровнем белка государства. Пост-транскрипционной регуляции генов является вероятным объяснением расхождения между ними. Движимый связывание РНК белков (РСБ), пост-транскрипционной регуляции влияет локализации мРНК, стабильности и перевода путем формирования рибонуклеопротеидных (RNP) комплекс с целевой мРНК. Выявление этих неизвестных целей De Novo мРНК из клеточных экстрактов в комплексе RNP имеет решающее значение для понимания механизмов и функций RBP и вытекающих из них влияет на белковый выход. Этот протокол описывает метод называется RNP иммунопреципитации-микрочипов (RIP-Chip), который позволяет для идентификации сpecific мРНК, связанные в рибонуклеопротеидных комплекса, при изменении условий эксперимента, наряду с возможностью дальнейшей оптимизации эксперимента для отдельных исследователей. При этом важным экспериментальным инструментом, исследователи могут изучать сложные механизмы, связанные с пост-транскрипционной регуляции генов, а также других взаимодействий рибонуклеопротеидных.
протокол
Эксперимент подготовки
Перед началом эксперимента, очень важно, чтобы все реагенты, контейнеры и посуда РНКазы бесплатно. Лечить посуды с ингибитором РНК (RNaseZAP, Ambion) с последующей промывкой DEPC обработанной воды. Убедитесь, что все реагенты утвержден в качестве РНКазы бесплатно.
1. Подготовка mRNP Lysate
- Вырастить и собрать экспоненциально растущих клеток тканей для производства между 2-5 мг общего белка на каждый RIP.
- Два P150 блюд культуры, как правило, достаточно.
- Для каждого RBP ведется расследование, общее количество сотовых числе и белков должны быть оптимизированы для максимально соответствующих мРНК мишени и RBP взаимодействия.
- RIP для QRT-PCR анализа может потребоваться меньше сотовой лизат (примерно 400 мкг общего белка) в связи с ее усилением и метод обнаружения, особенно для высоких ОДП обилие таких как HuR, AuF1, TIAR.
- Гранул клеток с помощью центрифугирования при 200 мкг в течение 8-10 мин при 4 ° С, затем промыть три раза ледяным PBS.
- После последней промывки, аккуратно вылить в нижней части трубки и ресуспендируют осадок клеток в равных объемах подготовленной полисом буфера для лизиса (ПРБ) с аз и ингибиторов протеазы.
- Рекомендуется, чтобы отмерить точное количество клеточных гранул.
- Аккуратно пипетки смесью (не вихря), чтобы разбить скопления клеток и инкубировать лизат на льду в течение 5 мин.
- Центрифуга при 13000 х г в течение 20 мин при 4 ° C, чтобы очистить лизат мусора.
- Немедленно передать очищены супернатант предварительно охлажденные пробирки.
- Держите на льду и хранят при температуре -80 ° C.
- Немедленное замораживание завершает надлежащего лизиса клеток и предотвращает нежелательные обязательным. Далее с RIP немедленно следующий пример оттепели и хранить образцы на льду, чтобы избежать деградации РНК.
- Это лизат может храниться до шести месяцев при температуре -80 ° C. Избегайте повторных циклов замораживания-оттаивания, так как это может привести к белка и / или деградации мРНК.
- Количественной концентрации белка в лизатах с использованием стандартных Bradford анализа белка.
2. Белка оболочки сефарозой Бусины с антителами и Wash
- Предварительно зыбь белка сефарозы (PAS) бисер ночь в NT2 буфер (3-4 тома) с 5% BSA. Хранить при температуре 4 ° C.
- Долгосрочное хранение до нескольких месяцев при 4 ° С возможна, когда дополнен с 0,1% азида натрия.
- Бисер белка сефарозой должны быть выбраны на основе изотипа целевых антител ОДП. Белки, G и A / G имеют конкретные цели изотипа и различаются по целевой близость. Белки сефарозе бисером были использованы на основе изотипа специфичность и сродство белков антител HuR.
- Перед использованием удалить излишки NT2 буфер, так чточто окончательное бисером буфера составляет 1:1.
- Использование 1,5 мл РНКазы труб микроцентрифужных, удалить 100 мкл суспензии PAS и добавить 30 мкг антител для каждой отдельной реакции IP (т.е. конкретные RBP и изотипа контроля).
- Добавить 100-200 мкл буфера для NT2 смесь антител шарик.
- Смесь может храниться в течение нескольких недель при температуре 4 ° С, когда дополнен с 0,1% азида натрия.
- Изотипа соответствием антител или целые нормальные сыворотки от одного вида должны использоваться параллельно, как антитела контроля фоне РНК.
- Добавить соответствующих антител к борту перемешать и инкубировать в течение ночи, упав на конец конца при 4 ° C.
- Оптимизация титр антител для конкретного исследуемого белка (1, 5, 10 или 30 мкг антител обычно достаточно).
- Подготовка антителами бисер непосредственно перед использованием путем промывания 1 млледяной NT2 буфером в 5 раз.
- Промойте шарик смеси путем центрифугирования при 13000 х г в течение 1-2 мин при 4 ° C.
- Осторожно снимите максимальное количество supernantant с пипетки руку или аспиратором, но будьте осторожны, чтобы не нарушить гранул.
- Стиральные помогает удаления несвязанного антитела, а также РНКазы загрязняющих веществ из смеси антител.
- После последней промывки была завершена, ресуспендируют бисером в 700 мкл ледяного буфера NT2 с последующей обработкой различных ингибиторов РНКазы для защиты мРНК мишеней, в том числе 10 мкл РНКазы при 40 ед / мкл, 10 мкл 100 мМ DTT и 15 мкл ЭДТА (15 мм). Принесите объемом до 1000 мкл с NT2 буфера.
- Комплексы ванадил рибонуклеозид не используются из-за тормозящего действия EDTA.
3. Иммунопреципитация и РНК осадков
- Дополнительно клиру Шаг:
- Для уменьшения фона, бусы и контрольного антитела могут быть использованы для предварительного ясно лизата. Это может уменьшить сигнал на выходе.
- Этот шаг может быть необходимым, чтобы уменьшить фоновый при выполнении IP следуют микрочипов. Это вообще не является необходимым для IP следуют QRT-PCR.
- Клиру с 15 мкг изотипа контроля в течение 30 мин / 4 ° C упасть на конец конца.
- Добавить 50 мкл preswollen бисером PAS, не покрытых антителами с шагом 2.1.
- Инкубировать 30 мин / 4 ° C с вращением конца по концу
- Центрифуга на 10000 мкг при 4 ° C. Сохранить супернатант для IP.
- Добавить 100 мкл изолированные очищены лизат (примерно 2-5 мг) до приготовленную смесь антител.
- Разбавление лизат поможет уменьшить фон и неспецифического связывания.
- Количество лизат входа может меняться в зависимости от метода обнаружения и обилие RBP оГ эффективность антител RBP как указано в шаге 1.1.c.
- (Необязательно) Сразу смешивать трубы, осторожно стряхивая несколько раз последующим кратким центрифугированием при 10000 мкг при 4 ° С для осаждения бисером и немедленно удалить 100 мкл супернатанта как общее представление мРНК вход для КПЦР анализа с использованием стандартных методов выделения РНК.
- Этот шаг подтверждает, что вход лизат РНК является оптимальным для IP и должны быть выполнены только в качестве проверки шаг или устранения неполадок после RIP с плохими результатами РНК.
- Wrap трубки в парафильмом обеспечить герметичное уплотнение и инкубировать при температуре 4 ° С в течение от 2 до 4 часов, упав на конец конца.
- Выдержка времени на инкубацию должны быть оптимизированы на основе целевых изобилие и должно быть сведено к минимуму, чтобы избежать сложного перестановки или деградации. Для некоторых ОДП короче инкубация может быть более оптимальным.
- Пелле бусины в 5000 XGFили 5 мин при 4 ° C и сохраните супернатант для потенциального анализа вестерн-блоттинга. Магазин аликвоты при -80 ° C.
- Аликвоты супернатанта с высоким содержанием остаточного белка-мишени может свидетельствовать о недостаточности белка, чтобы быть спровоцирован сефарозе бисера.
- Как описано выше, мыть бисера 5 раз с 1 мл ледяного буфера NT2 и центрифугирования (5.000 мкг в течение 5 мин при 4 ° С), затем удалите супернатант с пипетки руку или аспиратора.
- Более жесткие методы мытья могут быть использованы в целях уменьшения фона, дополняя NT2 буфера с дезоксихолат натрия, мочевиной или SDS.
- Храните образцы на льду как можно больше и работать быстро, чтобы минимизировать деградацию мРНК-мишени.
- Дополнительно: Сохранить небольшой аликвоты (10%) из бисера смеси или запустить дополнительный образец параллельно для проверки IP эффективности целевого белка использованием Вестерн-блоттинга.
4. ДНКазой и протеиназы К лечения
- После промывки ресуспендируют бусины с 100 мкл буфера NT2 с добавлением 5 мкл РНКазы ДНКазой 1 (2 ед / мкл).
- Хранить при температуре 37 ° С в течение 5-10 мин. Добавить 1 мл NT2 буфера и центрифугируют при 5000 х г в течение 1 мин при комнатной температуре.
- Мала (~ 10%) аликвоты из бисера может быть использована для проверки IP эффективность SDS-PAGE анализа.
- Ресуспендируют PAS осадок в 100 мкл буфера NT2, 5 мкл протеиназы К (10 мг / мл) и 1 мкл 10% SDS.
- Инкубируйте ресуспендированных шарик смеси в течение 30 мин при 55 ° С на водяной бане, аккуратно стряхивая на каждые 10 мин.
- Протеиназы К поможет в выпуске RNP компонентов.
- Пелле бусины в 5000 мкг в течение 5 мин при комнатной температуре (RT) и собирают супернатант (~ 100 мкл).
- Добавить 200 мкл буфера для NT2 бисера, центробежныйFuge 5000 мкг в течение 2 мин при комнатной температуре, собирают супернатант (~ 200 мкл), и выбросить бусы.
- Комбинат супернатанты (100 мкл и 200 мкл) и добавить 300 мкл нижний слой кислоты фенол-хлороформ 3.
- Vortex, 1 мин RT (или 37 ° C в шейкере) и центрифуге при 16000 х г при комнатной температуре в течение 1 мин.
- Соберите 250 мкл верхнего слоя (не нарушают интерфейс), добавить 25 мкл ацетата натрия при рН 5,2, 625 мкл 100% этанола и 5 мкл glycoblue, и хорошо перемешать.
- Хранить в течение ночи при температуре -20 ° C.
- Для обеспечения надлежащего восстановления РНК, добавление glycoblue увеличит видимость осадок РНК, выступая в качестве молекулы-носителя.
- На следующий день, перемешать труб путем инверсии 3-5 раза, спина при 12000 мкг при 4 ° С в течение 30 мин и отбросить супернатант.
- Добавить 1 мл 70% этанола и синие гранулы и перемешать инверсии или встряхиванием.
- Центрифуга 12000 мкг при 4 ° С в течение 2 мин.
- Реiscard супернатант и центрифуги 12000 х г в течение 1 мин при 4 ° C.
- Удалите любые остаточные 70% EtOH с помощью пипетки и воздух сухой осадок при комнатной температуре в течение 5 мин.
- Ресуспендируют в 20-40 мкл РНКазы / аз-свободная вода или другой соответствующий объем по мере необходимости.
- Образец готов к дальнейшему вниз по течению приложений, таких как QRT-PCR или микрочипов.
- NanoDrop спектрофотометрии могут быть использованы в оценке концентрация образца, однако с драгоценными образцами, это может быть выгодно, чтобы избежать nanodropping образцов, как это может быть расточительной и относительно неточными. Мы предлагаем нормализации образцов транскриптов гена домашнего хозяйства для оценки чистоты и IP эффективности на драгоценные или низкой доходности образцов.
5. Представитель Результаты
Если процедура оптимизирована и выполнены правильно, иммунопреципитация должно дать значительное обогащение мРНК мишеней. Типично, В зависимости от RBP и его мРНК мишени (ы), мы видим, обогащение примерно 10 - 50-кратный, когда оценивается QRT-PCR. Многие цели ОДП может быть обнаружено массовое использование микрочипов анализа. Тем не менее, этот метод является более чувствительным к деградации по сравнению с QRT-PCR. В зависимости от RBP, число целевых показателей и эффективности реакции, микрочип может открыть сотни новых целей, или он может раскрыть только немногие, если таковые имеются. Например, одна из лучших характеризуется HuR РНК-связывающих белков, пост-транскрипционно регулирует экспрессию и перевод многих важных физиологических генов 1, 2. Выделение HuR-ribonucleo-комплекс с помощью RIP-Chip в груди линий раковых клеток, например, показало, обогащение нескольких важных известно HuR целей, в том числе β-актина использование QRT-PCR, как показано на рисунке 1. В обеих линиях раковых клеток β-актина обогащена 12 - 15-кратный. Обычно, когда выполняется должным образом, мы видим значительный ENRichment из β-актина в различных клеточных линиях. Однако, если RIP не выявили каких-либо значительных обогащения β-актина это указывает на проблемы с RIP и процедуру, возможно, придется повторить. Кроме того, микрочипов анализа иммунопреципитации образцы из этих клеточных линий показали различные подмножества выражение HuR целей в различных рецепторов эстрогена (ER) положительные MCF-7 раковых клеток по сравнению с ER отрицательного MB-231 рака молочной железы клеточных линий, как показано на рисунке 2 1. Эти показатели делятся на несколько категорий: известные и неизвестные HuR целей, которые были либо связаны или не связаны с раком. Например, CALM2 и CD9 являются рак генов, которые ранее не были определены как HuR целей. С помощью микрочипов и подтверждения с QRT-PCR, CALM2 и CD9 было установлено, что 5 - до 180 раз обогащенный HuR гранул указывает видный взаимодействия между белком и HuR этих генов-мишеней.
Рисунок 1. Иммунопреципитация и RIP в MB-231 (ER-) и MCF-7 (ER +) клеток рака молочной железы. Immunoprecipitations были выполнены из MB-231 или MCF-7 клеточных лизатов с использованием анти-Гур моноклональных антител (3А2) и IgG1 изотипа контроля. A. IP-Западного Ора показали ожидаемый размер группы, которая была определена 3A2. Группа по правую показывает количество HuR на входе лизатов использовать с обеих клеточных линий, с β-тубулина в качестве управления загрузкой. B. Проверка по количественной ОТ-ПЦР показал, пятнадцать и одиннадцать раз обогащения β-актина, известный целевой HuR, в 3A2 IP-адреса из MB-231 и MCF-7, соответственно. Все ΔΔCT значения нормированы на GAPDH. Эксперименты проводились в двух экземплярах (п = 2).
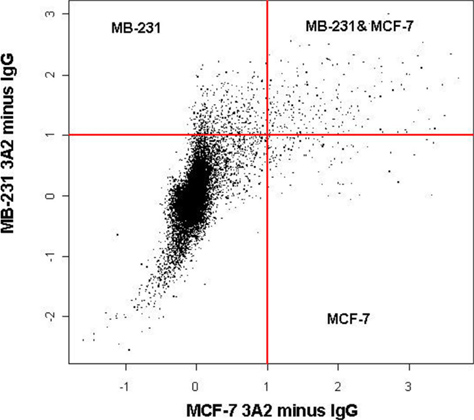
Рисунок 2. HuR RIP-CHIP идентифицирует различные генетические профили в ER + и ER-грудь раковыми клетками.HuR immunoprecipitations были выполнены из MB-231 или MCF-7 клеточных лизатов использованием антител HuR и IgG1 изотипа контроля гибридизовали с Illumina Sentrix массивов (47,000 генов). Управляющие сигналы были вычтены. Результаты представляют собой совокупные данные из 12 различных массивов. Эксперименты проводились в трех экземплярах (п = 3) для каждой клеточной линии с соответствующим контролем. Весы log2.
Обсуждение
Из-за природы этого эксперимента, оптимизации и опыт будет гарантирована только способы успешного приобретения желаемых результатов. Во многих шагов этой процедуры, температуры и эффективной обработки реагентов и продуктов являются критически важными. Правильное планирование и выполнение техника поможет гарантировать, что эксперимент был проведен в приемлемые сроки при оптимальных температурах рекомендуется. Главная проблема с экспериментами выделения РНК является чувствительность РНК к деградации РНКазы. Все реагенты должны быть РНКазы свободной и хранятся или используются в РНКазы контейнеров. Это очень важный шаг в обеспечении целостности вашей мРНК образца. Даже тогда, когда эксперимент проводится должным образом, однако, желаемого результата не может быть достигнуто за счет характера взаимодействия между РСП и его мРНК мишени.
Одна потенциальная проблема с низкой или даже нет сигнала от РНК выделяли RIP-Chip.Хотя может быть сигнал от общей РНК, это может быть результатом недостаточной связывающего белка тянут вниз бисером. На первом этапе устранения неполадок, чтобы подтвердить, что клеточная лизат используется имеет адекватного выражения конкретных ОДП. После подтверждения, белок может быть выделен после окончательного NT2 стирки и ресуспендировали в Laemmli буфера или другого соответствующего денатурирующих буфера и нагревали при 95 ° C в течение 5 мин. Вестерн-блот анализ может быть использован на этих образцов в координации с входом лизат, а также отрицательного контроля для обеспечения достаточного тянуть вниз связанные белка.
Кроме того, поскольку лизис клетки, необходимые для доступа к этим компонентам, потенциал для ненормальных и нежелательных взаимодействий между обычно разделенных белков и мРНК могут быть введены. Эти взаимодействия потенциально могут связываться и "впитывать" вашей целевой мРНК или белков через неспецифические взаимодействия. Кроме того, белки в этих различных сотрудничествеnditions можно сложить в несколько вариаций и их связывающие мотивы могут стать недоступными для своей целевой мРНК, предотвращая их взаимодействия. Оба эти укрепления важность эффективной работы, а также использования оптимальных температур перечисленных ограничить эти нежелательные взаимодействия. Кроме того, оптимизация стиральная условий для каждого конкретного белка-мишени будет иметь решающее значение для максимальной чистоты взаимодействия. Более жесткие условия стиральных могут быть необходимы. Например, промывочный буфер может быть дополнен SDS или соответствующее количество мочевины для уменьшения неспецифического взаимодействия и фон в выходной сигнал. Это будет полностью зависят от целевой экспериментатора RBP, а также целевой мРНК в их уникальных физиологических условий. Некоторые условия не будут пригодны для определенных мРНК инструментов анализа, которые должны быть отмечены в подготовке образцов.
Наконец, хотя RIP является успешным в обогащении РНК-RBP взаимодействия, известные проблемы с RIP (CHIP) метода является невозможность определить конкретные связывающие домены RBP на переходном цели мРНК. Несколько сшивания методы могут быть использованы следуют RIP выделить уникальную последовательность целей, однако использование коротковолнового ультрафиолетового правило, приводит к повреждению нуклеиновых кислот. Новый метод, известный как PAR-CLIP или фотоактивируемых сшивания рибонуклеозид и immuoprecipitation, работает длинноволнового ультрафиолетового включить тиоуридина в зарождающейся РНК, позволяющий идентифицировать уникальные сайты связывания с обеих стабильные и переходные взаимодействия РНК.
В целом, RIP-Chip была создана как отличный инструмент, используемый для выделения и изучения взаимодействия РНК-связывающих белков и их цели мРНК нашей группы, а также многих других исследовательских групп. Хотя чувствительны в природе и практике надлежащего выполнения этой процедуры приведет к изоляции этих RNP комплексов, которые до недавнего времени были inaccessible для обнаружения и анализа.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие интересы.
Благодарности
Министерство обороны (Идея премии W81XWH-07-0406) - Чтобы улуса Atasoy
NIH RO1 A1080870 - Для улуса Atasoy
NIH R21 A1079341 - Для улуса Atasoy
Университет Миссури институциональных фондов - Для улуса Atasoy
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| 1 М ДТТ | Рыбак | BP172-5 | DTT |
| ДНКазы 1 | Ambion | 2235 | РНКазы бесплатно |
| Этилендиамин Tetraccetic кислота | Рыбак | BP118-500 | EDTA |
| Гликоген | Ambion | 9516 | |
| 1 HEPES | Сигма | H3375-100G | рН 7,0 |
| Igepal Nonidet P-40 | USB | 78641 | NP40 |
| 1 M KCl | Рыбак | BP366-500 | |
| 1 М MgCl 2 | Рыбак | СиP214-500 | |
| NT2 буфера | * См. ниже | ||
| Полисом буфера для лизиса | * См. ниже | ||
| Протеаза таблетки ингибитора коктейль | Roche | 11873580001 | |
| Белки сефарозой бусины | Сигма | P3391 | |
| Протеиназы K | Рыбак | BP1700-100 | |
| РНКазы Out ингибитор РНКазы | Invitrogen | 10777-019 | 40 ЕД / мкл |
| 1 М NaCl | Рыбак | BP358-212 | |
| Сульфат натрия додецилсульфата | Рыбак | BP166-500 | SDS |
| 1 М Трис-HCl | Рыбак | BP153-500 | рН 7,4 |
| Trizol | Invitrogen | 15596-026 | |
| Ванадил комплексы рибонуклеозид | Новая Англия Labs | S1402S | VRC |
| Реагент Workup |
| Подготовка реагентов в РНКазы / аз-бесплатно, DEPC обработанные изделия из стекла |
| Полисом буфера для лизиса |
| 100 мМ KCl |
| 5 мМ MgCl 2 |
| 10 мМ HEPES (рН 7,0) |
| 0,5% NP40 |
| 1 мМ DTT |
| 100 ед / мл РНКазы Out |
| 400 мкМ VRC |
| Ингибитор протеазы коктейль таблетки |
| 5 мл буфера для лизиса полисом |
| Добавить 50 мкл 1 М HEPES (рН 7,0) |
| 500 мкл 1 М KCL |
| 25 мкл 1 М MgCl 2 |
| 25 мкл NP40 |
| 4,7 мл РНКазы ДНКазой свободного H 2 O |
| 50 мкл 1 М ДТТ |
| 12,5 мкл из 100 ЕД / мл РНКазы Out |
| 200 мкл ингибитора протеазы коктейль (растворенного в зависимости от производителя) |
| 10 мкл 200 мМ VRC (во время использования) |
| NT2 буфера |
| 50 мМ Трис-HCl (рН 7,4) |
| 150 мМ NaCl |
| 1 мМ MgCl 2 |
| 0,05% NP40 |
| 1 л NT2 буфера |
| 50 мл Трис (рН 7,4) |
| 30 мл 5 М NaCl |
| 1 мл 1 М MgCl 2 |
| 500 мкл NP40 |
| 820 мл РНКазы ДНКазой свободного H 2 O |
Ссылки
- Calaluce, R., Gubin, M. M., Davis, J. W., Magee, J. D., Chen, J., Kuwano, Y., Gorospe, M., Atasoy, U. The RNA binding protein HuR differentially regulates unique subsets of mRNAs in estrogen receptor negative and estrogen receptor positive breast cancer. BMC Cancer. 10, 126-140 (2010).
- Gubin, M. M., Calaluce, R., Davis, J. W., Magee, J. D., Strouse, C. S., Shaw, D. P., Ma, L., Brown, A., Hoffman, T., Rold, T. L., Ulus Atasoy, U. Overexpression of the RNA binding protein HuR impairs tumor growth in triple negative breast cancer associated with deficient angiogenesis. Cell Cycle. 9, 3337-3346 (2010).
- Keene, J. D., Komisarow, J. M., Friedersdorf, M. B. RIP-Chip: the isolation and identification of mRNAs, microRNAs and protein components of ribonucleoprotein complexes from cell extracts. Nature Protocols. 1, 302-307 (2006).
- Tenenbaum, S. A., Lager, P. J., Carson, C. C., Keene, J. D. Ribonomics: identifying mRNA subsets in mRNP complexes using antibodies to RNA-binding proteins and genomic arrays. Methods. 26, 191-198 (2002).
- Tenenbaum, S. A., Carson, C. C., Atasoy, U., Keene, J. D. Genome-wide regulatory analysis using en masse nuclear run-ons and ribonomic profiling with autoimmune sera. Gene. 317, 79-87 (2003).
- Tenenbaum, S. A., Carson, C. C., Lager, P. J., Keene, J. D. Identifying mRNA subsets in messenger ribonucleoprotein complexes by using cDNA arrays. Proc. Natl. Acad. Sci. U.S.A. 97, 14085-14090 (2000).
- Baroni, T. E., Chittur, S. V., George, A. D., Tennebaum, S. A. Advances in RIP-Chip Analysis. Methods in Molecular Biology. 419, 93-108 (2008).
- de Silanes Lopez, I., Zhan, M., Lal, A., Yang, X., Gorospe, M. Identification of a target RNA motif for RNA-binding protein HuR. Proc. Natl. Acad. Sci. U.S.A. 101, 2987-2992 (2004).
- de Silanes Lopez, I., Lal, A., Gorospe, M. HuR: post-transcriptional paths to malignancy. RNA Biol. 2, 11-13 (2005).
- Grigull, J., Mnaimneh, S., Pootoolal, J., Robinson, M. D., Hughes, T. R. Genome-wide analysis of mRNA stability using transcription inhibitors and microarrays reveals posttranscriptional control of ribosome biogenesis factors. Mol. Cell Biol. 24, 5534-5547 (2004).
- Hieronymus, H., Silver, P. A. Genome-wide analysis of RNA-protein interactions illustrates specificity of the mRNA export machinery. Nat. Genet. 33, 155-161 (2003).
- Hieronymus, H., Yu, M. C., Silver, P. A. Genome-wide mRNA surveillance is coupled to mRNA export. Genes Dev. 18, 2652-2662 (2004).
- Mukherjee, N., Corcoran, D. L., Nusbaum, J. D. Integrative Regulatory Mapping Indicates that the RNA-Binding Protein HuR Couples Pre-mRNA Processing and mRNA Stability. Molecular Cell. 43, 1-13 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены