Method Article
として不死化マウス脳微小血管内皮細胞株の生成
要約
この方法では、マウスの脳から微小血管内皮細胞を分離し不死化する方法について説明します。我々は、脳組織、消化手順、播種し、細胞の不死化の均質化から始まるステップ·バイ·ステップのプロトコルを記述します。通常、それは均質、不死化血管内皮細胞株を得るために約5週間かかります。
要約
上皮および内皮細胞(EC)は、外部と内部の環境から組織を保護する傍細胞壁を構築しています。 ECから成る血液脳関門(BBB)、アストロサイトのエンドフィート、周皮細胞と基底膜は、脳実質の保護や恒常性に責任があります。 体外 BBBのモデルでは BBBの構造と機能を研究するための一般的なツールである細胞レベルで。 in vitroでのBBBモデルで異なるの相当数は、これまでの異なる研究室の研究のために設立されています。通常、細胞は、ウシ、ブタ、ラットまたはマウスの脳組織(ウィルヘルムらによる審査で詳細に議論した。1)から得られる。ヒト組織試料は、実験室や企業2,3の限られた数でのみご利用いただけます。初代細胞の調製物は、時間がかかり、ECの文化がバッチにバッチとは異なる場合があります、不死のEC LINの設立ですがesは科学的関心の焦点となっています。
ここでは、新生児マウスの脳からの不死化脳微小血管ECのラインを確立するための方法を提案する。我々は、プロシージャ·ステップ·バイ·ステップのリストを使用した試薬および解決策を説明します。私たちの研究室で確立した方法は、4〜5週間以内に均質な不死化血管内皮細胞株の単離を可能にする。脳毛細血管内皮細胞株はCEND 4と呼ばれる(大脳皮質から)、5(小脳皮質から)cerebEND、フェルスターの研究室では、この手順に従って単離した、効果的に、BBBの異なる生理学的および病理学的プロセスの説明のために使用されている。 CENDを使用して、我々は、これらの細胞はグルココルチコイド4,6-9およびエストロゲン治療10まで並びにTNFアルファ5,8としてプロinfammatoryメディエーターに応答することが実証されているcerebEND。また、複数のSCの病理を研究してきたlerosis 11とEC-レベルの低酸素12,13。 CENDとcerebEND線はBBBの構造と機能を研究するための優れたツール、リンパ球や癌細胞と異なる刺激やECの相互作用にECの細胞応答とみなすことができる。
プロトコル
1。脳微小血管の分離
- それぞれの準備のためにどちらかの性別の五から十新生児マウス(3-5日齢)を使用します。
- 地元の動物実験委員会/獣医師の推奨事項に従って、マウスを安楽死させる、直ちに脳を削除し、次の解決策を含むペトリ皿に転送:15mMのHEPES(pH7.4)中、153 mMのNaCl、5.6のKCl、2.3 mMのCaCl 2×2H 2 O、2.6 mMのMgCl 2×6H 2 O、1%(w / v)のBSA(バッファと呼ぶ)。
- 特に断らない限り、すべての分離手順は、層流フードの下で室温(RT)(22-24℃)で行われるべきである。バッファ内に滅菌メスを使用して、髄膜および毛細血管の断片を除去した後、脳を(小脳、脳幹、大脳なし)カット。組織がない塊が表示されなくなるまで10mlのピペットを用いて上下に断片化し、ピペット。室温で5分間、250×gで50ミリリットルのファルコンチューブと遠心分離機に懸濁液を移す。
注:髄膜は脳組織の表面に薄い透明膜として識別することができます。彼らは慎重に滅菌ピンセットで除去することができる。
- 上清を捨てる。
- 4.5ミリリットルバッファ0.75%の1.5ミリリットル(w / v)のコラゲナーゼ/ディスパーゼ(Roche)を用いて、37℃で45分間インキュベート℃の水浴(時折揺れ)にCでペレットを溶解する。
- 一方、コラーゲンIV(0.1 mg / mlの50 mM酢酸に溶解したもの)でコーティングする4つのウェルで12ウェルプレートを準備します。 1時間付着することができます。
- 氷冷緩衝液Aを徹底的にペレットを再懸濁し、15ミリリットルを添加することによって消化を停止します。
- 室温で10分間250 xgで懸濁液を遠心分離します。
- 上清を捨てる。
- ミエリンを削除するには、4℃で20分間、1,000×gで10ミリリットル25%(w / v)のBSA(Sigma社製、純度> 98%)と遠心分離機を追加25%のBSAを1×PBS(PAAラボラトリーズ)に溶解し、0.2μmのfに通して濾過されるべきであるILTER)。
- 慎重に上清を捨て、10mlのバッファーと新しいファルコンチューブに移すでペレットを溶解する。
- 室温で5分間、250×gで懸濁液を遠心分離します。得られたペレットは、内皮細胞が含まれています。
- PBSで二回IV型コラーゲンコートした12ウェルプレートを洗浄してください。
- 2井戸、各ウェルに2ミリリットルに4成長培地1ml(DMEM、10%FCS、50U/mlペニシリン/ストレプトマイシン、1%L-グルタミンを含む)とプレートの細胞懸濁液中にペレットを再懸濁します。 37℃で45分間、4μg/ mlのインキュベートし、最終濃度°細胞培養インキュベーター中でCにピューロマイシンを追加します。このステップでは、急速に接着した細胞を除去することができます注:ピューロは、24時間のために追加されます。 ECSは、他の細胞型のピューロのために、それを代謝することができる唯一の脳は14有毒である。
- 2新鮮ウェル(これらの井戸は、EC画分を含む)にステップ1.14から非付着細胞を含む2 mlの培地を転送します。 STEから接着した細胞をウェルの中に埋める2ミリリットル新鮮培地(これらの井戸は、他の細胞型、 例えば 、線維芽細胞、アストロサイトが含まれており、並行して成長し、形態の比較のために使用することができる)を持つp 1.14。
- 翌日、培地を変更します。
2。脳微小血管内皮細胞を不死化する
- 10%熱不活性化FCS、50U/mlペニシリン/ストレプトマイシン、および2 mg / mlのG418を(含むDMEM培地でオーマミドルTの癌遺伝子とGP + E-86ネオ(GPENeo)15線維芽細胞、分泌複製欠損ウイルスを養うゼラチンコートフラスコでPAAラボラトリーズ) 注:オーマミドルTの癌遺伝子のトランスフェクションは、非-ECS文化の内皮細胞形態4〜6週間で細胞の均質な単層につながるオーバーECの増殖の利点を引き起こす。 GPENeoは市販されていないと(オリジナルの刊行物4,16を参照してください)共有公的材料として得ることができる。
- のウイルス含有培地を使用するには不死化、24時間G418を含まない培地でGPENeo細胞を養う。
- GPEneo上清10mlを取り外し、8μg/ mlの最終濃度にポリブレン(ヘキサジメトリンブロマイド)(シグマ)を追加し、細胞破片を除去するために0.45μmのフィルターで滅菌します。
- パート1で調製したEC培養から培地を除去し、ウェルにGPEneo上澄み/ポリブレン混合液2mlを加える。新鮮GPEneoポリブレン/上清混合物を使用して次の日にそれを繰り返す注:ポリブレンはウイルス粒子)の感染を容易にするために、細胞壁に孔を作るために使用されます。
- GPEneoポリブレン/上清を混合翌日を削除し、PBSで細胞を2回洗浄し、3日ごとにそれを変更する増殖培地中で細胞を維持。合流時には、コラーゲンIVコーティングプレート上の細胞1:2に分割します。
- 典型的には、安定した脳血管内皮(CEND)細胞株は4-5週間後に得られるべきである。
- 10ミリリットルあらかじめ温めておいた培地を用いて15ミリリットル·ファルコンで水浴して転送でcryoaliquotから細胞を解凍します。
- 室温で5分間、250×gで懸濁液を遠心分離します。
- 培養液を除去し、あらかじめ温めておいた増殖培地とコラーゲンIVコーティングされたTの25cm 2の細胞培養フラスコ(めっき用の細胞密度が少なくとも1×10 4細胞/ mlであるべきである)でペレットを転送します。
- 翌日、培地を変更して、細胞がコンフルエントに達した後(通常5日後)セルを分割する。
4。 CEND細胞の分裂(注:分割は週に一度の間隔で行われる必要があり、1:4より高い分割を避ける)。
- 、培地を除去し、PBSで細胞を洗浄する。
- 37℃でインキュベート暖かいトリプシン-EDTA溶液(PAAラボラトリーズ)(T 75cm 2フラスコ)、3 mlを追加℃、細胞層まで待つ(通常5〜15分以内)に分散されている。
- 5ミリリットルoを追加fの成長培地、ピペッティングと、新しいコラーゲンIVコーティングしたフラスコへの転送。
5。 CEND細胞の凍結
- ステップ4で説明したように細胞懸濁液を得
- 室温で5分間、250×gで懸濁液を遠心分離します。
- 6ミリリットルの凍結培地中で細胞ペレット(1 T 75cm 2フラスコから得られた)(95%成長培地、5%DMSO)を懸濁します。
- 。4 1.5ミリリットルクライオアリコートに細胞懸濁液を分割注:Oneクライオアリコートは、T 25cm 2フラスコに播種することができます。
- 液体窒素蒸気温度下クライオアリコートを格納します。
450ミリリットルDMEM、10%FCS、10ミリリットルのL-グルタミン、2%MEM-キット、2%NEAA、10mlのピルビン酸ナトリウム、50 U / mlペニシリン/ストレプトマイシン:増殖培地をCEND
6。代表的な結果
CENDとcerebEND細胞は内皮の免疫染色によって特徴づけられたND BBBは経内皮電気抵抗(TEER)と透磁率の測定によって、ならびにマーカー。 CENDとcerebENDは合流での成長阻害を示したすし詰め状態細長い細胞の単層で、脳ECの初代培養と同様の形態を有していた。細胞は、免疫蛍光( 図3)4,5で示される細胞間結合に局在していたクローディン-5、オクルディンとVE-カドヘリンタンパク質の良く検出可能なレベルを、表明した。血清低減培地で培養CEND細胞はTEERの増加(Ωcmの2 150から2%血清の存在下で500Ωcmで2〜10%血清の存在下)ヒドロコルチゾンを添加することによって増強された、(800Ω·cmであったにつながった2)またはインスリン(1,000Ω·cmであった2)4。 21日間血清低減培地で培養CENDの単分子膜は、900Ω·cmであった2( 図4)のTEERを持っていた。 TEERは、アセンブリを使用して測定した現在のパッシングと電圧測定電極(ワールド·精密機器)を含む。比較のために、主要な微小血管脳ECは200から600Ω·cmであった2と市販のマウス細胞株bEnd.3のTEER値はアボット2005とTothさんらを参照してください最近のレビューのために100から140Ωcmの2(のTEER値を持っていたことが報告されているら 、2011年17,18)。加えて、4時間かけてこのような非荷電分子量4、10、70、500 kDaのFITC-デキストラン、または2%FCSの分化培地でCENDの単層にわたるフルオレセイン(300 Da)のような巨大分子の通過は低下した10%FCSを含む成長培地中で維持コントロール細胞と比較して:傍細胞フラックスはFITC-デキストラン10〜70 kDaのために26%に、フルオレセインの制御細胞の30%に減少した、フラックスをFITC用コントロール細胞の4.5%に減少した-dextrtan 500kDaの。値をTEERと同様に、透磁率がglucの存在下で培養した細胞では、最低レベルであったocorticoids(GC)4。さらなる研究では、脳血管内皮4,7,9にクローディン-5およびVE-カドヘリン、オクルディン、グルココルチコイド標的遺伝子を同定した。 GCの治療は、これらのタンパク質の発現が増加したこと及び細胞骨格へのVE-カドヘリンの転位につながった。タイトジャンクションタンパク質オクルディンとクローディン-5の直接GC媒介規制は、そのプロモーター領域4,7,19のGC応答エレメントを通して表示されます。また、クローディン-5は血管内皮10における新規エストロゲン標的として同定された。
内皮機能障害の根底にさまざまな病気を。我々は、酸素/グルコース欠乏(OGD)条件下でCEND培養した。 OGDは、GCおよびプロテアソーム阻害剤ボルテゾミブ12との併用治療後に再構成することができるのBBB機能の破壊につながった。 OGD条件はグルコース取り込みの強い増加につながったとグルコースtransporの発現にMK801、NMDA受容体13の非競合的阻害剤を添加することにより減衰させることができるcerebENDでTERS、。
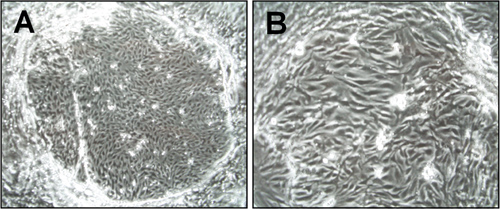
図1。脳微小血管内皮細胞の形態(CEND)分離後の1週間。光顕微鏡写真は6倍(A)と15倍(B)の倍率で撮影した。内皮細胞の島形成されたコロニーが表示されています。
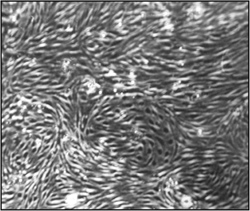
図2。一ヶ月隔離と不死化後の脳微小血管内皮細胞の形態(CEND)。光学顕微鏡写真は15倍の倍率で撮影した。コンフルエントに、均質な内皮細胞単層を観察することができる。
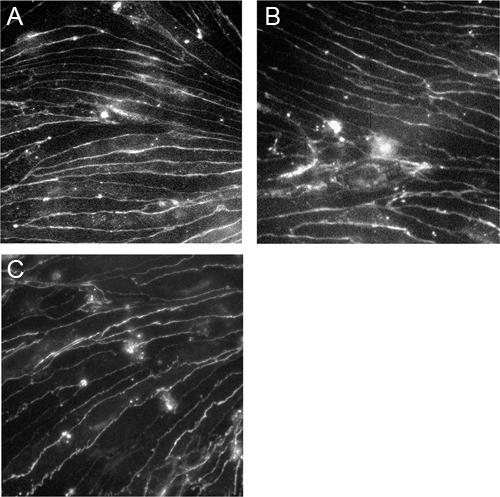
図3。不死化脳microvascularの内皮細胞はクローディン-5、オクルディンとVE-カドヘリン。CEND細胞がコラーゲンIVコーティングされたカバースリップ上で成長し、クローディン-5に対する抗体()、オクルディン(B)およびVE-カドヘリン(C)で染色した。画像は40倍の倍率でツァイスAxioscop2顕微鏡を用いて撮影した。
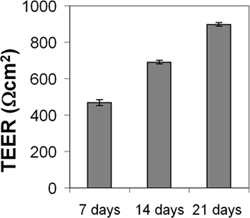
図4。 CEND単層。CENDの経内皮電気抵抗(TEER)の測定は、コラーゲンIVコーティングされたトランスウェルフィルター(孔径0.4μm)の上に成長した。コンフルエントに達した後、細胞を2%FCSを含む培地中で維持した。 TEERは、電流通過および電圧測定用電極を含むアセンブリを使用して、7日、14日及び21日後に測定した。
ディスカッション
説明する手順は、血管内皮機能の特定の変化を研究するために、異なるマウス系統からだけでなく、さまざまなノックアウトマウス系統からの微小血管ECの切り分けに使用することができます。 不死化の方法として、我々は、マウスポリオーマウイルス、ポリオーマミドルT抗原の癌タンパク質の形質転換を使用していました。これは、in vivoおよび in vitro 20,21,22 で急速に未熟な内皮細胞を変形させる。文献に記載されているECの不死化する他の方法は、例えばSV40ラージサル空胞化ウイルスのT抗原40 23、アデノウイルス遺伝子産物E1A 24またはヒトテロメラーゼ3の触媒サブユニットを過剰発現させると不死化を含む。 PymTと不死化は短時間で新生児マウスから均質のEC文化を得ることを可能にするマウス未熟ECS、特異的である。不死化は、細胞及び番目のプロパティを変更不死化細胞株を用いて得られた電子の結果は、一次細胞またはマウスを用いたin vivoでの実験とのどちらと比較する必要があります。 PymT不死ECはウロキナーゼ型プラスミノーゲン活性化因子の産生の増加に起因する線維素溶解活性を高レベルに発現することが記載とプラスミノーゲン活性化因子阻害剤25の産生を減少させてきた。プライマリとPymT bEND5不死細胞株の直接比較は 、in vitro BBBモデルの両方がよくT細胞接着の研究26に適していることを明らかにしたECS。
記載の手順に従って確立された細胞株は、細胞が老化中にこれらのプロパティを失うように、BBBとECの接合部タンパク質の高発現によりバリア性を維持するために低継代数で使用することができます。したがって、バリア性の損失の後、新たな細胞株の調製は、考慮されるべきである。これは細胞増殖に重要であるとして、細胞播種密度は、ECSの高いはずです。これは、単離手順と同様に不死ECのメンテナンスの際に考慮しなければならない。それぞれの新しい細胞株は、その障壁特性及び他の細胞型では不可能汚染物質に対するテストする必要があります。 ECの単層をオリゴデンドロサイト、アストロサイトおよび周皮4,27による汚染を除外するために一次抗体として抗ガラクトセレブロシド、抗グリア線維性酸性タンパク質と抗平滑筋抗原で染色することができます。 meningal血管系による汚染を排除するために、トロンボモジュリンの発現が脳の28を除いた全ての血管床で表現されて、テストすることができます。
興味深いことに、異なる脳領域から分離された不死化微小血管内皮細胞株は、プロ炎症性刺激に彼らのバリア性と感受性が異なります。例として、大脳や小脳CEND cerebEND細胞株を4,5挙げることができる。 CerebEND比較で示した、主要なタイトジャンクションコンポーネントclaudin-1のとオクルディンの低い発現レベルをCENDます。しかし、クローディン-3、-12のレベルはcerebENDで高かった。 cerebEND細胞のバリア機能は、炎症性メディエーターを用いた治療の下ではるかに苦しんだ、CEND細胞のバリア特性よりTNFαは5でした。炎症性刺激に高い小脳の脆弱性、多発性硬化症患者における脳脊髄炎と29の実験自 己免疫の動物モデルを用いたin vivo で観察することができます。これらの興味深い知見は、脳の中に将来の薬物ターゲティングを改善するために、異なる脳領域のためのin vitroモデル個体を生成し、特徴付けるの必要性を示す。
開示事項
特別な利害関係は宣言されません。
謝辞
この研究は、助成番号FO 315/4-1とDFGのSFB 688の下にドイツ学術振興DFGによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| ウシ血清アルブミン(BSA) | シグマアルドリッチ | A7906 | 純度> 98% |
| コラーゲンIV | シグマアルドリッチ | C5533 | 50mM酢酸で50μg/ mlの |
| コラゲナーゼ/ディスパーゼ | ロッシュ | 10269638001 | |
| ダルベッコ改変イーグル培地(DMEM) | シグマアルドリッチ | D5796 | |
| ジメチルスルホキシド(DMSO) | シグマアルドリッチ | D2650 | |
| ウシ胎児血清(FCS) | PAAラボラトリーズ | A15110-1333 | 最終濃度10%、熱不活化(56℃で30分間C) |
| L-グルタミン酸 | Biochrom AG | K0282 | 保管時:≤-15℃ |
| MEMビタミン | Biochrom AG | K0373 | 保管時:≤-15℃ |
| NA-ピルビン酸塩 | Biochrom AG | L0473 | |
| ネオマイシン(G418) | PAAラボラトリーズ | P11-012 | |
| 非必須アミノ酸(NEA) | Biochrom AG | K0293 | 4°Cでの保存 |
| ペニシリン/ストレプトマイシン | Biochrom AG | A2212 | 保管時:≤-15℃ |
| リン酸緩衝生理食塩水(PBS) | Biochrom AG | L1825 | |
| ポリブレン(ヘキサジメトリンブロマイド) | シグマアルドリッチ | 107689 | PBS中0.8 mg / mlと、-20℃で貯蔵 |
| ピューロマイシン | シグマアルドリッチ | P8833 | |
| トリプシン/ EDTA | Biochrom AG | L1825 | 0.05%、PBS中の0.02%EDTA |
参考文献
- Wilhelm, I., Fazakas, C., Krizbai, I. A. In vitro models of the blood-brain barrier. Acta Neurobiol. Exp (Wars). 71, 113 (2011).
- Forster, C. Differential effects of hydrocortisone and TNFalpha on tight junction proteins in an in vitro model of the human blood-brain barrier. J. Physiol. 586, 1937 (2008).
- Weksler, B. B. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. FASEB. J. 19, 1872 (2005).
- Forster, C. Occludin as direct target for glucocorticoid-induced improvement of blood-brain barrier properties in a murine in vitro system. J. Physiol. 565 (Pt 2), 475 (2005).
- Silwedel, C., Forster, C. Differential susceptibility of cerebral and cerebellar murine brain microvascular endothelial cells to loss of barrier properties in response to inflammatory stimuli. J. Neuroimmunol. 179, 37 (2006).
- Forster, C. Glucocorticoid effects on mouse microvascular endothelial barrier permeability are brain specific. J. Physiol. 573 (Pt 2), 413 (2006).
- Burek, M., Forster, C. Y. Cloning and characterization of the murine claudin-5 promoter. Mol. Cell Endocrinol. 298, 19 (2009).
- Forster, C., Kahles, T., Kietz, S., Drenckhahn, D. Dexamethasone induces the expression of metalloproteinase inhibitor TIMP-1 in the murine cerebral vascular endothelial cell line cEND. J. Physiol. 580 (Pt.3), 937 (2007).
- Blecharz, K. G., Drenckhahn, D., Forster, C. Y. Glucocorticoids increase VE-cadherin expression and cause cytoskeletal rearrangements in murine brain endothelial cEND cells. J. Cereb. Blood Flow Metab. 28, 1139 (2008).
- Burek, M., Arias-Loza, P. A., Roewer, N., Forster, C. Y. Claudin-5 as a novel estrogen target in vascular endothelium. Arterioscler. Thromb Vasc. Biol. 30, 298 (2010).
- Blecharz, K. G. Glucocorticoid effects on endothelial barrier function in the murine brain endothelial cell line cEND incubated with sera from patients with multiple sclerosis. Mult. Scler. 16, 293 (2010).
- Kleinschnitz, C. Glucocorticoid insensitivity at the hypoxic blood-brain barrier can be reversed by inhibition of the proteasome. Stroke. 42, 1081 (2011).
- Neuhaus, W. Addition of NMDA-receptor antagonist MK801 during oxygen/glucose deprivation moderately attenuates the upregulation of glucose uptake after subsequent reoxygenation in brain endothelial cells. Neurosci. Lett. 506, 44 (2012).
- Perriere, N. Puromycin-based purification of rat brain capillary endothelial cell cultures. Effect on the expression of blood-brain barrier-specific properties. J. Neurochem. 93, 279 (2005).
- Golenhofen, N., Ness, W., Wawrousek, E. F., Drenckhahn, D. Expression and induction of the stress protein alpha-B-crystallin in vascular endothelial cells. Histochem Cell Biol. 117, 203 (2002).
- Risau, W., Engelhardt, B., Wekerle, H. Immune function of the blood-brain barrier: incomplete presentation of protein (auto-)antigens by rat brain microvascular endothelium in vitro. J. Cell Biol. 110, 1757 (1990).
- Abbott, N. J. Dynamics of CNS barriers: evolution, differentiation, and modulation. Cell Mol. Neurobiol. 25, 5 (2005).
- Toth, A. Patented in vitro blood-brain barrier models in CNS drug discovery. Recent Pat. CNS Drug Discov. 6, 107 (2011).
- Harke, N. Glucocorticoids regulate the human occludin gene through a single imperfect palindromic glucocorticoid response element. Mol. Cell Endocrinol. 295, 39 (2008).
- Kiefer, F., Courtneidge, S. A., Wagner, E. F. Oncogenic properties of the middle T antigens of polyomaviruses. Adv. Cancer Res. 64, 125 (1994).
- Kiefer, F. Endothelial cell transformation by polyomavirus middle T antigen in mice lacking Src-related kinases. Curr. Biol. 4, 100 (1994).
- Ong, S. H. ShcA and Grb2 mediate polyoma middle T antigen-induced endothelial transformation and Gab1 tyrosine phosphorylation. EMBO J. 20, 6327 (2001).
- O'Connell, K. A., Edidin, M. A mouse lymphoid endothelial cell line immortalized by simian virus 40 binds lymphocytes and retains functional characteristics of normal endothelial cells. J. Immunol. 144, 521 (1990).
- Roux, F. Regulation of gamma-glutamyl transpeptidase and alkaline phosphatase activities in immortalized rat brain microvessel endothelial cells. J. Cell Physiol. 159, 101 (1994).
- Montesano, R. Increased proteolytic activity is responsible for the aberrant morphogenetic behavior of endothelial cells expressing the middle T oncogene. Cell. 62, 435 (1990).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. J. Cereb. Blood Flow Metab. 31, 315 (2010).
- Skaper, S. D., Conn, M. . Methods in Neurosciences. 2, 1303 (1990).
- Ishii, H. Thrombomodulin, an endothelial anticoagulant protein, is absent from the human brain. Blood. 67, 362 (1986).
- Minagar, A., Alexander, J. S. Blood-brain barrier disruption in multiple sclerosis. Mult. Scler. 9, 540 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved