Method Article
癌バイオマーカーの局在の小型動物のCTガイド下時間領域拡散蛍光トモグラフィー
要約
びまん性蛍光トモグラフィは、前臨床、高を通じて比較的低コストの可能性のあるアプローチを提供しています腫瘍イメージング。光データ収集、校正、画像再構成の方法論は、マウスグリオーマモデルにおける腫瘍マーカー上皮成長因子受容体を標的と蛍光灯を使用したCTガイド下非接触タイム·ドメイン·システムのために提示されています。
要約
小動物の蛍光分子イメージング(FMI)は、前臨床創薬と開発研究1の強力なツールとなることができます。しかし、組織発色団(例えば、ヘモグロビン、水、脂質、メラニン)による光吸収は、通常、数ミリの2以上の厚さを介して光信号の伝播を制限します。他の可視波長に比べて、赤と近赤外(近赤外)光の吸収のための組織の吸収が劇的に減少し、非弾性散乱が支配的な光の組織の相互作用のメカニズムになります。近赤外領域(600から1000 nm)の光を吸収し、放出する蛍光剤の比較的最近の開発、小動物3の全身の三次元イメージングを達成することができる画像処理システム及び光伝搬モデルの開発を推進してきました。
この分野での長足の進歩にもかかわらず、びまん性蛍光トモグラフィの悪いポーズ性質は重要なままで安定性、コントラストの回復と画像再構成技術と小動物のFMIに最適なアプローチの空間分解能の問題はで合意されていない。私たちのグループといくつかの他の10から13は、非常に高感度検出器に基づくシステムを追求している一方の研究グループの大半は、電荷結合素子(CCD)ベースの豊富な組織サンプリングが次善の感度4-9を提供するシステムに投資している、この時点では緻密な組織のサンプリングが低イメージングのスループットのコストでのみ達成されるようにすること。ここでは、マウスモデルで癌脳病変をローカライズするために蛍光トモグラフィシステムでは単一光子検出技術を適用するための方法論を示しています。
蛍光断層撮影法(FT)システムは、光電子増倍管(PMT)と非接触型コンフォメーション11の情報が豊富なタイム·ドメインの光検出を使用してカウント単一光子を用いた。これは同時colを提供しています送信された励起および発光光のlection、小さな動物のコンピューター断層撮影(microCT)システム15に自動蛍光励起露出制御14、レーザーの参照、および共同登録をされています。ヌードマウスモデルは、イメージングのために使用されていました。動物は、左大脳半球におけるヒト神経膠腫細胞株(U251)と同所を接種し、2週間後に撮影されました。腫瘍は蛍光トレーサーを注入することにより蛍光を発するように作られた、IRDye 800CW-EGF(LI-COR Biosciences社、リンカーン、ネブラスカ州)は、上皮成長因子受容体、U251腫瘍のラインや他の多くの癌で過剰発現することが知られている細胞膜タンパク質をターゲットに18。第二に、関連性の低い蛍光トレーサー、のAlexa Fluor®647(ライフテクノロジーズ、ニューヨーク州グランドアイランド)もトレーサーの結合および受容体の可用性/密度を定量化する手段を提供する対象とトレーサーの取り込みに対する非受容体介在性の影響を考慮するために注入した27。 CTガイド下は、tIMEドメインのアルゴリズムは、マウス脳内の両方の蛍光トレーサーの位置( すなわち 、腫瘍の位置)と、腫瘍は造影磁気共鳴イメージングによって検証されたローカライズする能力を再構築するために使用されていました。
神経膠腫マウスモデルにおける蛍光イメージングのための実証が、このビデオで紹介する方法は、ラット17のサイズに潜在的にまで、様々な小さな動物モデルで種々の腫瘍モデルに拡張することができます。
プロトコル
1。動物の準備
- ケタミン - キシラジンの腹腔内注射(10 mg / kgのIPは100 mg / kg)をヌードマウス(チャールズリバー、ウィルミントン、MA)を麻酔。
- 定位フレームに配置し、マウス頭蓋骨の左側に頭皮に切開を加えて、18ゲージ針を用いて、中心線から頭蓋骨2ミリメートルに1ミリメートル径の穴と後ろに2ミリメートルを作成するブレグマ。
- の表面の下に約2mmの深さで左大脳半球にリン酸緩衝液の5μlの5×10 5 U251ヒト神経膠芽腫細胞(親切にダートマス大学、ハノーバー、ニューハンプシャー州で博士マークイスラエルによって提供される)を注入脳。ハミルトンマイクロシリンジ18と鈍い使用するには、細胞移植のために27ゲージ針を終了し、頭蓋骨の外側の表面から針3ミリメートルの先端を挿入し、セルのポケットを作成するには、1ミリメートルを取り消すことができます。
- 縫合切開部位とができ、再手術からcovery。
- 腫瘍イメージングの前に成長できるようにするために〜14日を待つ。
2。蛍光トモグラフィシステムのキャリブレーション
- マウスイメージングの日に、システムを開始し、システム感度のドリフトを避けるために、レーザーと光検出器は約20分間ウォームアップすることができます。
- 配置100°×4°の撮像ガントリーの直接中心に設計されたラインディフューザー(Thorlabs、ニュートン、ニュージャージー州)は、励起レーザーのノーマル:ピコ秒パルス80 MHzのマルチモード635nmのレーザダイオード(PicoQuantフォトニクスノースアメリカ社は、ウェストフィールド、MA)。すべての5つの集光チャネルで検出された信号の量を最大化するために、ディフューザーの角度を調整します。イメージングの幾何学の完全な説明は他の11,14,15提供されています。
- 配置ODすべての蛍光検出光電子増倍管(PMT)と外径1 NDフィルターの目の前の2中性密度フィルター(Thorlabs、ニュートン、ニュージャージー州)(木すべての透過率の検出光電子増倍管の前面にorlabs、ニュートン、NJ)。レーザーの100時間、パルスの拡散プロファイル(TPSF)、1秒の積分時間でそれぞれ収集します。
- レーザーレーザー参照の時間的なドリフトの正しい基準、および各検出器のすべての反復の平均値によって各TPSFを正規化します。これらの平均TPSFsは、光学画像再構成に使用される検出器固有の測定器の応答関数(IRF)です。
3。イメージングプロトコル
- 酸素のイソフルラン2%(1 L /分)で、マウスを麻酔。
- 腫瘍内に上皮成長因子受容体の過剰発現を標的とする前の画像へのリン酸緩衝液、腹腔内、12時間100μlのIRDye 800CW-EGFの1ナノモルおよびAlexa Fluor 647の1ナノモルを注入します。
- その鼻はイソフルラン麻酔を提供するコーンに残るようにマウスを配置し、イメージングベッドからサポートしているグラスファイバーの上にマウスを置きます。
- ENベッドは、蛍光トモグラフィシステムに保護されているときにマウスが撮像ガントリーのおおよその中心にあること、 すなわち :マウスがベッドの上で適切に配置されていることを確認してください。この位置決めは、レーザーの焦点は、すべての角度でレーザーの観点から、マウスの中央に約点を照らすことを確認し、マウスについては、励起レーザーを180°回転させることによって導くことができる。
- 一度配置し、microCT(上の遺伝子座、GEヘルスケア、ロンドンを探索)スキャナにイメージングベッドとマウスを慎重に転送し、マウスの頭部全体の93μmの方の解像度での解剖学的情報を収集します。
- CT画像スタックを可視化し、蛍光トモグラフィシステムで撮像するスライス(複数可)を選択します。
- 慎重に蛍光トモグラフィシステムへのイメージングベッドとマウスを転送します。各イメージングSLIC用のマウスに関するデータを収集するために、ソース位置の数を選択します。E(32)、各TPSF測定(1秒)、それぞれのソースの位置(10)の反復回数、ステップ3.6からCT画像スタックから希望する画像のスライスの位置と数の積分時間。括弧内の数字は、画像スライスごとにデータ収集の〜5分が得られるそれぞれの撮像パラメータの典型的な値です。
- 飽和を回避するために、蛍光検出器に到達するからレーザー光を制限するために蛍光検出光電子増倍管の前にトリプルノッチフィルタ(クロマルネサステクノロジ、フォールズ、バーモント州ベローズ)と、透過率の検出光電子増倍管の前にOD 2中立の密度フィルタを配置それらの検出器。
- (635 nmと755 nmのは、それぞれのAlexa Fluor 647とIRDye 800CW-EGFトレーサーを励起するために)定義された各ソース検出器の位置で、それぞれの励起波長の蛍光と透過TPSFsを収集し、データ集録ソフトウェアを実行します。収集TPSFsのすべてのセットの場合、レーザー強度を監視し、記録参照PMTチャンネルを持つ。
4。画像再構成
- マウスの外周面とCT画像からの画像ベッドの支持棒の位置を決定するとは別に、マウスの範囲とイメージング棒を覆うマスクを作成します。
- NIRFASTソフトウェア19を用いた動物の有限要素メッシュを生成するために、マウスのマスクを使用しています。
- microCTと蛍光空間の登録座標20に基づいて、メッシュの表面に蛍光トモグラフィシステムからの線源と検出器の位置をローカライズします。
- イメージングベッド支持ロッドの位置との対話、ソースまたは検出器の位置に関連付けられている光学データポイントを削除します。
- 実験的なテストによって決定されたレーザー基準の時間ドリフトの正しい、フィルタ感度の正しいレーザー参照することにより、各ソースの検出器位置で収集したデータを、正規化購入の15時。
- 各ソース検出器の位置のデータの生まれ比率(蛍光は透過率で割った値)を取り、均一な光学特性の有限要素動物メッシュに基づいて透過率のフォワードモデルのシミュレーションを掛ける。これは、モデル22にデータを較正するために、モデルデータの不一致23,24の他の側面のデータを調整するために、ソースまたは検出器の組織の結合を21に関連するエラーを軽減するために行われます。
- 両方の波長で収集された生まれた比率データのスケールの違いから成るデータベクトルを構築します。スケーリング係数は、EGFR結合コントラストを最大にするために選択されています。入力として、それぞれの検出チャネルのためTPSFを用いてキャリブレーションの差分データとタイム·ドメインの画像再構成を行い、造影標的トレーサ15の蛍光マップを作成します。
5。代表的な結果
"> U251同所グリオーマ腫瘍は図1bに示されているとマウスの頭部からのCOに登録されたCTの解剖学的画像を重ねて蛍光再建の例を示しています。蛍光再建( 図1bによって決定される神経膠腫の重心)によって決定された大量の腫瘍センターの1ミリメートル以内であった磁気共鳴イメージング( 図1a)、コントラスト向上します。CTやMRI画像が相互の情報変換に基づく共存登録されました。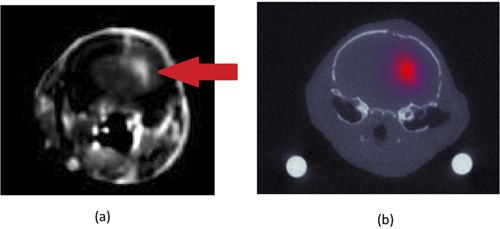
図1造影(ガドリニウム)マウス頭部の磁気共鳴画像()。マウスは、U251ヒトグリオーマ細胞株を同所性に接種した。正常脳より造影剤を吸収し、腫瘍の位置は、左大脳半球(右の画像で)見られ、白い矢印で示されていることができます。 correspondinグラムCT画像は、(マウスの頭部上の同じ場所から)(b)は上皮成長因子は、蛍光を引いた関連性の低い蛍光再建オーバーレイをターゲットとに描かれています。蛍光の単位は逆mmであり、その量子効率によって、その濃度を乗じてバインドされたターゲットの蛍光の吸収係数に関連しています。
ディスカッション
蛍光断層撮影法(FT)は、生体組織を介して可視および近赤外光トランスポートに基づいて敏感な、電離放射線の分子イメージングモダリティである。 FTへの関心のほとんどは、小さな動物実験モデルで創薬と開発を促進するために、その可能性に重点が置かれてきた1と研究の一つのキーエリアには、癌バイオマーカーの発現と分子療法26への応答の研究されています。現時点では、FTシステムの設計には、2つの競合する方法があります。最も一般的なデザインは、蛍光検出4-9冷却電荷結合素子(CCD)カメラに基づいています。この設計では、CCDカメラの各ピクセルは、組織を通じて一意のパスを旅してきた光を検出することができるので、組織のサンプリングを最大限に、測定の高密度を提供しています。しかし、CCDカメラは、限られたダイナミックレンジを持っており、読み出しノイズは、その究極の感度を制限します。第二の設計は、潜在的なlimitaを回避光電子増倍管やアバランシェ·フォトダイオード10から13のような検出器の使用に基づいて高感度単一光子計数技術を用いることによりCCDカメラの検出tions。これらのより高感度な検出方法の欠点は、各検出器は、単一ポイントで光を集めることができるということですので、緻密な組織のサンプリングを達成するために、多くの検出器のいずれかが(非常に高価である)が使用されなければならない、または多くの突起が撮像されなければならない(時間がかかる場合がありますが)同じ検出器である。小さな動物のFTの組織サンプリングの最適なレベルが合意されておらず、ケースバイケースで異なる場合がありますが、それは単一光子計数計測がより良い条件でFTの感度の限界を探るのに適していることで合意されている分子マーカーの低濃度を検出する能力。本研究では、マウスで腫瘍をローカライズするには、シングルフォトンカウンティング検出·インストルメントを使用してFTを実施するための方法論を提供しています。
ENT ">時間相関シングルフォトンカウンティングFTと堅牢なデータセットを生成するために関係する4つの重要なステップがあります。最初に適切かつ簡単なキャリブレーション手順のアプリケーションです。で紹介する方法では、各検出チャンネルのそれぞれの感度が計上されている各検出器15への光の等しい分数を指示するために設計されたラインディフューザーを透過した励起光のベースライン測定値を収集します。また、実験中に検出された光が連続的に両方の強度の面では、レーザー基準に校正され、意味されてい。レーザー基準チャネル11,15の操作により、時間の経過とともに変動する可能性があります時間は、2番目に重要なステップは、ガイド付きの蛍光再建のために解剖学的イメージングの正確な収集と共同登録であるFTデータは単独では解剖学的情報を提供していません。したがって、光輸送のモデルを作成するためにLOを再構築するために使用することができる試料の表面で検出された蛍光から試験片内の蛍光源のカチオンは、FTシステムとの関係で標本の解剖を正確に知る必要があります。私たちのシステムでは、解剖学的情報が空間的にFTシステム15,20のもので登録されている空間的な座標を持つマイクロコンピュータ断層撮影システムによって取得されます。第三の重要なステップは、最適な露出( すなわち 、それぞれのレーザー投影の総光子検出時間)はすべてのソース検出器位置で採用されることを確実に含まれます。検出ユニットを損傷する恐れがあり、検出器の飽和を避けるために、各検出位置での信号対雑音十分な第二があることを確認するには、最初:これは、2つの理由から重要です。各検出器の位置で最適な露出を得るためには、自動露出制御が採用され、基本的に2つ、低信号のエクスポージャー14から最適な露出をtriangulatesている。第四の重要な方法論のステップは、送信された励起光の量に収集した蛍光データを参照しています。この参照は頻繁に生まれ比と呼ばれ、モデルデータの不一致エラー23,24の緩和されて主なもので、FTのために多くの利点を提供します。提示システムは、チャネリングによって同時に2つの独立した光電子増倍管に各検出チャンネルの光を蛍光と透過の両方の励起光を検出するために設計されています。これにより、我々は生まれ比率の精度に動きのどのような影響を避けることができます。堅牢なデータセットは、手で、タイム·ドメイン·データの画像再構成では、発現を有する有限要素メッシュの逆問題を解く含まれます。
D = Jxが
ここで、d はnソース検出器の突起と m TPSF時間ゲートの n X m個の要素を持つベクトルであり、JはN×m行です。リットル感度メッシュの lノードの行列(またはヤコビ行列)、およびxはLサイズを有し、各ノードの蛍光光学特性のベクトルであるdは実験とJの間に収集されたキャリブレーションデータは、有限要素ソリューションを使用してシミュレートです。蛍光輸送25のタイム·ドメインの拡散近似に。 Jの時間次元は、検出器固有の測定器の応答関数で畳み込まれています。xは、関心の蛍光マップの表現であるとチホノフ正則15に伴うLevenberg-Marqardt非負最小二乗アプローチを使用するために解決されます。
方法論は、蛍光検出を数える高感度光子を用いたマウスに蛍光標識した腫瘍をローカライズすることができる手順を説明している、ここで紹介するFTの限界をプッシュする可能性を秘めています。以前の研究では、これを採用するの電位このようなラットと同様に、マウスの大きさの標本の既存のシステム設計上の改良された感度とより大きいよりもマウスの動物モデルにおけるアプローチは、17日明らかになった。このアプローチの即時アプリケーションでは、ハイスループットな手段で薬効を評価するための小さな動物腫瘍モデルにおけるin vivoでのバイオマーカー発現のモニタリングのためになる。複数の波長で励起すると蛍光を検出するシステムの能力は、複数の蛍光マーカーの同時検出を可能にします。追加の蛍光マーカーは、このようなin vivoで結合能の測定のデュアルレポーター方法、受容体密度のマーカーとして、より定量的なイメージング手法を採用すると同時に、病理学の複数の側面を尋問するか、この研究のように、使用することができる手段を提供する26,27。
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、国立がん研究所の助成金R01 CA120368、R01 CA109558(KMT、RWH、FEG、BWP)、RO1 CA132750(MJ、BWP)及びK25 CA138578(FL)によって資金を供給、衛生研究所ポスドクフェローシップ賞のカナダ研究所(KMTされています。)蛍光トモグラフィシステムの開発が部分的に高度な研究技術(モントリオール、QC)によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(オプション) |
| IRDye 800CW-EGF | LI-COR Biosciences社 | 926から08446 | |
| のAlexa Fluor 647、スクシンイミジルエステル | ライフテクノロジーズ | A20106 | 非特異的結合を最小限に抑えるために水と反応 |
参考文献
- Rudin, M., Weissleder, R. Molecular imaging in drug discovery and development. Nat. Rev. Drug Discov. 2, 123-131 (2003).
- Arridge, S. Optical tomography in medical imaging. Inverse Problems. 15, R41-R93 (1999).
- Leblond, F., Davis, S. C., Valdes, P. A., Pogue, B. W. Pre-clinical whole-body fluorescence imaging: Review of instruments, methods and applications. J. Photochem. Photobiol. B. 98, 77-94 (2010).
- Cao, J., Moosman, A., Johnson, V. E. A Bayesian chi-squared goodness-of-fit test for censored data models. Biometrics. 66, 426-434 (2010).
- Da Silva, A. Optical calibration protocol for an x-ray and optical multimodality tomography system dedicated to small-animal examination. Appl. Optics. 48, 151-162 (2009).
- Deliolanis, N. Free-space fluorescence molecular tomography utilizing 360 degrees geometry projections. Opt. Lett. 32, 382-384 (2007).
- Guo, X. A combined fluorescence and microcomputed tomography system for small animal imaging. IEEE Trans. Biomed. Eng. 57, 2876-2883 (2010).
- Lin, Y. Quantitative fluorescence tomography using a combined tri-modality FT/DOT/XCT system. Opt. Express. 18, 7835-7850 (2010).
- Zhang, X. High-resolution reconstruction of fluorescent inclusion in mouse thorax using anatomically guided sampling and parallel Monte Carlo computing. Biomedical Optics Express. 2, 2449-2460 (2011).
- Dominguez, J. B., Berube-Lauziere, Y. Diffuse light propagation in biological media by a time-domain parabolic simplified spherical harmonics approximation with ray-divergence effects. Appl. Optics. 49, 1414-1429 (2010).
- Kepshire, D. A microcomputed tomography guided fluorescence tomography system for small animal molecular imaging. Rev. Sci. Instrum. 80, 043701 (2009).
- Lin, Y. A photo-multiplier tube-based hybrid MRI and frequency domain fluorescence tomography system for small animal imaging. Phys. Med. Biol. 56, 4731-4747 (2011).
- Niedre, M. J. Early photon tomography allows fluorescence detection of lung carcinomas and disease progression in mice in vivo. Proc. Natl. Acad. Sci. U.S.A. 105, 19126-19131 (2008).
- Kepshire, D. L., Dehghani, H., Leblond, F., Pogue, B. W. Automatic exposure control and estimation of effective system noise in diffuse fluorescence tomography. Opt. Express. 17, 23272-23283 (2009).
- Tichauer, K. M. Imaging workflow and calibration for CT-guided time-domain fluorescence tomography. Biomedical Optics Express. 2, 3021-3036 (2011).
- Kennedy, J. C., Pottier, R. H. Endogenous protoporphyrin IX, a clinically useful photosensitizer for photodynamic therapy. Journal of photochemistry and photobiology. 14, 275-292 (1992).
- Leblond, F., Tichauer, K. M., Holt, R., El-Ghussein, F., Pogue, B. W. Towards whole-body optical imaging of rats using single-photon counting fluorescence tomography. Opt. Lett. 36, 3723-3725 (2011).
- Gibbs-Strauss, S. L. . Noninvasive fluorescence monitoring for functional assessment of murine glioma treatment [dissertation]. , (2008).
- Dehghani, H. Near infrared optical tomography using NIRFAST: Algorithm for numerical model and image reconstruction. Commun. Numer. Meth. En. 25, 711-732 (2009).
- Holt, R., El-Ghussein, F., Tichauer, K. M., Leblond, F., Pogue, B. W. . Proceedings of SPIE. , 789213 (2011).
- Ntziachristos, V., Weissleder, R. Experimental three-dimensional fluorescence reconstruction of diffuse media by use of a normalized Born approximation. Opt. Lett. 26, 893-895 (2001).
- Davis, S. C. Magnetic resonance-coupled fluorescence tomography scanner for molecular imaging of tissue. The Review of scientific instruments. 79, 064302 (2008).
- Leblond, F., Tichauer, K. M., Pogue, B. W. Singular value decomposition metrics show limitations of detector design in diffuse fluorescence tomography. Biomedical Optics Express. 1, 1514-1531 (2010).
- Soubret, A., Ripoll, J., Ntziachristos, V. Accuracy of fluorescent tomography in the presence of heterogeneities: Study of the normalized born ratio. Ieee T. Med. Imaging. 24, 1377-1386 (2005).
- Zhu, Q. A three-dimensional finite element model and image reconstruction algorithm for time-domain fluorescence imaging in highly scattering media. Phys. Med. Biol. 56, 7419-7434 (2011).
- Weissleder, R., Pittet, M. J. Imaging in the era of molecular oncology. Nature. 452, 580-589 (2008).
- Tichauer, K. M. In vivo quantification of tumor receptor binding potential with dual-reporter molecular imaging. Mol. Imag. Biol. , (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved