Method Article
感染マウスノロウイルスのリバースジェネティクスを介したリカバリ
要約
ノロウイルスは胃腸炎の主要原因である、まだそれらの特性評価のための分子技術はまだ比較的新しいです。ここでは、マウスノロウイルス(MNV)、細胞培養で増殖させることができるこの属の唯一のメンバーを効率的に回収するための2つの異なる逆遺伝学のアプローチを報告します。
要約
人間のノロウイルスはヒトの胃腸炎(GE)は、世界中のほとんどの責任があると近い人から人への接触が1、2を回避することはできません環境での再発問題である。ここ数年の間に病院内で感染の発生率の増加は、その運用能力だけでなく、大規模な経済的損失に大きな混乱を引き起こして、報告されている。新たな抗ウイルスアプローチの識別は、細胞培養3で生産的な感染症を完了するには、人間のノロウイルスの無力のために限られていました。密接に人間のノロウイルス4に関連したマウスノロウイルス(MNV)、最近の分離がどのセル5に伝播することができますが、これらの病原体6,7の調査のための新しい道を開いた。
新しい正のセンスゲノムおよびサブゲノムRNA分子の合成MNVの複製の結果は、後者の最後のTHIに対応ウイルスゲノムのRD( 図1)。 MNVは、ORF1は、ゲノムの大部分を占有し、ポリプロテイン前駆体から放出される7つの非構造タンパク質(NS1-7)をコードする4つの異なるオープンリーディングフレーム(ORF)が含まれています。 ORF2とORF3はサブゲノムRNA領域内に含まれており、キャプシドタンパク質(それぞれVP1およびVP2)( 図1)エンコードされています。最近、我々はORF2が重複し、追加ORF4を同定したが、別のリーディングフレームで機能的であり、ミトコンドリアのローカライズされた病原性因子(VF1)8にエンコードしています。
ノロウイルスを含む正センスRNAウイルス、の複製は、新しい上限なしRNAゲノムの合成で得られる細胞質内で行われます。ウイルスの翻訳を促進するために、ウイルスが細胞のタンパク質合成機械9-11募集を目的としたさまざまな戦略を利用する。興味深いことに、ノロウイルスの変換は多機能ウイルスのタンパク質プライマーVPGによって駆動され共有ゲノムおよびサブゲノムRNAを12から14の両方の5 '末端にリンクされています。翻訳のこの洗練されたメカニズムは、従来の逆遺伝学的アプローチによるウイルス回収の限られた効率の主要な要因となる可能性があります。
ここでは、5 '末端にキャップされたマウスノロウイルス-1(同封MNVと呼ばれる)の転写産物の生成に基づいて2つの異なる戦略を報告します。 2番目のアプローチは、T7 RNAポリメラーゼを発現する細胞のcDNA MNVの転写を伴うのに対し、いずれかの方法では、in vitroでの合成およびウイルスRNAのキャップの両方が含まれます。 MNVと小動物モデルの研究のためのこれらの逆遺伝学·システムの可用性は、レプリケーションと病因15から17にウイルス配列の役割を分析するための前例のない能力を提供しています。
プロトコル
1。 RNA転写と感染MNVの回復のためのキャッピング
このプロトコルは、in vitro転写と(セクション1.1)キャッピングin vitroでのそれに続くのを経由してcDNAから感染性のMNVの効率的な回収を可能にするために設計されています。得られたキャップの転写は、その後感染MNV(セクション1.2および1.3)を回復する細胞にトランスフェクトされています。このアプローチでは、35ミリメートル当たり10 5感染単位(直径)皿MNVのための細胞の過剰の典型的な収率でMNVの回復のための最も感度の高い方法を提供します。プロトコルは以下に詳述されています。
感染キャップMNVの転写産物の1.1合成:
- NHEと私は直鎖状DNAを取得するためにNHEを私がMNVゲノムの3 '末端にポリAテール( 図2)の後にユニークな制限部位を認識します。野生型のcDNA MNV(MNV 3'RzをpT7)を含むプラスミドを消化。線状化プラスミドは一般的に精製されているシリカカラム(GEヘルスケアから、例えばGFX PCR DNAゲルのバンドの精製キット )を使用し、H 2 Oで溶出した
- 試験管内で前述の17としてT7 RNAポリメラーゼを用いて線状化ベクターを書き写す。多くの市販のキットは、この目的のために利用可能であり、そのようなMEGAScript(Life Technologies)をとRiboMAX(Promega社)などのRNA合成、大量の再現可能な方法を提供します。転写反応は、通常、DNアーゼは、さらなる分析の前に消化されています。効率的にDNAを沈殿させていない下記のようにしかし、多くのインスタンスで、これは塩化リチウム精製として必要とされていません。
- 転写反応を効率的に働いており、RNAがフルレングスであることを確認するためにアガロースゲル電気泳動によりRNA転写反応の小アリコート、典型的には0.5μl以下を、分析します。多くのユーザーが正しくサイズRNAに変性ゲルを実行することができながら、我々は通常、非変性アガロースゲルに電気泳動を使用しRNAの整合性を分析するための迅速な方法としてESIS。などの感染性cDNAクローンをpT7から生成MNVゲノム:MNV 3'Rzは、非変性アガロースゲル( 図3)上の二本鎖DNAラダーへの相対約3 kbpのに実行されます。
- 他の方法は、Agilentのbioanalyser( 図3)を使用してなどのRNAの完全性の高速分析を得るための代替として利用可能であることを考慮してください。
- あまりにも多くのRNAがロードされている場合貧しいゲルの解像度が発生する可能性があることに注意してください。アガロースゲルは、バンドの分解能に影響を与える可能性があり、電気泳動中にRNAの分解を避けるために、RNaseフリーの試薬を用いて調製されていることを確認するために細心の注意を払って。 °C、氷上で冷却し、続いて65〜RNAを加熱しても、いくつかのインスタンスに役立つ可能性があります。
- 取り込まれなかったヌクレオチドを除去するためにRNAサンプルを精製する。多くのメソッドは、このプロトコルで我々は一般的に費用対効果の高い代替物として塩化リチウムを使用するただし、これを含むシリカカラム基づくアプローチのために用意されています。のためにこの目的は、100μlの最終容量に到達するためにH 2 Oを追加した後、 塩化リチウム沈殿溶液 (7.5 M LiClを、50mMのEDTA、pH8.0で、Ambion社)40μlを追加し、少なくとも-20℃でサンプルを保存する少なくとも30分。
- 4で12,000 x gで遠心分離によってペレットRNA℃で15分間。
- 半透明のRNAペレットを乱さ、70%エタノール150μlでそれを洗浄しないように注意しながら、上清を取り除きます。 15分間、4℃で12,000 x gでチューブを遠心します。
- エタノールを除去し、空気乾燥RNA、この再懸濁が困難になりますようにペレットが完全に乾燥させて避けることができます。
- その後、RNAストレージソリューション (Ambion社)の50〜100μLにMNV転写物を再懸濁します。ケアは、全てのRNAが正常に溶解しているように注意する必要があります。 RNAは完全に溶解することが困難に表示されます、60サンプルを加熱して°Cは、それを再懸濁するのに役立つ可能性があります。任意の不溶性物質は、その後Bを削除する必要があります定量化をRNAに前のy遠心分離。精製された転写産物は上限なしと感染するステップ(ScriptCapのm7G上限システム、EPICENTREバイオテクノロジー)をキャッピングin vitroでの後続を必要とします。
- 分光光度法によりRNAを定量化する。転写反応の性質や規模に応じて、典型的な収量は、100μlの転写反応当たりのRNAの50から150μgの範囲である。 RNAの整合性は1%アガロースゲル( 図3)にサンプルの100から300 ngのを実行することにより、キャッピング反応する前に分析する必要があります。
- キャッピングRNAの効率を改善するために、その熱60から70 65 MNV RNA転写物のμg℃で10分間とは氷の上ですぐにチューブを配置します。このステップでは、キャッピングのRNA構造の任意の阻害効果を減らすことができます。加熱工程の間に形成された液滴を収集するために冷却したマイクロチューブをパルス。
- メーカー(ScriptCap m7Gによって提案されるようにキャッピング反応液を調製キャッピングシステム、EPICENTREバイオテクノロジー)。簡潔に、100μlの最終反応ボリュームにMNV RNAの60〜70μgを追加します。キャッピング反応混合物は、緩衝液(500mMのトリスpH8.0で、60mMのKClを、12.5のMgCl 2)を上限10×、10 mMのGTP、Scriptguardの20mMのS-アデノシルメチオニン、2.5μlの0.5μlの10μlの10μlを含めることができます(100単位)、およびScriptcap酵素を4μl(40単位)。
- 設定し、反応中に、劣化を防ぐため、氷の上でRNA転写物を保持します。よく、反応混合物を混合し、その後1時間37℃で反応させる。反応の大きさが必要なキャップ転写産物の量に応じてスケーリングされる場合があります。
- 前述したようにLiClを沈殿によりRNAを精製し(ポイント1.1.6を参照)。 RNAストレージソリューション(Ambion社)の50〜100μlにペレットを溶解し、RNAの量を定量化する。一般的に、RNAサンプルは、その後の1μg/μlに正規化されます。再び、全てのRNAが正常に溶解したことを確認します。それが適切に溶解されていない場合は、熱トン彼サンプル60°Cまで解散を許可する。遠心分離して定量化をRNAに前に不溶性物質を除去します。
- トランスフェクションの手順に進む前に、再びRNAの整合性をチェックします。この目的のために、1%アガロースゲル( 図3)にサンプルの100から300 ngの量を実行します。
RAW264.7細胞へのRNAのネオン媒介トランスフェクション1.2重量リカバリ:
許容細胞ラインのMNV感染性ウイルス粒子を回収するための、それはネオントランスフェクションシステム (Invitrogen)を用いてRAW264.7細胞に覆われたMNV転写産物をエレクトロポすることが可能です。 RAW264.7は、ウイルスの複製とその後の再感染の複数のラウンドをサポートし、MNV感染に感受性細胞である。その結果、典型的な収量は48時間後に> 10 7感染単位で24時間トランスフェクション後がピーク時にはmlあたり10 5感染単位の過剰に近づきます。
- トランジスタ前日sfection、コンフルエントの推定50%の種子RAW264.7細胞。一般的に細胞の2 T75フラスコは3トランスフェクションに必要とされる。
- トランスフェクションの日は、あなたが繰り返しピペッティングによって単一細胞懸濁液を生成確保、10%ウシ胎児血清(FCS)を含むダルベッコ改変イーグル培地(DMEM)に細胞単層をこすり。
- 非生細胞を標識するためにトリパンブルー排除を用いてhaemocytometerで生細胞の濃度を決定します。
- ペレットを5分間1,200×gで細胞やDMEMは8×10 6細胞/ mlの最終濃度で10%FCSを含む再懸濁します。
- トランスフェクション、2分間トランスフェクション、1,200 X gでペレットそれら当たり細胞のアリコート1ミリリットルの直前に。メディアを取り出し、PBS 500μlの(のMg 2 + / Ca 2 +を除く)で細胞を洗浄する。 2分間1200×gで再び細胞をスピンダウンする。それはできるだけ長くのためにDMEM中で細胞を維持することをお勧めであることに注意してください長時間のPBS中のストレージとして細胞の生存およびトランスフェクション率を損なうことがあります。
- チューブからPBSを除去し、6×10 7細胞/ mlの最終濃度に再懸濁液を130μL(ネオントランスフェクション·システム·キット 、Invitrogen)を追加します。ケアは、トランスフェクションと妥協の細胞生存率の間にスパークが発生します気泡の形成を回避するため、細胞を再懸濁に注意する必要があります。
- 一般に、細胞( 図2)、キャップRNAの1.3μgのキャップMNV転写産物の適切な量を追加すると、懸濁している細胞の130μlに添加し、穏やかに混合されています。その後、100μlのネオントランスフェクションの先端で混合物100μlを収集します。これは実験の失敗の原因になりますように特別な注意がない気泡がエレクトロポレーションキュベット( ネオントランスフェクション·システム·キット100μlの先端)で形成されないように注意する必要があります。
- 25ミリ秒、専用のために1,700 Vの単一パルスを用いて細胞をエレクトロポサンプル中の気泡の存在が示されているパルスの間に火花が存在しないことをジューリング。スパークケースが発生した場合には、サンプルを破棄し、トランスフェクションを繰り返します。抗生物質を含まないDMEM、10%FCSを含む1 mlを含むエッペンドルフチューブに細胞を解放します。トランスフェクトした細胞の大きい番号が必要な場合は、各チップが同一のRNAサンプルで3回まで再利用することができます。
- その後、10%FCSを含む温め抗生物質を含まないDMEM、適切な量を含む独立したウェルにチューブからの細胞を配布しています。 300μlの12皿プレートのウェルに適切であるのに対し、一般的なガイダンスとして、ステップ1.2.8中に生成された細胞懸濁液150μlのは、温めたDMEM 0.5 mlを含む24皿プレートの単一ウェルのに十分である温めたDMEM 1mlを含む。
- 24〜72時間37℃、10%CO 2で細胞をインキュベートします。その後、1(またはそれ以上)によって細胞から感染性ウイルス粒子を放出凍結と融解とプラークアッセイまたはTCID50のいずれかを使用して、サンプル中のウイルス力価を決定します。ライセートを最高速度で、または、その前の滴定に0.22μmの孔径フィルターを通して濾過することにより1〜2分間遠心分離して明確にすべきであることに注意してください。通常は、MNVは、最大1×10 9から72時間後にトランスフェクション時の約1×10 6〜24時間後にトランスフェクション時のTCID50/mlとの力価に達しています。
- をpT7に導入された変異の存在と安定性:MNVの3'Rzは、通常、RAW264.7細胞において2から5の追加継代後救出、ウイルスをシーケンシングによって決定されます。
BHK-21細胞にリポフェクション法により1.3回復:
キャップの転写産物から感染MNVの回復のためのより直接的かつ頻繁に、よりコスト効果的な方法は、リポフェクション( リポフェクタミン2000、インビトロジェン社製)を使用することです。 RAW264.7細胞は我々が正常にOTHを利用して脂質ベースのアプローチを使用してトランスフェクションが困難であることを考えるとERベビーハムスター腎線維芽細胞由来不死化ラインであるようなBHK-21などの細胞株をトランスフェクトしやすい。これらの細胞がMNVの複製をトランスフェクションとサポートが容易である一方で、彼らは適切な受容体を欠いているとして、我々の研究室で標準的なアプローチとして、我々はできるように、BSR-T7細胞、BHK-21細胞株の誘導体を使用し、再感染のいくつかのラウンド。その結果、このシステムから生成されたウイルスの収率は、ウイルス複製の単一サイクルの指標である。それは、複数のトランスフェクションは、ネオン媒介トランスフェクションに比べて大幅にコスト削減で実行することができ、また、専門的な機器を必要としないウイルス回収の突然変異の効果を調べるときにこのアプローチが特に有用である。そのようなヒト胚性腎臓293T細胞のような他の容易に利用可能な細胞株はまた、最初の効率的なRNAの配信を保証するために最適化する必要がありますMNVただし、トランスフェクション条件の効率的な回復をサポートしていることは注目に値します。
- トリプシンISE BHK-21細胞(またはBSR-T7細胞)、シード7.5×10 5、抗生物質フリー増殖培地で35 mm径のディッシュに細胞と2泊、10%CO、37℃で細胞をインキュベートします。の単分子層トランスフェクションは、播種と同じ日に予定されている場合は、各プレートに細胞の量を倍増し、細胞が10%CO 2で37℃で2-3時間のためにプレートに付着することができます。このアプローチに適した他の細胞がヒト293T細胞、ヒト肝細胞癌Huh7細胞とアフリカミドリザルCOS7細胞を含むことに注意してください。
- 細胞から培地を除去し、トランスフェクションの最大効率を確保するために抗生物質を含まない新鮮な培地3mlで置き換えます。
- のOpti-MEM(Invitrogen社製)100μlの中にキャップMNV転写産物の1〜2μgの混合物を準備し、以前のOpti-MEM100μlに混合リポフェクタミン20004μlのとそれを混ぜる。上下に15回、それをピペッティングにより完全にサンプルを混ぜる。残す20分間室温で混合。
- 細胞単層に滴下方式でキャップMNVの転写産物を含むトランスフェクション複合体を加え、穏やかに垂直方向の板を横に振る。
- 24〜72時間37℃、10%CO 2で細胞をインキュベートします。その後、凍結により細胞から感染性ウイルス粒子を解放し、解凍し、プラークアッセイまたはTCID50によるウイルス力価を決定します。約1×10 6 TCID50/mlの典型的な収率が達成されました。
2。 T7 RNAポリメラーゼを発現する細胞のcDNAから感染MNVの直接回収
このプロトコルは、感染プラスミド宿る細胞内で発現T7ポリメラーゼによる完全なゲノムのcDNA配列の転写によって細胞内でMNVの回復を可能にするために設計されています。我々は通常、BHK-21およびBSR-T7 CEで最高の収率を得るが、異なる細胞株は、このアプローチによって感染MNVを回復するために使用することができますLLS 15。彼らは親のBHKクローンラインよりも早く成長するので、我々は一般的にBSR-T7細胞を使用しています。細胞はウイルスRNAと感染性ウイルスを回収する( 図4)の発現を駆動するためにヘルパーウイルスとして機能するT7 RNAポリメラーゼ(FPV-T7)18鶏痘(FPV)エンコーディングに感染しています。恒常的にBSR-T7の細胞はT7 RNAポリメラーゼが、この式はをpT7のトランスフェクションの後に感染MNVを救出するのに十分ではありません。ヘルパーFPV-T7の不在下でMNV 3'Rz。このシステムからの典型的な利回りは上記のものより少なくとも10倍低くなっていながら、このアプローチでは、衰弱させる変異の同定を可能にする変異体をスクリーニングする迅速な方法を提供しません。通常、このメソッドは、cDNA構築物の生存率を評価するために最初に使用されます。その後、感染性ウイルスを生産するために失敗するか、または野生型感染性クローンのそれより低いレベルでウイルスを得るように見えるのいずれかのRNAベースのapproaを構築する必要があります上記のchは行われています。
- 抗生物質フリー増殖培地で35 mmディッシュにBHK-21細胞(またはBSR-T7細胞)とシード7.5×10 5細胞の単層をTrypsinise℃と10%CO 2で一晩37℃で細胞をインキュベートします。トランスフェクションは、播種と同じ日に予定されている場合は、各プレートに細胞の量を倍に追加し、細胞は37℃で2-3時間のためにプレートに付着することができ℃、10%CO 2。
- 細胞培養培地を除去し、( 図4)を各ウェルにFPV-T7 700μlを加える。主なニワトリ胚線維芽細胞上に滴定に基づいて、セル当たり約0.5 PFUの感染多重度(MOI)は、一般的に使用されています。しかし、それは主要な線維芽細胞で増殖させたヘルパーウイルスの新しい製剤は、機能的に効率的なウイルス·リカバリに必要な用量を決定するために滴定されていることは注目に値する。 FPV-T7の伝播と滴定のためのプロトコルは、以前18に記載されている。
- で37℃で細胞に感染するFPV-T7を可能にするために1時間°C、10%CO 2を cubate。その後、抗生物質を含まないDMEM 2 mlの10%FCSを含有し、T7 RNAポリメラーゼの発現を可能にするために°C、10%CO 2で37さらに1時間細胞をインキュベートを追加します。
- 感染性プラスミドのトランスフェクションを続行するには、まず感染した細胞からメディアを削除するには、メディアの2ミリリットル(抗生物質を含まないDMEMに10%FCS)で洗浄し、最後にメディアの3mlで細胞単層をカバーしています。彼らはリポフェクトアミン2000(Invitrogen)の効率を妨げる可能性があるので抗生物質は、培地に添加すべきではありません。
- 以前は100μlと混合のOpti-MEM100μlの(Invitrogen社)とリポフェクタミン2000の4液(Invitrogen社製)を混ぜ:野生型のcDNA MNV感染プラスミド1μgの(MNV 3'RzなどをpT7)のミックスを調製するOPTI-MEM(Invitrogen社)。上下に15回、それをピペッティングにより完全に反応を混合し、室温テンペでミックスを維持する20分間気温の上昇下降。
- その結果、トランスフェクションミックスを細胞単層とプレートに滴下すべきである静かに垂直方向に振とうしなければなりません。
- 37 FPV-T7感染、MNVプラスミドトランスフェクトした細胞をインキュベート°Cおよび10%24〜72時間CO 2。感染プラスミドをpT7でトランスフェクションした細胞:MNV 3'Rzは、通常1×10 4〜5×10 4 TCID50/mlから力価をレンダリングします。
3。代表的な結果
図5に示すように両方の逆遺伝学的ア プローチは、細胞培養における感染MNVの回復のための非常に効率的です。 10 5 TCID50/mlを超える抗体価と感染MNVは、RAW264.7細胞に覆われたMNV RNAのトランスフェクション後24時間で回収されています。同様に、感染プラスミドをpT7のトランスフェクション:以前にヘルパーFPVに感染してBSR-T7細胞にMNV 3'Rzは、ウイルスの力価につながっT7(FPV-T7)は、主にexcee表現する鼎10 4 TCID50/ml( 図5)。合成RNAとDNA分子を用いて得られたこれらのウイルス力価の値が同じセル( 図5)に感染性ビリオンから単離された天然のVPG-結合型RNAを含むトランスフェクションで得られたものと似ています。これらの結果は、細胞培養で遺伝的に定義されているMNVバリアントを回復するためにここで説明する逆遺伝学的アプローチの高効率を強調表示します。
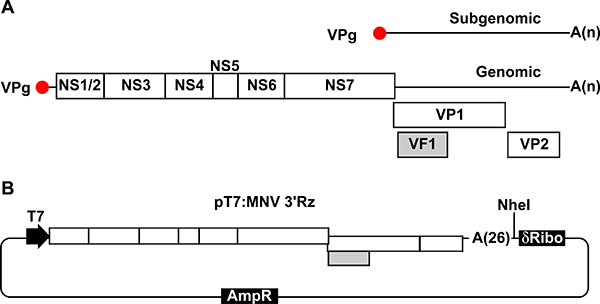
図1。 MNVゲノムおよび感染性ウイルスの回収のためのプラスミドのイラスト。MNVゲノム組織の、模式図。それぞれのタンパク質コーディング領域は、単一の白いボックスとして示されている。 ORF1は自己タンパク質分解処理後の前駆体ポリタンパク質から放出される7種類の非構造タンパク質(NS1 / 2〜NS7)に変換されます。 ORF 2は、主要キャプシドタンパク質VP1、ORF 3はマイナーキャップをエンコードするエンコードsidの蛋白質VP2、およびORF2コーディング領域と重なってORF4は、病原因子VF1をエンコードします。ゲノムおよびサブゲノムRNAは、可変長の彼らの3 '末端にポリAテールを含まれています。 B、私たちの逆遺伝学的アプローチ(をpT7:MNV 3'Rz)で使用されるcDNAを含むプラスミドMNV。 cDNAをMNVは、その3 '末端の26残基のポリA尾部に融合されています。 MNVのcDNA配列はT7駆動型の転写を可能にするために、切り捨てられたT7プロモーター配列のすぐ下流に位置し、上流のユニークなNHE私のサイトとそのあと自己切断リボザイムをコードするDNA配列である。これらの配列は、右の3 '末端に存在するゲノムのポリAテールの後のRNA転写終結を確保するための手段です。
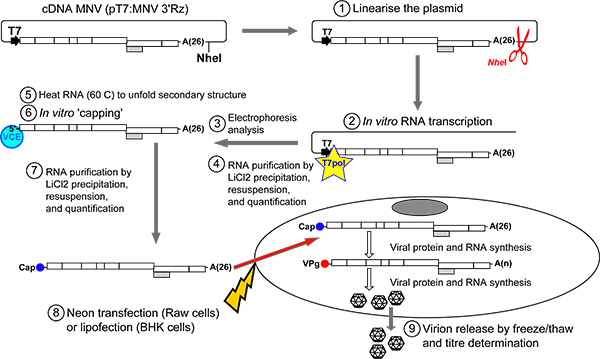
図2。 in vitroで転写し、キャッピングRNAから感染MNVの回復のためのプロトコルの概要プラスミドをpT7:MNV 3'Rzがすぐ下流に直線化されていNHE I制限酵素(ステップ1)を使用して、MNVゲノム配列の。 DNA精製後、MNV RNA転写物は、T7 RNAポリメラーゼ(ステップ2)を用いてin vitroで生成されます。転写産物は、通常、非変性1%アガロースゲル(ステップ3では、 図3)2.5 3KBの見かけの移動度で実行されます。テンプレートDNAは市販のRNase-free DNaseを用いて除去されます。 RNAは、その後、LiCl沈殿(ステップ4)で遊離ヌクレオチドから精製される。精製したRNA産物はin vitro でかもしれません以前は65℃に加熱された後、蓋を°C二次RNA構造を(ステップ5-6)展開します。 LiCl沈殿による精製の 後、RNAはRAW264.7細胞( ネオントランスフェクションシステム 、Invitrogen社)やBSR-T7細胞( リポフェクタミン2000、インビトロジェン社製)(ステップ7-8)のいずれかにトランスフェクトされる。一度細胞内で、キャップRNA転写物は、新しいMNV RNA分子へのウイルスの転写複製を触媒するだろうウイルスタンパク質に翻訳されます。それらの5 '末端で適切なVPG分子を含む。ウイルスの翻訳を伴う複製の連続したサイクルが感染性ウイルス粒子を生成するために包まれるウイルスゲノムの大規模な番号を生成します。細胞からのウイルスの放出を容易にするために、凍結融解のいずれかまたはいくつかのサイクル(ステップ9)実行されます。ウイルスの収率は、その後、TCID50またはプラークアッセイ手順により決定することができる。
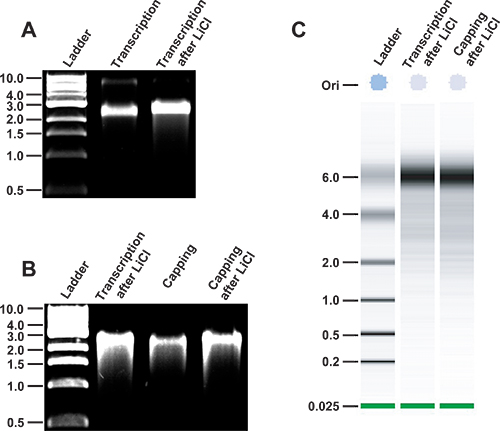
図3。プロトコルに沿ってMNV RNA転写物の整合性の分析は。MNV RNAの、整合性は 、in vitro で合成した。プラスミドをpT7:MNV 3'Rzは、まずNHE I制限酵素を用いて直線化されています。 DNA精製後、MNV RNA転写物は、T7 RNAポリメラーゼ(レーン2)を用いてin vitroで生成されます。 RNAは、その後purifiです。 LiCl沈殿(レーン3)によって遊離ヌクレオチドからED。転写産物は、1 KBのDNAラダー(New England Biolabs社、レーン1)と平行に非変性1%アガロースゲル上で実行されます。非変性条件下でのウイルス転写物の相対移動度は2.5から3 KBの二本鎖DNAの製品に似ています。 B、キャッピング後のMNV RNA転写物の整合性。 LiCl沈殿(レーン2)で以前に精製したMNVの転写産物は、酵素キャッピング(レーン3)、LiCl沈殿(レーン4)によって精製に供されています。 C、MNVの転写産物(第二車線)と以前にLiClを中に沈殿されたキャップMNV転写(第三車線) の Agilent RNA 6000ナノチップの解析。 ssRNAラダーは並列に実行されます。
= "pdflinebreak"> 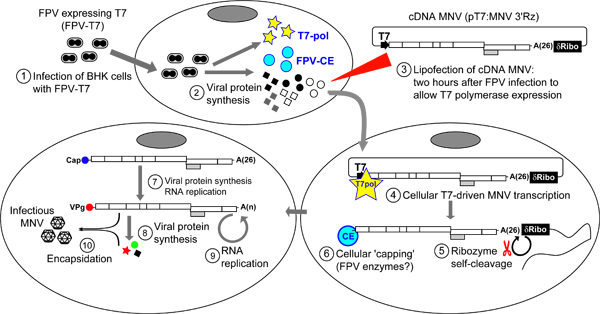
図4。 cDNAからの感染MNVの回復のためのプロトコルの概要を説明します。当初、BSR-T7(またはBHK)細胞は、バクテリオファージT7 RNAポリメラーゼ(FPV-T7)(ステップ1)を発現する組換え鶏痘ウイルス(FPV)に感染しています。感染した細胞は、組換えT7 RNAポリメラーゼ(ステップ2)を含むFPVタンパク質の発現を可能にするために更なる処理の前に2時間インキュベートされています。その後、をpT7:MNV 3'Rzはリポフェクトアミン2000(Invitrogen)を(ステップ3)を用いて細胞にトランスフェクトされています。一度セルをpT7内側:MNV 3'RzがMNV RNA転写産物(ステップ4)をつくり出すT7 RNAポリメラーゼによって認識されている。ゲノムの3 '末端における自己切断δ-リボザイム配列の存在は、転写産物の3' tを保証erminusはちょうどポリAテール(ステップ5)の後に位置しています。いくつかのウイルスの転写産物が細胞内にFPVキャッピング酵素(ステップ6)でおおわれています。結果MNVキャップ転写産物がMNV転写複製を触媒するだろうMNVのタンパク質を生成するために変換されます。それらの5 '末端で適切なVPG分子を含む新たに合成されたMNV RNA分子は、最終的に伝染性ウイルスのカプシド世代になることがあり、ウイルスの翻訳に伴う複製の連続したサイクルを受けるだろう。細胞からのウイルスの放出を容易にするために、凍結融解のいずれかまたはいくつかのサイクル(ステップ7)実行されます。ウイルスの収率は、その後、TCID50またはプラークアッセイ手順により決定することができる。
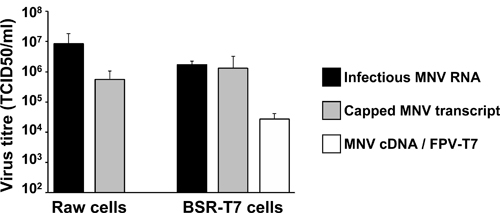
図5テキストで説明されているさまざまな逆遺伝学のアプローチから得られたウイルス力価の代表的な結果。グレーバーはネオン後24時間で得られたウイルスの力価を表す2×10 6 RAW264.7細胞、または後のトランスフェクション、in vitroで転写し、キャップMNV RNAを用いた2×10 6 BSR-T7細胞のリポフェクション。以前に組換えT7ポリメラーゼ(FPV-T7)を発現する鶏痘ウイルスで2時間感染させ、2×10 6 BSR-T7細胞にMNV 3'Rz(MNVのcDNA):白いバーは、通常、pT7などのリポフェクション後に得られたウイルスの力価を表しています。生とBSR-T7cellsにトランスフェクションのためのポジティブコントロールとして、我々は一般的にVPG架橋MNV RNAのハイレベルを含むMNVに感染した細胞から抽出したRNA2μgのを使用しています。ネガティブコントロールは、MNV RNAまたはpT7などのいずれかで実施されています:MNV 3'Rzは、検出可能なウイルス(データは示さず)、その結果、レプリケーションをabrogatesフレームシフト変異(F / S)をコードする。
ディスカッション
ここでは、細胞培養における感染MNVの回復を可能にする2つの異なった逆遺伝学的アプローチを説明しました。両方を効果的に近づくし、細胞リボソームによって認識されるキャップMNVの転写産物の生成を介したウイルスRNAゲノムの5 '末端にVPGの共有結合のための絶対的な要件をバイパスします。in vitro転写酵素キャッピング続いて、より効率的です。転写物はFPVキャッピング酵素によってキャップされるかもしれないT7 RNAポリメラーゼを発現する細胞に感染するプラスミドの転写より感染MNVの回復。これらの逆遺伝学システムで回収し、ウイルス力価は、感染した細胞培養液17( 図5)から精製したウイルスVPG-結合型RNAのトランスフェクションによって得られたこれらに類似しています。寛容なRAW264.7細胞に覆われたMNV RNAのトランスフェクションは、transfectioを含む実験より1つだけログ低いウイルス力価をレンダリングn個のウイルスVPG-結合型RNA( 図5)を含む感染細胞からのトータルRNA。この事実は、これらのシステムによって生成された転写産物の5 '末端にVPG分子の添加はVPGに関連付けられている細胞にMNV感染性の根底にある機能的側面を明らかにすることが増加したウイルスの収率につながるかどうかを判断するためにさらなる調査を奨励しています。他のRNAウイルスに匹敵する高効率のいずれかの遺伝システムは現在、in vitro転写RNA のウイルス粒子19、20と実際の感染症に比べて唯一の10から100まで低価の回復を可能にするに使用される逆にそれにもかかわらず、我々は、このリバースジェネティクス系を考えています。
全体として、現在の方法論は、ノロウイルスの分子生物学の分野で大きな前進を構成し、ノロウイルスのゲノム中のタンパク質と保存されたRNAモチーフの機能的役割を調べるためのツールを提供してくれる。これらのアプローチは、既にCと組み合わされています10日未満4、21 -マウスurrentマウスモデル使用可能で、MNVが感染性cDNAから回収されたことが示されているが> 80%STAT1-/の致死的感染を引き起こすことができます。我々はキャプシドタンパク質のおよび in vivo 21、22 でやや減衰の表現型を示すさまざまな宿主因子(PTBとPCBP)の結合に関与するポリピリミジン管の生存マウスノロウイルスの変異体を回復したこのシステムを活用した。さらに、我々は最近、ORF4からVF1タンパク質を発現する能力を欠いているウイルスが効率的に細胞培養で複製が再びWT MNV 8に対してマウスにおける病原性が低下していることを明らかにした。これらの研究は、私たちは潜在的なワクチン候補として検討することができMNVの研究に基づいて人間のノロウイルスの弱毒化のバージョンを設計することをお勧めします。
開示事項
我々は、開示することは何もありません。
謝辞
本研究では、イアン·グッドフェローに授与ウェルカムトラストシニア·フェローシップによって資金を供給し、マリーキュリーイントラヨーロッパのフェローシップ(FP7欧州研究評議会)は、アルマンド·アリアスに授与されました。私達は私達に彼らのAgilentのbioanalyserを使用する許可を与え、RNAサンプルを実行すると助けるためにイオ香港チョン博士レベッカロービーとDrマイクスキナーに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| 塩化リチウム沈殿ソリューション | Ambionの | AM9480 | |
| RNA·ストレージ·ソリューション | Ambionの | AM7000 | |
| MEGAscript T7スクリプト | Ambionの | AM1333 | |
| ScriptCap m7Gキャッピングシステム | EPICENTREバイオテクノロジー | SCCE0610 | |
| ネオントランスフェクションシステム | インビトロジェン | MPK5000 | |
| ネオントランスフェクション·システム·キット | インビトロジェン | MPK1025 | |
| のOpti-MEM I | インビトロジェン | 31985070 | |
| リポフェクトアミン2000トランスフェクション試薬 | インビトロジェン | 11668-027 | |
| アジレント·RNA 600ナノキット | アジレント | 5067-1511 | |
| Agilent 2100バイオアナライザの双方向oanalyzer | アジレント | G2939AA | |
| Illustra GFX PCR DNAとジェルバンド精製キット | GEヘルスケア | 28-9034-70 | |
| RiboMAX大規模RNA生産システム-T7 | プロメガ | P1300 |
参考文献
- . Outbreaks of gastroenteritis associated with noroviruses on cruise ships--United States. MMWR Morb. Mortal. Wkly. Rep. 51, 1112-1115 (2002).
- Lopman, B. A. Epidemiology and cost of nosocomial gastroenteritis, Avon, England, 2002-2003. Emerg. Infect. Dis. 10, 2002-2003 (2004).
- Duizer, E. Laboratory efforts to cultivate noroviruses. J. Gen. Virol. 85, 79-87 (2004).
- Karst, S. M., Wobus, C. E., Lay, M., Davidson, J., Virgin, H. W. T. STAT1-dependent innate immunity to a Norwalk-like virus. Science. 299, 1575-1575 (2003).
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432 (2004).
- Bok, K. Inhibition of norovirus replication by morpholino oligomers targeting the 5'-end of the genome. Virology. 380, 328-337 (2008).
- Kim, Y., Thapa, M., Hua, D. H., Chang, K. O. Biodegradable nanogels for oral delivery of interferon for norovirus infection. Antiviral Res. 89, 165-173 (2011).
- McFadden, N. Norovirus Regulation of the Innate Immune Response and Apoptosis Occurs via the Product of the Alternative Open Reading Frame 4. PLoS Pathog. 7, e1002413 (2011).
- Kormelink, R., van Poelwijk, F., Peters, D., Goldbach, R. Non-viral heterogeneous sequences at the 5' ends of tomato spotted wilt virus mRNAs. J. Gen. Virol. 73, 2125-2128 (1992).
- Shuman, S., Hurwitz, J. Mechanism of mRNA capping by vaccinia virus guanylyltransferase: characterization of an enzyme--guanylate intermediate. Proc. Natl. Acad. Sci. U.S.A. 78, 187-191 (1981).
- Jang, S. K., Pestova, T. V., Hellen, C. U., Witherell, G. W., Wimmer, E. Cap-independent translation of picornavirus RNAs: structure and function of the internal ribosomal entry site. Enzyme. 44, 292-309 (1990).
- Chaudhry, Y. Caliciviruses differ in their functional requirements for eIF4F components. J. Biol. Chem. 281, 25315-25325 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4. E. EMBO Rep. 6, 968-972 (2005).
- Herbert, T. P., Brierley, I., Brown, T. D. Identification of a protein linked to the genomic and subgenomic mRNAs of feline calicivirus and its role in translation. J. Gen. Virol. 78 ( Pt5 ), 1033-1040 (1997).
- Chaudhry, Y., Skinner, M. A., Goodfellow, I. G. Recovery of genetically defined murine norovirus in tissue culture by using a fowlpox virus expressing T7 RNA polymerase. J. Gen. Virol. 88, 2091-20100 (2007).
- Ward, V. K. Recovery of infectious murine norovirus using pol II-driven expression of full-length cDNA. Proc. Natl. Acad. Sci. U.S.A. 104, 11050-11055 (2007).
- Yunus, M. A., Chung, L. M., Chaudhry, Y., Bailey, D., Goodfellow, I. Development of an optimized RNA-based murine norovirus reverse genetics system. J. Virol. Methods. 169, 112-118 (2010).
- Arias, A., Perales, C., Escarmis, C., Domingo, E. Deletion mutants of VPg reveal new cytopathology determinants in a picornavirus. PLoS One. 5, e10735 (2010).
- Werf, S. v. a. n. d. e. r., Bradley, J., Wimmer, E., Studier, F. W., Dunn, J. J. Synthesis of infectious poliovirus RNA by purified T7 RNA polymerase. Proc. Natl. Acad. Sci. U.S.A. 83, 2330-2334 (1986).
- Bailey, D., Thackray, L. B., Goodfellow, I. G. A single amino acid substitution in the murine norovirus capsid protein is sufficient for attenuation in vivo. J. Virol. 82, 7725-7728 (2008).
- Bailey, D. Functional analysis of RNA structures present at the 3' extremity of the murine norovirus genome: the variable polypyrimidine tract plays a role in viral virulence. J. Virol. 84, 2859-2870 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved