このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
事後組織から心筋細胞核の分離
要約
心臓核密度沈降を介して分離し、フローサイトメトリーにより心筋細胞核を識別し、ソートするための中心体周辺物質1(PCM-1)に対する抗体で免疫標識されています。
要約
ほとんどの戦略は、唯一の細胞マーカータンパク質1に依存しているとして、心筋細胞の核の同定は、組織切片に挑戦されています。そのような増殖およびアポトーシスとして心筋細胞では稀なイベントは、心筋細胞核の正確な同定は、恒常性と病理学的状態2の細胞の更新を分析する必要があります。ここでは、中心体周辺物質1(PCM-1)およびそれ以降のフローサイトメトリー選別に対する抗体を用いた密度の堆積作用と免疫標識によって死後組織から心筋細胞核を単離する方法を提供します。この戦略は、新鮮な組織と凍結アーカイブ材料にも同様の作業の利点を有するハイスループット解析と分離することができます。これにより、既にバイオバンクで収集された材料を研究することができます。この手法は適用可能で、種の広い範囲でテストし、そのような炭素14年代測定3、セル-CYなどの複数のダウンストリームアプリケーションに適していますCLE分析4、チミジン類似体の可視化(例えば、BrdUとIDU)4、トランスクリプトームとエピジェネティクス解析。
プロトコル
1。心臓核の単離
- 1%BSA / PBSコーティング溶液10mlとコート遠心管(Beckmanの遠心チューブ#363664)。チューブにフタをし、それらがチューブローテーターで30分間回転させましょう。コーティング溶液を除去し、遠心チューブの空気乾燥した(マウスの心臓ごとに管が異なる種からの単一のマウスの心臓、交互に最大5つのマウスの心臓や心臓の組織の1グラムの分析のために必要とされるみましょう(例えば、ヒト)処理することができます1チューブで)。
- すべての次の手順は氷の上で実行する必要があります。メスで新鮮な、またはスナップインを凍結したマウスの心臓から左心室を解剖。 (注)このプロトコルは、マウスの心臓のために最適化されていますが、また、ラットやヒトの心臓に適合させることができます。また、異なる種から心臓組織の1グラムまで使用しています。
- メスの小さな個室に試料をトリミングします。
- 溶解緩衝液15ミリリットルを充填した50mlファルコンチューブに組織片を転送します。
- ホモジナイズ10秒24,000 rpmでT-25ウルトラタラックスプローブホモジナイザー(IKA)の心臓組織。
- 30ミリリットルに溶解用緩衝液と等量のホモジネートを希釈する。
- さらに組織と自由核を均一にガラスdouncer(40ミリリットル)を使用します。大クリアランス乳棒で8打を実行します。
- 連続して、100μmと70μmのナイロンメッシュセルストレーナー(BD Biosciences社)を介して分離し、粗核を渡します。
- 原油核スピンダウンし、10分間700×gで冷却遠心(4°C)に分離します。
- 反転管によって注意深く上清を除去し、ペーパータオルで管の内側を拭いてください。核ペレットを乱さないように注意してください。
- 原油核が上下にソリューションを数回ピペッティングしてショ糖緩衝液の5ミリリットルで分離溶解する。溶解したペレットに、ショ糖バッファのさらに25ミリリットルを追加します。
- コーティングされた遠心チューブ(ステップ1.1参照)に新たに調製し、ショ糖緩衝液10mlを追加します。
- 慎重にステップ1.9からショ糖緩衝液に溶解し再懸濁した核ペレットを蔗糖バッファーの追加10ミリリットルを重ねる。
- JS13.1フリースイングローターにそれらを配置する前に、遠心チューブのバランスをとり、高速遠心機(ベックマンアヴァンティS-25)にローターを配置します。
- 60分間、4℃で13000×gで核サンプルをスピン。
- スピンが完了したとき、ロータから慎重にチューブを取り外し、反転チューブの上清を捨て、ペーパータオルのチューブの内側から、残りの破片を拭く。
- 核格納バッファの1ミリリットル(NSBプラスバッファ)で核ペレットを溶解する。注:NSBに加えて、DNAの安定剤として1.5mMのスペルミンが含まれています。
- 心筋細胞核の免疫染色は、ステップ2.1に進みます。
2。フローサイトメトリーのために免疫染色
- 免疫染色のために、ネガティブコントロールを用意します。核サンプルの20μlのアリコートを取り出し、NSB PlusバッファのDD 980μL。
- immunolabel心筋細胞核に1:500の希釈で核サンプルに抗中心体周辺物質1抗体(ウサギ抗-PCM-1、アトラス抗体)を追加します。ステップ2.1で調製したネガティブコントロールに抗-PCM-1抗体と同じ希釈でアイソタイプの抗体を追加します。
- 4℃で一晩、ネガティブコントロールとサンプルチューブをインキュベートします。
- NSBプラスバッファ(10分間700×gで冷却遠心(4℃)にチューブをスピンダウンし、上清を捨て、NSB Plusバッファの1ミリリットルで核ペレットを溶解)で少なくとも1回はネガティブコントロールとサンプルを洗浄します。
- 1:1000の希釈で、ネガティブコントロールとサンプルチューブに抗ウサギ蛍光二次抗体(FITCまたはAPC)を追加します。
- 1時間4℃で、ネガティブコントロールとサンプルチューブをインキュベートします。
- NSBプラスバッファ(10分間700×gで冷却遠心(4℃)にチューブをスピンダウンして、少なくとも一度はネガティブコントロールとサンプルを洗う。上清を破棄して)NSB Plusバッファの1ミリリットルで核ペレットを溶解する。
- フローサイトメトリー分析およびソートを続行します。
3。フローサイトメトリー
- 手順1.1で説明したようにソートし、フローサイトメトリーを開始する前に、1%BSA / PBS溶液で被覆核のコレクションチューブ(ファルコン15ミリリットル)。
- 30μmのセルストレーナーを通してサンプルとネガティブコントロールをフィルタリングし、フローサイトメーター(BD流入)に最初の負の制御をロードします。前方散乱光(FSC)、前方散乱パルス幅(FSパルス幅)と側方散乱(SSC)( 図2AおよびB)に基づいて、核とシングレット(単核)を定義する第1および第2のゲートを定義します。サンプルにDNA染色(DRAQ5(1:500))を追加すると、最初に核の集団を識別するのに役立ちます。
- 免疫標識サンプルをロードし、非心筋細胞核(PCM-1陰性)から心筋細胞核(PCM-1高い正)を分離する第3のゲートを定義します。ソートを開始( 図2cおよびd)。
オプション:核DNA量(倍数性)を分析し、核への染色適切なDNA(例えば、ヘキスト33342またはDRAQ5)( 図2e)を追加し 、細胞周期の解析を実行するために。
- フローサイトメトリー選別した後、氷上に核を配置し、選別純度( 図3AおよびB)を決定するために再分析します。
- 15分間冷却遠心機で1500×gでコレクションチューブ内のソート済み核スピンダウンする。
- 下流のアプリケーションと互換性の緩衝液中で核ペレットを溶解する。
4。代表的な結果
核の形態との整合性は、DNA染色により評価し、顕微鏡( 図1)によって可視化することができます。成功したPCM-1標識は、落射蛍光顕微鏡により、フローサイトメトリー( 図1、図2CおよびD)で評価することができる。 PCM-1-positiveと負の集団がよく( 図2cおよびd)互いに分離する必要があります。マウスの左心室にすべての核の約30%が心筋細胞核( 図2D)でなければなりません。純度のソートは、再分析ソート核( 図3a及びb)によって評価することができる。両方の原子核の集団は95%を超えて選別純度を持っている必要があります。
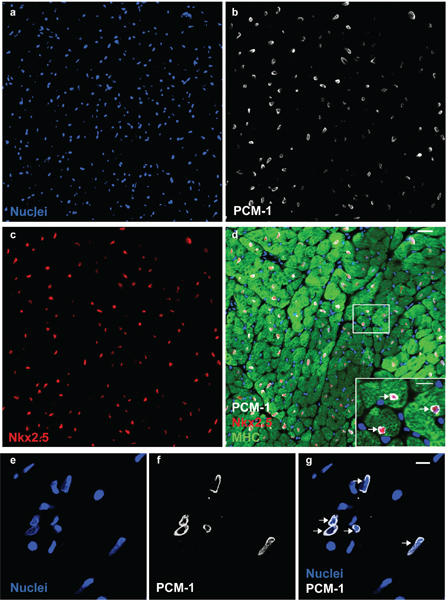
図1。 PCM-1は心筋細胞の核を識別します。心臓核()は、成体マウスの心臓にPCM-1(b)に及びNkx2.5(C)に対する抗体で染色されています。 (d)のPCM-1-標識心筋細胞の核細胞質に囲まれた(ミオシン重鎖(MHC))と転写因子Nkx2.5を発現し、PCM-1染色(スケールバーは20μmと10心筋細胞核の正確な識別を文書化されているμmの(D、挿入図))。 (e)のDNAを用いて可視化心臓核分離株はDRAQ5を染色する。 (FおよびG)Cardiomyocyte核は、PCM-1(スケールバーは10μm)に対する抗体で標識されています。 (注)、組織切片の筋細胞核内および単離された核(矢印)のPCM-1のepinuclear染色パターン。
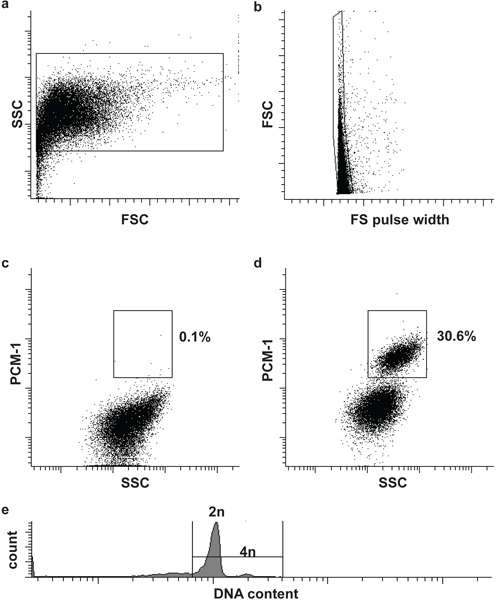
図2。心筋細胞核のフローサイトメトリー選別()心臓核は前方散乱光(FSC)と側方散乱(SSC)によって識別されます。 (b)は第二のゲートは、FSCとFSパルス幅5で、単一の核を識別します。 (c、d)の蛍光ゲーティングは、心臓組織から心筋細胞核の分離(PCM-1陽性)と非心筋細胞(PCM-1陰性)が核になります。マウスの心筋細胞はほとんど(> 80%)二倍体(2n)である(e)は、唯一の小さなサブセットの(4n)6倍体である。 (注)、人間の心筋細胞は倍数性核(> 2n)の7,8の高い周波数が含まれています。

図3。ソートされた心筋細胞と非心筋細胞核の純度分析。ソートされた非心筋細胞()と心筋細胞核(b)の再解析。両集団は99%を超えるソート純度を示しています。
ディスカッション
心筋細胞核の正確な識別は、心筋2,3の再生過程の分析のために重要である。新鮮な組織から心筋細胞を分離する従来の手法は、主に細胞外マトリックスタンパク質の酵素消化と低速遠心分離により間質細胞からの後続の精製に基づいています。胚性幹細胞(ESC)から生きている心筋細胞のさらなる精製は、そのようなSIRPA 9またはミトコンドリアの染料10などの表面マ?...
開示事項
利害の衝突が宣言されません。
謝辞
我々は、フローサイトメトリーの支援についてはマルセロ·トロに感謝したい。本研究では、スウェーデンのハートと肺財団、欧州委員会FP7 "CardioCell"、スウェーデンの研究評議会、AFA保険やALFによってサポートされていました。 OBは、ドイツ学術振興によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 1。溶解バッファー | |||
| 試薬の名前 | |||
| 0.32Mスクロース | |||
| 10mMトリス-HCl液(pH = 8) | |||
| 5mMのCaCl 2を | |||
| 5mMの酢酸マグネシウム | |||
| 2.0mMのEDTA | |||
| 0.5mMのEGTA | |||
| 1mMのDTT |
| 2。ショ糖バッファ |
| 試薬の名前 |
| 2.1 Mのショ糖 |
| 10mMトリス-HCl液(pH = 8) |
| 5mMの酢酸マグネシウム |
| 1mMのDTT |
| 3。核貯蔵緩衝液(NSBプラス) |
| 試薬の名前 |
| 0.44 Mショ糖 |
| 10mMトリス-HCl液(pH = 7.2) |
| 70mMのKClを |
| 10mMのMgCl 2 |
| 1.5 mMのスペルミン |
| 試薬および器具 | 会社 |
| アイソタイプウサギIgG-ChIP用グレード、#ab37415 | アブカム |
| ウサギ抗-PCM-1抗体、#HPA023374 | アトラス抗体 |
| ロバ秒。抗体、抗ウサギアレクサ488弗素、#-21206または同等秒。蛍光抗体 | ライフテクノロジーズ |
| DRAQ5 | Biostatus |
| セルストレーナーは30μm、70μmと100μm | BDバイオサイエンス |
| ガラスdouncer(40ml)および"L"を乳棒 | VWR(ウィートン工業株式会社) |
| T-25ウルトラタラックスホモジナイザー | IKAドイツ |
| 分散ツールS25 N-18 G | IKAドイツ |
| ベックマン·アヴァンティ遠心 | ベックマン·コールター |
| ファルコンチューブ15ミリリットルと50ミリリットル | VWR |
| ベックマン遠心チューブ#363664 | ベックマン·コールター |
| JS13.1フリースイングローター | ベックマン·コールター |
| 流入メーター | ベックマン·コールター |
| チューブローテーター | VWR |
参考文献
- Ang, K. L. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American journal of physiology. Cell physiology. , 298-1603 (2010).
- Bergmann, O. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental cell research. 327, 188-194 (2011).
- Bergmann, O. Evidence for Cardiomyocyte Renewal in Humans. Science. 324, 98-102 (1126).
- Walsh, S. Cardiomyocyte cell cycle control and growth estimation. Cardiovascular Research. , 1-31 (2010).
- Spalding, K., Bhardwaj, R. D., Buchholz, B., Druid, H., Frisén, J. Retrospective birth dating of cells in humans. Cell. 122, 133-143 (2005).
- Adler, C. P., Friedburg, H., Herget, G. W., Neuburger, M., Schwalb, H. Variability of cardiomyocyte DNA content, ploidy level and nuclear number in mammalian hearts. Virchows Arch. 429, 159-164 (1996).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovascular Research. 36, 45-51 (1997).
- Adler, C. P., Friedburg, H. Myocardial DNA content. ploidy level and cell number in geriatric hearts: postmortem examinations of human myocardium in old age. Mol. Cell Cardiol. 18, 3953-39 (1986).
- Dubois, N. C. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nature. 29, 1011-1018 (2011).
- Hattori, F. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7, 61-66 (2010).
- Fransioli, J. Evolution of the c-kit-Positive Cell Response to Pathological Challenge in the Myocardium. Stem Cells. 26, 1315-1324 (2008).
- Elliott, D. A. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nature Methods. 8, 1037-1040 (2011).
- Laflamme, M. A. Evidence for Cardiomyocyte Repopulation by Extracardiac Progenitors in Transplanted Human Hearts. Circulation Research. 90, 634-640 (2002).
- Srsen, V., Fant, X., Heald, R., Rabouille, C., Merdes, A. Centrosome proteins form an insoluble perinuclear matrix during muscle cell differentiation. BMC cell biology. 10, 28 (2009).
- Spoelgen, R. A novel flow cytometry-based technique to measure adult neurogenesis in the brain. Journal of neurochemistry. 119, 165-175 (2011).
- Soonpaa, M. H., Kim, K. K., Pajak, L., Franklin, M., Field, L. J. Cardiomyocyte DNA synthesis and binucleation during murine development. The American journal of physiology. 271, H2183-H2189 (1996).
- Olivetti, G. Aging, cardiac hypertrophy and ischemic cardiomyopathy do not affect the proportion of mononucleated and multinucleated myocytes in the human heart. J Mol Cell Cardiol. 28, 1463-1477 (1996).
- Okada, S. Flow cytometric sorting of neuronal and glial nuclei from central nervous system tissue. Journal of cellular physiology. 226, 552-558 (2011).
- Matevossian, A., Akbarian, S. Neuronal Nuclei Isolation from Human Postmortem Brain Tissue. J. Vis. Exp. (20), e914 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved