Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение ядер кардиомиоцитов с Посмертные тканей
В этой статье
Резюме
Сердечная ядра изолированы с помощью осаждения и плотность immunolabeled с антителами против pericentriolar материал 1 (PCM-1) определить и сортировать ядер кардиомиоцитов с помощью проточной цитометрии.
Аннотация
Идентификация ядер кардиомиоцитов была сложной в срезах тканей большинство стратегий полагаться только на цитоплазматических белков-маркеров 1. Редкие события в кардиомиоциты, таких как пролиферации и апоптозе требуют точной идентификации сердечных миоцитов ядер для анализа клеточного обновления в гомеостаза и при патологических состояниях 2. Здесь мы предлагаем метод, чтобы изолировать ядер кардиомиоцитов из тканей после смерти путем осаждения и плотность immunolabeling с антителами против pericentriolar материала 1 (PCM-1) и последующая сортировка проточной цитометрии. Эта стратегия обеспечивает высокую пропускную способность и анализ изоляцией с преимуществом работы одинаково хорошо на свежем ткани и замороженных архивных материалов. Это позволяет изучать материалы уже собраны в биобанках. Этот метод применим и испытан в широком диапазоне видов и пригодны для нескольких ниже приложений, таких как углерод-14 знакомства 3, клетка-суCLE анализа 4, визуализация тимидина аналогов (например, BrdU и ПИН) 4, транскриптом и эпигенетических анализа.
протокол
1. Выделение сердечного ядра
- Пальто ультрацентрифуге труб (Beckman пробирок # 363664) с 10 мл 1% BSA / PBS покрытие решение. Закройте трубы, и пусть они вращаются в течение 30 минут в трубке ротатора. Удалите покрытие решение, и пусть пробирок воздух сухой (одна трубка в сердце мыши требуется для анализа одного сердца мыши, поочередно до 5 сердца мыши или 1 г ткани сердца от различных видов (например, человека) может быть обработан в одной трубке).
- Все последующие шаги должны быть выполнены на льду. Проанализируйте левого желудочка из свежих или замороженных оснастки мышь сердца с помощью скальпеля. Обратите внимание, что данный протокол оптимизирован для мыши сердце, но также может быть адаптирована к крысе или человеческое сердце. Кроме того, использовать до 1 г ткани сердца от различных видов.
- Обрежьте образца на маленькие ячейки с помощью скальпеля.
- Передача части ткани в 50 мл Сокол трубки, заполненной 15 мл лизис буфера.
- Однородныйткани сердца с Т-25 Ultra-Turrax зонд гомогенизатор (IKA) на 24 000 оборотов в минуту на 10 секунд.
- Развести гомогената с равным объемом лизис буфера до 30 мл.
- Использование стекла douncer (40 мл) для дальнейшего гомогенизации ткани и свободные ядра. Выполнять восемь ударов с большим пестиком оформления.
- Передайте сырой ядер изоляции через 100 мкм и 70 мкм нейлоновая сетка ячейка фильтр (BD Biosciences), последовательно.
- Спином вниз сырой ядер изолировать в охлажденном центрифуги (4 ° С) при 700 мкг в течение 10 мин.
- Удаляют супернатант тщательно обращения трубки и вытрите трубки с бумажным полотенцем. Будьте осторожны, чтобы не нарушить ядра гранулы.
- Растворите сырой ядер изолировать в 5 мл сахарозы буфера с помощью пипетки раствор несколько раз вверх и вниз. Добавьте еще 25 мл сахарозы буфер растворенных гранул.
- Добавить 10 мл свежеприготовленного сахарозы буфер покрытием труб ультрацентрифуге (см. п. 1.1).
- Аккуратно наложить добавляют 10 мл буфера с сахарозой ресуспендированного ядра гранулы растворяются в сахароза буфера, начиная с шага 1.9.
- Баланс пробирок перед помещением их в JS13.1 бесплатно размахивая ротора и поместить ротор в высокоскоростной центрифуге (Beckman Avanti S-25).
- Спин ядра образца при 13000 х г при 4 ° С в течение 60 мин.
- Когда спина завершено, удалить трубы тщательно от ротора и отказаться от супернатант обращения трубы и уничтожить оставшихся обломков от внутренней поверхности трубы с бумажным полотенцем.
- Растворите гранулы ядер в 1 мл буфера хранения ядра (NSB плюс буфер). Примечание: NSB также содержит 1,5 мМ спермина как ДНК-стабилизатор.
- Перейдите к шагу 2.1, иммунной ядер кардиомиоцитов.
2. Иммуноокрашивание для проточной цитометрии
- Подготовка отрицательного контроля для иммунной. Возьмите аликвоту 20 мкл из ядер образца идд 980 мкл NSB плюс буфера.
- Добавить анти-pericentriolar материала 1 антител (кролик анти-PCM-1, Атлас антитела) с ядрами образца в разведении 1:500 до immunolabel ядер кардиомиоцитов. Добавить изотипа антител в том же разведении как анти-PCM-1 антитела к отрицательным контролем, подготовленный в шаге 2.1.
- Инкубируйте отрицательного контроля и пробирку при 4 ° С в течение ночи.
- Вымойте отрицательного контроля и образцов по крайней мере, один раз с NSB плюс буфер (спин вниз трубы в охлажденном центрифуги (4 ° С) при 700 мкг в течение 10 минут. Удалить супернатант и растворить ядер гранул в 1 мл NSB плюс буфер).
- Добавить анти-кролик люминесцентные вторичными антителами (FITC или APC) для отрицательного контроля и пробирку в разведении 1:1000.
- Инкубируйте отрицательного контроля и пробирку при 4 ° С в течение 1 часа.
- Вымойте отрицательного контроля и образцов по крайней мере, один раз с NSB плюс буфер (спин вниз трубы в охлажденном центрифуги (4 ° С) при 700 мкг в течение 10 минут. Удалить супернатант и растворить ядер гранул в 1 мл NSB плюс буфер).
- Приступить к проточной цитометрии и сортировки.
3. Проточной цитометрии
- Пальто ядер коллекции труб (Falcon 15 мл) с 1% BSA / PBS решение, прежде чем начать проточной цитометрии сортировки, как описано в пункте 1.1.
- Фильтр образца и отрицательного контроля через 30 мкм фильтр клетки и загрузить сначала отрицательного контроля в проточной цитометрии (BD приток). Определение первых и вторых ворот для определения ядер и фуфайки (одного ядра), основанный на рассеяние вперед (FSC), длительность импульса вперед разброс (FS ширины импульса) и боковых рассеяния (SSC) (рис. 2, б). Добавление ДНК пятна (DRAQ5 (1:500)) в образце может помочь выявить ядер населения на начальном этапе.
- Загрузите immunolabeled образца и определить третьи ворота, чтобы изолировать ядер кардиомиоцитов (PCM-1-positve) от не-ядер кардиомиоцитов (PCM-1-отрицательный). Начать сортировку(Рис. 2, г).
Дополнительно: Для того, чтобы проанализировать содержание ядерной ДНК (плоидности) и проводить анализ клеточного цикла добавить соответствующие ДНК пятна с ядрами (например, Hoechst 33342 или DRAQ5) (рис. 2д).
- После того, как поток сортировки цитометрии, поместите ядер на льду и повторный анализ, чтобы определить чистоту сортировки (рис. 3а, б).
- Спином вниз отсортированы ядер в коллекции труб в 1500 мкг в охлажденном центрифуги в течение 15 мин.
- Растворите гранулы ядер в буфере совместим с приложением вниз по течению.
4. Представитель Результаты
Морфология ядра и целостности могут быть оценены с помощью ДНК пятна и визуализированы с помощью микроскопа (рис. 1). Успешное PCM-1 маркировка может быть оценена эпифлуоресцентной микроскопии и проточной цитометрии (рис. 1 и рис. 2в, г). PCM-1-positiве и отрицательные население должно быть хорошо отделены друг от друга (рис. 2, г). В мышиной левого желудочка около 30% всех ядер должно быть ядер кардиомиоцитов (рис. 2). Сортировка чистоты могут быть оценены путем повторного анализа отсортированы ядер (рис. 3а, б). Оба ядра популяции должны сортировки чистотой более 95%.
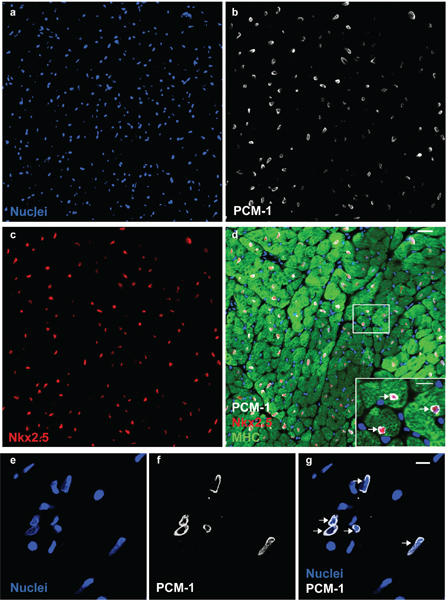
Рисунок 1. PCM-1 определяет ядер кардиомиоцитов. Сердечная ядер (а) окрашивали антителами к PCM-1 (б) и Nkx2.5 (с) во взрослом сердце мыши. (Г) PCM-1-меченых ядер кардиомиоцитов окружении цитоплазмы (тяжелой цепи миозина (MHC)) и выразить транскрипционный фактор Nkx2.5, документально точной идентификации ядер кардиомиоцитов на PCM-1 окрашивания (масштаб баров 20 мкм и 10 мкм (г, вставка)). (Е) Сердечная изолятов ядер визуализированы с ДНК пятна DRAQ5. (Е, ж) Cardiomyocyte ядер, меченных антител против PCM-1 (линейки 10 мкм). Обратите внимание, что шаблон epinuclear окрашивания PCM-1 в ядрах миоцитов в тканях раздел и в изолированных ядрах (стрелки).
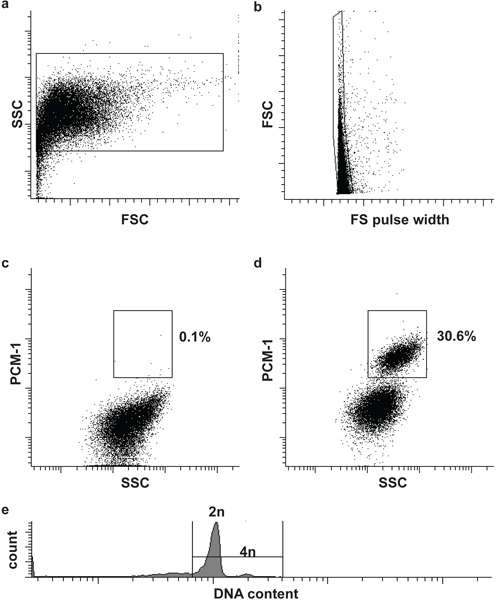
Рисунок 2. Проточной цитометрии сортировка ядер кардиомиоцитов. (А) Сердечная ядер определяются вперед рассеяния (FSC) и бокового рассеяния (SSC). (Б) вторые ворота определяет единый ядер FSC и FS длительность импульса 5. (C, D) Флуоресцентные стробирования позволяет разделение ядер кардиомиоцитов (PCM-1-положительных) и не кардиомиоцитов (PCM-1-отрицательная) ядер из ткани сердца. (Е) Мышь кардиомиоцитов в основном (> 80%) диплоидный (2п), лишь небольшое подмножество тетраплоидных (4л) 6. Обратите внимание, что человеческие кардиомиоциты содержат более высокой частоте полиплоидии ядер (> 2п) 7,8.

Рисунок 3. Чистота анализа отсортированы кардиомиоцитов и не ядер кардиомиоцитов. Повторный анализ отсортированных без кардиомиоцитов (а) и ядер кардиомиоцитов (б). Обе популяции показать сортировки чистотой более 99%.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Точная идентификация ядер кардиомиоцитов имеет решающее значение для анализа регенеративных процессов в миокарде 2,3. Обычные методы, чтобы изолировать кардиомиоцитов из свежей ткани в основном на основе ферментативного переваривания белки внеклеточного матрикса и последующе?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы выражаем свою признательность Marcelo Торо за помощь с проточной цитометрии. Работа выполнена при поддержке шведского сердца и легких фонда, Комиссии ЕС FP7 "CardioCell" Шведский исследовательский совет, AFA страхования и ALF. Б. был поддержан Deutsche Forschungsgemeinschaft.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1. Лизирующего буфера | |||
| Название реагента | |||
| 0,32 М сахарозы | |||
| 10 мМ Трис-HCl (рН = 8) | |||
| 5 мМ CaCl 2 | |||
| 5 мМ ацетат магния | |||
| 2,0 мМ ЭДТА | |||
| 0,5 мМ EGTA | |||
| 1 мМ DTT |
| 2. Сахароза буфер |
| Название реагента |
| 2,1 М сахарозы |
| 10 мМ Трис-HCl (рН = 8) |
| 5 мМ ацетат магния |
| 1 мМ DTT |
| 3. Ядер хранения буфера (NSB плюс) |
| Название реагента |
| 0,44 М сахарозы |
| 10 мМ Трис-HCl (рН = 7,2) |
| 70 мМ KCl |
| 10 мМ MgCl 2 |
| 1,5 мМ спермина |
| Реактивы и оборудование | Компания |
| Изотип кролика IgG-CHIP класса, # ab37415 | Abcam |
| Кролик анти-PCM-1 антител, # HPA023374 | Атлас Антитела |
| Осел сек. антитела, анти-кролик Alexa Fluor 488, #-21206 или эквивалент сек. флуоресцентных антител | Life Technologies |
| DRAQ5 | Biostatus |
| ячейки сита 30 мкм, 70 мкм и 100 мкм | BD Biosciences |
| Стекло douncer (40 мл) ипестик "L" | VWR (Уитон Industries Inc) |
| Т-25 Ultra-Turrax Гомогенизатор | IKA Германии |
| Диспергирование инструмент S25 N-18 G | IKA Германии |
| Бекман Avanti центрифуги | Beckman Coulter |
| Сокол трубы 15 мл и 50 мл | VWR |
| Бекман пробирок # 363664 | Beckman Coulter |
| JS13.1 свободного качания ротора | Beckman Coulter |
| Приток цитометр | Beckman Coulter |
| Труба Rotator | VWR |
Ссылки
- Ang, K. L. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American journal of physiology. Cell physiology. , 298-1603 (2010).
- Bergmann, O. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental cell research. 327, 188-194 (2011).
- Bergmann, O. Evidence for Cardiomyocyte Renewal in Humans. Science. 324, 98-102 (1126).
- Walsh, S. Cardiomyocyte cell cycle control and growth estimation. Cardiovascular Research. , 1-31 (2010).
- Spalding, K., Bhardwaj, R. D., Buchholz, B., Druid, H., Frisén, J. Retrospective birth dating of cells in humans. Cell. 122, 133-143 (2005).
- Adler, C. P., Friedburg, H., Herget, G. W., Neuburger, M., Schwalb, H. Variability of cardiomyocyte DNA content, ploidy level and nuclear number in mammalian hearts. Virchows Arch. 429, 159-164 (1996).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovascular Research. 36, 45-51 (1997).
- Adler, C. P., Friedburg, H. Myocardial DNA content. ploidy level and cell number in geriatric hearts: postmortem examinations of human myocardium in old age. Mol. Cell Cardiol. 18, 3953-39 (1986).
- Dubois, N. C. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nature. 29, 1011-1018 (2011).
- Hattori, F. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7, 61-66 (2010).
- Fransioli, J. Evolution of the c-kit-Positive Cell Response to Pathological Challenge in the Myocardium. Stem Cells. 26, 1315-1324 (2008).
- Elliott, D. A. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nature Methods. 8, 1037-1040 (2011).
- Laflamme, M. A. Evidence for Cardiomyocyte Repopulation by Extracardiac Progenitors in Transplanted Human Hearts. Circulation Research. 90, 634-640 (2002).
- Srsen, V., Fant, X., Heald, R., Rabouille, C., Merdes, A. Centrosome proteins form an insoluble perinuclear matrix during muscle cell differentiation. BMC cell biology. 10, 28(2009).
- Spoelgen, R. A novel flow cytometry-based technique to measure adult neurogenesis in the brain. Journal of neurochemistry. 119, 165-175 (2011).
- Soonpaa, M. H., Kim, K. K., Pajak, L., Franklin, M., Field, L. J. Cardiomyocyte DNA synthesis and binucleation during murine development. The American journal of physiology. 271, H2183-H2189 (1996).
- Olivetti, G. Aging, cardiac hypertrophy and ischemic cardiomyopathy do not affect the proportion of mononucleated and multinucleated myocytes in the human heart. J Mol Cell Cardiol. 28, 1463-1477 (1996).
- Okada, S. Flow cytometric sorting of neuronal and glial nuclei from central nervous system tissue. Journal of cellular physiology. 226, 552-558 (2011).
- Matevossian, A., Akbarian, S. Neuronal Nuclei Isolation from Human Postmortem Brain Tissue. J. Vis. Exp. (20), e914(2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены