Method Article
真菌病原体の食作用の生細胞ビデオ顕微鏡
要約
我々は、のライブセルビデオ顕微鏡のための方法を説明しますカンジダ·アルビカンス貪食。これらのメソッドは、マクロファージ遊走、認識、貪食とファゴソーム成熟のステージ固有の分析を可能にし、食作用の新たな側面を明らかにする。
要約
真菌病原体、そしてより一般的に微生物の貪食クリアランスは、4つの段階から成ると考えられるかもしれません:病原体が配置されているサイトへの貪食細胞の(i)の移行、パターンを介して病原体関連分子パターン(PAMP)の(ii)の認識認識受容体(PRRS);成熟ファゴソームと摂取した粒子の消化中に飲み込まれた細胞の(iii)の食細胞の細胞膜に結合した微生物の貪食、及び(iv)の処理。その全体を貪食を評価する研究は、1、2、3、4、5、有益ではありますが、通常は差動で影響を受ける可能性があり、移行、貪食とファゴソーム成熟へとプロセスを分解しないように制限されています。さらに、このような研究では、単一のイベントとしてではなく、連続的な動的プロセスとして取り込みを評価します。最近我々は、高度なライブセルイメージング技術を開発している、との両方の遺伝的機能解析とこれらを組み合わせている病原体と宿主細胞は、自然免疫細胞の機能と真菌病原性の分析のための学際的なプラットフォームを作成することができます。これらの研究では、唯一のより一般的には人間の食細胞および真菌病原体や感染性微生物の間の分子と細胞の相互作用を体系的に時間的な分析を用いて観察することができた貪食の小説の側面を明らかにした。例えば、私たちは、次の内容を定義し始めている:(a)細胞表面の成分が認識、貪食および真菌細胞1、6、7、8の殺害の過程の各段階で必要なこと、(b)どのように表面形状マクロファージの取り込みおよび酵母と菌糸細胞7の殺害の効率に影響を与えると、(c)は、貪食細胞周期およびマクロファージ9,10の行動の変化につながる方法。
単一の時点のスナップショットとは対照的に、ライブセルビデオ顕微鏡は、共として研究する宿主細胞や病原体の様々な可能細胞遊走、レプリケーションや小胞輸送などのダイナミックなプロセスの広範囲に空間的、時間的な情報を提供する長い期間にわたってntinuous配列。ここでは、ホストと真菌細胞を準備するために、ビデオ顕微鏡実験を実施する方法を詳細に説明します。これらのメソッドは、他の食細胞および微生物による将来の研究のため、ユーザガイドを提供することができます。
プロトコル
1℃、 albicansの成長と条件
- アミノ酸、1 mlの1 M NaOHを、10ミリリットルの1%(w / v)アデニン硫酸塩塩と20グラムテクニカル寒天(以前は11で詳述)を使用せずに6.9グラム酵母窒素塩基を加えることにより、SC-Ura寒天プレートを準備します。蒸留H 2 Oで900ミリリットルにボリュームを作るオートクレーブ、寒天を冷ましますが、固化した後、無菌条件下で50ミリリットル滅菌40%D-グルコースおよび50 mlの滅菌4パーセントのSC-浦ドロップアウトを追加するのに十分ではない。ミックス、ペトリ皿に注ぎ、冷却して凝固寒天プレートにしておきます。ストア寒天プレート5℃で使用時まで。
- ストリークC.カンジダ血清型菌株CAI4 + CIp10グリセロールストックから-80℃で保存し、SC-Ura寒天プレート上に。
- 30℃でプレートをインキュベート℃〜5℃までコロニーフォーム℃で保存
- 文化シングルC.カンジダは、5mlのSC-URA培地(1.1のようにレシピが、技術的な寒天なし)でコロニーと30℃で一晩インキュベート固定相Cを生成するために℃、200rpmでカンジダ 。
2℃ でフルオレセインイソチオシアネート(FITC)を用いて染色アルビカンス
- 10μlのCを追加990μlのPBSにアルビカンス一晩培養した培養液(pH7.4)および血球計を用いて細胞数を実行します。
- Cの可視化を支援するために食作用アッセイ時アルビカンスは 、1×10 8℃を染色暗所で室温で10分間、0.05M炭酸塩-重炭酸塩緩衝液(pH9.6)に1 mg / mlのFITCを使用アルビカンス 。
- 未結合のFITCを削除するには、Cを洗う1ミリリットル1×PBSで5分間3000×gで遠心分離で菌は 、1ミリリットル1×PBS中で上清とペレットを再懸濁しを削除します。 3回繰り返します。
- 1でペレットを再懸濁し×1×PBS中10 6細胞/μl。
3。 J774.1マウスマクロファージ細胞株の作製
- 75cm 2の組織中のマクロファージJ774.1を維持DMEM培地で培養フラスコは、10%(v / v)ウシ胎児血清(FCS)、37℃で200 U / mlペニシリン/ストレプトマイシン、2mM L-グルタミン°5%CO 2を使用したCを補充。初代マクロファージの調製は、詳細図12、図13の他の部分で説明されています。
- 組織培養フラスコからJ774.1細胞をこすり取ると50 mlファルコンチューブに移す。細胞ペレットを得るために5分間600×gで遠心分離します。
- 10ミリリットルの予め温めたDMEM培地で上清とペレットを再懸濁しを削除します。 35ミリメートルガラスベースのイメージング皿に2ミリリットルDMEM培地で血球とプレートに1×10 6 J774.1マクロファージを用いて細胞をカウントする。 37℃で一晩インキュベート℃、5%CO 2で 。
- 事前のイメージングに、2ミリリットルプリ温め補わCO 2の独立した培地(10%(v / v)ウシ胎児血清(FCS)、200 U / mlペニシリン/ストレプトマイシンおよび2mMのL-グルタミンを含む)を添加したDMEM培地を交換1μMのLysoTrackerレッドDND-99を含む。
4。ライブセルビデオ顕微鏡貪食アッセイ
- 顕微鏡の選択は、局所的に利用可能なものにかかっているが、顕微鏡のセットアップが反転段、選ばれた汚れのために37℃、励起/発光フィルタ(FITCおよびTRITC)に加熱環境室をインクルードする必要があります。
- 実験に先立って顕微鏡ヒーターの電源をオンにして、37まで温め環境制御室のための十分な時間を認め℃に安定させるためにチャンバ温度に要する時間は異なる顕微鏡のセットアップごとに異なります。
- 顕微鏡とコンピューターの電源をオンにして、イメージングソフトウェアをロードします。顕微鏡ステージ上の撮像皿をマウントし、マクロファージJ774.1を見つけるためにピントを合わせます。透過光と露光時間の割合を調整することにより、TRITCやDIC画像の外観を最適化します。
- イメージング皿を取り外し、3×10 6のFITC-汚さCを追加トンへ·アルビカンス彼は料理。時間を記録しておくことでカンジダは、皿に追加されます。ステージに皿を返却し、必要に応じて、FITC画像の外観を最適化します。必要に応じて、ポイントリストを設定します。
- すべての点がフォーカスされているとチャンネルが最適化されているときに撮影を開始する。 FITC、TRITCやDIC画像で6時間分ごとにキャプチャします。
結果
ここでは、Cの代表的な結果を示す6時間ライブセルビデオ顕微鏡実験中のマウスマクロファージ細胞株J774.1によるカンジダの取り込み。 図1は、Cの食作用を示す、代表的な生細胞ビデオ顕微鏡ムービーですネズミJ774.1マクロファージによるカンジダ 。ライブセルビデオ顕微鏡は、C.の内在化を可能にカンジダカンジダ外部を染色する必要がなく、可視化する。しかし、これらの実験中、C.カンジダは、マクロファージファゴソームの酸性化の間に急冷されるpH感受性色素FITC(緑)を使用して染色し、 カンジダが ( 図1)は、内在化されたことの確認を容易にしました。摂取した後の更なる援助の可視化へカンジダ、マクロファージは赤色蛍光色素LysoTracker赤DND-99、シミ酸性コンパートメントおよびファゴソーム成熟の非特異的マーカーとして機能を用いて染色した。図2は、ライブセルビデオ顕微鏡実験から静止画像であり、Cの数の変化を示してカンジダは、個々 の J774.1マクロファージによって摂取した。この実験では、J774.1マクロファージの82%が少なくとも1℃を巻き込ん6時間貪食アッセイの終了時アルビカンス細胞。 図3は 、内在化Cの数のマクロファージ当たりアルビカンス細胞が報告されている。 Cの平均数マクロファージあたり取り上げアルビカンスは 3.4であるが、興味深いことにマクロファージが16真菌細胞まで取り込むことができます。 図4は Cを貪食マクロファージを示す代表的なライブセルビデオ顕微鏡実験から静止画像の連続ですアルビカンス細胞 、マクロファージ、最終的にマクロファージ溶解による菌糸の成長図4は、ビデオ顕微鏡では、標的細胞の貪食、次のイベントの分析を可能にする、 すなわちデータが気に生成することができる示しC.によるマクロファージのlling摂取された標的細胞の数や形態形成に関連してカンジダ菌糸方法、およびマクロファージの殺害は、リアルタイムで調べることができるファゴソーム成熟に関する。
図1℃の貪食作用を示すライブセルビデオ顕微鏡映画ネズミJ774.1マクロファージによるカンジダ 。マクロファージは、赤色蛍光色素LysoTracker赤DND-99、 および C を用いて染色されているカンジダは、FITC(緑色)を用いて染色されています。マクロファージおよびC.カンジダは 、2独立培地を完全COで37℃で6時間の期間の間共培養した。画像は6時間1分間隔で撮影した。マクロファージはCで細胞間の接触を確立見ることができます次に Cの取り込みが続いているアルビカンス、マクロファージのファゴソームにカンジダ 。矢印は Cを指すJ774.1マクロファージによる貪食前にカンジダ 。このビデオでは、またFITC蛍光がquencであることを示していますCのHED以下呑食カンジダ 。スケールバーは、10μmである。 ムービーを見るにはここをクリック 。
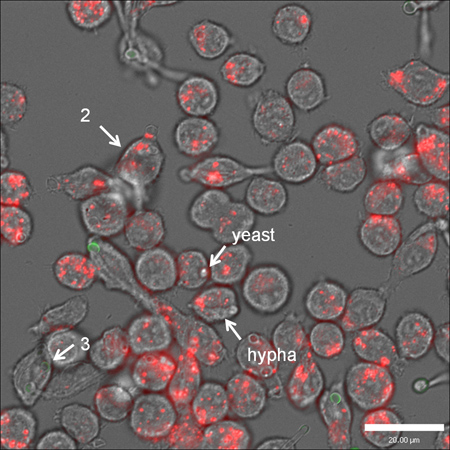
個々のマクロファージに飲み込まC.albicans数の図2代表的なライブセルビデオ顕微鏡静止画像表示バリエーション。マクロファージ(ステンド使用LysoTracker赤DND-99)は、FITC で染色されたと共培養したカンジダ·アルビカンス (緑)。 Cの数にばらつきがあるカンジダは (矢印の隣にある数字は、C. albicansの数が飲み込ま示します)のみ込ま、およびC でalbicansの形態( すなわち酵母の詩菌糸)。スケールバーは20μm。
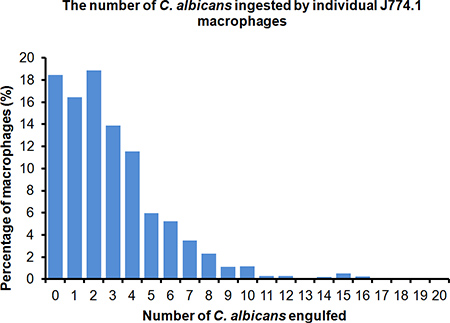
図3℃の数を示すグラフalbicansは 6時間貪食アッセイの終了時にマウスマクロファージJ774.1あたり摂取。データは、2つの独立した実験を表しています。 100マクロファージの合計は600個のマクロファージの合計を与えて、それぞれの実験からの3つのフィールドから数えた。
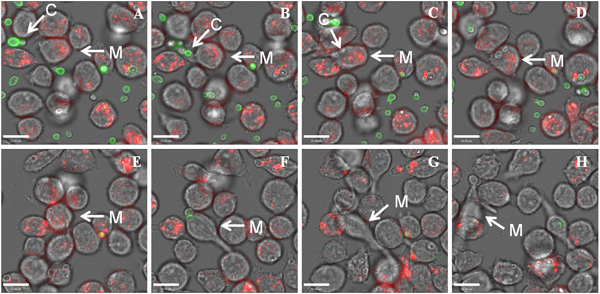
図4:代表的なライブセルビデオ顕微鏡マクロファージを示す実験(M)とCからの一連のイメージ認識(A、B)との間に事前アルビカンス (C)、および取り込み(C、D)の最中や後に。C. albicansの菌糸はマクロファージ溶解(G)になる可能性がマクロファージ(E、F)、内に成長を続けている。他のマクロファージは破裂してリリースされたCを摂取しようとする部位に補充されるカンジダ·アルビカンス (H)。マクロファージは、赤色蛍光色素を用いて染色LysoTracアールケール赤DND-99、 および C カンジダは、FITC(緑色)を用いて染色されています。 FITCの染色が C以下のクエンチされることに注意してくださいJ774.1マクロファージ(C)によりカンジダ取り込み。スケールバーは、10μmである。
ディスカッション
ここで、マクロファージの食作用を研究するための生細胞ビデオ顕微鏡を使用するための方法が記載されている。ビデオ顕微鏡は、分析のための情報の複数の追加の層を提供しています。つの基本的な利点は、取り込みデータは6時間の観察期間を通していずれの時点(1つの実験から)を生成することができるということです。さらに重要なことは、記載された方法は、食作用の個々の段階の差分析を可能にします。我々は、例えば、示されていることで全体の取り込みの変化マクロファージ細胞株および初代マクロファージによるアルビのグリコシル化と形態形成変異体は、細胞-細胞接触一度標的細胞や貪食率に向かってマクロファージ遊走の変化7を確立されているいずれかの結果であることができます。
これらの実験を行う際に避けるために落とし穴がいくつかあります。まず最初に、それは実験proceを通して安定した環境条件を確保することが非常に重要であるdure。これは最高の実験を開始する前に、実験条件を数時間に設定されている環境室で達成される。ビデオの品質は関係なく、自動的にこのようにマニュアルフォーカス補正の必要性を排除し、機械的または熱変化のサンプルz位置を維持するために赤外線レーザーを使用し洗練されたモジュールに強く依存しています。
実験の拡張された性質を考えると、それは低露光時間を容易にする高度に蛍光マーカーを採用することで最小限に抑えることができ、レーザ光曝露と関連する光退色と光電効果を制限することが重要です。ここで説明されたFITC染色プロトコルは、迅速かつ信頼性の高いです。 FITCであるように非常に明るく、安定した汚れは、低露光時間が必要であり、これは、拡張タイムラプスムービーのFITC最適ですされています。しかし、我々は日常的にCalcofluorホワイトとPKH染料と同様のタグ付き生物を含む、様々なターゲットの汚れのさまざまな使用。
私たちの出版物のほとんどは、広視野顕微鏡を用いて実施されていますが、露出がさらに回転するディスク共焦点顕微鏡を用いて、我々の手の中に、これは時間経過の3Dビデオ顕微鏡に不可欠であることで最小限に抑えることができます。
この研究中に、画像が6時間貪食アッセイで1分間隔で撮影した。画像間の間隔は、調査中のプロセスに応じて調整することができる。そのような小胞輸送など迅速なプロセスを調査するときにたとえば、間隔を小さくすることができる。最小の時間間隔は、顕微鏡やカメラの仕様によって制限されます。タイミングを調整するときに心に留めて、いくつかの考慮事項があります。まず、スナップショットの間隔を小さくすると、より少ない点が結像させることができると、ファイルサイズが大幅に増加されることを意味します。それどころか、あまりにも多くの画像の間隔を長くすると、ムービーが連続性を失うことになります。
このアプローチを適用することができる原理的には他の病原体と宿主細胞を瀕死の取り込みを調べた。例えば、我々は最近、シアロアドヘシン欠損マウスから骨髄由来マクロファージを大幅にシアリルカンピロバクター 8の付着及び貪食減少呈することが示されている。画像解析は、標的細胞の大きさの減少とともにますます困難になるしかし、目標サイズは、実現可能性のための重要な決定要因である。洗練された画像解析ソフトウェアは、迅速なビデオ顕微鏡分析のために不可欠であり、これは7個の細胞と全体の細胞集団の移行を研究するためのアルゴリズムの生成を容易にするための適切なバイオインフォマティクスのサポートと組み合わせなければならない。移行および個々のマクロファージC.albicans相互作用の分単位の分析のための洗練された画像解析ソフトウェアと組み合わせて、生細胞ビデオ顕微鏡、Cの複雑さにユニークな洞察を提供していますmacrophagによってアルビカンス貪食ES。他の病原体や貪食細胞(樹状細胞、好中球)を勉強すると、より詳細に、またはそのような上皮および内皮細胞層など、より生理的な表面上の画像、細胞間相互作用に3Dビデオ顕微鏡を開発するために、これらのメソッドを展開する巨大な可能性があります。この手法は、宿主 - 病原体相互作用の研究のツールの次の世代の一部であり、ダイナミックなプロセスの広範囲の詳細な空間的および時間的な情報を生成するのに役立ちます。
開示事項
著者らは、開示することは何もない。 NGはギリアド·サイエンシズによる基礎研究のための無制限の助成金を受けています。 LEは、早期の薬剤開発におけるGSKのためのコンサルタントとして働いています。
謝辞
LPEはスコットランドのシニア·クリニカル·フェロー兼チーフサイエンティストオフィス(SCD/03)の支援を認めている。この作品は、LPE(089930)にウェルカムトラストプロジェクト無償資金によって賄われていた。 NARGはウェルカムトラストプログラムグラント(080088)と機器グラント(075470)(DeltaVision用)によって、およびFP7-2007から2013グラント(健康-F2-2010から260338-ALLFUN)によって賄われていた。我々は、有用サポートやアドバイスのために、特定のケヴィン·マッケンジーでは、アバディーンイメージング施設の大学に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| アミノ酸を含まない酵母窒素塩基 | Formedium | CYN0402 | |
| NaOHを | シグマ | S5881-500G | |
| アデニン硫酸塩塩 | シグマ | A3159-25G | |
| 寒天技術(第3号) | オキソイド | LP0013 | |
| D-グルコース | シグマ | G7021-1KG | |
| SC-浦ドロップアウト | Formedium | DSCK102 | |
| FITC | シグマ | F7250-1G | |
| 炭酸ナトリウム | BDH | 301215M | |
| 重炭酸ナトリウム | BDH | 102475W | |
| PBS | ギブコ | 18912-014 | |
| DMEM | ロンザ | BE12-614F | |
| FCS | ライフテクノロジーズ | 10106169 | |
| ペニシリン/ストレプトマイシン | PAA | P11-010 | |
| L-グルタミン酸 | ロンザ | BE17-605E | |
| LysoTrackerレッドDND-99 | インビトロジェン | L7528 | |
| 35ミリメートルのガラス皿 | PAA | PAA12305160X |
参考文献
- McKenzie, C. G. J., et al. Contribution of Candida albicans cell wall components to recognition by and escape from murine macrophages. Infect. Immun. 78, 1650-1658 (2010).
- Mora-Montes, H. M., et al. Recognition and blocking of innate immunity cells by Candida albicans chitin. Infect. Immun. 79, 1961-1970 (2011).
- Keppler-Ross, S., et al. Recognition of yeast by murine macrophages requires mannan but not glucan. Eukaryot. Cell. 9, 1776-1787 (2010).
- Vijayan, D., et al. Mincle polarizes human monocyte and neutrophil responses to Candida albicans. Immunol. Cell Biol. , (2012).
- Seider, K., et al. The facultative intracellular pathogen Candida glabrata subverts macrophage cytokine production and phagolysosome maturation. J. Immunol. 187, 3072-3086 (2011).
- Sheth, C., et al. Glycosylation status of the C. albicans cell wall affects the efficiency of neutrophil phagocytosis and killing but not cytokine signalling. Med. Mycol. (5), 513-524 (2011).
- Lewis, L. E. Stage specific assessment of Candida albicans phagocytosis by macrophages identifies cell wall composition and morphogenesis as key determinants. PLoS Pathog. 8 (3), e1002578 (2012).
- Klaas, M., et al. Sialoadhesin Promotes Rapid Proinflammatory and Type I Interferon Responses to a Sialylated Pathogen, Campylobacter jejuni. J. Immunol. , (2012).
- Lewis, L. E., et al. Candida albicans infection inhibits macrophage cell division and proliferation. Fungal Genet. Biol. , (2012).
- Bain, J. M., et al. Non-lytic expulsion/exocytosis of Candida albicans from macrophages. Fungal Genet. Biol. , (2012).
- Mora-Montes, H., et al. Interactions between macrophages and cell wall oligosaccharides of Candida albicans. Methods Mol. Biol. 845, 247-260 (2012).
- McPhillips, K., et al. Assessment of apoptotic cell phagocytosis by macrophages. Methods Mol. Biol. 559, 247-256 (2009).
- Erwig, L. -. P., et al. Differential regulation of phagosome maturation in macrophages and dendritic cells mediated by Rho GTPases and ezrin-radixin-moesin (ERM) proteins. Proc. Natl. Acad. Sci. U.S.A. 103 (34), 12825-12830 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved