Method Article
エレクトロ作成のための迅速なプロトコル
要約
エレクトロポレーションは、変換と呼ばれるプロセスで、細菌にDNAを導入するために一般的に用いられている方法である。エレクトロコンピテント細胞の調製のための伝統的なプロトコルは、時間がかかり、労働集約的である。この記事では、現在、いくつかの研究室で採用エレクトロコンピテント細胞を調製するための代替、迅速かつ効率的な方法を説明します。
要約
エレクトロポレーションは、迅速かつ効率的に広範囲の細胞に外来DNAを導入するために広く用いられる方法となっている。 Electrotransformationは自然に有能でない原核生物にDNAを導入するための選択の方法となっている。エレクトロポレーションは、精製されたDNAとコンピテントバクテリアに加えて、市販の遺伝子パルスコントローラとキュベットを必要とする、迅速で効率的かつ合理化された形質転換法である。パルスするステップとは対照的に、エレクトロコンピテント細胞の調製は時間がかかり、滅菌、冷水の容積を減少させる遠心分離および洗浄の反復ラウンドを含む労働集約的、または中間対数期まで増殖させた培養物の大量の非イオン性緩衝液である成長。時間と労力は、商業的供給源からエレクトロセルを購入して保存することができますが、選択は、一般的にEを採用するように制限されています大腸菌実験室株。我々はここに急速に普及しているとエレクトロE.を調製するための効率的な方法しばらくの細菌学研究所によって使用されている大腸菌は、V.に適合させることができるコレラ菌および他の原核生物。我々は独自の技術を開発するための信用に誰を把握することはできませんが、我々はここに科学界が利用できるようにしている。
概要
1980年代初期1年の'以来、エレクトロポレーションは、一体的な分子生物学的手法、環状または直鎖状の核酸と/トランスフェ生細胞を形質転換するために採用可能性が高い単一の最も一般的な方法となっている。元々の真核細胞1のトランスフェクションのために開発、エレクトロポレーションは、その後、E.の形質転換のために適応されましたコリ 2、3。細菌学では、エレクトロポレーションは、実験室での標準となっていると、グラム陰性緑膿菌 4、 サルモネラ菌 5、 ビブリオ6、Serratiae、及び赤痢菌属細菌 7を含む広範囲の細菌を変換するように変更されました。グラム陽性クロストリジウム 8、 桿菌 9、 乳酸菌 10そして腸球菌 11。さらにいくつかの古細菌はメタノコッカスを含む、エレクトロポレーションによる形質転換の影響を受けやすいことが証明されている 12とスルホロブス種 13。総合的なレビューについてはAuneとAachmann 14を参照してください。エレクトロポレーションによる形質転換の効率は、化学的能力または熱ショック2よりも伝えられる10〜20倍高い。しかし、多くの1980年代15にダグラスハナハンによって最適化などの化学的能力に関する細菌を準備するように、細胞はまた、エレクトロとなるように調製しなければならない。
エレクトロポレーションは、エレクトロ細菌、精製されたDNA、電気インパルスを供給するパルス制御モジュールと、電極として機能する小型の使い捨てキュベットを収容するチャンバを必要とする、細菌形質転換の迅速かつ有効な手段である。簡単に説明すると、冷たい、コンピテント細菌を栄養寒天(プラスミドDNAと混合し、キュベット中の高電圧パルスを施し、増殖培地中に再懸濁させ、30〜45分間30〜37℃でインキュベートした後、半固形培地上にプレーティングするAPPR付きプレート)選択的抗生物質をopriate。
パルスするステップ、 エレクトロコンピの調製とは対照的に大腸菌は、伝統的に大量に行われるマルチパート手順のままである。簡潔には、細菌の一晩培養物を、1 Lルリアブロス(LB)100 mlの三角フラスコに接種し増殖の中期対数期(1.0の600)まで増殖させ、そして滅菌非シリアルでの洗浄に供される4℃でのボリュームを減少させるのにイオン性緩衝液または蒸留水(のddH 2 O)細心の注意は、手順全体を通して冷たい細胞を維持し、汚染を防止するために注意する必要があります。これはオートクレーブし、遠心分離バケットと非イオン性の緩衝液または蒸留H 2 Oを使用、オービタルシェーカーインキュベーター、大容量、高速冷却遠心機とローターのセットが必要です。細菌は、最終的に10%グリセロールを補充した少量の緩衝液に再懸濁し、〜40μlの容量、WHのに等分されているICHは、使用するまで-80℃で保存する。低温保存は、多くの場合、経時的生存率の損失による減少形質転換効率をもたらす。
エレクトロ細菌細胞は、様々な商業的供給源からではなく、唯一の(多くの場合、組換え欠損)Eの限られた数のためにも利用できます大腸菌株は、一般的に、プラスミドの広い範囲を伝播するための宿主として用いられる。その結果、研究者は、形質転換のために、自分の株/変異体を準備するために、社内の方法に依存しています。
エレクトロコンピの製造のための代替、迅速かつ効率的なプロトコル大腸菌は、今しばらくの間、いくつかの分子細菌学研究室で使用されてきたし、我々の場合Vに、追加のグラム陰性細菌に拡張されましたコレラ菌 。それは時間をかけて、他の研究者によって最適化されているように、プロトコルの発信者は特定できない。ここで紹介する方法は、我々の研究所で使用されているほぼ二十年のためのIES、そしてそれは我々の仲間と、この便利なプロトコルを共有することが、当社の目標です。
プロトコル
1。細菌培養、ツール、および試薬の調製(1日目、午後)
- 午後遅くに1-5 mlの滅菌でオートクレーブLBブロス細菌( 大腸菌やコレラ菌 )の少量で(例えば、100×13ミリメートル)ホウケイ酸ガラス試験管に接種。
- 、37°Cの温度(暖かい部屋またはインキュベーター)に収容ローラードラムに接種し、試験管を設定し、高速でローラードラムをオンにし、O / Nでインキュベートする。
- ガラスが軟化するまで、ブンゼンバーナーの炎で棒の中央を加熱することでガラス棒から「ホッケースティック」の形をした細胞スプレッダーを準備して、135°の角度にピンセットやペンチで軽く曲げを演出。もう一度端部と第1の屈曲の中間点にある棒を加熱し、(第1屈曲部と反対方向に)内側に45°の角度でそれを曲げる。
- 抗生物質を含まないLB寒天を準備し、物の製造にペトリ皿に注ぐelectrocompetenceプロトコル、および(エレクトロポレーションするベクター上耐性マーカーに応じて)適切な抗生物質を含むLB寒天プレート、4℃で保存
- Vのための2のCaCl 2溶液を滅菌フィルターを準備しますコレラ菌 、またはEオートクレーブのddH 2 O 4℃での大腸菌 、およびストア
2。エレクトロ細菌の増殖(2日目、朝)
- 各LB寒天プレート上に、O / N細菌培養液100μlをお届け、凍結したグリセロールストックも利用し、直接プレートに送達することができる。
- 100パーセントエタノールにホッケースティック型セルスプレッダーを浸し、簡単に排出し、使用前と普及、それを殺菌する残りのエタノールを燃焼。滅菌ガラスセルスプレッダーが(ブレーク)寒天表面を破壊するかわからないことを均等に100μlのO / N細菌培養を広げた。
- 細菌増殖の薄い芝生があることまでは4〜6時間、37℃でプレートをインキュベートするか、に区別しています。細胞が活発に増殖している場合に最も有能である。
3。エレクトロ細菌細胞の調製(2日目午後)
- 寒天の表面に穴を開けたり、壊れないように注意し、無菌接種ループで細菌を収穫します。一つの直径2mm菌体は単一の変換のために十分である。典型的には、これは、接種ループ2回または3回の薄い芝生の表面をこする必要とする。 (通常は4〜6の間)は、いくつかのサンプルは、同じプレートから収集することができる。
- 1ミリリットルの氷冷2のCaCl 2( コレラ菌の場合)または無菌のddH 2 O( 大腸菌用)で菌体を再懸濁し、全く塊が見えなくなるまでよく混ぜ、氷上に保つ。
- 遠心機4℃に設定し、冷蔵微量遠心中、または4℃に設定し、低温室に保存され微量での5000×gで5分間、各細菌懸濁液
- 上清を捨て、resusp氷のように冷たい2のCaCl 2又は滅菌蒸留H 2 Oを、同じボリューム内の細菌ペレットを終了し、合計3回の洗浄のためにさらに2回の前に行ったように遠心分離工程を繰り返します。
- 上清を除き、再懸濁した後、40μlの氷の中に徹底的に細菌ペレットを緩め冷2のCaCl 2又は滅菌蒸留H 2 Oを、氷上に保つ。
4。エレクトロ細菌の形質転換(2日目午後)
- 40μlの細菌懸濁液にプラスミドDNA(最大1μlの水またはTris-EDTA緩衝液中)を1μgまで追加し、予備冷却、無菌0.2cmのギャップキュベットにこの混合物を移す。それは次のステップでパルスのアーク放電に貢献するようにDNA試料中の塩濃度は、低いAでなければなりません。
- パルス制御モジュールのエレクトロポレーションチャンバーにキュベットを挿入し、1.8 kVの、25μFでエレクトロポレーション。時定数は、約5.0ミリ秒であるべきであり、アーク放電は発生しないはずである。
- すぐに1ミリリットルLBブロス中に再懸濁することにより細胞懸濁液を回収し、予めオートクレーブしホウケイ酸ガラス試験管に移す。
- 細胞を、抗生物質選択なしで37℃で30分間(ローラードラム内)曝気成長条件下でインキュベートすることによって回復させる。
- 適切な選択剤(抗生物質)の存在下で、予め用意されたLB寒天プレート上に細菌をプレートし、37℃のCO / Nでインキュベート細菌を精製したベクター(0.1〜1μgのスーパーコイルプラスミド)を高濃度で形質転換された場合、LB寒天プレートのエッジに象限ストリーク法を用いて単離されたコロニーのための無菌接種ループストリークと細菌培養液10μlをお届け。連結混合物を転換した場合は、それぞれの寒天プレート上に細菌培養液100μlを提供し、均等に滅菌したガラスセルスプレッダーでそれを広げる。
Aは時定数があること(短い場合低3.5ミリ秒)、またはパルス化は、次いで、DNA試料を再沈殿させ、乾燥前に塩を除去するために二回、70%EtOHで洗浄し、TE緩衝液に再懸濁し、アーク放電をもたらす。
結果
我々はEで変換のセットを行った大腸菌およびVもともとダワーらによって記載され(従来)方式の適応と私たちの迅速な方法論の形質転換効率を比較するためのコレラ菌。エレクトロ菌の調製のための2。テントセルの伝統的な準備を行うために、2 L-三角フラスコに500ミリリットルのLBを大腸菌 500μlの一晩培養物を接種した大腸菌 DH5αまたはVコレラ菌 O395、オービタルシェーカー(37℃、215回転)中でインキュベートし、0.5〜1.0の間のOD 600で収穫。フラスコを氷で冷却し、培養物を4℃で10分間、4,000×gで予め冷却ローター中で遠心分離細胞ペレットを完全にV. 500 mlの氷冷2のCaCl 2に再懸濁したコレラ菌および大腸菌のためのddH 2 O 大腸菌 、同じ条件下で再度遠心分離した。再懸濁ANのその後のラウンドd個の遠心分離を確認し、培養を4℃で冷却したままで作り200と100mlの体積の体積を減少させることで行った最後に10mlの体積の再懸濁および遠心分離を10%グリセロールを用いて行った。最終ペレットを2mlの10%グリセロールに再懸濁し、40μlのアリコートを-80℃で凍結せず、エレクトロポレーションの前に一週間よりも、もはや保存した。
パルス設定とキュベットサイズを含むエレクトロポレーション条件に関係なく、有能な細胞の調製方法の全てのエレクトロポレーションの両方の細菌種のために同一であった。唯一の違いは、我々は、E.のために寒さをddH 2 Oに回の洗浄を行ったということでした大腸菌およびV冷2のCaCl 2細菌の菌 。結果を表1に示すが、同一エレクトロポレーションにより形質転換されたが、迅速なプロトコルで、または従来の方法のいずれかでコンピテント。我々は共通のようにひずみO395やDH5αを採用VのLY使用、代表株コレラ菌および大腸菌大腸菌それぞれ、同様の結果が、同じ種の他の株を用いて得られた(すべての単一の株が試験されているいないが)、おそらく他のグラム陰性細菌に、おそらく越えて適合させることができる。
等しい細胞数がパルス各バッチ中に存在したことを保証するため、迅速な方法を利用して生成されたエレクトロ細菌は、回収時にプールし混合し、均一に懸濁したまま、及びダウンロードがエレクトロポレーションの前に40μlの容量ずつに分取した。伝統的な方法を利用して生成されたエレクトロ細菌は前40μlのアリコートで凍結と同様に処理した。パルスの供給に続いて、細菌エレクトロポレーション40μLの各バッチは、400μLのLBに懸濁し、連続的に1:10に希釈した。各希釈液100マイクロリットルを、100μg/ mlのアンピシリンの存在下でLB寒天上にプレーティングし、無菌のガラスセルスプレッダーを用いて広げたそして37℃で一晩インキュベートした。それぞれの形質転換に用いた細菌の総数を定量するために、それぞれの調製されたバッチのエレクトロ細菌の40μlの体積を連続希釈し、並列で同じ抗生物質を含まないLB寒天上にプレーティングした。各バッチから平等に扱わ細菌の1つのアリコートをシリアルの配信によって失われた細胞の数を推定するために抗生物質を含まないLB寒天上に希釈し、プレートし、1μlのトリス-EDTA(TE)緩衝液が、DNAなし(モックトランスフォーメーション)をエレクトロポレーションした電気パルス。最後に、実験1つの付加的な変化は、エレクトロポレーション後のが、先行LB-寒天上にプレーティング、1 mlのLB中、37℃で30分間のインキュベーションは、形質転換細胞の回復に影響を与えるかどうかを決定するために行った。コロニー形成単位(CFU)は、次の日に計数した。
この実験のために我々をpUC18、一般的な実験用プラスミドを採用し、テント細菌のバッチは、以下のものからなるpproximately細胞について10 8 CFUを、伝統的な方法を利用して調製し、細胞について10 7 CFUを、迅速なプロトコルを利用して作成した。 (DNAなしで)単独でエレクトロポレーションにかかわらず、エレクトロコンピテント細胞を調製するために使用される方法の10〜100倍にすることによって、生存CFUを減少させた。 表1に示すように、形質転換体の収量は、E.のための3回の反復実験(カッコ内の標準偏差)でのDNAの範囲の10 6 -10 7 CFUを/μgの範囲内であった大腸菌 (DH5α)およびVコレラ菌 (O395)にそれぞれエレクトロ細胞調製のための伝統的な、より長いメソッドを使って。形質転換体の収率は10 5〜10 6 CFUの/ Eの3つの繰り返し実験(カッコ内標準偏差)でのDNAμgのに減少し10倍に登場大腸菌およびV迅速な方法を用いて、それぞれコレラ菌 。この理由のため、我々は、形質転換のCFUを分割することにより形質転換された細菌の割合を決定CFUの数によってテントセルの他の点では同一バッチから(プラスミドなし) "モック変換」から回収。形質転換された細菌の割合にかかわらず( 表1の括弧内の数字)の調製及び形質転換種の方法の一つのログ(2.5から9.4パーセント)以内であった。これらの結果は、迅速な方法の効率はコンピテントセルを調製し、 コレラ菌、大腸菌の代表的な株は迅速な手順にも等しく適していること、従来のより長い手順と同等であることを示唆している。
我々は、β-ラクタマーゼカセットを保有するプラスミドをpUC18等のために、LBブロス中で30分間の回復時間に影響されない、その形質転換効率を発見した。形質転換体の同じ数を直接、エレクトロポレーション後、またはそれらは30〜45分間の回復時間を許されたかどうかの細胞を、アンピシリンの存在下でLB寒天培地にプレーティングしたか否かを回収した37℃でLBブロス中でプレーする前に。アンピシリン耐性の非選択的な条件の下で成長を必要としないことを我々の調査結果は、β-ラクタマーゼの発現は形質転換の際に十分に高速で起こることを示唆している。しかしながら、電気ショックからの回復に寄与し、遺伝子発現を開始している可能性が、我々はLBブロス中でパルス化細菌の希釈を行うことに留意すべきである。
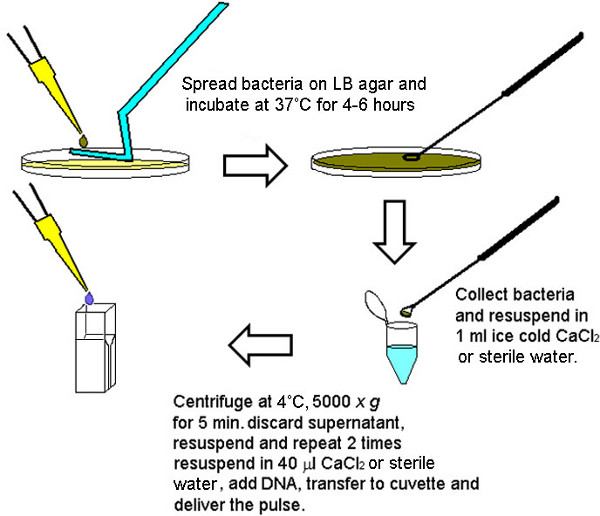
図1。エレクトロ細菌の迅速な調製のための方法論を示すグラフ。4-6時間後(接種物の濃度に依存する)細菌の十分な数は、単一のLB寒天プレートから五時五十六の変換を実行するために収集することができる。エレクトロポレートされるそれぞれの最終容量コンピテント細胞の等しい数を保証するために、LB寒天プレートから採取した細菌は、最初にプールし、次いでら一緒に洗浄したペレットの大きさに応じて40μlの容量でiquoted(より大きなペレットは40μLで割り切れるより大容量で希釈した)。
| アンピシリン耐性形質転換体/μgのDNAの数(アンピシリン耐性形質転換が回復[%]) | ||
| 歪み | 伝統的方法 | 迅速な方法 |
| 大腸菌の (DH5α) | 2.3×10 6(5 10×7.3±)[9.4%] | 3×10 6(5 10×7.1±)[2.5%] |
| コレラ菌 (O395) | 4×10 7(7 10×1.7±)[5%] | 6.7×10 5(5 10×2.1±)[3.3%] |
表1。エレクトロBのDNAのマイクログラムあたりの形質転換効率(pUC18中)迅速な方法に比べて、従来の方法で調製acteria。
すべての変換は、(1%アガロースゲル電気泳動によって可視化されるように〜80%のスーパーコイルDNA)500 ngのpUC18のDNAを用いて実施し、そしてエレクトロポレーションした細胞を直列に抗生物質をLB-寒天上CFUのためにプレーティングする前にLBブロス中で10倍に希釈した。非細菌およびプラスミドをエレクトロポレーションすることなく、細菌のエレクトロポのコントロールは、直列に抗生物質を含まない希釈し、LB寒天上にプレーティングの前及びアフターパルス生菌数の合計を決定するために、変換の各セットに対して実施した。エレクトロポレーションコントロールは、形質転換が成功生存細菌のパーセントのためのベースラインを表した。
ディスカッション
形質転換効率は関係なく、コンピテント細胞を調製するために用いられる方法の種々の要因を受ける。類似の変数は、このメソッドに適用され、細心の注意を取る必要があることを細胞は、それらが一定の低温(高くない°4より℃)に維持されるように寒天プレートから収穫された後。細菌ローンを積極的に収集時に成長している必要があります。細胞は、成長の中間対数相でなければなりません。 DNA(塩すなわち汚染)の品質は、形質転換効率に影響を与えます。この方法を採用した場合具体的には、寒天は、キュベット内の寒天の断片は、パルスのアーク放電の原因になりますように壊れてはいけません。
彼らは活発に成長している時に、寒天プレートからの時間の適切な窓の間の細菌を収集し、この手法で遭遇するほとんどの問題は、二つの問題に関連している。あまりにも早く、それらを収集することは不十分な細胞数が得られますし、レンダリングされますそれらが形成する「pellicule "は板の表面を持ち上げにくいのでイライラするLB寒天プレートを掻き落とす。収集細菌は手遅れ劇的に彼らの能力が低下します。時間窓は、天然LB寒天プレート上にプレートし、接種材料の濃度に依存して変化する。第二の重要なステップは、それらが形質転換後にLB寒天上にプレーティングするまで、寒天プレートから持ち上げ及びCaCl 2又はのddH 2 Oに再懸濁した瞬間から(4°C)冷細菌を維持することである。細菌、キュベットおよび緩衝液を含むマイクロチューブは、あらかじめ冷却することや細菌がメッキされるまで、常に氷上で維持しなければならない。しかし、新たな問題には、無菌のddH 2 Oまたは塩化カルシウムが沈殿物が含まれているか、汚染されている場合に発生することができます。このような理由から、我々はこの試薬新鮮を準備することをお勧めします。
トラブルシューティングの変換は、BAを変換する際にコントロールを含めることによって促進されるいずれかの方法によりコンピテントcteria。選択マーカーを含有するLB寒天プレート上にプレーティングし、非形質転換コンピテント細菌のバッチからなる陰性対照は、急速にプレート上の抗生物質が有効であるか否かを判断するのに役立ちます。実験サンプルと同じ選択マーカーを保有する優れた質と量の既知のプラスミド調製と陽性対照変換は細菌が有能であるだけでなく、変換された実験的なDNAは量や質が十分であったかどうかを決定する際に参考になります。
この技術の利点は、複数あり、この方法は、変換がのために計画されているのと同じ日のうちに行うことができる。我々は(一晩培養の前に一日を始めるのを忘れた後)「緊急」の状況でこれを行っている、私たちは、凍結した細菌のグリセロールストックをelectrocompetenceを損失することなく、LB寒天上に直接めっきすることができることを発見した。我々は、電子をテストできなかったが既知の非常に歪み、あらゆるE.大腸菌またはVエレクトロポレーションによって形質転換することができるコレラ菌株は、私たちの手で、このプロトコルに適していた。技術は、迅速で効果的な、伝統的な方法を用いるエレクトロ細菌を調製から得られたものに匹敵する形質転換効率が得られる。この方法は、高速遠心機および関連ローター、オービタルインキュベーターシェーカーや滅菌遠心バケット(コンテナ)、およびオートクレーブ処理し、バッファの大容量の必要がなくなります。具体的な試薬および器具の表は非常に包括的ですが、エレクトロポレーションを行うほとんどの研究室は、すでに利用可能なこれらの材料の、ほとんどの、すべてではないにしています。おそらく最も重要なのは、技術が容易に急速に変異体バックグラウンドを持つエレクトロ検査室毎の株を生成するために適用することができます。それは電気の準備の伝統的な方法に取って代わったように、我々はこの技術の制限事項を知らない私たちの研究室で細菌をtrocompetent。
ここに示した実験の結果は、1週間以上、もはや-80℃で保存されていた従来の方法で製造エレクトロ新鮮な細胞を用いて行った。しかし、凍結したエレクトロ細胞ストックは、ストレージの長期間にわたって能力とまたは生存を失う。当社の要約プロトコルは、同じ日に変換が減少した形質転換体の収量を生じ得る株式の年齢を気にせずに計画されている新鮮なエレクトロ·セルの製造を可能にする。我々は、これは必要ではなかったとして別の日に使用するための迅速な方法を用いて製造エレクトロコンピテント細胞を保存する試みられていない。
ここには示されていないが、エレクトロ電池の効率は、我々の迅速な方法は、ライゲーション混合物で十分である使用して調製。非O1 V.のために報告の変換Unterweger らによる最近の記事でコレラ。17は (コンジュゲーションによって行うものを除く)ここに記載の方法により調製エレクトロ細菌を用いて行った。この技術は、細胞の大きなバッチを調製することなく、迅速かつ効果的背景を持つ突然変異株を形質転換するために、研究者が得られる。エレクトロ細菌メソッドのこの迅速な調製は、準備とエレクトロポレーションの設定の原理は、従来のプロトコルと同じであることを行っているように、エレクトロポレーションの影響を受けやすいことが示されている他の原核生物に適合させることがあります。
開示事項
全く開示は適用されません。
謝辞
著者は、彼らの同僚や、この技術の発展を支えてきた現在と過去の研究室のスタッフに感謝しています。 SPの研究室では、健康の研究オペレーティンググラントMOP-84473のためのカナダの研究所(医学研究基金基金アルバータヘリテージ財団によって資金を供給)アルバータ革新健康ソリューションによってサポートされています。 DPのは、国立衛生研究所MD001091-01とGM068855-02を補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| Gene Pulser Module | Bio-Rad | 165-2668 | |
| Gene Pulser Cuvette Chamber | Bio-Rad | 165-2669 | |
| Electrocuvettes (0.2 cm gap) | Bio-Rad | 165-2082 | |
| 13 x 100 mm Pyrex Rimless Culture Tubes | Corning | 70820-13 | |
| 13 mm Culture Tube Closures | Cole Parmer | EW-04500-00 | |
| 6 x 250 mm Glass Rod | Lab Source | 11381D | |
| Disposable Petri Dishes | Fisher Scientific | 08-757-12 | |
| Roller Drum Motor Assembly | New Brunswick Scientific | M1053-4004 | |
| Roller Drum for 13 x 100 mm Culture Tubes | New Brunswick Scientific | M1053-0306 | |
| Calcium chloride | Sigma Chemicals | C5670 | |
| Ethanol, anhydrous/denatured | Sigma Chemicals | 227649 | |
| Inoculating Loop | Decon Labs | MP182-5 | |
| Refrigerated Microcentrifuge 5451 R | Eppendorf | 22621425 | |
| Bunsen Burner | Fisher Scientific | 03-917Q | |
| LB Broth MILLER | EMD | 1.10285.0500 | |
| Bacteriological Agar | Fisher Scientific | S25127 |
参考文献
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1 (7), 841-845 (1982).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16 (13), 6127-6145 (1988).
- Taketo, A. DNA transfection of Escherichia coli by electroporation. Biochim. Biophys. Acta. 949 (3), 318-324 (1988).
- Fiedler, S., Wirth, R. Transformation of bacteria with plasmid DNA by electroporation. Anal. Biochem. 170 (1), 38-44 (1988).
- O'Callaghan, D., Charbit, A. High efficiency transformation of Salmonella typhimurium and Salmonella typhi by electroporation. Mol. Gen. Genet. 223 (1), 156-158 (1990).
- Hamashima, H., Nakano, T., Tamura, S., Arai, T. Genetic transformation of Vibrio parahaemolyticus, Vibrio alginolyticus, and Vibrio cholerae non O-1 with plasmid DNA by electroporation. Microbiol. Immunol. 34 (8), 703-708 (1990).
- Grones, J., Turna, J. Transformation of microorganisms with the plasmid vector with the replicon from pAC1 from Acetobacter pasteurianus. Biochem. Biophys. Res. Commun. 206 (3), 942-947 (1995).
- Allen, S. P., Blaschek, H. P. Electroporation-induced transformation of intact cells of Clostridium perfringens. Appl. Environ. Microbiol. 54, 2322-2324 (1988).
- Belliveau, B. H., Trevors, J. T. Transformation of Bacillus cereus vegetative cells by electroporation. Appl. Environ. Microbiol. 55, 1649-1652 (1989).
- Chassy, B. M., Flickinger, J. L. Transformation of Lactobacillus casei by electroporation. FEMS Microbiol. Lett. 44, 173-177 (1987).
- Dunny, G. M., Lee, L. N., LeBlanc, D. J. Improved electroporation and cloning vector system for gram-positive bacteria. Appl. Environ. Microbiol. 57 (4), 1194-1201 (1991).
- Micheletti, P. A., Sment, K. A., Konisky, J. Isolation of a coenzyme M-auxotrophic mutant and transformation by electroporation in Methanococcus voltae. J. Bacteriol. 173 (11), 3414-3418 (1991).
- Schleper, C., Kubo, K., Zillig, W. The particle SSV1 from the extremely thermophilic archaeon Sulfolobus is a virus: demonstration of infectivity and of transfection with viral DNA. Proc. Natl. Acad. Sci. U.S.A. 89 (16), 7645-7649 (1992).
- Aune, T. E., Aachmann, F. L. Methodologies to increase the transformation efficiencies and the range of bacteria that can be transformed. Appl. Microbiol. Biotechnol. 85 (5), 1301-1313 (2010).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166, 557 (1983).
- Unterweger, D., Kitaoka, M., et al. Constitutive Type VI Secretion System Expression Gives Vibrio cholerae Intra- and Interspecific Competitive Advantages. PLoS One. 7 (10), e48320 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved