Method Article
Rapid Protocollo per la preparazione di elettrocompetenti
In questo articolo
Riepilogo
L'elettroporazione è un metodo comunemente impiegato per introdurre DNA in batteri in un processo noto come trasformazione. Protocolli tradizionali per la preparazione di cellule elettrocompetenti sono in termini di tempo e manodopera. Questo articolo descrive un modo alternativo, rapido ed efficiente metodo per la preparazione di cellule elettrocompetenti attualmente impiegati da alcuni laboratori.
Abstract
Elettroporazione è diventato un metodo ampiamente utilizzato per rapidamente ed efficacemente introdurre DNA esogeno in una vasta gamma di celle. Electrotransformation è diventato il metodo di scelta per introdurre DNA in procarioti che non sono naturalmente competente. L'elettroporazione è un metodo di trasformazione rapida, efficiente e semplificato che, oltre al DNA purificato e batteri competenti, richiede commercialmente disponibile regolatore di impulsi gene e cuvette. In contrasto con il passo pulsare, preparazione di cellule elettrocompetenti richiede molto tempo e manodopera coinvolgendo ripetuti cicli di centrifugazione e lavaggi in diminuzione volumi di acqua fredda e sterile, o buffer non-ionici di grandi volumi di colture cresciute a metà fase logaritmica di crescita. Il tempo e lo sforzo possono essere salvati con l'acquisto di cellule elettrocompetenti da fonti commerciali, ma la scelta è limitata a comunemente impiegati E. ceppi di laboratorio coli. Stiamo presente diffusione di una rapida emetodo efficiente per la preparazione elettrocompetenti E. coli, che è stato in uso nei laboratori di microbiologia per qualche tempo, può essere adattato a V. cholerae e altri procarioti. Anche se non possiamo accertare chi al credito per lo sviluppo della tecnica originale, stiamo dichiara renderlo disponibile alla comunità scientifica.
Introduzione
Fin dalla sua 'nascita nei primi anni del 1980 1, elettroporazione è diventata una tecnica di biologia molecolare integrale, probabilmente il singolo metodo più utilizzato per trasformare / trasfezione cellule vive con acidi nucleici circolari o lineari. Originariamente sviluppato per la trasfezione di cellule eucariotiche 1, elettroporazione è stato successivamente adattato per la trasformazione di E. coli 2, 3. In batteriologia, elettroporazione è diventato lo standard di laboratorio ed è stato modificato per trasformare una vasta gamma di batteri Gram-negativi, tra cui Pseudomonas 4, 5 salmonelle, vibrioni 6, Serratiae e Shigella 7; Clostridia Gram-positivi 8, Bacilli 9, lattobacilli 10 ed enterococchi 11. Anche alcuni Archaebacteria hanno dimostrato suscettibile di trasformazione mediante elettroporazione, tra cui Methanococci 12 e Sulfolobus specie 13. Per una rassegna completa si rimanda al Aune e Aachmann 14. L'efficienza di trasformazione mediante elettroporazione è riferito 10-20 volte superiore a quello di competenza chimico o shock termico 2. Tuttavia, come per la preparazione di batteri per la competenza chimica ottimizzata da Douglas Hanahan nel 1980 15, le cellule devono anche essere pronti a essere elettrocompetenti.
L'elettroporazione è un mezzo rapido ed efficace di trasformazione batterica, che richiedono batteri elettrocompetenti, DNA purificato, un modulo di controllo degli impulsi che fornisce l'impulso elettrico, e una camera che può ospitare piccole celle monouso che funzionano come un elettrodo. Brevemente, freddo, batteri competenti sono mescolati con DNA plasmidico, sottoposto ad un impulso ad alta tensione in una cuvetta, risospese in terreno di crescita, incubate a 30-37 ° C per 30-45 min, e quindi piastrate su terreno semisolido (agar nutriente piastre) con la caopriate antibiotico selettivo.
In contrasto con il passo pulsare, la preparazione di elettrocompetenti E. coli rimane una procedura più parti che è tradizionalmente effettuata in grandi volumi. In breve, una cultura overnight di batteri viene inoculato in una beuta con 100 ml a 1 L Luria Broth (LB), cresciuto fino a metà fase logaritmica di crescita (OD 600 <1.0), e sottoposti a lavaggi seriali con una non sterile ionico tampone o acqua bidistillata (DDH 2 O) discendente volumi a 4 ° C. Grande cura deve essere presa per mantenere le cellule freddo durante tutta la procedura ed evitare la contaminazione. Ciò richiede l'impiego di secchi centrifugazione autoclave e tamponi non ionici o DDH 2 O, un agitatore incubatore orbitale, un grande volume ad alta velocità centrifuga refrigerata e un set di rotori. I batteri sono infine risospese in un piccolo volume di tampone supplementato con 10% glicerolo e frazionato in ~ 40 volumi microlitri, which vengono conservati a -80 ° C fino all'utilizzo. Stoccaggio a bassa temperatura spesso si traduce in efficienza di trasformazione è diminuito a causa della perdita di redditività nel tempo.
Cellule batteriche elettrocompetenti sono disponibili da una varietà di fonti commerciali ma solo per un numero limitato di (spesso ricombinazione-deficient) E. coli comunemente impiegati come host di propagare una vasta gamma di plasmidi. Come risultato i ricercatori si basano su metodi di in-house per preparare i propri ceppi / mutanti per la trasformazione.
Un alternate, protocollo rapido ed efficiente per la preparazione di elettrocompetenti E. coli è stato in uso da alcuni laboratori di microbiologia molecolare per qualche tempo ed è stato esteso a ulteriori batteri Gram-negativi, nel nostro caso V. cholerae. Il mittente del protocollo non può essere identificato come è stato ottimizzato da altri ricercatori nel tempo. Il metodo qui presentato è stato usato nella nostra laboratories per quasi due decenni, ed è il nostro obiettivo di condividere questo protocollo utile con i nostri coetanei.
Protocollo
1. Preparazione di colture batteriche, strumenti e reagenti (DAY 1, Pomeriggio)
- Nel tardo pomeriggio, inoculare 1-5 ml di brodo LB in autoclave sterile (ad esempio, 100 x 13 mm) provette di vetro borosilicato con una piccola aliquota di batteri (E. coli o V. cholerae).
- Impostare le provette inoculate in un tamburo rullo alloggiata a 37 ° C di temperatura (ambiente caldo o incubatore), accendere il tamburo rullo ad alta velocità, e incubare O / N.
- Preparare un divaricatore cella nella forma di un "bastone da hockey" di una bacchetta di vetro riscaldando il centro della sbarra nella fiamma di un becco Bunsen fino ammorbidisce il vetro e quindi indirizzare la curva delicatamente con pinzette o pinze in un angolo di 135 ° . Riscaldare l'asta di nuovo nel punto medio tra la fine e la prima curva e piegare a 45 ° verso l'interno (in senso opposto della prima curva).
- Preparare LB-agar senza antibiotici e versare in piastre di Petri in preparazione dellaprotocollo electrocompetence, e LB-agar piastre contenenti l'antibiotico appropriato (secondo il marcatore di resistenza sul vettore da elettroporate), e conservare a 4 ° C.
- Preparare un filtro sterilizzato 2 mM CaCl 2 soluzione per V. cholerae, o autoclave DDH 2 O per E. coli, e conservare a 4 ° C.
2. Crescita di batteri elettrocompetenti (DAY 2, Mattino)
- Fornire 100 ml di coltura batterica O / N su ogni piatto agar LB, scorte glicerolo congelati possono anche essere utilizzati e direttamente consegnati sul piatto.
- Immergere l'hockey a forma di bastone spreader cella in 100% EtOH, brevemente drenare e bruciare il restante EtOH per sterilizzarlo prima dell'uso e diffusione. Diffondere la coltura batterica 100 microlitri O / N uniformemente con la sterile spreader cella di vetro facendo attenzione a non disturbare (break) la superficie agar.
- Incubare la piastra a 37 ° C per 4-6 ore, o fino ad un sottile prato di crescita batterica siaviene distinguibili. Le cellule sono più competenti quando si attiva crescita.
3. Preparazione di cellule batteriche elettrocompetenti (DAY 2, Pomeriggio)
- Raccogliere i batteri con un'ansa da inoculo sterile facendo attenzione a non forare o rompere la superficie dell'agar. Una massa batterica 2 mm di diametro è sufficiente per una trasformazione. Tipicamente, ciò richiede raschiare la superficie del sottile prato con l'ansa due o tre volte. Diversi campioni (in genere tra 4-6) possono essere raccolti dallo stesso piatto.
- Risospendere la massa batterica in 1 ml di ghiacciata 2 mM CaCl 2 (per V. cholerae) o sterili DDH 2 O (per E. coli) e mescolare bene fino a quando non sono visibili grumi, tenere su ghiaccio.
- Centrifugare ogni sospensione batterica per 5 minuti a 5000 xg in una microcentrifuga refrigerata impostato a 4 ° C, o in una microcentrifuga memorizzato in una camera fredda impostato su 4 ° C.
- Eliminare il surnatante, resuspterminare il pellet batterico nello stesso volume di 2 mM CaCl ghiacciata 2 o sterile DDH 2 O, e ripetere la fase di centrifugazione come fatto in precedenza altre due volte per un totale di tre lavaggi.
- Rimuovere il surnatante, risospendere, e quindi allentare completamente il pellet batterico in 40 microlitri freddo ghiaccio 2 mM CaCl 2 o sterili DDH 2 O e tenere in ghiaccio.
4. Trasformazione di batteri elettrocompetenti (DAY 2, Pomeriggio)
- Aggiungere fino a 1 mg di DNA plasmidico (fino a 1 microlitri di acqua o tampone Tris-EDTA) alla sospensione batterica 40 microlitri e trasferire il composto in un pre-raffreddata, sterile 0,2 centimetri gap cuvetta. La concentrazione di sale nel campione di DNA deve essere bassa a, poiché contribuirà a scariche di impulsi nel passaggio successivo.
- Inserire la cuvetta nella camera di elettroporazione del modulo di controllo degli impulsi, e l'elettroporazione a 1,8 kV, 25 uF. La costante di tempo deve essere ~ 5,0 msec, e nessun arco dovrebbe verificarsi.
- Recuperare rapidamente la sospensione cellulare risospendendo in 1 ml di brodo LB e trasferire in precedenza autoclavato provetta di vetro borosilicato.
- Permettono alle cellule di recuperare incubando condizioni colturali gassose (in un tamburo rullo) a 37 ° C per 30 min senza selezione antibiotica.
- Piastra batteri sulle piastre di LB agar precedentemente preparati in presenza di agente selettivo appropriato (antibiotico), e incubare a 37 ° CO / N. Se i batteri vengono trasformati con un'alta concentrazione di vettore purificato (0,1-1 mg plasmide superavvolto), consegnare 10 ml di coltura batterica sul bordo della piastra di LB agar e realizzato con un'ansa sterile per colonie isolate utilizzando il metodo realizzato quadrante. Se una miscela di ligazione è stata trasformata, consegnare 100 ml di coltura batterica su ogni piastra di agar e in modo uniforme stenderlo con la spatola cella di vetro sterilizzati.
a Se la costante di tempo è breve (saràbasso 3.5 msec), o pulsazione porta a arco, poi ri-precipitare il campione di DNA, lavare con il 70% EtOH due volte per rimuovere i sali prima dell'essiccazione e risospendere in tampone TE.
Risultati
Abbiamo effettuato una serie di trasformazioni con E. coli e V. cholerae per confrontare l'efficienza della trasformazione della nostra metodologia rapida con un adattamento del metodo (tradizionale) originariamente descritto da Dower et al. 2 per la preparazione di batteri elettrocompetenti. Per effettuare la tradizionale preparazione di cellule competenti, 500 ml LB in un pallone da 2 L-Erlenmeyer state inoculate con 500 microlitri cultura durante la notte di E. coli DH5a o V. cholerae O395, incubata in un agitatore orbitale (215 rpm a 37 ° C) e raccolto a OD 600 compreso tra 0,5-1,0. Il pallone è stato raffreddato su ghiaccio e le culture centrifugato in un rotore pre-raffreddata a 4.000 xg per 10 min a 4 ° C. I pellet cellulari sono stati completamente risospese in 2 ml di CaCl mm 500 ghiacciata 2 per V. cholerae e DDH 2 O per E. coli, e centrifugato di nuovo nelle stesse condizioni. Turni successivi di risospensione und centrifugazione sono state effettuate discendente volumi di 200 e 100 ml di volume assicurandosi che la coltura è rimasta refrigerata a 4 ° C. Infine, una risospensione e centrifugazione in un volume di 10 ml è stata effettuata con il 10% glicerolo. Il pellet finale è stato risospeso in 2 ml di glicerolo al 10% e 40 microlitri aliquote sono state congelate a -80 ° C e non più conservato di una settimana prima di elettroporazione.
Condizioni elettroporazione incluse le impostazioni di impulsi e dimensioni cuvetta erano identici per entrambe le specie batteriche in tutti electroporations indipendentemente dal metodo di preparazione di cellule competenti. L'unica differenza è che abbiamo svolto i lavaggi in DDH 2 O fredda per E. coli e fredda 2 mM CaCl 2 per V. cholerae Tabella. 1 mostra i risultati di batteri trasformati mediante elettroporazione in modo identico, ma resi competente sia con il protocollo rapido o con il metodo tradizionale. Abbiamo impiegato ceppo O395 e DH5a come comuneutilizzati ly, ceppi rappresentativi di V. cholerae e E. coli rispettivamente; risultati simili possono essere ottenuti con altri ceppi della stessa specie (anche se non ogni singolo ceppo è stato testato) e probabilmente adattati ad altri batteri Gram-negativi e probabilmente oltre.
Per assicurare che un numero uguale di cellule erano presenti in ogni partita pulsata, batteri elettrocompetenti generati utilizzando il metodo rapido sono stati raggruppati sulla raccolta, mescolati, tenuti omogeneo sospesi, e aliquotare 40 volumi microlitri poco prima elettroporazione. Batteri elettrocompetenti generati utilizzando il metodo tradizionale sono stati trattati in modo simile prima del congelamento in 40 microlitri aliquote. Dopo la consegna del polso, ogni lotto di 40 microlitri batteri elettroporate è stato sospeso in 400 microlitri LB e serialmente diluito 1:10. Cento microlitri di ogni diluizione sono state piastrate su LB agar in presenza di 100 pg / ml ampicillina e diffondono mediante spatola cella di vetro sterilee incubate a 37 ° C per una notte. Per quantificare il numero totale di batteri impiegati in ciascuno trasformazione, 40 volumi microlitri di batteri elettrocompetenti di ogni batch preparato sono stati diluiti, e piastrate su LB agar senza antibiotici identicamente in parallelo. Una aliquota di batteri ugualmente trattati da ogni lotto è stato elettroporate con 1 ml Tris-EDTA (TE) accumulo ma senza DNA (finto trasformazione), diluiti serialmente e piastrate su LB agar senza antibiotici per stimare il numero di cellule perse dalla consegna del impulso elettrico. Infine, una variazione addizionale esperimento è stato condotto per determinare se 30 min di incubazione a 37 ° C in 1 ml di LB dopo l'elettroporazione ma prima placcatura su LB-agar inciderebbero il recupero delle cellule trasformate. unità formanti colonie (CFU) venivano registrati il giorno seguente.
Per questo esperimento abbiamo impiegato pUC18, un plasmide laboratorio comune, e lotti di batteri competenti costituito da unpproximately 10 8 CFU per le cellule preparate utilizzando il metodo tradizionale e 10 7 CFU per le cellule preparate utilizzando il protocollo rapido. Solo elettroporazione (senza DNA) ha ridotto CFU vitali da 10-100 volte indipendentemente dal metodo utilizzato per preparare le cellule elettrocompetenti. Come mostrato in Tabella 1, resa trasformante era entro le 10 6 -10 7 CFU / pg di DNA gamma in tre esperimenti replicati (deviazioni standard tra parentesi) per E. coli (DH5a) e V. cholerae (O395), rispettivamente con il metodo tradizionale, più lunghe per la preparazione delle cellule elettrocompetenti. Resa trasformante apparso diminuito di 10 volte a 10 5 -10 6 CFU / pg di DNA in tre esperimenti replicare (deviazione standard tra parentesi) per E. coli e V. cholerae rispettivamente con il metodo rapido. Per questo motivo abbiamo determinato la percentuale di batteri trasformati dividendo CFU trasformatiper il numero di CFU recuperato da "trasformazioni finti" (senza plasmide) da lotti altrimenti identici di cellule competenti. La percentuale di batteri trasformati era entro un log (2,5-9,4%) indipendentemente dal metodo di preparazione e specie trasformati (Tabella 1 numeri tra parentesi). Questi risultati suggeriscono che l'efficacia del metodo rapido è paragonabile a quella della procedura tradizionale lungo di preparazione di cellule competenti e che i ceppi rappresentativi di Vibrio cholerae e Escherichia coli sono ugualmente suscettibili alla procedura rapida.
Abbiamo trovato che l'efficienza di trasformazione, per plasmidi come pUC18 ospitano cassette β-lattamasi, non è influenzato dal tempo di recupero 30 min in brodo LB. Lo stesso numero di trasformanti è stato recuperato se le cellule sono state piastrate a LB agar in presenza di ampicillina direttamente dopo l'elettroporazione, o se ne ha permesso un tempo di recupero 30-45 minin brodo LB a 37 ° C prima della placcatura. I nostri risultati che ampicillina-resistenza non richiede conseguenza in condizioni non selettivi suggerisce che l'espressione di β-lattamasi si verifica abbastanza veloce al momento di trasformazione. Tuttavia, va notato che abbiamo condotto diluizioni seriali dei batteri pulsati in brodo LB, che può aver contribuito al recupero dallo shock elettrico e avviare l'espressione genica.
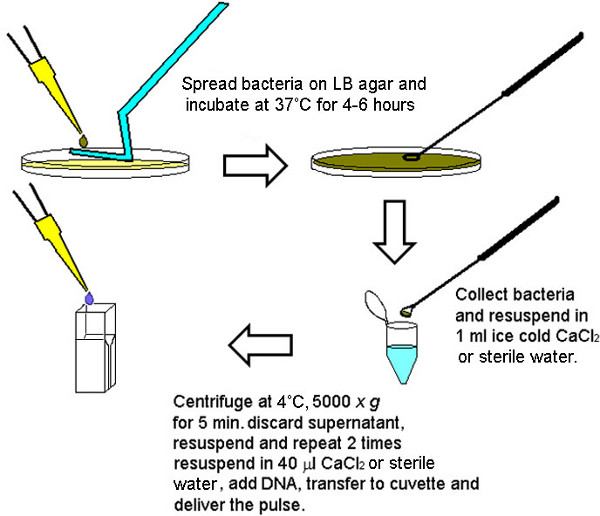
Figura 1. Rappresentazione grafica della metodologia per la rapida preparazione di batteri elettrocompetenti. Dopo 4-6 ore (a seconda della densità del inoculi) un numero sufficiente di batteri possono essere raccolti per svolgere 05:56 trasformazioni da una singola piastra di agar LB. Per assicurare la parità di numero di cellule competenti per ciascun volume finale da elettroporate, batteri raccolti dalla piastra di agar LB sono stati inizialmente riuniti e lavati insieme poi aliquoted in 40 volumi microlitri seconda delle dimensioni del pellet (granuli più grandi sono stati diluiti in grandi volumi divisibili da 40 microlitri).
| Numero di Ampicillina resistenti DNA trasformanti / mg (trasformanti Ampicillina resistenti recuperati [%]) | ||
| Strain | Metodo tradizionale | Metodo rapido |
| E. coli (DH5a) | 2,3 x 10 6 (± 7,3 x 10 5) [9,4%] | 3 x 10 6 (± 7,1 x 10 5) [2,5%] |
| V. cholerae (O395) | 4 x 10 7 (± 1,7 x 10 7) [5%] | 6,7 x 10 5 (± 2,1 x 10 5) [3,3%] |
Tabella 1. Efficienza di trasformazione per ogni microgrammo di DNA (pUC18) di elettrocompetenti bacteria preparato con il metodo tradizionale rispetto al metodo rapido.
Tutte le trasformazioni sono state effettuate con 500 ng di DNA pUC18 (~ 80% DNA supercoiled come visualizzato da 1% agarosio elettroforesi su gel) e le cellule elettroporate sono stati diluiti 10 volte in brodo LB prima placcatura per CFU su LB-agar con antibiotici. Controlli di batteri non elettroporate e di batteri elettroporate senza plasmide, diluiti serialmente e piastrate su LB agar senza antibiotici sono state effettuate per ogni serie di trasformazioni per determinare il numero totale di batteri vitali prima e dopo pulsare. I controlli elettroporate rappresentavano la linea di base per la percentuale di batteri vitali trasformati con successo.
Discussione
Efficienza di trasformazione è soggetta ad una varietà di fattori indipendentemente dal metodo impiegato per preparare cellule competenti. Variabili analoghe valgono per questo metodo; grande cura deve essere presa che una volta che le cellule vengono raccolte dalla piastra di agar tale che essi siano mantenuti a temperatura costante fredda (non superiore a 4 ° C). Il prato batterica deve essere in fase di crescita al momento della raccolta, le cellule devono essere in fase mid-logaritmica di crescita. Qualità di DNA (cioè sporcizia di sali) influenza l'efficienza della trasformazione. In particolare, quando si impiega questo metodo, l'agar non deve essere rotto come frammenti di agar nella cuvetta causeranno arco dell'impulso.
La maggior parte dei problemi incontrati con questa tecnica sono associate a due questioni, raccogliere i batteri durante la corretta finestra di tempo dalla piastra di agar quando sono in attiva crescita. Raccolta troppo presto darà il numero di cellule insufficiente e renderà l'raschiando la piastra di agar LB frustrante, perché il "pellicule" essi costituiscono è difficile da sollevare la superficie della piastra. Batteri Raccolta troppo tardi diminuiranno la loro competenza in modo drammatico. La finestra di tempo sarà naturalmente variare a seconda della densità dell'inoculo piastrate su piastre di LB agar. Il secondo passo fondamentale è quello di mantenere i batteri freddo (4 ° C) dal momento in cui sono sollevati da piastra di agar e risospese in CaCl 2 o DDH 2 O fino a quando sono piastrate su agar LB seguente trasformazione. I tubi microcentrifuga contenenti i batteri, cuvette e tampone devono essere pre-raffreddato e conservato in ghiaccio a tutte le ore fino a quando i batteri sono placcati. Tuttavia, ulteriori problemi possono sorgere quando la sterile DDH 2 O o CaCl 2 contengono precipitato o sono contaminati. Per questo motivo si consiglia di preparare questa nuova reagente.
Trasformazione risoluzione dei problemi è facilitato dalla compresi i controlli durante la trasformazione bacteria reso competente con qualsiasi metodo. Un controllo negativo costituito da un gruppo di batteri competenti non trasformate placcato su una piastra di agar LB contenente il marcatore selettivo sarà rapidamente aiutare a determinare se l'antibiotico sulla piastra è efficace. Una trasformazione controllo positivo con una preparazione plasmide noto di buona qualità e quantità ospitare lo stesso marcatore selettivo come il campione sperimentale sarà utile per determinare se i batteri sono competenti, ma anche se il DNA sperimentale trasformata era sufficiente in quantità o qualità.
I vantaggi di questa tecnica sono molteplici, il metodo può essere effettuato nello stesso giorno che una trasformazione è prevista. Abbiamo scoperto che il glicerolo batteriche congelati magazzino può essere placcato direttamente sul agar LB senza alcuna perdita di electrocompetence, abbiamo fatto in situazioni di "emergenza" (dopo dimenticando per avviare la cultura durante la notte il giorno prima). Anche se non abbiamo potuto testare emolto ceppo noto, qualsiasi E. coli o V. ceppo cholerae che può essere trasformato da elettroporazione è suscettibile di questo protocollo nelle nostre mani. La tecnica è rapida, efficace e produce efficienze di trasformazione paragonabili a quelli ottenuti da preparare batteri elettrocompetenti impiegano metodi tradizionali. Il metodo elimina la necessità di centrifuga ad alta velocità e rotori associati, un agitatore incubatore orbitale e secchi centrifuga sterili (contenitori), e grandi volumi di tampone autoclave. Anche se la tabella di reagenti specifici e attrezzature è abbastanza completo, la maggior parte dei laboratori che effettuano elettroporazione avranno la maggior parte, se non tutti, di questi materiali già disponibili. Forse la cosa più importante, la tecnica può essere facilmente applicata per generare ceppi specifici del laboratorio elettrocompetenti con sfondi mutanti rapidamente. Siamo consapevoli dei limiti di questa tecnica in quanto ha sostituito il tradizionale metodo di preparazione di elettrocompetent batteri nei nostri laboratori.
I risultati dei nostri esperimenti qui illustrati sono stati effettuati con cellule elettrocompetenti freschi prodotti con il metodo tradizionale che era stato conservato a -80 ° C per non più di 1 settimana. Tuttavia, scorte congelate cellulari elettrocompetenti perdono la competenza e la redditività o per lunghi periodi di stoccaggio prolungati. Il nostro protocollo abbreviata consente la preparazione di cellule elettrocompetenti freschi stesso giorno la trasformazione è prevista senza preoccupazioni età del magazzino che può provocare resa trasformante diminuito. Non abbiamo tentato di conservare le cellule elettrocompetenti prodotte utilizzando il metodo rapido per l'utilizzo in un altro giorno come questo non è stato necessario.
Sebbene non mostrato qui, l'efficienza delle cellule elettrocompetenti preparato utilizzando il nostro metodo rapido è sufficiente per le miscele di ligazione. Le trasformazioni riportati per non-O1 V. cholerae in un recente articolo di Unterweger et al.17 sono state effettuate utilizzando batteri elettrocompetenti preparato con il procedimento descritto qui (tranne quelle effettuate mediante coniugazione). Questa tecnica permette ai ricercatori di trasformare ceppi mutanti con background rapido ed efficace, senza dover preparare grandi lotti di cellule. Questa rapida preparazione del metodo di batteri elettrocompetenti potrebbe essere adattato ad altri procarioti che hanno dimostrato di essere suscettibili di elettroporazione come il principio di preparazione e le impostazioni di elettroporazione stanno per essere le stesse di quelle dei protocolli tradizionali.
Divulgazioni
Nessuna informativa sono applicabili.
Riconoscimenti
Gli autori sono riconoscenti ai loro colleghi e il personale dei laboratori presenti e passati che hanno sostenuto lo sviluppo di questa tecnica. Il laboratorio di SP è sostenuta dal Canadian Institute for Health Research Grant operativo MOP-84473 e Alberta innova-Health Solutions (finanziati dalla Fondazione Alberta Heritage per la ricerca medica Endowment Fund). PS è stato sostenuto dal National Institutes of Health concede MD001091-01 e GM068855-02.
Materiali
| Name | Company | Catalog Number | Comments |
| Gene Pulser Module | Bio-Rad | 165-2668 | |
| Gene Pulser Cuvette Chamber | Bio-Rad | 165-2669 | |
| Electrocuvettes (0.2 cm gap) | Bio-Rad | 165-2082 | |
| 13 x 100 mm Pyrex Rimless Culture Tubes | Corning | 70820-13 | |
| 13 mm Culture Tube Closures | Cole Parmer | EW-04500-00 | |
| 6 x 250 mm Glass Rod | Lab Source | 11381D | |
| Disposable Petri Dishes | Fisher Scientific | 08-757-12 | |
| Roller Drum Motor Assembly | New Brunswick Scientific | M1053-4004 | |
| Roller Drum for 13 x 100 mm Culture Tubes | New Brunswick Scientific | M1053-0306 | |
| Calcium chloride | Sigma Chemicals | C5670 | |
| Ethanol, anhydrous/denatured | Sigma Chemicals | 227649 | |
| Inoculating Loop | Decon Labs | MP182-5 | |
| Refrigerated Microcentrifuge 5451 R | Eppendorf | 22621425 | |
| Bunsen Burner | Fisher Scientific | 03-917Q | |
| LB Broth MILLER | EMD | 1.10285.0500 | |
| Bacteriological Agar | Fisher Scientific | S25127 |
Riferimenti
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1 (7), 841-845 (1982).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16 (13), 6127-6145 (1988).
- Taketo, A. DNA transfection of Escherichia coli by electroporation. Biochim. Biophys. Acta. 949 (3), 318-324 (1988).
- Fiedler, S., Wirth, R. Transformation of bacteria with plasmid DNA by electroporation. Anal. Biochem. 170 (1), 38-44 (1988).
- O'Callaghan, D., Charbit, A. High efficiency transformation of Salmonella typhimurium and Salmonella typhi by electroporation. Mol. Gen. Genet. 223 (1), 156-158 (1990).
- Hamashima, H., Nakano, T., Tamura, S., Arai, T. Genetic transformation of Vibrio parahaemolyticus, Vibrio alginolyticus, and Vibrio cholerae non O-1 with plasmid DNA by electroporation. Microbiol. Immunol. 34 (8), 703-708 (1990).
- Grones, J., Turna, J. Transformation of microorganisms with the plasmid vector with the replicon from pAC1 from Acetobacter pasteurianus. Biochem. Biophys. Res. Commun. 206 (3), 942-947 (1995).
- Allen, S. P., Blaschek, H. P. Electroporation-induced transformation of intact cells of Clostridium perfringens. Appl. Environ. Microbiol. 54, 2322-2324 (1988).
- Belliveau, B. H., Trevors, J. T. Transformation of Bacillus cereus vegetative cells by electroporation. Appl. Environ. Microbiol. 55, 1649-1652 (1989).
- Chassy, B. M., Flickinger, J. L. Transformation of Lactobacillus casei by electroporation. FEMS Microbiol. Lett. 44, 173-177 (1987).
- Dunny, G. M., Lee, L. N., LeBlanc, D. J. Improved electroporation and cloning vector system for gram-positive bacteria. Appl. Environ. Microbiol. 57 (4), 1194-1201 (1991).
- Micheletti, P. A., Sment, K. A., Konisky, J. Isolation of a coenzyme M-auxotrophic mutant and transformation by electroporation in Methanococcus voltae. J. Bacteriol. 173 (11), 3414-3418 (1991).
- Schleper, C., Kubo, K., Zillig, W. The particle SSV1 from the extremely thermophilic archaeon Sulfolobus is a virus: demonstration of infectivity and of transfection with viral DNA. Proc. Natl. Acad. Sci. U.S.A. 89 (16), 7645-7649 (1992).
- Aune, T. E., Aachmann, F. L. Methodologies to increase the transformation efficiencies and the range of bacteria that can be transformed. Appl. Microbiol. Biotechnol. 85 (5), 1301-1313 (2010).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166, 557 (1983).
- Unterweger, D., Kitaoka, M., et al. Constitutive Type VI Secretion System Expression Gives Vibrio cholerae Intra- and Interspecific Competitive Advantages. PLoS One. 7 (10), e48320 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon