Method Article
Electrocompetent의 준비를위한 신속한 프로토콜
요약
일렉트로 변형으로 알려진 공정에서 박테리아로 DNA를 도입하기위한 일반적으로 사용되는 방법이다. electrocompetent 세포의 제조를위한 기존의 프로토콜은 시간 소모적이고 노동 집약적이다. 이 문서는 다른, 빠른, 그리고 현재 일부 실험실에서 사용 electrocompetent 세포의 준비를위한 효율적인 방법을 설명합니다.
초록
전기 천공은 신속하고 효율적으로 셀의 넓은 범위로 외래 DNA를 도입하는 방법에 널리 이용되고있다. Electrotransformation 자연스럽게 능력이없는 원핵 세포에 DNA를 도입하는 선택의 방법이되고있다. 전기 천공은 정제 DNA 유능한 박테리아 외에도, 시판되는 유전자 펄스 제어부와 큐벳 필요 신속하고 효율적이며 능률적 변환 방법이다. 펄싱 단계 달리 electrocompetent 세포의 제조 미드 로그 상으로 성장 반복 멸균 냉수의 양을 감소 시키는데 원심 분리 및 세척의 라운드 또는 배양 대용량의 비 - 이온 성 버퍼를 포함하는 집중 시간 소모적이고 노동이며 성장. 시간과 노력은 상업적 출처 electrocompetent 세포를 구매하여 저장 될 수 있지만, 선택은 일반적 E. 고용에 한정 대장균 실험 균주. 우리는 이에 신속하게 보급되고electrocompetent E.을 준비하기위한 효율적인 방법 몇 시간 동안 세균학 실험실에서 사용, V.에 적용 할 수있다 대장균, 콜레라와 다른 원핵 생물. 우리가 독자적인 기술 개발을위한 신용에 누구를 확인할 수는 없지만, 우리는 이에 과학계가 사용할하고 있습니다.
서문
1980 년대 초 1에서의 '처음부터, 일렉트로는 중요한 분자 생물학 기술, 원형 또는 선형 핵산과 / 형질 살아있는 세포를 변환하기 위해 사용 가능성이 하나의 가장 일반적인 방법이되었다. 원래 진핵 세포 1의 형질 개발, 일렉트로은 이후 E.의 변화에 적응했다 콜라이 (2, 3). 세균학에서, 일렉트로 실험실 표준이되었습니다 및 그람 음성 슈도모나스 4, 살모넬라 5, Vibrios 6 Serratiae 및 Shigellae 7을 포함하여 박테리아의 넓은 범위를 변환하도록 수정되었습니다; 그람 양성 클로스 트리 디아 8, 바실러스 9, 유산균 10 및 장구균 11. 심지어 일부 고세균은 Methanococci 포함, 일렉트로으로 변환 의무 입증 12 Sulfolobus의 종 13. 종합적인 검토를 위해 오운과 Aachmann 14을 참조하십시오. 일렉트로 변환 효율은 화학 능력 또는 열 쇼크 2보다 소문에 의하면 10 ~ 20 배 높다. 그러나, 많은 1980 년대 15 더글라스 하나 한 최적화로 화학 능력에 박테리아를 준비 같은 세포는 또한 electrocompetent 할 준비를해야합니다.
전기 천공은 electrocompetent 박테리아, 정제 된 DNA, 전기 임펄스를 전달 펄스 제어 모듈 및 전극으로서 기능 작은 일회용 큐벳을 수용 챔버를 필요로하는, 세균성 변환의 신속하고 효과적인 방법이다. 간단히, 감기, 유능한 박테리아 30-45 분 동안 30-37 ℃에서 배양 성장 배지에 재현 탁 큐벳에 고전압 펄스 실시 플라스미드 DNA, 함께 혼합 한 후 반고체 배지 (영양 한천에 도금 아르 하거든 Appr와 함께 접시)선택적 항생제를 opriate.
펄싱 단계 electrocompetent E.의 제조 대조적 대장균은 전통적으로 대량으로 수행되는 다중 절차 남아있다. 간단히, 박테리아의 하룻밤 문화는 성장의 중반 로그 단계 (<1.0의 OD 600)로 성장하고, 멸균 비 직렬 세척을 실시 1 L 루리아 국물 (LB) 100 ㎖,와 삼각 플라스크에 접종 이온 4 ℃에서 볼륨을 감소 버퍼 또는 이중 증류수 (DDH 2 O) 큰 관심은 전체 절차를 통해 차가운 세포를 유지하고 오염을 방지하기 위해주의해야합니다. 이 멸균 원심 분리 버킷 및 비 이온 버퍼 또는 DDH 2 O의 사용, 진탕 배양기, 대용량 고속 냉장 원심 분리기 회 전자의 집합이 필요합니다. 세균은 결국 10 % 글리세롤이 보충 된 버퍼의 작은 부피에 재현 탁하고 ~ 40 μL 부피, WH로 분주된다무형 문화 유산은 사용할 때까지 -80 ° C에 저장됩니다. 저온 저장은 종종 인해 시간이 지남에 따라 생존의 손실을 감소 변환 효율성을 초래한다.
Electrocompetent 박테리아 세포는 상업 다양한 소스로부터 만 (자주 재조합 결핍) E.의 제한된 수도 있습니다 호스트가 플라스미드의 광범위한 전파로 대장균 균주는 일반적으로 채택했다. 그 결과 연구팀은 변환에 대한 자신의 변종 / 돌연변이를 준비하기 위해 사내 방법에 의존하고 있습니다.
electrocompetent E.의 제조를위한 대안, 신속하고 효율적인 프로토콜 대장균은 지금 시간이 몇 분자 세균학 실험실에서 사용되었으며, 우리의 경우 V.에 추가 그람 음성 세균으로 확장되었습니다 콜레라. 이 시간이 지남에 따라 다른 연구자에 의해 최적화 된 바와 같이 프로토콜의 송신자는 식별 될 수 없다. 여기에 제시된 방법은 우리의 실험 실용에 사용 된거의 두 수십 년 동안 이거, 그것은 우리의 동료와 함께이 유용한 프로토콜을 공유하는 것이 저희의 목표입니다.
프로토콜
1. 세균성 문화, 도구, 시약의 제조 (1 일, 오후)
- 늦은 오후, 1 ~ 5 ㎖의 멸균에서 멸균 LB의 국물 박테리아 (대장균 또는 V. 콜레라)의 작은 나누어지는와 (예를 들어, 100 × 13mm) 붕규산 유리 시험관에 접종.
- , 37 ° C 온도 (따뜻한 방이나 인큐베이터)에서 지내게 롤러 드럼에 접종 테스트 튜브를 설정 고속 롤러 드럼을 켜고 O / N을 품어
- 유리가 부드럽게 될 때까지 분젠 버너의 불꽃 막대의 중간을 가열하여 유리 막대에서 "하키 스틱"의 형태로 세포 스프레더를 준비하고 135 ° 각도로 핀셋이나 집게 부드럽게 굴곡을 직접 . 한번 더 단부 및 제 구부 사이 중간 지점에서로드를 가열하고 (제 벤드의 반대 방향) 안쪽으로 45 ° 각도로 구부리.
- 항생제없이 LB 한천을 준비하고 준비에 페트리 접시에 부어4 ° C에서 적절한 (일렉트로 할 벡터의 저항 마커에 따라) 항생제 및 저장을 포함 electrocompetence 프로토콜 및 LB 한천 플레이트
- 2 mM의 염화칼슘 V. 2 솔루션 살균 필터를 준비 E. 용 콜레라, 또는 오토 클레이브 DDH 2 O 4 ℃에서 대장균 및 저장
2. Electrocompetent 박테리아의 성장 (제 2 일 아침)
- 각 LB 한천 플레이트 상에 O / N 균 배양 100 μl를 제공, 냉동 글리세롤 주식도 활용하고 직접 접시에 전달 될 수있다.
- 100 %의 EtOH에서 하키 스틱 모양의 세포 스프레더를 찍어 간단히 배수 및 사용하기 전에 확산 소독하는 나머지의 EtOH를 구울 수 있습니다. 멸균 유리 셀 스프레더 (휴식) 한천 표면을 방해하는 확실하지 않은 결정으로 균등하게 100 μL의 O / N 박테리아 문화를 확산.
- 박테리아 성장의 얇은 잔디가 될 때까지 4 ~ 6 시간 동안 37 ° C에서 접시를 품어, 또는구별된다. 적극적으로 성장하면 세포는 대부분의 관할이다.
3. Electrocompetent 세균 세포의 준비 (제 2 일, 오후)
- 한천의 표면을 관통하거나 휴식 확실하지하고 멸균 접종 루프 박테리아를 수확. 하나 2mm 직경 박테리아 질량은 단일 변환 충분하다. 일반적으로이 접종 루프 두세 회 경상 잔디 표면을 긁는 요구한다. (일반적으로 4 ~ 6 사이에) 몇 가지 샘플은 같은 플레이트에서 수집 할 수있다.
- 1 ML 얼음처럼 차가운 2 ㎜ 염화칼슘 (V. cholerae의 경우) 또는 멸균 DDH 2 O (대장균)에있는 박테리아 질량을 재현 탁 더 덩어리가 보이지 않을 때까지 잘 섞어 얼음 계속.
- 원심 분리기 4 ° C 또는 11 ° C로 설정 냉장실에 저장되어있는 마이크로 원심의 설정 냉장 마이크로 원심 5,000 XG에서 5 분 각 세균 현탁액
- 상층 액, resusp 폐기빙냉 2 ㎜ 염화칼슘 또는 멸균 DDH 2 O의 동일 부피 세균 펠렛을 종료, 총 3 회 세척 한 번 더 해본 같이 원심 분리 단계를 반복한다.
- 상층 액에 resuspend를 제거하고 40 ㎕의 얼음 추위에 철저하게 2 ㎜ 염화칼슘 또는 멸균 DDH 2 O를 박테리아 펠렛을 풀고 얼음 계속.
4. Electrocompetent 박테리아의 변환 (DAY 2 일 오후)
- 40 ㎕의 세균 현탁액에 플라스미드 DNA (최대 1 μL 물 또는 트리스 - EDTA (에틸렌 다이아 민 테트라 초산) 버퍼)의 1 μg을 추가하고 미리 냉장, 무균 0.2 cm 간격 베트로이 혼합물을 전송합니다. DNA 샘플에서 염 농도는 다음 단계에서 펄스의 아킹을 올릴 수있는 바와 같이, 로우이어야한다.
- 펄스 제어 모듈의 일렉트로 챔버에 큐벳을 삽입하고, 1.8 kV의 25 μF에서 electroporate. 시간 상수는 ~ 5.0 밀리 초이어야하고, 아킹은 발생하지 않습니다.
- 빨리 1 ㎖ LB 브로스에 재현 탁하여 세포 현탁액을 회수하고 멸균 이전 붕규산 유리 시험관에 옮긴다.
- 세포가 항생제 선택하지 않고 30 분 동안 37 ° C에서 (롤러 드럼) 폭기 성장 조건에서 배양하여 복구 할 수 있습니다.
- 적합한 선택제 (항생제)의 존재 하에서 미리 제조 LB 아가 플레이트 상에 박테리아 플레이트, 및 37 ° CO / N. 부화 박테리아는 정제 벡터 (0.1-1 μg 수퍼 코일 플라스미드)의 높은 농도로 변환하는 경우, LB 한천 플레이트의 가장자리에와 상한 행진 방법을 사용하여 격리 된 식민지에 대한 멸균 접종 루프 행진 세균 배양의 10 μl를 제공합니다. 결찰 혼합물 변형 된 경우, 각 한천 플레이트에 균 배양 100 μl를 제공하고 균등하게 멸균 유리 셀 스프레더로 확산.
시간 상수 (BE 짧으면낮은 3.5 밀리 초), 또는 펄스는, DNA 샘플을 다시 침전 건조하기 전에 염을 제거하기 위해 두 번 70 % EtOH로 세척하고 TE 버퍼에 재현 탁, 아크 발생합니다.
결과
우리는 E.로 변환 세트를 실시 대장균 및 V. 콜레라는 원래 electrocompetent 박테리아의 준비를 위해 결혼 지참금 등. 2에 의해 기술 (전통적인) 방법의 적응과 우리의 빠른 방법의 변환 효율을 비교합니다. 적격 세포의 전통적인 제조를 수행하기 위해, 2-L 삼각 플라스크에 500 ㎖의 LB는 E. 500 μL 하룻밤 배양 접종했다 대장균 DH5α 또는 V. 진탕 기 (37 ° C에서 215 RPM)에서 배양하고 0.5 ~ 1.0 사이의 OD 600에서 수확의 cholerae O395. 플라스크를 얼음 냉각시키고, 문화를 4 ℃에서 10 분 동안 4,000 XG에서 미리 냉장 회에서 원심 분리 세포 펠렛을 철저히 V. 500 ML 얼음처럼 차가운 2 ㎜ 염화칼슘에 재현 탁 E. 용 콜레라와 DDH 2 O 콜라이, 다시 원심 분리하여 동일 조건 하에서. 재 부유의 후속 라운드D 원심 분리는 반드시 문화가 4 ℃에서 냉장 유지하고 200의 볼륨과 100 ㎖의 볼륨을 감소 실시 하였다 마지막으로, 10 ml의 부피에서 재 부유하고 원심 분리를 10 % 글리세롤로 행했다. 최종 펠렛은 2 ㎖의 10 % 글리세롤에 재현 탁하고, 40 ㎕의 분취 액은 -80 ° C에서 냉동하지 전에 일렉트로 1 주일보다 더 이상 저장되었습니다.
펄스 설정과 베트의 크기를 포함 일렉트로 조건에 관계없이 유능한 세포의 준비 방법의 모든 electroporations 두 종의 박테리아에 대한 동일했다. 유일한 차이는 우리가 감기 DDH에서 E. 2 O를 세척을 실시이었다 대장균 및 V. 감기 2 ㎜ 염화칼슘 콜레라. 표 1과 동일하지만, 빠른 프로토콜을 사용하거나 전통적인 방법 중 하나를 관할 렌더링 일렉트로에 의해 변형 박테리아의 결과. 우리는 일반적으로 변형 O395과 DH5α를 사용V.의 LY 사용, 대표 변종 콜레라와 E. 각각 대장균, 유사한 결과 (매일 변형이 테스트되었습니다되지이기는하지만) 같은 종의 다른 변종을 얻을 가능성이 아마 넘어 다른 그람 음성 세균에 적용 할 수 있습니다.
동일한 세포 수는 펄스 각각의 배치에 존재 것을 확실히하기 위해, 빠른 방법을 이용하여 생성 electrocompetent 박테리아, 수집에 풀링 혼합, 균일하게 정지 보관하고, 곧 이전의 일렉트로 40 μL 볼륨에 분주했다. 전통적인 방법을 이용하여 생성 Electrocompetent 박테리아는 유사 이전의 40 μL 씩 분주 동결로 처리 하였다. 펄스가 송달 된 후, 40 ㎕의 electroporation하여 박테리아의 각 배치는 400 ㎕의 LB에 중단 및 직렬 1시 10분 희석시켰다. 각 희석 백 마이크로 리터는 100 ㎍ / ㎖의 암피실린의 존재에 LB 한천에 도금 및 멸균 유리 셀 스프레더를 사용하여 확산되었다밤새 37 ° C에서 배양 하였다. 각각의 형질 전환에 사용 박테리아의 총 수를 정량화하기 위해, 각각 준비 배치 electrocompetent 박테리아의 40 μL 볼륨은 순차적 희석하고, 동일하게 평행 항생제없이 LB 한천 배지에 플레이 팅 하였다. 각 배치에서 동등하게 취급 박테리아 중 하나 분취 DNA가없는 1 ㎕의 트리스-EDTA (TE) 버퍼 만 (모의 변환), 직렬로의 배송을 잃은 세포의 수를 추정하기 위해 항생제없이 희석 LB 한천에 도금 일렉트로했다 전기 펄스. 마지막으로, 실험에 하나의 추가 변화는 일렉트로하지만 LB 한천에 도금하기 전에이 형질 전환 된 세포의 회복에 영향을 미칠 후 1 ㎖의 LB에 37 ° C에서 30 분 배양 여부를 결정하기 위해 실시 하였다. 콜로니 형성 단위 (CFUs)는 다음 날에 열거 하였다.
이 실험을 위해 우리는 한 pUC18, 일반적인 실험실 플라스미드를 고용하고 유능한 박테리아의 일괄 처리로 구성된pproximately 세포에 대한 10 8 CFUs는 기존의 방법과 빠른 프로토콜을 이용하여 제조 된 세포에 대한 10 7 CFUs을 이용하여 제조. (DNA)없이 단독으로 일렉트로 무관 electrocompetent 세포를 제조하는데 사용되는 방법의 접어 10-100에 의해 실행 가능한 CFUs을 감소시켰다. 표 1에 나타낸 바와 같이, 형질 전환 수율은 E. 세 복제 실험 (괄호 안은 표준 편차)의 DNA 범위의 10 6 -10 7 CFUs / μg 이내였다 대장균 (DH5α) 및 V. 콜레라 (O395)는 각각 electrocompetent 전지 제조를위한 전통, 더 긴 방법을 사용하여. 형질 전환 수율은 E. 세 복제 실험 (괄호 안은 표준 편차)에있는 DNA의 10 5 -10 6 CFUs / μg 감소 10 배 등장 대장균 및 V. 신속한 방법을 이용하여 각각의 cholerae. 따라서 우리는 변형 CFUs 나누어 변형 박테리아의 비율을 결정CFUs의 수는 유능한 세포의, 그렇지 않으면 동일한 일괄 처리에서 (플라스미드없이) "모의 변환"에서 회복하여. 형질 전환 된 박테리아의 비율에 관계없이 준비하고 (표 1 괄호 숫자) 변환 종의 방법의 하나의 로그 (2.5-9.4 %) 이내였다. 이러한 결과는 빠른 방법의 효율성 유능한 세포를 준비하고 콜레라 균과 대장균의 대표 균주가 빠른 절차에 동등하게 의무가 있는지의 전통적인 더 긴 절차의 비교입니다 것이 좋습니다.
우리는 β-락타 마제 카세트를 숨겨을 pUC18 같은 플라스미드를 들어, LB의 국물에 30 분 복구 시간에 영향을받지 않습니다, 그 변환 효율을 발견했다. 형질 전환 체의 동일 개수가 직접, 전기 천공 후에, 또는 그들이 30-45 분 복구 시간을 허용되었는지 세포 앰피 실린의 존재하에 LB 한천 배지에 도말 여부를 회수했다이전 도금 37 ° C에서 LB의 국물에. 암피실린 저항은 비 선택적 조건 하에서 부산물을 필요로하지 않는다는 것을 우리의 연구 결과는 β-락타 마제 발현이 변형에 충분히 빠르게 발생하는 것을 제안합니다. 그러나, 우리는 감전으로부터 회복에 기여하고 유전자 발현을 시작할 수도 LB 액체 배지에서 펄스 박테리아의 희석으로 이루어진 것을 주목해야한다.
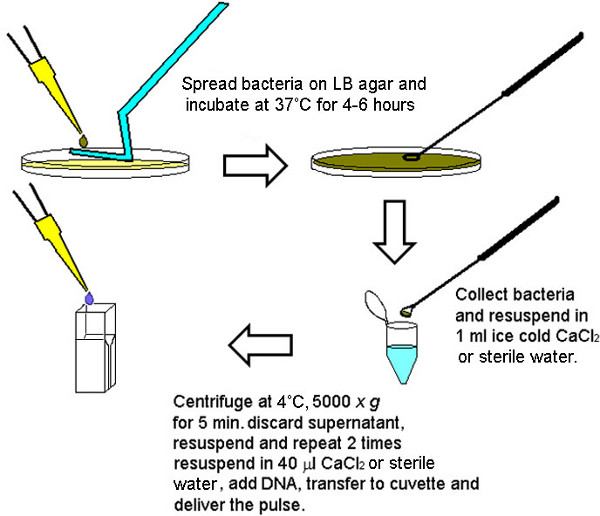
그림 1. electrocompetent 균의 신속한 제조를위한 방법론의 그래픽 묘사. 4-6 시간 후 (접종원의 밀도에 따라) 박테리아의 충분한 숫자는 단일 LB 한천 플레이트에서 4-6 변환을 수행하기 위해 수집 될 수있다. 일렉트로 될 각 최종 부피에 대한 적격 세포의 동일한 수를 확보하기 위해, LB 아가 플레이트로부터 수집 된 박테리아는 초기 앨라배마 후에 함께 모으고 세정펠렛의 크기에 따라 40 μL 볼륨에 iquoted (큰 펠릿은 40 μL로 나누어 큰 볼륨에 희석).
| 암피실린 내성 형질 전환 / μg의 DNA 수 (암피실린 내성 형질 전환 회복 [%]) | ||
| 변형 | 전통적인 방법 | 빠른 방법 |
| 대장균 (DH5α) | 2.3 × 10 6 (5 10 × 7.3 ±) [9.4 %] | 3 × 10 6 (5 10 × 7.1 ±) [2.5 %] |
| V. cholerae의 (O395) | 4 × 10 7 (7 ~ 10 X 1.7 ±) 5 %] | 6.7 × 10 5 (5 10 × 2.1 ±) [3.3 %] |
표 1. electrocompetent B의 DNA (을 pUC18)의 마이크로 그램 당 변환 효율acteria 신속한 방법에 비해 전통적인 방법으로 제조.
모든 변형은 (1 % 아가로 오스 겔 전기 영동으로 가시화로 ~ 80 % 수퍼 코일 DNA) 500 ng를 한 pUC18 DNA로 수행하고, 일렉트로 셀 직렬 항생제 LB 한천에 CFU를 위해 도금 이전에 LB 액체 배지에서 10 배 희석 하였다. 비 일렉트로 박테리아 플라스미드없이 electroporation하여 박테리아의 컨트롤이 직렬 항생제없이 희석하고, LB 한천에 도금 전에 깜박임 후의 생균의 총 수를 결정하기 위해 변환의 각 세트에 대해 수행 하였다. 일렉트로 컨트롤 성공적 형질 생균의 퍼센트에 대한 기준선을 나타낸다.
토론
변환 효율에 관계없이 유능한 세포를 준비하기 위해 사용되는 방법의 다양한 요인에 따라 달라질 수 있습니다. 유사 변수는이 방법에 적용, 큰주의가되어야한다는 세포들이 일정한 저온 (더 높은 ° 4 이상 C)로 유지되도록 한천 플레이트에서 수확 한 번. 세균 잔디 적극적으로 수집시 성장해야하며 세포 성장의 중간 로그 상에 있어야합니다. DNA (염 즉, 오염)의 품질은 변환 효율에 영향을 미친다. 이 방법을 사용하는 경우 특히, 한천 큐벳에있는 한천 조각이 펄스의 아크가 발생합니다 깨진 수 없습니다.
이 기술로 발생하는 대부분의 문제는 두 가지 문제와 관련된 그들은 적극적으로 성장하는 경우 한천 플레이트에서 시간의 적절한 창 동안 박테리아를 수집. 너무 빨리를 수집하는 것은 불충분 한 세포 수를 산출하고 렌더링그들이 형성하는 "pellicule"는 판의 표면을 떠 어렵 기 때문에 실망 LB 한천 플레이트를 긁어. 수집 박테리아는 너무 늦게 극적으로 자신의 능력을 감소합니다. 시간 창은 자연스럽게 LB 아가 플레이트 상에 플레이 팅 종균의 밀도에 의존 될 것이다. 두 번째 중요한 단계는이 변환 다음 LB 한천에 도금 될 때까지 그들은 한천 플레이트를 들어 올려 염화칼슘 또는 DDH 2 O에 재현 탁하는 순간부터 (4 ° C) 차가운 박테리아를 유지하는 것입니다. 박테리아, 큐벳과 버퍼를 포함하는의 미세 튜브는 미리 냉각하고 박테리아가 도금 될 때까지 항상 얼음에 보관해야합니다. 멸균 DDH 2 O 또는 염화칼슘이 침전물을 포함하거나 오염되는 경우에는 추가 문제가 발생할 수 있습니다. 이러한 이유로 우리는이 시약 신선한 준비하는 것이 좋습니다.
문제 해결의 변환은 학사 학위를 변환 할 때 컨트롤을 포함하여 용이cteria는 어떤 방법으로 능력을 렌더링합니다. 선택적 마커를 함유하는 LB 아가 플레이트 상에 플레이 팅 비 형질 전환 박테리아의 능력 배치 이루어진 대조군 급속 플레이트에 항생제가 효과적인지 여부를 결정하는 것을 도울 것이다. 실험 샘플과 같은 선택적 마커를 숨겨 좋은 품질과 수량의 알려진 플라스미드 준비와 양성 대조군 변환은 박테리아가 능력이 아니라 변형 실험 DNA가 양 또는 질에 충분한인지 여부를 결정하는 데 도움이 될 것입니다.
이 기술의 장점은 여러이며 방법은 변환이 계획되어 당일 내에서 수행 될 수있다. 우리는 (야간 문화를보기 전에 하루를 시작 잊고 후) "긴급"상황에서이 작업을 수행 한, 우리는 얼어 붙은 세균의 글리세롤 주식 electrocompetence 손실없이 LB 한천에 직접 도금 될 수 있다는 것을 발견했다. 우리는 전자를 테스트 할 수 있지만매우 긴장 어떤 E.에게 알려진 대장균 또는 V. 전기 충격에 의해 변형 될 수있다 콜레라 긴장은 우리의 손에이 의정서의 의무가있다. 이 기술은, 빠른 효과, 전통적인 방법을 사용 electrocompetent 박테리아를 준비에서 얻은 수익률은 변환 효율 비교. 이 방법은 고속 원심 분리기와 관련 로터, 궤도 보육 흔드는 멸균 원심 분리기 버킷 (컨테이너), 및 멸균 버퍼의 큰 볼륨에 대한 요구 사항을 제거 할 수 있습니다. 특정 시약 및 장비의 표는 매우 포괄적이지만, 일렉트로을 수행하는 대부분의 실험실은 이미 이러한 자료의 대부분이 아니더라도 모든 것입니다. 아마도 가장 중요한 기술은 용이하게 빠르게 돌연변이 배경을 electrocompetent 실험실 특정 균주를 생성하기 위해 적용될 수있다. 이 ELEC의 준비의 전통적인 방법을 대체했다로 우리는이 기술의 한계를 자각하는우리의 실험실에서 박테리아를 trocompetent.
여기에 표시된 실험의 결과를 1 주일 이상 더 이상을 위해 -80 ° C에 저장했던 전통적인 방법으로 생산 된 신선한 electrocompetent 세포를 실시했다. 그러나, 냉동 electrocompetent 세포 주식은 장기간 보관을 통해 능력과 또는 생존 능력을 잃게됩니다. 우리의 요약 된 프로토콜은 같은 날 변환이 감소 형질 전환 수율이 발생할 수 있습니다 주식의 나이에 대한 우려없이 계획되어 신선한 electrocompetent 세포의 제조를 허용한다. 우리는이 필요한되지 않았기 때문에 다른 날에 사용하기 위해 빠른 방법을 사용하여 생산 electrocompetent 세포를 저장하는 시도하지 않았습니다.
여기에 도시되지는 않았지만, electrocompetent 셀의 효율은 우리의 신속한 방법 결찰 혼합물 충분하여 제조. 비-O1 V.에 대해보고 된 변환 Unterweger 등의 최근 기사에서 콜레라.(17) (접합에 의해 수행 제외한) 여기서 설명한 방법으로 제조 electrocompetent 박테리아를 사용하여 수행 하였다. 이 기술은 세포의 큰 배치를 준비 할 필요없이 신속하고 효과적으로 돌연변이 배경을 가진 균주를 변환하는 연구자를 제공한다. electrocompetent 박테리아 방법이 빠른 준비는 준비의 원칙으로 일렉트로 의무 것으로 표시되었습니다 및 일렉트로 설정이 기존의 프로토콜과 동일 할 예정 다른 원핵 생물에 적용 할 수 있습니다.
공개
어떤 공개는 적용되지 않습니다.
감사의 말
저자는 자신의 동료들과이 기술의 개발을 지원 한 현재와 과거 연구소의 직원에게 감사의 말씀을 전합니다. SP의 실험실을위한 캐나다 연구소에 의해 지원되는 건강 연구 운영 그랜트 MOP-84473 및 (의학 연구 기금 기금 앨버타 헤리티지 재단 후원) 앨버타 Innovates가 건강 솔루션을 제공합니다. DP의는 MD001091-01 GM068855-02을 부여는 건강의 국립 연구소에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Gene Pulser Module | Bio-Rad | 165-2668 | |
| Gene Pulser Cuvette Chamber | Bio-Rad | 165-2669 | |
| Electrocuvettes (0.2 cm gap) | Bio-Rad | 165-2082 | |
| 13 x 100 mm Pyrex Rimless Culture Tubes | Corning | 70820-13 | |
| 13 mm Culture Tube Closures | Cole Parmer | EW-04500-00 | |
| 6 x 250 mm Glass Rod | Lab Source | 11381D | |
| Disposable Petri Dishes | Fisher Scientific | 08-757-12 | |
| Roller Drum Motor Assembly | New Brunswick Scientific | M1053-4004 | |
| Roller Drum for 13 x 100 mm Culture Tubes | New Brunswick Scientific | M1053-0306 | |
| Calcium chloride | Sigma Chemicals | C5670 | |
| Ethanol, anhydrous/denatured | Sigma Chemicals | 227649 | |
| Inoculating Loop | Decon Labs | MP182-5 | |
| Refrigerated Microcentrifuge 5451 R | Eppendorf | 22621425 | |
| Bunsen Burner | Fisher Scientific | 03-917Q | |
| LB Broth MILLER | EMD | 1.10285.0500 | |
| Bacteriological Agar | Fisher Scientific | S25127 |
참고문헌
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1 (7), 841-845 (1982).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16 (13), 6127-6145 (1988).
- Taketo, A. DNA transfection of Escherichia coli by electroporation. Biochim. Biophys. Acta. 949 (3), 318-324 (1988).
- Fiedler, S., Wirth, R. Transformation of bacteria with plasmid DNA by electroporation. Anal. Biochem. 170 (1), 38-44 (1988).
- O'Callaghan, D., Charbit, A. High efficiency transformation of Salmonella typhimurium and Salmonella typhi by electroporation. Mol. Gen. Genet. 223 (1), 156-158 (1990).
- Hamashima, H., Nakano, T., Tamura, S., Arai, T. Genetic transformation of Vibrio parahaemolyticus, Vibrio alginolyticus, and Vibrio cholerae non O-1 with plasmid DNA by electroporation. Microbiol. Immunol. 34 (8), 703-708 (1990).
- Grones, J., Turna, J. Transformation of microorganisms with the plasmid vector with the replicon from pAC1 from Acetobacter pasteurianus. Biochem. Biophys. Res. Commun. 206 (3), 942-947 (1995).
- Allen, S. P., Blaschek, H. P. Electroporation-induced transformation of intact cells of Clostridium perfringens. Appl. Environ. Microbiol. 54, 2322-2324 (1988).
- Belliveau, B. H., Trevors, J. T. Transformation of Bacillus cereus vegetative cells by electroporation. Appl. Environ. Microbiol. 55, 1649-1652 (1989).
- Chassy, B. M., Flickinger, J. L. Transformation of Lactobacillus casei by electroporation. FEMS Microbiol. Lett. 44, 173-177 (1987).
- Dunny, G. M., Lee, L. N., LeBlanc, D. J. Improved electroporation and cloning vector system for gram-positive bacteria. Appl. Environ. Microbiol. 57 (4), 1194-1201 (1991).
- Micheletti, P. A., Sment, K. A., Konisky, J. Isolation of a coenzyme M-auxotrophic mutant and transformation by electroporation in Methanococcus voltae. J. Bacteriol. 173 (11), 3414-3418 (1991).
- Schleper, C., Kubo, K., Zillig, W. The particle SSV1 from the extremely thermophilic archaeon Sulfolobus is a virus: demonstration of infectivity and of transfection with viral DNA. Proc. Natl. Acad. Sci. U.S.A. 89 (16), 7645-7649 (1992).
- Aune, T. E., Aachmann, F. L. Methodologies to increase the transformation efficiencies and the range of bacteria that can be transformed. Appl. Microbiol. Biotechnol. 85 (5), 1301-1313 (2010).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166, 557(1983).
- Unterweger, D., Kitaoka, M., et al. Constitutive Type VI Secretion System Expression Gives Vibrio cholerae Intra- and Interspecific Competitive Advantages. PLoS One. 7 (10), e48320(2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유