Method Article
Protocolo Rápido para Preparação de electrocompetentes
Neste Artigo
Resumo
A electroporação é um método vulgarmente utilizado para a introdução de ADN em bactérias, num processo conhecido como transformação. Protocolos tradicionais para a preparação de células electrocompetentes são demorados e trabalhosos. Este artigo descreve uma alternativa, rápida e eficiente método para a preparação de células electrocompetentes atualmente empregadas por alguns laboratórios.
Resumo
A electroporação tornou-se um método amplamente utilizado para rapidamente e eficientemente a introdução de ADN estranho em uma ampla variedade de células. Eletrotransformação tornou-se o método de eleição para a introdução de ADN em procariotas que não são naturalmente competente. A electroporação é um método de transformação rápida, eficiente, e simplificada, que, além de ADN purificado e bactérias competentes, requer disponível comercialmente controlador de impulsos de genes e tinas. Em contraste com o passo de condicionamento, a preparação de células electrocompetentes é moroso e de trabalho intenso que envolve ciclos repetidos de centrifugação e lavagens com uma redução dos volumes de água esterilizada, fria, ou tampões não-iónicos de grandes volumes de culturas cultivadas até à fase semi-logarítmica crescimento. Tempo e esforço podem ser salvas através da compra de células electrocompetentes de fontes comerciais, mas a seleção é limitada a comumente empregada E. estirpes laboratoriais coli. Estamos aqui divulgando uma rápida emétodo eficiente para preparar electrocompetentes E. coli, o que tem sido utilizado por laboratórios de bacteriologia por algum tempo, pode ser adaptado para V. cholerae e outros procariotas. Embora não possamos saber quem ao crédito para o desenvolvimento da técnica original, estamos aqui tornando-o disponível para a comunidade científica.
Introdução
Desde a sua 'criação no início dos anos 1980 1, eletroporação tornou-se uma técnica de biologia molecular integral, provavelmente, o único método mais comum empregado para transformar / transfectar células vivas com ácidos nucléicos circulares ou lineares. Desenvolvida originalmente para a transfecção de células eucarióticas 1, electroporação foi subsequentemente adaptado para a transformação de E. coli 2, 3. Em bacteriologia, electroporação tornou-se o padrão de laboratório e foi modificado para transformar uma vasta gama de bactérias, incluindo bactérias Gram-negativas Pseudomonas 4, 5 Salmonella, Vibrios 6, Serratiae, e bacilos disentéricos 7; Clostridia Gram-positivos 8, Bacilos 9, 10 Lactobacilos e enterococos 11. Mesmo algumas arqueobactérias provaram susceptível à transformação por electroporação, incluindo Methanococci 12 e 13 Sulfolobus espécies. Para uma revisão abrangente consulte Aune e Aachmann 14. Eficiência de transformação por eletroporação é declaradamente 10-20 vezes maior do que a competência química ou choque térmico 2. No entanto, assim como a preparação de bactérias para a competência química como otimizado por Douglas Hanahan na década de 1980 15, as células também deve estar preparado para ser electrocompetentes.
Eletroporação é um meio rápido e eficaz de transformação bacteriana, exigindo bactérias electrocompetentes, DNA purificado, um módulo de controle de pulso que fornece o impulso elétrico, e uma câmara que acomoda pequenas células descartáveis, que funcionam como um eletrodo. Resumidamente, as bactérias competentes frias, são misturados com o DNA de plasmídeo, submetido a um impulso de alta tensão numa cuvete, ressuspensas em meio de crescimento, incubadas a 30-37 ° C durante 30-45 min, e, em seguida plaqueadas em meio semi-sólido (agar nutriente placas), com a aproxopriate antibiótico seletiva.
Em contraste com o passo de condicionamento, a preparação de electrocompetentes E. coli continua a ser um processo de várias partes que tradicionalmente é realizado em grandes volumes. Resumidamente, uma cultura durante a noite de bactérias é inoculado num balão de Erlenmeyer com 100 ml a 1 litro de Luria Broth (LB), crescidas até à fase semi-logarítmica de crescimento (DO600 de <1,0), e sujeitos a lavagens em série com um não estéril iónico tampão ou água bidestilada (ddH2O), em uma redução dos volumes a 4 ° C. Grande cuidado deve ser tomado para manter as células frio durante todo o procedimento e evitar a contaminação. Isto requer a utilização de baldes centrifugação autoclavados e tampões não-iónicos ou ddH2O, uma incubadora agitador orbital, um volume grande de alta velocidade centrífuga refrigerada e um conjunto de rotores. As bactérias são finalmente ressuspensas num pequeno volume de tampão suplementado com 10% de glicerol e divididas em alíquotas para ~ 40 volumes ul, which são armazenadas a -80 ° C até à sua utilização. De armazenamento a baixa temperatura, muitas vezes resulta em eficiências de transformação diminuiu, devido à perda de viabilidade ao longo do tempo.
Células bacterianas electrocompetentes estão também disponíveis a partir de uma variedade de fontes comerciais, mas apenas para um número limitado de (frequentemente recombinação deficiente) E. coli como hospedeiros vulgarmente utilizados para propagar uma vasta gama de plasmídeos. Como resultado os pesquisadores contam com métodos in-house para preparar as suas próprias linhagens / mutantes para a transformação.
Um suplente, protocolo rápido e eficiente para a preparação de electrocompetentes E. coli tem sido usada por alguns laboratórios de bacteriologia molecular por algum tempo e agora foi estendido para as bactérias Gram-negativas adicionais, no nosso caso V. cholerae. O criador do protocolo não pode ser identificado, pois foi otimizado por outros pesquisadores ao longo do tempo. O método aqui apresentado foi usado no nosso laborats por quase duas décadas, e é nosso objetivo de compartilhar esse protocolo útil com nossos pares.
Protocolo
1. Preparação de culturas bacterianas, Ferramentas e Reagentes (dia 1, Tarde)
- No final da tarde, inocular 1-5 ml de caldo LB autoclavado em estéril (por exemplo, 100 x 13 mm) tubos de ensaio de vidro de borosilicato com uma pequena alíquota de bactérias (E. coli ou V. cholerae).
- Defina os tubos de ensaio inoculados em um tambor rolo alojados a 37 ° C de temperatura (sala quente ou incubadora), ligue o tambor rolo em alta velocidade, e incubar O / N.
- Preparar um espalhador de célula na forma de um "stick de hóquei" de uma vareta de vidro por aquecimento do meio da haste na chama de um bico de Bunsen, até o vidro amolece e, em seguida, dirigir a curva suavemente com uma pinça ou um alicate em um ângulo de 135 ° . Aquece-se a haste de, mais uma vez, no ponto médio entre a extremidade e a primeira curva e dobrá-lo em um ângulo de 45 ° para dentro (no sentido oposto ao da primeira curva).
- Prepare LB-agar sem antibióticos e despeje em placas de Petri, em preparação daprotocolo electrocompetence, e LB-agar placas contendo o antibiótico apropriado (de acordo com o marcador de resistência no vector a ser electroporada), e armazenar a 4 ° C.
- Preparar um filtro esterilizado de CaCl 2 a 2 mM para a solução de V. cholerae, ou autoclave DDH 2 O para E. coli, e armazenar a 4 ° C.
2. Crescimento de electrocompetentes Bactérias (DIA 2, Manhã)
- Entregar 100 ul da cultura bacteriana S / N em cada placa de agar LB, os estoques de glicerol congelados podem também ser utilizados e entregue directamente sobre a placa.
- Mergulhe o hóquei em forma de bastão espalhador de celular em 100% EtOH, escorra rapidamente e queimar o restante EtOH para esterilizar antes do uso e disseminação. Espalhe a cultura bacteriana 100 l O / N uniformemente com o espalhador célula de vidro estéril tomando cuidado para não perturbar (break) a superfície do ágar.
- Incubar a placa a 37 ° C durante 4-6 horas, ou até que um relvado fina de crescimento bacteriano servem distinguíveis. As células são mais competente quando crescendo ativamente.
3. Preparação de electrocompetentes bacterianas Cells (dia 2, à tarde)
- Colha as bactérias com uma ansa de inoculação estéril tomando cuidado para não furar ou quebrar a superfície do ágar. Uma massa bacteriana 2 mm de diâmetro é suficiente para uma única transformação. Tipicamente, isto requer a raspagem da superfície da relva fina com a ansa de inoculação de duas ou três vezes. Várias amostras (normalmente entre 4-6) podem ser recolhidos a partir do mesmo prato.
- Ressuspender a massa bacteriana em 1 ml de gelado 2 mM de CaCl2 (para V. cholerae) ou estéril ddH2O (para E. coli) e misture bem até que não são visíveis aglomerados, manter em gelo.
- Centrifugar cada suspensão bacteriana durante 5 min a 5000 x g numa microcentrífuga refrigerado ajustado para 4 ° C, ou em uma microcentrífuga armazenada num quarto frio para definir a 4 ° C.
- Desprezar o sobrenadante, resuspterminar o sedimento bacteriano no mesmo volume de 2 mM de CaCl 2 gelada ou ddH2O estéril, e repetir a etapa de centrifugação, tal como feito antes de mais duas vezes para um total de três lavagens.
- Remover o sobrenadante, ressuspender, e em seguida soltar a pelota bacteriana completamente em 40 mL de gelo frio de 2 mM de CaCl2 ou estéril ddH2O e manter em gelo.
4. Transformação de electrocompetentes Bactérias (dia 2, à tarde)
- Adicione-se a 1 ug de DNA de plasmídeo (até 1 uL de água ou solução tampão de Tris-EDTA) a suspensão bacteriana e transferir 40 ul desta mistura num pré-gelada, estéril cuvete 0,2 centímetros lacuna. A concentração de sal na amostra de DNA deve ser acessível a, uma vez que irá contribuir para a formação de arco do pulso no passo seguinte.
- Coloque a célula para a câmara de eletroporação do módulo de controle de pulso, e electroporate em 1,8 kV, 25 mF. A constante de tempo deve ser ~ 5.0 ms, e nenhum arco deve ocorrer.
- Recuperar rapidamente a suspensão de células por ressuspensão em 1 ml de caldo LB e transferir para previamente autoclavada tubo de vidro de borosilicato.
- Permitir que as células para recuperar por incubação sob condições de crescimento gaseificadas (num tambor de rolos), a 37 ° C durante 30 min sem selecção de antibiótico.
- Placa as bactérias em placas de agar LB previamente preparadas na presença do agente selectivo apropriado (antibiótico), e incuba-se a 37 ° CO / N. Se as bactérias são transformadas com uma elevada concentração de vector purificado (0,1-1 ug de plasmídeo super-enrolado), volumes 10 mL de cultura bacteriana sobre a borda da placa de agar LB e com uma sequência de ansa de inoculação estéril para colónias isoladas usando o método de sequência de quadrante. Se uma mistura de ligação foi transformada, entregar 100 ml de cultura bacteriana em cada placa de ágar e espalhar uniformemente com o espalhador de célula de vidro esterilizado.
a Se a constante de tempo é curto (serbaixo 3,5 ms), ou pulsação leva a formação de arco eléctrico, em seguida, re-precipitar o ADN da amostra, lava-se com EtOH a 70%, duas vezes para remover sais antes da secagem e ressuspensão em tampão TE.
Resultados
Foi realizado um conjunto de transformações com E. coli e V. cholerae para comparar a eficiência de transformação da nossa metodologia rápida com uma adaptação do método (tradicional) originalmente descrito por Dower et al. 2 para a preparação de bactérias electrocompetentes. Para levar a cabo a preparação tradicional de células competentes, 500 ml de LB num balão Erlenmeyer de 2 L-foram inoculados com 500 ul da cultura durante a noite de E. coli DH5a ou V. cholerae O395, incubadas num agitador orbital (215 rpm, a 37 ° C) e colhidas em OD 600 de entre 0,5-1,0. O frasco foi arrefecido em gelo e as culturas centrifugada num rotor pré-refrigerada a 4000 xg durante 10 min a 4 ° C. As pelotas de células foram cuidadosamente ressuspendidas em 500 ml de 2 mM de CaCl 2 gelada para V. cholerae e DDH 2 O para E. coli, e centrifugado novamente nas mesmas condições. Rodadas subsequentes de uma ressuspensãod centrifugação foram realizados em uma redução dos volumes de 200 e 100 ml volumes certificando-se a cultura permaneceu refrigeradas a 4 ° C. Finalmente, uma ressuspensão e centrifugação num volume de 10 ml foi efectuada com 10% de glicerol. O sedimento final foi ressuspenso em 2 ml de glicerol a 10% e 40 mL alíquotas foram congeladas a -80 ° C e não armazenado do que uma semana antes da electroporação.
Condições de eletroporação incluindo as configurações de tamanho de pulso e tina foram idênticos para as duas espécies de bactérias em todas as electroporations independentemente do método de preparação das células competentes. A única diferença foi que realizou as lavagens em DDH 2 O frio para E. coli e frio mM CaCl 2 2 para V. cholerae. Tabela 1 mostra os resultados de bactérias transformadas por electroporação de forma idêntica, mas tornadas competentes ou com o protocolo rápido ou com o método tradicional. Nós empregamos O395 tensão e DH5ct tão comumutilizados ly, estirpes representativas de V. cholerae e E. coli, respectivamente, com resultados semelhantes podem ser obtidos com outras estirpes da mesma espécie (embora não a cada estirpe foi testado) e susceptível adaptado para outras bactérias gram-negativas e, provavelmente, mais além.
Para garantir que os números de células iguais estavam presentes em cada lote pulsada, bactérias electrocompetentes gerados utilizando o método rápido foram reunidas após a recolha, misturada, mantida de forma homogénea em suspensão, e aliquotado em 40 volumes ul imediatamente antes da electroporação. Bactérias electrocompetentes gerados utilizando o método tradicional foram tratados da mesma forma antes de congelar em 40 mL alíquotas. Após a entrega do impulso, de cada lote de 40 uL de bactérias electroporadas foi suspensa em 400 ul de LB e diluída em série 1:10. Cem microlitros de cada diluição em placas em agar de LB na presença de 100 ug / ml de ampicilina e espalhar usando um espalhador de vidro estéril de célulase incubou-se a 37 ° C durante a noite. Para quantificar o número total de bactérias empregues em cada transformação, 40 volumes ul de bactérias electrocompetentes de cada lote preparado foram diluídas em série e plaqueadas em agar LB sem antibióticos de forma idêntica em paralelo. Uma alíquota de bactérias igualmente tratados, de cada lote foi electroporada com 1 ul de Tris-EDTA (TE) de tampão, mas sem DNA (transformação simulada), diluídos em série e plaqueados em agar LB sem antibióticos para estimar o número de células perdidas pela entrega do pulso elétrico. Por último, uma variação adicional de que o experimento foi realizado para determinar se as incubações 30 min a 37 ° C em 1 ml de LB após a electroporação, mas antes do plaqueamento em placas de LB-agar que afectam a recuperação de células transformadas. unidades formadoras de colônia (CFUs) foram enumerados no dia seguinte.
Para esta experiência utilizou-pUC18, um plasmídeo de laboratório comuns, e os lotes de bactérias competentes consistindo de umpproximately 10 8 CFU para células preparadas utilizando o método tradicional e 10 7 CFU para células preparadas utilizando o protocolo rápido. Eletroporação sozinho (sem DNA) reduziu UFC viáveis por 10-100 vezes, independentemente do método utilizado para preparar as células electrocompetentes. Como mostrado na Tabela 1, o rendimento era transformante na 10 6 -10 7 CFU / ug de ADN gama de três experiências em replicado (desvios padrão entre parêntesis) para E. coli (DH5a) e V. cholerae (O395), respectivamente, utilizando o método tradicional, mais longas para a preparação de células electrocompetentes. Rendimento transformante apareceu diminuiu de 10 vezes a 10 5 a 10 6 UFC / mg de DNA em três experimentos replicados (desvio padrão entre parênteses) para E. coli e V. cholerae, respectivamente, usando o método rápido. Por essa razão, determinou a percentagem de bactérias transformadas pela divisão UFC transformadospelo número de UFCs recuperado de "transformações" simulados (sem plasmídeo) de lotes idênticos de células competentes. A percentagem de bactérias transformadas foi dentro de um log (2,5-9,4%), independentemente do método de preparação e as espécies transformadas (Tabela 1 Os números entre parênteses). Estes resultados sugerem que a eficiência do método rápido é comparável ao do processo tradicional de preparação demorado células competentes e que as estirpes representativas de Vibrio cholerae e Escherichia coli são igualmente receptivo ao processo rápido.
Descobrimos que a eficácia de transformação, para os plasmídeos tais como pUC18 abrigando cassetes β-lactamase, não é afectada pelo tempo de recuperação de 30 minutos em meio líquido LB. O mesmo número de transformantes foi recuperada se as células em placas de agar LB na presença de ampicilina directamente, após a electroporação, ou se podiam um tempo de recuperação de 30-45 minem caldo LB a 37 ° C antes de plaqueamento. Nossos resultados que ampicilina-resistência não exige conseqüência sob condições não-seletivos sugere que a expressão β-lactamase ocorre suficientemente rápido sobre transformação. No entanto, deve notar-se que foram realizadas diluições em série de bactérias pulsados em caldo LB, o que pode ter contribuído para a recuperação do choque eléctrico e iniciar a expressão do gene.
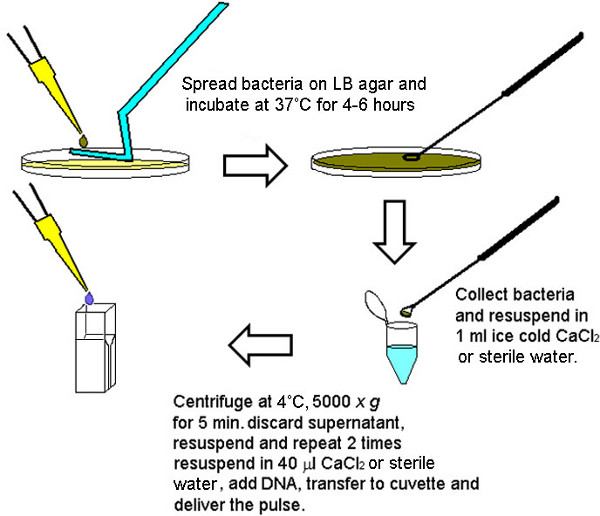
Figura 1. Representação gráfica da metodologia para a preparação rápida de bactérias electrocompetentes. Após 4-6 horas (dependendo da densidade do inóculo) um número suficiente de bactérias pode ser recolhido para levar a cabo as transformações 4-6 a partir de uma única placa de agar LB. Para segurar um número igual de células competentes para cada volume final a ser electroporado, bactérias recolhidas a partir da placa de agar LB foram inicialmente recolhidos e lavados juntos então aiiquoted em 40 volumes ul, dependendo do tamanho da pastilha (peletes maiores foram diluídos em volumes maiores divisível por 40 ul).
| Número de ADN transformantes / ug resistente à ampicilina (transformantes resistentes à ampicilina recuperada [%]) | ||
| Tensão | Método tradicional | Método rápido |
| E. coli (DH5a) | 2,3 x 10 6 (± 7,3 x 10 5) [9,4%] | 3 x 10 6 (± 7,1 x 10 5) [2,5%] |
| V. cholerae (O395) | 4 x 10 7 (± 1,7 x 10 7) [5%] | 6,7 x 10 5 (± 2,1 x 10 5) [3,3%] |
Tabela 1. A eficiência de transformação por micrograma de ADN (pUC18) de electrocompetentes bacteria preparado pelo método tradicional em comparação com o método rápido.
Todas as transformações foram realizadas com 500 ng de pUC18 DNA (~ 80% do ADN super-enrolado, como visualizado através de electroforese em gel de agarose a 1%) e as células electroporadas foram diluídas em série de 10 vezes em caldo LB antes do plaqueamento para CFU em LB-ágar com antibióticos. Controles de bactérias não-eletroporados e de bactérias eletroporados sem plasmídeo, diluído em série e semeadas em agar LB sem antibióticos foram realizados para cada conjunto de transformações para determinar o número total de bactérias viáveis antes e depois de pulsar. Os controles eletroporados representou a linha de base para a porcentagem de bactérias viáveis transformados com sucesso.
Discussão
A eficiência de transformação é sujeito a uma variedade de fatores, independentemente do método utilizado para preparar as células competentes. Variáveis análogas são aplicáveis a este método, um grande cuidado deve ser tomado para que uma vez que as células são colhidas a partir da placa de agar tal que eles são mantidos a baixa temperatura constante (não superior a 4 ° C). A camada de bactérias deve ser activamente crescente no momento da recolha, as células devem estar em fase semi-logarítmica de crescimento. Qualidade do ADN (isto é, a contaminação de sais) influencia a eficiência de transformação. Especificamente, quando se emprega este método, o ágar não deve ser quebrado como fragmentos de agar na cuvete irá causar faíscas do pulso.
A maioria dos problemas encontrados com esta técnica está associada com dois problemas, recolhendo as bactérias durante a janela de tempo apropriada da placa de agar, quando eles estão em crescimento activo. Coletá-los muito em breve trará o número de células insuficientes e irá processar araspando a placa de agar LB frustrante porque o "pellicule" formam é difícil de levantar para fora da superfície da placa. Bactérias Coleta tarde vai diminuir drasticamente a sua competência. A janela de tempo irá variar, naturalmente, dependendo da densidade de inoculo semeado em placas de agar LB. O segundo passo essencial é a de manter as bactérias frio (4 ° C) a partir do momento em que eles são levantados para fora da placa de ágar e ressuspensas em CaCl 2 ou ddH2O até serem semeadas em agar LB transformação seguinte. Os tubos de microcentrífuga contendo as bactérias, cuvetes e tampão deve ser pré-arrefecido e mantido em gelo para todas as vezes até que as bactérias são plaqueadas. No entanto, problemas adicionais podem surgir quando a estéril ddH2O ou CaCl2 conter precipitado ou contaminados. Por este motivo, recomendamos a elaboração deste novo reagente.
Solução de problemas de transformação é facilitada pela inclusão de controles ao transformar bacteria prestados competente por qualquer método. Um controle negativo constituído por um grupo de bactérias competentes não transformadas semeadas em uma placa de ágar LB contendo o marcador selectivo irá ajudar rapidamente determinar se o antibiótico na placa é eficaz. A transformação do controlo positivo com uma preparação plasmídeo conhecido de boa qualidade e quantidade abrigar o mesmo marcador seletivo como a amostra experimental será útil para determinar se as bactérias são competentes, mas também se o DNA experimental transformada foi suficiente em quantidade ou qualidade.
As vantagens desta técnica são múltiplos, o método pode ser realizado no mesmo dia em que a transformação é planejado. Nós descobrimos que o estoque de glicerol bacteriana congelado pode ser banhado diretamente sobre o agar LB sem qualquer perda na electrocompetence, temos feito isso em situações de "emergência" (depois de esquecer de iniciar a cultura durante a noite do dia anterior). Embora não pudemos testar emuito estirpe conhecida, qualquer E. coli ou V. cholerae tensão que pode ser transformado por eletroporação tem sido favorável a este protocolo em nossas mãos. A técnica é rápida, eficaz e produz eficiências de transformação comparáveis aos obtidos desde a preparação bactérias electrocompetentes empregam métodos tradicionais. O método elimina a necessidade de centrífuga de alta velocidade e de rotores associados, num agitador orbital incubadora e baldes de centrífuga estéreis (recipientes), e grandes volumes de tampão autoclavado. Embora a tabela de reagentes específicos e Equipamentos é bastante abrangente, a maioria dos laboratórios que realizam eletroporação terá a maioria, se não todos, estes materiais já disponíveis. Talvez o mais importante, a técnica pode ser facilmente aplicado para gerar estirpes electrocompetentes específicos do laboratório com fundos mutantes rapidamente. Não temos conhecimento de quaisquer limitações desta técnica, uma vez que substituiu o método tradicional de preparação de electrocompetent bactérias nos nossos laboratórios.
Os resultados de nossas experiências mostradas aqui foram realizados com células electrocompetentes frescos produzidos com o método tradicional, que tinha sido armazenado a -80 ° C durante não mais de 1 semana. No entanto, os estoques de células congeladas electrocompetentes de perder competência e viabilidade ou durante longos períodos de armazenamento. O protocolo simplificado permite a preparação de células electrocompetentes fresco no mesmo dia da transformação está prevista, sem preocupações com a idade do material, que podem resultar em rendimento transformante diminuiu. Não tentamos armazenar células electrocompetentes produzidos usando o método rápido para uso em outro dia, pois isso não foi necessário.
Embora não seja mostrado aqui, a eficiência das células electrocompetentes preparadas utilizando o nosso método rápido é suficiente para misturas de ligação. As transformações relatados para não-O1 V. cholerae em um recente artigo de Unterweger et al.17 foram realizados com bactérias electrocompetentes preparadas pelo método descrito aqui (exceto as realizadas por conjugação). Esta técnica permite aos pesquisadores transformar cepas mutantes com fundos rápida e eficazmente sem ter que preparar grandes quantidades de células. Este método de preparação rápida de bactérias electrocompetentes pode ser adaptado para outros procariotas que foram mostrados para ser passível de electroporação, como o princípio da preparação e as definições de eletroporação vão ser as mesmas que as de protocolos tradicionais.
Divulgações
Não há divulgações são aplicáveis.
Agradecimentos
Os autores agradecem aos colegas e funcionários de laboratórios presentes e passadas que têm apoiado o desenvolvimento desta técnica. Laboratório de SP é apoiado pelo Instituto Canadense de Pesquisa em Saúde Grant operacional MOP-84473 e Alberta Soluções Inova-Saúde (financiados pela Fundação Alberta Heritage para Fundo de Doações de Pesquisa Médica). DP de foi apoiado pelo National Institutes of Health concede MD001091-01 e GM068855-02.
Materiais
| Name | Company | Catalog Number | Comments |
| Gene Pulser Module | Bio-Rad | 165-2668 | |
| Gene Pulser Cuvette Chamber | Bio-Rad | 165-2669 | |
| Electrocuvettes (0.2 cm gap) | Bio-Rad | 165-2082 | |
| 13 x 100 mm Pyrex Rimless Culture Tubes | Corning | 70820-13 | |
| 13 mm Culture Tube Closures | Cole Parmer | EW-04500-00 | |
| 6 x 250 mm Glass Rod | Lab Source | 11381D | |
| Disposable Petri Dishes | Fisher Scientific | 08-757-12 | |
| Roller Drum Motor Assembly | New Brunswick Scientific | M1053-4004 | |
| Roller Drum for 13 x 100 mm Culture Tubes | New Brunswick Scientific | M1053-0306 | |
| Calcium chloride | Sigma Chemicals | C5670 | |
| Ethanol, anhydrous/denatured | Sigma Chemicals | 227649 | |
| Inoculating Loop | Decon Labs | MP182-5 | |
| Refrigerated Microcentrifuge 5451 R | Eppendorf | 22621425 | |
| Bunsen Burner | Fisher Scientific | 03-917Q | |
| LB Broth MILLER | EMD | 1.10285.0500 | |
| Bacteriological Agar | Fisher Scientific | S25127 |
Referências
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1 (7), 841-845 (1982).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res. 16 (13), 6127-6145 (1988).
- Taketo, A. DNA transfection of Escherichia coli by electroporation. Biochim. Biophys. Acta. 949 (3), 318-324 (1988).
- Fiedler, S., Wirth, R. Transformation of bacteria with plasmid DNA by electroporation. Anal. Biochem. 170 (1), 38-44 (1988).
- O'Callaghan, D., Charbit, A. High efficiency transformation of Salmonella typhimurium and Salmonella typhi by electroporation. Mol. Gen. Genet. 223 (1), 156-158 (1990).
- Hamashima, H., Nakano, T., Tamura, S., Arai, T. Genetic transformation of Vibrio parahaemolyticus, Vibrio alginolyticus, and Vibrio cholerae non O-1 with plasmid DNA by electroporation. Microbiol. Immunol. 34 (8), 703-708 (1990).
- Grones, J., Turna, J. Transformation of microorganisms with the plasmid vector with the replicon from pAC1 from Acetobacter pasteurianus. Biochem. Biophys. Res. Commun. 206 (3), 942-947 (1995).
- Allen, S. P., Blaschek, H. P. Electroporation-induced transformation of intact cells of Clostridium perfringens. Appl. Environ. Microbiol. 54, 2322-2324 (1988).
- Belliveau, B. H., Trevors, J. T. Transformation of Bacillus cereus vegetative cells by electroporation. Appl. Environ. Microbiol. 55, 1649-1652 (1989).
- Chassy, B. M., Flickinger, J. L. Transformation of Lactobacillus casei by electroporation. FEMS Microbiol. Lett. 44, 173-177 (1987).
- Dunny, G. M., Lee, L. N., LeBlanc, D. J. Improved electroporation and cloning vector system for gram-positive bacteria. Appl. Environ. Microbiol. 57 (4), 1194-1201 (1991).
- Micheletti, P. A., Sment, K. A., Konisky, J. Isolation of a coenzyme M-auxotrophic mutant and transformation by electroporation in Methanococcus voltae. J. Bacteriol. 173 (11), 3414-3418 (1991).
- Schleper, C., Kubo, K., Zillig, W. The particle SSV1 from the extremely thermophilic archaeon Sulfolobus is a virus: demonstration of infectivity and of transfection with viral DNA. Proc. Natl. Acad. Sci. U.S.A. 89 (16), 7645-7649 (1992).
- Aune, T. E., Aachmann, F. L. Methodologies to increase the transformation efficiencies and the range of bacteria that can be transformed. Appl. Microbiol. Biotechnol. 85 (5), 1301-1313 (2010).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166, 557 (1983).
- Unterweger, D., Kitaoka, M., et al. Constitutive Type VI Secretion System Expression Gives Vibrio cholerae Intra- and Interspecific Competitive Advantages. PLoS One. 7 (10), e48320 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados