Method Article
前立腺癌におけるバイオマーカーの発見への応用:個々のHERV座発現のマイクロアレイベースの識別
要約
ヒトゲノムの8%を占めるヒト内在性レトロウイルス(HERV)は、希少なコーディング能力が、10万末端反復配列(LTR)を保持する。カスタムアフィメトリクスマイクロアレイは、個々のHERV遺伝子座発現を同定するために設計されており、今後の臨床研究のための概念の証明として、前立腺癌組織で使用された。
要約
前立腺特異抗原(PSA)は、臨床使用における前立腺癌のための主要な診断バイオマーカーであるが、それは特に、低用量の値1は 、特異性および感度を欠いている。 「PSAの使用方法は、「どちらの診断のための明確な差別化は、がんとがん以外の2の間、または患者のフォローのために行われることを許可しません2.5-10 ng / mLの血清中の濃度に対応するグレーゾーンとして、現在の課題であるアップ術後のPSAの分析などの動力学的パラメーターは、その実用化の3,4のためにかなりの課題を提起することができます。代わりに、非コードRNA(ncRNAのは)、疾患の新規なマーカーとして、前立腺癌5,6における例えば PCA3および腫瘍生物学の特徴付けされていない側面を明らかにする可能性を秘めた、ヒトの癌において重要な分子として浮上している。また、2012年に出版され、ENCODEプロジェクトからのデータは、異なるRNAタイプがGENの約62%をカバーすることを示したOME。それはまた、転写調節モチーフの量は、タンパク質をコードするエクソンに対応するものよりも少なくとも4.5倍高いと思われる。それは、感染性レトロウイルスでの一次関数であるように、従って、ヒト内在性レトロウイルス(のHERV)の長い末端反復配列(LTR)は、推定上の/候補の転写調節配列の広い範囲を構成する。ヒトゲノム全体に広がっているのHERV、生殖系列内で先祖代々、独立した感染症に由来し、コピー&ペーストの伝播過程が続き、ヒトゲノムの8%を占める家族をマルチコピーに至るには、(エクソンが私たちのゲノムの2%に及ぶことに注意してください)。いくつかのHERV遺伝子座は、依然として癌7-10を含むいくつかの病状と関連しているタンパク質を発現する。彼らはのncRNA転写またはMを運転する場合、我々は、より良い彼らがアクティブにできるかどうかを理解するためには、最適な個々のHERV座式を特徴づけることを目指し、アフィメトリクス形式で、高密度マイクロアレイを設計した遺伝子発現のコーディングodulate。このツールは、前立腺癌のフィールド( 図1)に適用されている。
概要
(またのHERV呼ばれる)ヒト内在性レトロウイルスは、私たちのゲノム全体に広がっている。彼らは、コピー&ペーストの伝播過程が続き、マルチコピーの家族につながる生殖系列内で先祖代々、独立した感染症に由来する。今日では、彼らはこれ以上の感染はないが、彼らはヒトゲノムの8%を占める。比較のポイントとして、エクソンは、ヒトゲノムの2%に及ぶ。 2012年に公開さENCODEプロジェクトからのデータは、異なるRNA型は遺伝子間領域内の三分の一を含め、ゲノムの約62%をカバーすることを示した。また、転写調節モチーフの量は、タンパク質をコードするエクソンに対応するものよりも少なくとも4.5倍高いと思われる。それは、感染するレトロウイルスでのそれらの通常の機能であるとしてのHERV長い末端反復配列(LTR)は、潜在的な転写調節エレメントの広い範囲を表している。歴史的には、離れて胎盤や精巣に発現し、いくつかの遺伝子座から、それは一般的に、HERVによるepに沈黙していると考えられていたigenetic規制。したがって、我々は最適に良好それらがlncRNAの転写を駆動または遺伝子発現を符号化変調した場合、それらがアクティブであるかどうかを理解するために、個々のHERV遺伝子座発現を特徴付けることを目指して、アフィメトリクス形式で、高密度マイクロアレイを設計した。 HERV-V2のGeneChip吹き替えこのツールは、23583 HERVのプローブセットを統合し、5573ソロのLTRで構成される個別のHERV要素だけでなく、完全および部分プロウイルス( 図2)を判別することができる。
診断、評価、およびプラン:
前立腺癌の診断は、前立腺特異抗原(PSA)、臨床検査室におけるバイオマーカー、直腸指診の病理学者によって観察され、前立腺、最終的に前立腺生検の形態学的変化を評価するための投与量に基づいている。例えば、前立腺癌のPSAのような従来の癌バイオマーカーのうち十分な特異性及び感度の欠如は、幅広くのafが認識されている臨床的意義の数十年TER 1。最初は、PSAは前立腺11の腺癌の診断と治療のために提案した。これは、癌のスクリーニングのために提案12および疾患の進行をモニターする後者であった。 「PSAの使用方法」:しかし、定期的に尋ねられる疑問が残っている。 (I)2.5〜NGの血清中の濃度に対応したグレーゾーン/ mlの明確な違いは、がんとがん以外の2の間で行われることはできません。(II)2大規模コホート研究では、ヨーロッパで数十万人の人々を登録し、米国は疾患特異的死亡率13,14の面でのスクリーニングの有用性についての明確な結論を出すことができなかった、このような粘着剤のクリアランス、PSA上昇速度と倍加時間などの術後のPSA動態パラメータ(III)の分析、理論的には単純ですが、実用化3,4にはかなりの課題を提起することができます。我々は、今後数年間で、バイオマーカーのアプリを受けたりできるlicationsは経過観察とより多くのまたは腫瘍表現型に応じて、攻撃性の低い治療間の臨床選択をサポートします。病理学者によってレンダリング診断に関しては、最初の制限要因は、(多くの癌は、サンプリングにより失われている)は、前立腺生検中の20%偽陰性診断から来ている。第二の懸念は、悪影響を提示することができる負の1、以下の追加の生検処置の必要性を扱っています。
根治的前立腺は現在、前立腺がんの標準治療の一つです。これは、特に攻撃的なパターン(10グリーソン7)、多病巣性腫瘍または触知可能な腫瘍の場合には、45〜65歳より高齢化、健康な患者に提案されている。現在では、ロボット支援手術を使用して当科で行われます。なぜなら、分子マーカーは、今後数年間で最も重要な重要性を持っていることを成長している証拠、我々はすべて我々の患者に前立腺のためのプログラムに参加の可能性を提案することを決定した組織バンキング。より正確には、前立腺癌に対する拡大分子研究プログラムは、前立腺切除標本から高品質の新鮮な腫瘍組織へのアクセスの増大する要求をもたらしている。この研究は、特定のゲノムアプローチは、高いDNA / RNAの質の大きな試料を必要とした。腫瘍と同じ患者から、隣接する「非腫瘍性」の組織が必要である。ラジカル前立腺切除を処理し、処理するための推奨事項は、ステージと縁の状態、それによって潜在的なさらなる治療と予後を決定する病理学的特徴を維持するように設計されています。任意の新鮮な組織採取方法は、したがって、診断的に許容されるようにするために後続の病理学的評価を損なうべきではない。前立腺の肉眼解剖は困難であり、大きな注目がマージン組織や被膜浸潤に支払われる必要がある:前立腺バンキングのための任意の解剖は常に同意に応じて訓練されたuropathologistによって行われるべきであるDプロトコル。医学部の倫理委員会と国家の医療ボードは、これらの調査に同意し、すべての患者が前立腺組織バンキングに含まれているためにインフォームドコンセントを得た。
プロトコル
1。手術
外科医によって除去されると病理学者が担当して取られるまで、氷上で前立腺を維持する。
2。前立腺組織の取り扱い
- 周術期虚血の遅延を尊重し、外科的切除後の30分以内に、専用のスタッフが研究室に氷上で根治的前立腺切除術の標本を転送します。凍結の遅延は、以下で20〜30分( 図3A)である必要があります。
- (左側の黒い右側例えば緑、 図3Bおよび3C参照 )通常のプロトコルに従って、前立腺を計量して染色。
- 後部側の腺( 図3D)の大規模な横断面を実行します。前立腺を方向付けし、前側の上に置いた。無菌メスで後部側の腺の大横断面を実行します。
- 遷移領域での組織片を解剖、( 図3E)は無傷の余白を残して、左右の周辺ゾーン、上。
- エッペンドルフチューブに組織のコアを入れ、液体窒素( 図3F)で凍結して保存スナップ。あなたは行っていない場合はバイオバンクは、ステップ2.7に進んでください。
- 生検での癌の全長が10ミリメートルよりも優れている場合にのみ、前立腺バンキングを行う。前立腺を閉じるには、グランド歪みや切除断端( 図3G)の最小限の中断を防ぐために、縫合糸を使用しています。その後、組織学的分析のための通常の手順に従ってパラフィンにホルマリンとembedで根治的前立腺標本を固定します。
- 10月の小さなマウンド上に垂直に凍結した組織コアをマウントし、クライオスタット内のセクションを作る。最初のシングルは5μm凍結切片を取り、トルイジンブルーでそれを染色。
- ( すなわち 。良性または悪性)組織の性質を分析するために迅速な組織学的検査を行う。腫瘍のため組織は、腫瘍細胞の量を推定し、腫瘍細胞の80%以上でのみコアを選択します。
- これに続いて、ニューシングル5μmの凍結切片を行い、ヘマトキシリン、エオシン及びサフランでそれを染色。その後、X 30〜15μmの部分をカットし、RNA分解酵素フリーのエッペンドルフチューブに入れてください。
- ヘマトキシリン、エオシンおよびサフランのための最後の5ミクロン凍結切片を取り、手順の最後に腫瘍細胞の量を制御するために、それを染色。
- ドライアイスでエッペンドルフチューブを入れて、分子生物学の研究室にサンプルを送ってください。
3。 RNAを抽出、精製、および品質管理
- 均質化。組織が完全に溶液に溶解されるまでTrizol/100 mgの組織を1mlの存在下での均質化を行う。徐々にトリゾールソリューションを追加し、ハンドヘルドグラインダーを用いて氷上でのケアを進める。一回均質化し、エッペンドルフチューブにソリューションをアリコートを室温でトリゾールに残し5分。
- 相分離。 300μlのクロロホルム(または150μLBCP/1.5ミリリットルトリゾール)を追加します。ボルテックス15秒後、2〜3分間室温で残す。 2〜8℃で15分間、12,000×gで遠心分離
- RNA沈殿。新しいチューブに慎重に上部の水相を転送します。 750μlのイソプロパノールを追加します。 10分(戻入により攪拌)を、室温でインキュベートする。 ℃でC/-31°-19で2時間インキュベートする2〜8℃で30分間12,000 xgで遠心分離器のサンプル
- RNAの洗浄とサスペンション。遠心分離後、上清を除去します。 1ミリリットル80パーセントエタノール(優しくチューブを逆に)で洗浄し、RNAペレット。 2〜8℃で10分間7500×gで遠心分離器のサンプルP1000とP10を用いて上清を取り除きます。 2〜3分間空気乾燥エタノールを残り許す。 70℃のヒートブロックに100μlのRNaseフリー水、移送チューブを追加し、ペレットを溶解するために2〜3分間放置します。その後、氷の上に置く。短期記憶のためのC°C/-31°-19で保存して -長期保存のために80°C。
- RNA精製。をRNeasy Miniキット(Qiagen)を用いてRNAを精製する。キアゲンの手順に従って、簡単に言えば、100μlのRNAサンプルに350μlのバッファーRLTを追加することから始め、よく混ぜる。最終的には、品質管理(ステップ3.6)のために精製された生成物の3μL(50μLのうち)アリコートを取る。で保管してRNAを-19°C/-31°Cの短期期間や長期保存のために-80℃で。
- RNAのQC( 図4A)。製造者の指示に従って、RNAの品質やバイオアナライザ(アジレント)とナノドロップ(サーモ)を使用して、RNAの完全性を確認してください。 RNA完全性番号(RIN)は、RNAの品質を評価するために使用される。具体的には、18Sおよび28Sピークの検出に成功して強く更なるステップでサンプルを使用することをお勧めします。
4。 WT-オベーションRNA増幅
WT-OVを用いた増幅ステップを実行するための推奨事項最適な条件でのATION増幅キット:
- ピペットの精度を確保するために一度に8増幅サンプルよりも少ないを実行しない。 8反応の3バッチにキットの分割を必要とするマスターミックスを準備するときに、1廃棄物の量を占めている。
- 特に指示がない限り、常に氷上で融解試薬および反応チューブを保持します。
- 精製のための唯一の新鮮な80%エタノール溶液を使用する。
- プロトコルのどの段階で停止しないでください。
- 25 NG /μLの濃度を得るために、全RNAを希釈します。希釈した試料の2μLを処理します。
- 1:25,000希釈を達成するために、ポリ-RNAスパイクインコントロールソリューションポリコントロール希釈バッファー(Affymetrix社)とポリA RNAの株式の連続希釈によりを準備します。
ステップ1:第一鎖cDNA合成4.3から4.8。次のように述べた試薬は、供給者によって参照される。A1(ファーストストランドプライマーミックス)、A2(FIRSTストランドバッファーミックス)、A3(ファーストストランド酵素ミックス)。
- 室温でA1とA2を解凍する。 2秒2秒、スピンボルテックス·ミキサーを用いて混合します。その後、すぐに氷上に置きます。氷の上のA3を配置します。
- 0.2ミリリットルのPCRチューブに全RNA(50 NG)の2液を入れて、A1の2液(最終容量:4μL)を追加します。キャップと2秒間チューブをスピン。
- その後、チューブを氷上に置いて5分間65℃でインキュベートする。
- (単一反応のために与えられた)は、以下のように第一鎖cDNAのマスターミックスを準備します。ピペッティングにより混合し、マスターミックスを簡単にスピンダウン。すぐに、氷の上に置きます。
試薬 ボリューム 第一鎖バッファーミックス(A2) 5μL ポリA RNAコントロール(1:25,000) 0.5μL 第一鎖酵素ミックス(A3) 0.5μL - 追加6µ RNA /プライマーを含むチューブにマスターミックスのL。 2秒間のチューブ、スピンをフリックで混合し、すばやく氷(最終容量:10μL)に配置します。
- 15分間、10分間、その後70℃で、次いで42℃、10分間、次いで25℃、1分間、4℃でインキュベートする。 4℃で、冷静さを保つサーマルサイクラーから反応管を取り外して、簡単にスピンし、氷上に保つ。第二鎖cDNA合成ステップですぐに続ける。
ステップ2:第二鎖cDNA合成4.8から4.12。 B1(第二鎖バッファーミックス)とB2(第二鎖酵素ミックス)を次のように述べた試薬は、供給者によって参照される。
- 2秒間B2、B3はスピンダウンし、すぐに氷上に置きます。室温でB1を解凍する。 、2秒間ボルテックスミキサーを使用してミックス2秒間スピンし、すぐに氷上に置きます。
- (単一反応のために与えられた)は、以下のように第二の鎖マスターミックスを準備します。ピペッティングにより混合し、マスターミックスのブリーチーズをスピンダウン飛ぶ。すぐに、氷の上に置きます。
試薬 ボリューム 第二鎖緩衝液ミックス(B1) 9.75μL 第二ストランド酵素ミックス(B2) 0.25μL - 各第一鎖反応チューブにマスターミックス10μlを加える。 3X、氷上で2秒と場所(:20μL最終容量)のためのスピンをピペッティングして混ぜる。
- 5分間、30分間、次いで50℃で10分間、次いで25°C、1分間4℃でインキュベートし、その後70°C。 4℃で、冷静さを保つサーマルサイクラーから反応管を取り外して、簡単にスピンし、氷上に保つ。ポスト第二の鎖の強化の段階ですぐに続ける。
ステップ3:ポスト第二の鎖の強化4.13から4.15。 B1(第二鎖バッファーミックス)、B3(反応の強化酵素ミックス)を次のように述べた試薬は、供給者によって参照される。
- (単一反応のために与えられた)、次のようにB1とB3のミックスを組み合わせることにより、マスターミックスを準備します。ピペッティングにより混合し、マスターミックスを簡単にスピンダウン。すぐに、氷の上に置きます。
試薬 ボリューム 第二鎖緩衝液ミックス(B1) 1.9μL 反応エンハンスメント酵素ミックス(B3) 0.1μL - 各第二鎖反応チューブにマスターミックスの2を添加する。 3X、氷上で2秒と場所(:22μL最終容量)のためのスピンをピペッティングして混ぜる。
- 20分間、15分間、次いで37℃、1分間、4℃でインキュベートし、次いで80℃。 4℃で、冷静さを保つサーマルサイクラーから反応管を取り外して、簡単にスピンし、氷上に置きます。 SPIA増幅工程と、すぐに続けています。
ステップ4:4.16からSPIA法による単鎖cDNA(sscDNAを)合成-4.19。 C1(SPIAプライマーミックス)、C2(SPIAバッファーミックス)、C3(SPIA酵素ミックス)を次のように述べた試薬は、供給者によって参照される。
- 室温でのC1とC2を解凍する。 2秒間ボルテックスミキサー、スピンを使用して、すぐに氷上に置いて混合する。氷の上のC3を解凍する。優しく5Xを反転させたコンテンツを混ぜる。気泡を導入しないことを確認してください。その後、氷上で2秒、場所をスピン。
- 以下のように、0.5廃棄物の量を占め、SPIAマスターミックスを調製する。ピペッティングにより混合し、マスターミックスを簡単にスピンダウン。すぐに、氷の上に置きます。
試薬 ボリューム SPIA-バッファ·ミックス(C2) 5μL SPIA - プライマーミックス(C1) 5μL SPIA-酵素ミックス(C3) 10μL - 強化された第二鎖反応tにSPIAマスターミックス20μLを追加UBE。 6-8X、スピンをピペットで混合し、すばやく氷上で(最終容量:42μL)を配置します。
- 5分間、60分間、その後95℃で、次いで47℃、1分間、4℃でインキュベートする。 4℃で、冷静さを保つサーマルサイクラーからチューブを取り外し、簡単にスピンし、氷上に置きます。
5。 sscDNAを精製および品質管理
- sscDNAを精製。 QIAquik PCR精製キット(Qiagen)を用いてsscDNAを精製する。簡単に説明すると、増幅されたcDNA産物の42μlに200μlのBuffer PBを追加することから始め混ぜてカラム上にロードします。それからキアゲン手順に従ってください。最終的には、品質管理(ステップ5.2)のためのsscDNAを精製した生成物の3μL(30μLのうち)アリコートを取る。
- ( 図4B)を得、サイズ分布sscDNAを確認。製造者の指示に従って、sscDNAを収率およびバイオアナライザおよびナノドロップを使用して粒度分布を確認してください。増幅されたcDNAの分布の大きさは、aがb必要がありますEは、一般的に600塩基付近にピークとの長い100〜1,500塩基の間で構成される。
6。 sscDNAを断片化
- ヌクレアーゼフリー水で容量を調整し、30μlのcDNAを2μgのを準備します。
- 10倍のOPAバッファーPLUSソリューションから始めて、1×ワンPHOR-すべてのバッファープラス(OPA)を準備します。
- 0.2 U /μlのDNA分解酵素を準備し、I(1 U /μLのDNase Iの5倍希釈)。
- 以下のように(単一反応のために与えられた)断片化マスターミックスを準備します。
試薬 ボリューム 10XワンPHOR - すべての緩衝液+ 3.6μL DNアーゼI(0.2 U /μL) 3μL - sscDNAを30μlに断片化ミックスの6.6を添加する。
- スピンし、次いで10分間95℃でのDNase Iを不活性化し、氷上に置き、10分間37℃でインキュベートする。分量1µアジレント·ベースのサイズ分布を検証するための断片化されたcDNAのlである。
- sscDNAをサイズ分布の確認( 図4C)。バイオアナライザ(アジレント)を使用して、sscDNAをサイズ分布を確認してください。断片化されたcDNAのサイズ分布は、一般的に35と200塩基の間に含まれるべきである。
7。断片化されたsscDNAをの標識
- のDEPC水に5 mMまでDLR-1A 7.5ミリメートル希釈する。
- 以下のように(単一反応のために与えられた)ラベルマスターミックスを準備します。
試薬 ボリューム 5XのTdT反応バッファー 14μL のCoCl 2(25 mM)を 14μL DLR-1A(5ミリモル) 1μL ターミナルトランスフェラーゼ(400 U /μL) 4.4μL - 標識ミックスの33.4μl加え各断片化されたcDNAサンプルである。
- 氷上で保管した後、簡単にスピンし、60分間37℃でインキュベート、チューブをフリックで混ぜる。
8。 HERVチップマイクロアレイへのハイブリダイゼーション
- プレハイブリダイゼーションミックス(Affymetrix社)200μlとのHERVのGeneChipを予め湿らし、10分間、50℃、60 rpmでインキュベートする。
- (単一反応のために与えられた)は、以下のようにハイブリダイゼーション混合物を準備します。
試薬 ボリューム コントロールオリゴB2(3nMの) 3.3μL 20X真核生物のハイブリダイゼーションコントロール 10μL 2Xハイブリダイゼーションミックス 100μL 99.9%のDMSO 17.7μL - 最終的なVOを作るために、室温で断片化し、標識されたcDNAの69μlにハイブリダイゼーションミックスの131μLを追加200μLのLUME。
- 混合し、95℃で2分間変性させ、次いで5分間、最大速度で5分間遠心し、50℃でインキュベートする。
- 予め湿らせHERV遺伝子チップを空にし、200μlのターゲット調製をロードします。 2セプタムにタフなスポットを適用します。
- 18時間、50°C、60rpmでハイブリダイズする。
- 18時間後、HERVの遺伝子チップを空にして、4℃で収集されたハイブリダイゼーション溶液を保存するチップはすぐに流体工学に実行されていない場合は4℃で保存し、250μlの洗浄緩衝液Aとプローブアレイを埋める
9。洗浄·染色
- GCOSのメニューバーから流体工学を実行します。流体工学]ダイアログボックスで、目的の駅を選択(1から4)には、すべてのモジュールのShutdown_450を選択し、[ファイル名を指定して実行。ミリQ水に3流体工学吸引ラインを浸す。液晶画面の指示に従ってください。
- すべてのモジュールにPrime_450プログラムを適用します。洗浄バッファーAのためのチューブを置きます400ミリリットル洗浄バッファーAを含む哺乳瓶、および200ミリリットル洗浄バッファーBを含むボトル内の洗浄緩衝液Bの1その後、再び、液晶画面の指示に従ってください。
- 針を持ち上げて600μlの染色カクテル1(SAPEソリューションミックス)と600μlの染色カクテルを置く2(抗体液ミックス)位置#1、#2で、マイクロ遠心チューブを含有し、800μlの配列が位置#3の緩衝液を保持する。
- 各モジュールに右のチップを割り当て、FS450-004プロトコルを選択し、各モジュールを実行し、画面の指示に従います。
10。スキャニング
- GS3000スキャナをウォームアップ。これは、ライトが緑色に変わったときにスキャンする準備ができています。
- 直接スキャナーにオートローダにまたは代わりにチップをロードし、リークを防ぐためにセプタム上にタフなスポットを適用します。スキャンを開始します。
- チップをスキャンした後、。CELファイルが生成されます。 <画像を確認し、プローブ細胞を(識別するためにスポットにグリッドを揃える強い>フィギュア4D-F)。
11。データ解析
- 品質管理。標準アフィメトリクスを参照して下さいHERV-V2チップは品質管理基準を満たしているかどうかを確認するように制御する。この目的のために、次の表現を使用することができる。強度の中央値に対する対数強度値分布(密度プロットおよびボックスプロット)、中央絶対偏差(MAD)(MAD-メッド)をプロットし、背景プロット、正規化されスケーリングされていない標準誤差(NUSE)プロットと相対対数発現(RLE)のプロット。
- 正規化。また、データセットは、予想外のバッチ効果を強調するために、統計分析の前にそれらを修正する検討されるべきである。データの前処理は、このようにバックグラウンド補正( 例 。トリプトファンプローブベースライン信号に基づいて)、RMAの正規化および要約15に続いています。
- データマイニングと差分的に発現される遺伝子を検索します。チップを正常化し、階層的クラスターと適用データセット( 図6A)探索するのNGアプローチ。その後、マイクロアレイの古典の重要な分析(SAM)偽発見率(FDR)補正17に続いて手順16を使用して示差的に発現された遺伝子(DEG)の検索を実行します。これらのステップは、完全のPartek GSのようないくつかのソフトウェア解析·スイートに統合されているが、代わりにバイオコンダクタープロジェクト19のパッケージによりR統計ソフトウェア18を使用して行うことができることに注意してください。統計分析の後、発現値が2未満であるために6個のプローブセットを除外したデータセットをフィルタ処理する。
- 可視化と解釈。注釈データベースを使用して専用のインターフェースにおけるHERV-V2マイクロアレイから得られた結果を解釈する。
結果
トランスクリプトーム研究の値は、主に出発生物材料の品質にある。 RNA抽出を最適な条件で行われる場合、RNA完全性番号(RIN)は、典型的には7以上( 図4A)である。アフィメトリクスHERV-V2チップ上にcDNAを2μgのハイブリダイズする必要性は増幅プロセスの使用を意味する。成功した増幅工程は、釣鐘型の分布( 図4B)をもたらす。次いで、DNAse1断片は約100ヌクレオチドハイブリダイゼーション( 図4C)の前にcDNAのサイズ分布を均一化するために行われる。ハイブリダイゼーションおよびスキャン( 図4D)の後、画像の目視検査は、グリッドはよくスポット( 図4E)に整列しているかどうかをチェックするために1を可能にし、ハイブリダイゼーションコントロールが一貫している場合には( 図4F)。このステップは、内気泡やエラーマイクロアレイを排除するためにも役立ちます実験中に発生しました。
チップは( 図5)品質管理に合格していると正常化した後、リヨンシュッ病院からの5試合対腫瘍と正常な前立腺RNAサンプルの統計分析は、差動式の値と207のHERVプローブセットが同定された一回(p.val <0.05)( 図6A)。これらの記録をサポートし、前立腺特異的情報を得るために、35の追加のマッチ対試料(結腸、卵巣、精巣、乳房、肺および前立腺)が最終的に同定分析およびSAM-FDR法(FDR = 20%)に添加した44前立腺特異HERVのプローブセット。これらの中でも、最も関連性の10 HERV構造が( 図6B)に記載されている。さらなる臨床研究は、これらの候補バイオマーカーの感度および特異性の値を評価するために必要とされる。
pload/50713/50713fig1.jpg "幅=" 500px "/>
図1診療所 (1:臨床医による前立腺切除し、病理学者による組織標本) からの全体的な手順のスキーム。ベンチに:候補バイオマーカーの同定につながる(2-6サンプル調製、ターゲット調製、マイクロアレイ処理) (7:HERVマイクロアレイのbiocomputing分析)。正常な組織に由来する核酸がオレンジ色で描かれている。腫瘍の領域から得られた核酸は、(オレンジ色)および腫瘍特異的(黒)核酸の通常のミックスで構成されています。 拡大画像を表示するには、ここをクリックしてください 。
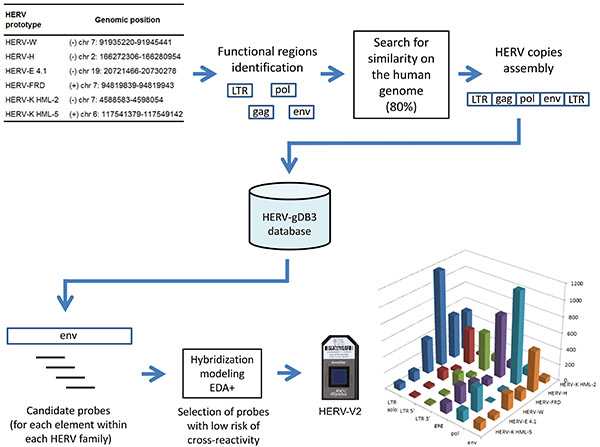
図2概念とHERV-V2チップの内 容:HERVシーケンスヒトゲノムから取得HERV-gDB3と呼ばれるデータベースに格納され、次いで、25マーの候補プローブが得られた標的サブ領域がそれぞれに示されている(最終的にはアレイ上で合成される前に、専用のハイブリダイゼーションモデリング手順(EDA +)を通過する家族)。 拡大画像を表示するには、ここをクリックしてください 。
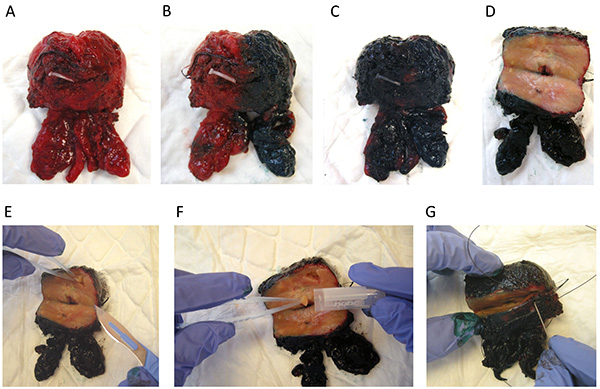
図3。病理学者による前立腺取り扱い。(A)新鮮な前立腺全摘除標本を研究室に転送されます。 (BC)の前立腺は(左側の黒い右側に緑)染色する。 (D)は 、後側の腺の大横断面。 (E)は無傷、PIEC余白を残す組織のエスは、前立腺の異なる領域から切除される。組織の(F)コアをエッペンドルフ管に入れる。 (G)縫合糸は、前立腺を閉じるために、グランド歪みおよび切除縁の最小限の中断を防止するために使用される。その後、根治的前立腺摘除術標本を組織学的分析のための通常の手順に従って、ホルマリンで固定できるようになります。 拡大画像を表示するには、ここをクリックしてください 。
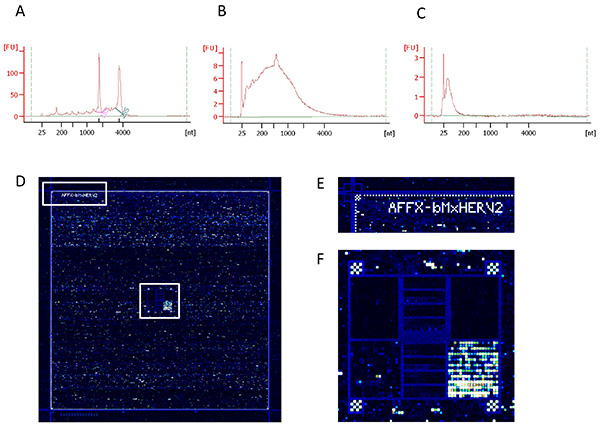
図4。核酸調製とハイブリダイゼーション効率の品質管理 。 (A)RNAの完全性、(B)cDNAの増幅標的およびハイブリダイゼーション段階に用いられる(C)断片化された標的。目3品質管理は、RNAナノチップと真核生物ナノセリエIIアッセイを使用してバイオアナライザを用いて得られたESE。 (D)は 、グリッド整列コントロールを示す左上隅のスキャン、(E)の拡大やスポッティングハイブリダイゼーションコントロールを示す中央部の(F)拡大後のHERV-V2マイクロアレイハイブリダイゼーション領域の全体的なイメージ。 拡大画像を表示するには、ここをクリックしてください 。
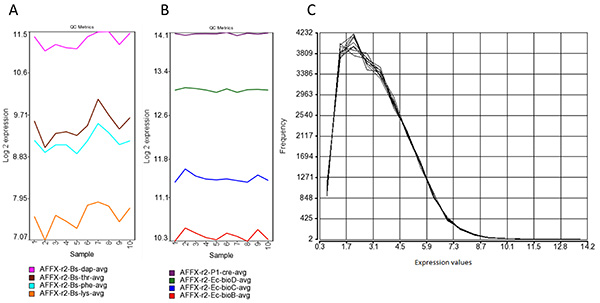
図5。信号の処理 。 (A)アフィメトリクスポリAはスパイクでの増幅を制御します。ポリAはBからDapは、スレオニン、PheおよびLysの転写産物を制御枯草菌遺伝子は、RNAサンプルにスパイクし、全体的な成功を評価するために役立つているターゲット調製工程。強度はバイアスが高および低発現遺伝子の間に、WT-オベーション増幅中に存在しなかったことを確認するためにこれらのスパイクでのコントロール間の値を減少させることで検出する必要があります。 (B)は Affymetrix社のスパイクインハイブリッド形成を制御します。 Eから分離され、これらのターゲット大腸菌とP1バクテリオファージは、標識操作の前にスパイクされています。 bioBの、BIOC、bioD遺伝子およびCreをから増加する値は、ハイブリダイゼーションの全体的な成功を示している。 RMA正規化後のチップの信号(C)の強度分布を示す。主にいくつかの特定のHERV座に制限され、全体的な表現を示す、2 6(バックグラウンド)よりも低い値を持つプローブセットの展示信号のほとんどは。 拡大画像を表示するには、ここをクリックしてください 。
ftp_upload/50713/50713fig6.jpg "幅=" 500px "/>
図6。データ解析 。正常および腫瘍の試料(A)階層的クラスタリング解析。正常および腫瘍サンプルのうち、下(青)レギュレーション - 区分化クラスタリングは、最大(赤色)にプローブセットをグループ化し、ユークリッド距離関数アルゴリズムを用いて正規化された発現値に適用した。 (B)前立腺癌の候補バイオマーカーとして同定された上位10 HERV構造の選択。各HERV要素については、関連HERVファミリは、ゲノム座標(NCBI 36/hg18)とHERV構造の簡単な説明が与えられている。 拡大画像を表示するには、ここをクリックしてください 。
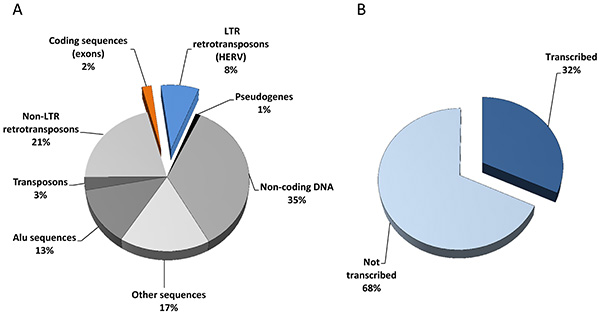
図7。 HERVレパートリーは、(A)は、ヒトゲノムの配列決定は、25000タンパク質をコードする遺伝子(エクソン、2%)20万の長い末端反復配列(LTR)レトロトランスポゾン(HERV、8%)を含む、転移因子の膨大な量を明らかにした。 (B)HERV-V2チップの内 容からの外挿および関連発現データ(腫瘍の組織型正常対8から発信さ79サンプル)HERVレパートリーの三分の一が転写的に活性であることを示唆している。 拡大画像を表示するには、ここをクリックしてください 。
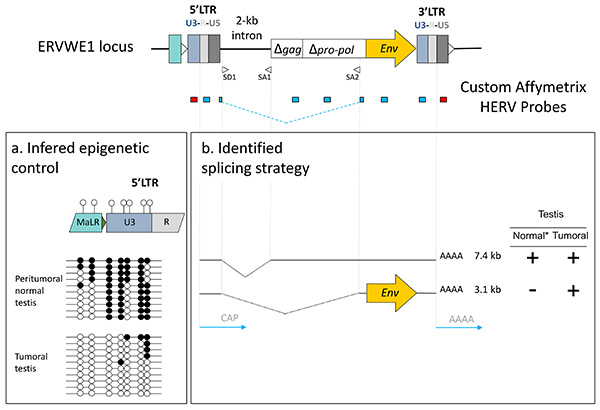
図8。チップからの信号の機能的な解釈 。 (A)プロモーターの識別とエピジェネティック制御:U3負の信号(赤のプローブ、5'LTR)R-U5正の信号対 (青プローブ、5'LTR)は、異なるCpGメチル化(黒丸)腫瘍組織に対する腫瘍周囲の正常中のU3の内容によってサポートU3主導の転写を、示唆している。 (B)スプライシング戦略:mRNAをコードする推定の3.1キロバイトエンベロープは腫瘍でのみ発現は、プローブを重ねSD1/SA2スプライス部位を使用して識別されます。 *その他の非胎盤組織との比較によって推定した。 拡大画像を表示するには、ここをクリックしてください 。
ディスカッション
過去10年間で、HERV発現測定のための試みのほとんどは、RT-PCR技術を使用しているかのHERV属25,26内の一般的な傾向を評価するためのpol遺伝子の相対的な保全に基づいて、特定の遺伝子座20〜24かに焦点を当てる。さらに、HERVファミリー27,28の発現を検出および定量することを意図した低密度マイクロアレイと結合され、高度に縮重プライマーを用いてPCR増幅。家族内の個々の遺伝子座の発現をトレースするためには、その後のクローニングおよび配列決定と組み合わせて保存された領域のPCR増幅に基づくアプローチはへのHML-2 29,30またはHERV-E4.1 31家族の転写活性のある別個の要素を有効に識別すること。また、活性HML-2特異的ヒト孤立性のLTRを同定した反復間のプロモーターを同定することを目指した技術をモニターゲノムリピート発現は、クローニングおよび配列決定段階によって終了 32,33。我々は、順次ファミリー34,35内のパラロガス要素間の交差反応を最小限にするために、繰り返しエレメントプローブの設計のための適切な方法論を導入し、HERVトランスクリプトームの解析に専用の高密度マイクロアレイの二世代を開発した。 2690明確なプロウイルスおよびHERV-W、HERV-H、HERV-E 4.1、HERV-FRD、HERV-K HML-2とHERV-K HML-5ファミリの2883ソロのLTRをターゲットHERV-V2チップは、発表推定される前立腺癌バイオマーカーの同定によって、本論文に示された組織35の広い範囲で1,718 HERV遺伝子座(図7AおよびB)の発現。また、所定の遺伝子座に複数のプローブセットを使用すると、その転写調節については有益である。まず、U5正1と連携して、U3負のシグナルは、プロモーターとしてのLTRを分類し、逆に、U3、正と負の信号U5は、ポリアデニルの役割を反映しているのかもしれない。私たちはこのように私組織35の広い範囲で326プロモーターのLTRをdentifiedと、配列によって提供されるこのU3-U5二値情報に基づいて、我々が提案し、実験的にこのような自律的な転写は、メチル化依存エピジェネティックなプロセス34によって制御されたことをいくつかの選択された場合のため確認した( 図8)。胎盤や腫瘍精巣34にERVWE1/Syncytin1発現プロファイルによって示されるように第二に、 例えば、LTR、gag及びenvの独立したプローブセットまたは特定のスプライス部位をターゲットとプローブから発行されたからの信号の検出は、プロウイルスのスプライシング戦略について有益である。これは、HERV特異的プローブ選択のプロセスは、従来のように効率的な遺伝子36( 図8)のような、組織に関連するスプライシング戦略の識別をサポートするのに十分堅牢であることを示している。
この方法は、個別にHERV座式を識別するための最初の試みであるアフィメトリクス技術に基づくカスタム高密度マイクロアレイを用いて。マイクロアレイフォーマットの明確な利点は、(i)からなるHERVトランスクリプトームを解読するには、いくつかのHERVファミリーの協調探索し、各遺伝子座について様々な領域(II)の同時かつ独立した分析、 例えば 。ソロとプロウイルスのLTRのためのU3とU5ドメイン、 ギャグやENV地域や任意の先験的 HERV要素の機能性にすることなく、プロウイルスの構造と関連することが可能にスプライスジャンクション。見通しは、マイクロアレイ関連biocomputingツールで注釈の改善に依存している。これは1がそのような明らかなアクティブのHERVはlncRNA転写を駆動するか、多かれ少なかれ、近位をコードする遺伝子の発現を調節するかどうかなどの生物学的仮説にチップ信号を変換できるようにする必要があります。実際、このような仮定は、vの成分を含む、前立腺癌関連のncRNA転写物を同定最近の研究によって支持されているHERV-K内在性レトロウイルスファミリーまたはウイルスのLTRプロモーター領域37だけでなく、2つの遺伝子融合事象すなわちHERV-K22q11-ETV1およびHERV-K17-ETV 38,39の部分からIRALのORF。一緒になって、LTR機能やスプライシング戦略の識別と合わせ、この全トランスクリプトームのアプローチは、トリガ慢性40,41におけるHERV式のコンポーネントや感染症42,43対マーカーを解読するのに役立つことがあります。
開示事項
この作品は、ビオメリューSA、オスピスCivilsリヨンとフランスの公的機関OSEO(新規治療アプローチのための高度な診断、個別化医療に特化し、フランス政府出資プログラム)によってサポートされていました。 PP、VC、囲碁、メキシコ、およびFMはビオメリューSAの従業員です。 PP、NMとFMは、この論文の調査結果をカバーする特許出願を提出した。
謝辞
私たちは、HERV-V2プロトコルの初期の開発と最適化への貢献のためにセシルMontgiraud、ジュリエット·ヒメネス、マガリJaillardとベルトランBonnaudに感謝します。我々はまた、倫理的配慮の彼の指導のためHader Haidousに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Trizol | Invitrogen | 15596-026 | |
| RNA poly-A control stock | Affymetrix | 900433 | |
| DNAse 1 | Promega | M6101 | 1,000 U (1 U/µl) |
| Terminal transferase | Roche | 3333574001 | 400 U. Including enzyme and coenzyme (CoCl2). |
| DLR-1a | Affymetrix | 900542 | |
| Hybridization internal controls B2 and 20x Eukaryotic Hybridization Control | Affymetrix | 900454 | |
| GeneChip Hybridization, Wash and staining | Affymetrix | 900720 | Including PreHybridization Mix and 2x Hybridization Mix for 30 reactions |
| 10x One-Phor-All Buffer PLUS | Composition in DEPC-treated water: 100 mM Tris-acetate pH 7.5; 100 mM magnesium acetate; 500 mM potassium acetate. | ||
| RNeasy Mini kit | Qiagen | 74104 | RNA cleanup protocol |
| WT-Ovation RNA amplification system | Nugen | 2210-24 | |
| QIAquik PCR purification kit | Qiagen | 28104 | |
| EQUIPMENT | |||
| Material Name | Company | Catalogue Number | Comments |
| Nanodrop 1000 | Thermo Scientific | ||
| GeneChip Scanner 3000 7G | Affymetrix | GS30007G | Optional: autoloader |
| GeneChip Fluidics Station 450 | Affymetrix | FS450 | |
| GeneChip Hybridization 640 Oven | Affymetrix | 640 | Includes 4 GeneChip Probe array carriers |
| Workstation loaded with GeneChip Operating Software (GCOS) including the GeneChip Scanner 3000 High-Resolution Scanning Patch | |||
| HERV-V2 chip | Affymetrix | Custom array. For microarray availability (for research use only), please contact: François Mallet Laboratoire Commun de Recherche Hospices Civils de Lyon-bioMérieux Medical Diagnostic Discovery Department Centre Hospitalier Lyon Sud, Bâtiment 3F 69495, Pierre Bénite cedex France Phone: 33 (0)4 72 67 87 85 Email: francois.mallet@biomerieux.com | |
| HERV-V2 conception Dedicated database and annotations The construction of a dedicated database, grouping genomic HERV sequences belonging to 6 HERV families, has been achieved by the following procedure: (i) the most complete and representative sequence of each HERV family was selected from the literature and defined as a prototype sequence (Figure 2). (ii) The 6 prototypes were functionally annotated with reference to their LTR (U3/R/U5) and internal parts (gag/pol/env). (iii) RepeatMasker 44 was then applied using these functional sequences as input libraries. A genome-wide search of all related sequences was performed over the human genome on the basis of a minimum 80% homology (NCBI 36/hg18). (iv) Finally, the functional sequences retrieved by this process were assembled into distinct loci on the basis of their genomic location and eventually implemented in a dedicated HERV database. This database, called HERV-gDB3, contains 10,035 individual HERV loci35. Locus-specific probes design Starting from HERV-gDB3, overlapping tracks of 25-mer candidate probes were firstly generated. Each candidate probe was then aligned against the human genome using KASH 45 in order to assess the cross-hybridization potentialities. This latter estimation was performed by a model developed specifically for this purpose and referred to as EDA+. Briefly, the principle of EDA+ is to take into account the instability brought by mismatches and gaps in a 25-mer target/probe hybridization complex. Candidate probes exhibiting low cross-hybridization risks (i.e. a low number of non-specific genomic targets) are selected and lastly assembled into probesets. Custom HERV GeneChip microarray The custom HERV GeneChip integrates 23,583 HERV probesets and can discriminate 5,573 distinct HERV elements, composed of solo LTRs, complete and partial proviruses (Figure 2). The standard Affymetrix control probes for unbiased amplification and hybridization were also included in the microarray. | |||
参考文献
- Artibani, W. Landmarks in prostate cancer diagnosis: the biomarkers. BJU Int. 110, Suppl 1. 8-13 (2012).
- Girometti, R., et al. Negative predictive value for cancer in patients with "gray-zone" PSA level and prior negative biopsy: preliminary results with multiparametric 3.0 Tesla MR. J. Magn. Reson. Imaging. 36, 943-950 (2012).
- You, B., et al. Prognostic value of modeled PSA clearance on biochemical relapse free survival after radical prostatectomy. Prostate. 69, 1325-1333 (2009).
- Vickers, A. J., Brewster, S. F. PSA Velocity and Doubling Time in Diagnosis and Prognosis of Prostate Cancer. Br. J. Med. Surg. Urol. 5, 162-168 (2012).
- Bussemakers, M. J., et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer. Cancer Res. 59, 5975-5979 (1999).
- Vlaeminck-Guillem, V., Ruffion, A., Andre, J., Devonec, M., Paparel, P. Urinary prostate cancer 3 test: toward the age of reason. Urology. 75, 447-453 (2010).
- Buscher, K., et al. Expression of the human endogenous retrovirus-K transmembrane envelope, Rec and Np9 proteins in melanomas and melanoma cell lines. Melanoma Res. 16, 223-234 (2006).
- Ishida, T., et al. Identification of the HERV-K gag antigen in prostate cancer by SEREX using autologous patient serum and its immunogenicity. Cancer Immun. 8, 15(2008).
- Sauter, M., et al. Human endogenous retrovirus K10: expression of Gag protein and detection of antibodies in patients with seminomas. J. Virol. 69, 414-421 (1995).
- Pérot, P., Bolze, P. A., Mallet, F. Viruses: Essential Agents of Life. Witzany, G. , Springer-Verlag. 325-361 (2012).
- Stamey, T. A., Kabalin, J. N. Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. I. Untreated patients. Untreated patients. J. Urol. 141, 1070-1075 (1989).
- Catalona, W. J., et al. Measurement of prostate-specific antigen in serum as a screening test for prostate cancer. New Engl. J. Med. 324, 1156-1161 (1991).
- Schroder, F. H. Prostate cancer around the world. An overview. Urol. Oncol. 28, 663-667 (2010).
- Klotz, L. Active surveillance for favorable-risk prostate cancer: background, patient selection, triggers for intervention, and outcomes. Curr. Urol. Rep. 13, 153-159 (2012).
- Irizarry, R. A., et al. Exploration, normalization, and summaries of high density oligonucleotide array probe level data. Biostatistics. 4, 249-264 (2003).
- Tusher, V. G., Tibshirani, R., Chu, G. Significance analysis of microarrays applied to the ionizing radiation response. Proc. Natl. Acad. Sci. U.S.A. 98, 5116-5121 (2001).
- Storey, J. D., Tibshirani, R. Statistical significance for genomewide studies. Proc. Natl. Acad. Sci. U.S.A. 100, 9440-9445 (2003).
- Team, R. D. C. R: A language and environment for statistical computing. , (2008).
- Gentleman, R. C., et al. Bioconductor: open software development for computational biology and bioinformatics. Genome Biol. 5, R80(2004).
- de Parseval, N., Lazar, V., Casella, J. F., Benit, L., Heidmann, T. Survey of human genes of retroviral origin: identification and transcriptome of the genes with coding capacity for complete envelope proteins. J. Virol. 77, 10414-10422 (2003).
- Wang-Johanning, F., et al. Detecting the expression of human endogenous retrovirus E envelope transcripts in human prostate adenocarcinoma. Cancer. 98, 187-197 (2003).
- Smallwood, A., et al. Temporal regulation of the expression of syncytin (HERV-W), maternally imprinted PEG10, and SGCE in human placenta. Biol. Reprod. 69, 286-293 (2003).
- Okahara, G., et al. Expression analyses of human endogenous retroviruses (HERVs): tissue-specific and developmental stage-dependent expression of HERVs. Genomics. 84, 982-990 (2004).
- Buscher, K., et al. Expression of human endogenous retrovirus K in melanomas and melanoma cell lines. Cancer Res. 65, 4172-4180 (2005).
- Forsman, A., et al. Development of broadly targeted human endogenous gammaretroviral pol-based real time PCRs Quantitation of RNA expression in human tissues. J. Virol. Methods. 129, 16-30 (2005).
- Muradrasoli, S., Forsman, A., Hu, L., Blikstad, V., Blomberg, J. Development of real-time PCRs for detection and quantitation of human MMTV-like (HML) sequences HML expression in human tissues. J. Virol. Methods. 136, 83-92 (2006).
- Seifarth, W., et al. Comprehensive analysis of human endogenous retrovirus transcriptional activity in human tissues with a retrovirus-specific microarray. J. Virol. 79, 341-352 (2005).
- Pichon, J. P., Bonnaud, B., Mallet, F. Quantitative multiplex degenerate PCR for human endogenous retrovirus expression profiling. Nat. Protoc. 1, 2831-2838 (2006).
- Flockerzi, A., et al. Expression pattern analysis of transcribed HERV sequences is complicated by ex vivo recombination. Retrovirology. 4, 39(2007).
- Flockerzi, A., et al. Expression patterns of transcribed human endogenous retrovirus HERV-K(HML-2) loci in human tissues and the need for a HERV Transcriptome Project. BMC Genomics. 9, 354(2008).
- Gosenca, D., et al. HERV-E-Mediated Modulation of PLA2G4A Transcription in Urothelial Carcinoma. PLoS ONE. 7, e49341(2012).
- Buzdin, A., Kovalskaya-Alexandrova, E., Gogvadze, E., Sverdlov, E. GREM, a technique for genome-wide isolation and quantitative analysis of promoter active repeats. Nucleic Acids Res. 34, e67(2006).
- Buzdin, A., Kovalskaya-Alexandrova, E., Gogvadze, E., Sverdlov, E. At least 50% of human-specific HERV-K (HML-2) long terminal repeats serve in vivo as active promoters for host nonrepetitive DNA transcription. J. Virol. 80, 10752-10762 (2006).
- Gimenez, J., et al. Custom human endogenous retroviruses dedicated microarray identifies self-induced HERV-W family elements reactivated in testicular cancer upon methylation control. Nucleic Acids Res. 38, 2229-2246 (2010).
- Pérot, P., et al. Microarray-based sketches of the HERV transcriptome landscape. PLoS ONE. 7, e40194(2012).
- Fehlbaum, P., Guihal, C., Bracco, L., Cochet, O. A microarray configuration to quantify expression levels and relative abundance of splice variants. Nucleic Acids Res. 33, e47(2005).
- Prensner, J. R., et al. Transcriptome sequencing across a prostate cancer cohort identifies PCAT-1, an unannotated lincRNA implicated in disease progression. Nat. Biotechnol. 29, 742-749 (2011).
- Tomlins, S. A., et al. Distinct classes of chromosomal rearrangements create oncogenic ETS gene fusions in prostate cancer. Nature. 448, 595-599 (2007).
- Hermans, K. G., et al. Truncated ETV1, fused to novel tissue-specific genes, and full-length ETV1 in prostate cancer. Cancer Res. 68, 7541-7549 (2008).
- Brodziak, A., et al. The role of human endogenous retroviruses in the pathogenesis of autoimmune diseases. Med. Sci. Monit. 18, RA80-RA88 (2012).
- Mullins, C. S., Linnebacher, M. Human endogenous retroviruses and cancer: Causality and therapeutic possibilities. World J. Gastroenterol. 18, 6027-6035 (2012).
- Young, G. R., et al. Resurrection of endogenous retroviruses in antibody-deficient mice. Nature. 491, 774-778 (2012).
- Vander Kuyl, A. C. HIV infection and HERV expression: a review. Retrovirology. 9, 6(2012).
- Smit, A. F. A., Hubley, R. RepeatMasker Open-3.0. , (1996).
- Navarro, G., Raffinot, M. Flexible Pattern Matching in Strings: Practical On-Line Search Algorithms for Texts and Biological Sequences. , Cambridge University Press. (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved