Method Article
蛍光タグ付きワクシニアウイルスタンパク質の効率的な生成のための方法論
* これらの著者は同等に貢献しました
要約
一過性の支配的選択の方法を使用して蛍光タグ付きタンパク質を同時に発現する組換えワクシニアウイルスの生成のための迅速かつモジュール的なプロトコルがここに記載されている。
要約
ウイルスタンパク質に蛍光タンパク質をタグ付けすることは、ウイルスと宿主の相互作用に関する理解を深める上で不可欠なアプローチであることが証明されています。天然痘の根絶に用いられる生ワクチンであるワクシニアウイルス(VACV)は、その大きなビリオンサイズとゲノムレベルでの操作が容易なため、蛍光生細胞顕微鏡に特に適度である。我々は、組換えウイルスを生成するための最適化されたプロトコルをここに報告する。ワクシニア複製時の標的相同組換えの最小要件を決定し、構築物生成の簡素化を可能にした。これにより、蛍光レポーターと代謝選択との一過性支配的選択(TDS)のアライアンスが可能になり、蛍光的に標識されたウイルスタンパク質に対する迅速かつモジュール的なアプローチが可能になりました。蛍光組換えウイルスの生成を合理化することにより、ウイルス複製中に発生するウイルス・宿主相互作用の多くの側面の高度なイメージング解析などの下流アプリケーションを容易にすることができる。
概要
ワクシニアウイルス(VACV)は原型ポックスウイルスであり、天然痘の原因物質であるバリオラウイルスとの関連性が高い。これらのウイルスはいずれも、サルモンポックスやエクトロメリアウイルス(マウスポックス)1などの他の注目すべき病原体を含む正射体属のメンバーである。オルソポックスウイルスは、200以上の予測オープンリーディングフレーム2,3をコードする大きな二本鎖DNAゲノム(180〜220kb)を有する。これらのウイルスの複製は、成熟したウイルス(MV)がなされる核周辺ウイルス工場の形成と、MVのサブセットがラップされたウイルス(WV)を生成するために2つの追加膜を獲得するトランスゴルジネットワーク(ロバーツとスミス4によってレビューされた)を含む。オルソポックスゲノムは、VACVゲノム複製の特徴である遺伝子組換えの高度に起因する遺伝子操作に対して非常に適しており、ウイルスDNAポリメラーゼ5によって媒介される。組換えウイルスの生成は、ホマロジーが12bp以下の相似性の相似組換えおよび線形DNA分子に依存し、ワクシニアウイルス感染細胞6の再結合を媒介するのに十分である。ワクシニアウイルスの蛍光標識は、オルソポックス粒子の大きなサイズのために非常に明るいウイルス粒子を生じることができ、これはビリオン7あたり多くの蛍光タンパク質の組み込みを可能にする。ワクシニアは、外来DNA8の大きな断片を運ぶ能力を有し、さらに、硬質キャプシド対称性の欠如は、それらの内因性遺伝子9からウイルスタンパク質遺伝子融合を発現する際の柔軟性の程度を可能にし得る。VACVタンパク質の蛍光タグ付けは、細胞内レベルでの宿主と病原体相互作用の研究に非常に有用であることが証明されており、特にウイルス侵入10の分野において、輸送11〜13、および形態形成、特に包まれたビリオン7の。
組換えウイルスは、減衰成長表現型14,15、代謝選択16-18、またはマーカー遺伝子の発現(例えばX-gal19または蛍光タンパク質13,20)の救助によって選択することができる。ここでは、蛍光性と代謝性の選択の強力な組み合わせを用いた蛍光ウイルスの選択について説明する。フォークナーとモス(1990)21によって開発された過渡的な支配的選択(TDS)ベクターは、目的の望ましい蛍光タグ付き遺伝子と一緒にマーカーを統合することを可能にする。代謝選択が除去されると、選択遺伝子を切除する二次的な組換え事象が起こり得るが、蛍光タグ付きウイルスタンパク質はそのまま残る。下図2は、実験手順の概要を示す。本研究で利用される選択遺伝子は、mCherryおよび大腸菌グアニンホスホリルトランスビセラーゼ(gpt)遺伝子であり、いずれも合成早期/後期ウイルスプロモーターから発現し、Cordeiroららが以前に使用した。22加えて、対象とするタグ付き融合タンパク質の蛍光がある。代謝選択が除去されると、選択可能なマーカー(mCherryおよびgpt)が切除され、タグ付き遺伝子の蛍光のみが残り、正しい組換えウイルスの同定が可能になる。選択マーカーの切除は、複数の蛍光タグを組み合わせる可能性を提供し、複数のウイルスタンパク質を同時に蛍光標識する能力を持つウイルスを作成することを可能にします。これまでの研究では、ワクシニアウイルス感染細胞にトランスフェクトされた直線的および円形DNA分子のワクシニア再結合に関する最小限の相同性要件を決定した。我々は、ワクシニアウイルスゲノムへの組み込みを通じて、gpt-mCherry TDSベクターにおける横向きの腕の様々な相同性の長さの再結合効率を決定したかった。TDSベクター中の100bpの相同領域は、相同組換えによって組換えDNAをVACVゲノムに標的化し、媒介するのに十分であると判断した(図4)。より小さな相同性の長さはまた、組み換えを可能にするが、100 bp相同性の長さは、代謝および蛍光選択で容易に識別できる十分な組換えウイルスを提供した。このサイズのDNA断片は、比較的低コストで商業的に合成することができ、組換えウイルスの作成のための複数のベクターの産生を大いに促進する。我々は、隣接する領域のオリゴヌクレオチド配列の合成のコストを抑えながら、より大きな再結合頻度を提供するために、相同性の長さを150 bpに増やすことを選んだ。
プロトコル
1. 再結合ベクトルの作成
- N-またはC末端に対象のウイルス遺伝子を標識するために必要な相同性の150bpの長い横置き領域(左右の腕と呼ばれる)を特定する( 図1b参照)。
- 選択した一対の制限部位によって分離された150bp左右の腕を含むオリゴヌクレオチド配列を設計する。この全体のシーケンスは、合成された後にTDSベクターに組み込むことを可能にするために、(最初のペアとは異なる)第2の制限部位のペアによって横たわらなければならない。配列が所望の挿入部位とフレーム内にあるという制限部位を有するオリゴヌクレオチドを設計する際には注意してください。
- 合成用オリゴヌクレオチドを設計する際には、左右の腕の間に制限部位を組み込み、選択した蛍光タグの開いた読み取りフレームに隣接するものと一致する必要がある( 図1b参照)。NotI制限部位を、左腕と蛍光タグの開始との間の3つのアミノ酸リンカーとして使用することができる。
- PCRによって蛍光タグの両側にこれら同じ制限部位を組み込む( 図1cを参照)。
- 合成したフラグメントを TDS ベクターに複製します。
- ホモロジーの左右の腕領域の間の制限部位を使用して、得られた再結合ベクターに蛍光タグをクローン化する( 図1dを参照)。
2. 組換えウイルス生成
- 図2に従って、多重感染性(MOI)>1で、血清フリー培地中のバクシニアウイルスを有するBS-C-1細胞の単層に感染する。
- 1時間の感染後、Dulbeccoの修飾イーグル培地(DMEM)を有するレスキュー細胞と、無血清培地中の3:1の比での組換えベクタープラスミドおよびトランスフェクション試薬の混合物を用いたトランスフェクト。
- 24時間後、牛胎児血清(FBS)を含んでいないDMEMの細胞を掻き取り、回収し、開いた細胞を破壊してウイルス粒子を放出するために3回の凍結融解サイクルを行う。
- 10% FBS DMEMおよびGPT選択試薬ミコフェノール酸(25 μg/ml)とキサンチン(250 μg/ml)の液体オーバーレイで、次のようにプラークアッセイを実行します。
- 6ウェルプレートにBS-C-1細胞の単層をシードします。
- ウイルス粒子を含む凍結解凍細胞の連続希釈液を100%コンフルエント細胞単層に感染させることで、個々のプラークの適切な分離を確実にする。
- GPT選択試薬を含むDMEMを含む液体10%FBSとのオーバーレイ - ミコフェノール酸とキサンチンは、それぞれ25 μg/mlと250 μg/mlの最終濃度で。
- 24時間のインキュベーションの後、液体のオーバーレイを取り除き、蛍光顕微鏡を使用して、TDSベクターからウイルスへのmCherryの組み込みに対応する拡散赤色蛍光を示すプラークを探します。標的遺伝子および選択した蛍光タグに応じて、タグ付き遺伝子の局在した蛍光も同じ赤色プラークで観察され得る。
- 各組換えウイルスに対して、ピペットチップを使用した局所的な擦り傷と、DMEMを含む5%FBSの100 μlの100 μlを選んで細胞をエッペンドルフチューブに移し、続いて3ラウンドの掻き取り細胞を凍結解凍して組換えウイルスを放出する。
- 凍結解凍ウイルスを含むDMEMを12ウェルプレートの細胞の単層に加え、増殖培地中のGPT選択試薬で組換えウイルスを増幅する。感染後24時間の増幅に成功した。
- 赤い蛍光を示すプラークの正常に増幅されたプラークのプラークアッセイを実行し、今度はアガロースオーバーレイとGPT選択を行い、次のように行います。
- 6ウェルプレートにBS-C-1細胞の単層をシードします。
- 組換えウイルスの連続希釈を行い、FBSフリーDMEMで増加するウイルスの希釈にウェルに感染します。
- 感染後1時間、液体培地を取り除き、2.5%FBS、292 μg/ml L-グルタミン、100 U/mlペニシリン、100μg/mlストレプトマイシンを含む最小必須培地(MEM)で0.5%アガロースを重ねたGPT選択試薬を重ねた。
- 感染後2〜3日、選択した蛍光タグの赤色と色の両方が再び増幅される蛍光を示すプラークをピックし、今回はGPT選択なし。
- 選択なしのアガロースオーバーレイで次のプラークアッセイを実行します。
- 拡散赤蛍光を失ったが、選択したタグに対応する局所的な蛍光を保持しているプラークを選んでください。
- 選択なしでプラークの精製を続けると 、mCherry および gpt 選択遺伝子を失ったが、選択されたタグに対応する局所的な蛍光を保持する組換えウイルスの純粋なストックを得る。チェック株はプラークアッセイによって純粋であり、すべてのプラークは同様のプラーク表現型を有するべきである。
- ゲノムDNAのPCRスクリーニングを使用して、ウイルスストックが純粋であることを確認します。
- 蛍光遺伝子挿入部位に隣接するプライマーと、挿入された蛍光遺伝子自体を増幅するプライマーを設計する。これらのプライマーの異なる組み合わせは、遺伝子挿入を検出し、純度を示すPCRアンプリコンを生成します。
- ウイルス株を増幅して、PCRを1つのウェルでスクリーニングし、BS-C-1細胞の12ウェルプレート単層をスクリーニングする。
- 感染後24時間、感染した細胞をDMEMの250 μlに擦り込む。
- 遠心分離機感染細胞(18,000 x g 10分間、4°C)、上清を除去し、500 μl TE(10 mM Tris-HClおよび1 mM EDTA、pH 8)で細胞ペレットを0.1%(v/v)SDSで再懸濁します。細胞をライスするボルテックス。
- 500 μl フェノール-クロロホルム-イソアミルアコホールを加え、インバートを混ぜます。遠心分離機(18,000 x g 4分、4°C)。上清を取り、繰り返します。
- 1ml100%エタノール(チルド)と50μl酢酸ナトリウムを加えて上清にエタノール沈殿を行い、インバートを混合する。
- -20 °Cで一晩、または-80°Cで1時間放置します。遠心分離機(30分間18,000 x g、4°C)、すべての液体を取り除き、沈殿したDNAを空気乾燥させます。50 μl TE で再中断します。
- これをゲノムDNA PCRスクリーニングのテンプレートとして使用します。
3. 複数のタグを持つ組換えウイルスの生成
- 同じ細胞単層を蛍光組換えウイルスと共感染させて、ダブルまたはトリプル標識ウイルスを作成するか、プロトコル1)から繰り返し手順を別のタグで作成します。
- プラーク表現型またはPCRスクリーニングに基づいてウイルスを精製するウイルス分離ゲノムDNA。
結果
図 1は、この手順に必要なさまざまな構成体を示しています。 図2は、選択プロセスの各ステップに対して描かれたA3-GFP組換式VACVの代表的な蛍光プラーク画像を用いた実験手順の概要を示している。図3において、内部ウイルスコア23および外包24の一部であるウイルス構造タンパク質A3およびF13を標的とする蛍光マーカーでタグ付けされたタンパク質を発現する組換えワクシニアウイルスが、それぞれ示されている。作成された組換えウイルスのそれぞれについて、ウイルスプラークおよび感染細胞の観察が描かれている。VACVゲノムとの相同組換えの効率は、それに対する相同性の70bp領域を低く含み、試験を行い、その結果を図4に示した。100 bp相同性を含むベクターとの組み換えから作られたウイルスプラークを同定する相対的な成功は、標的遺伝子に150 bpの長さの左右の腕の相同性を合成することを選択した背後にある推論であった。
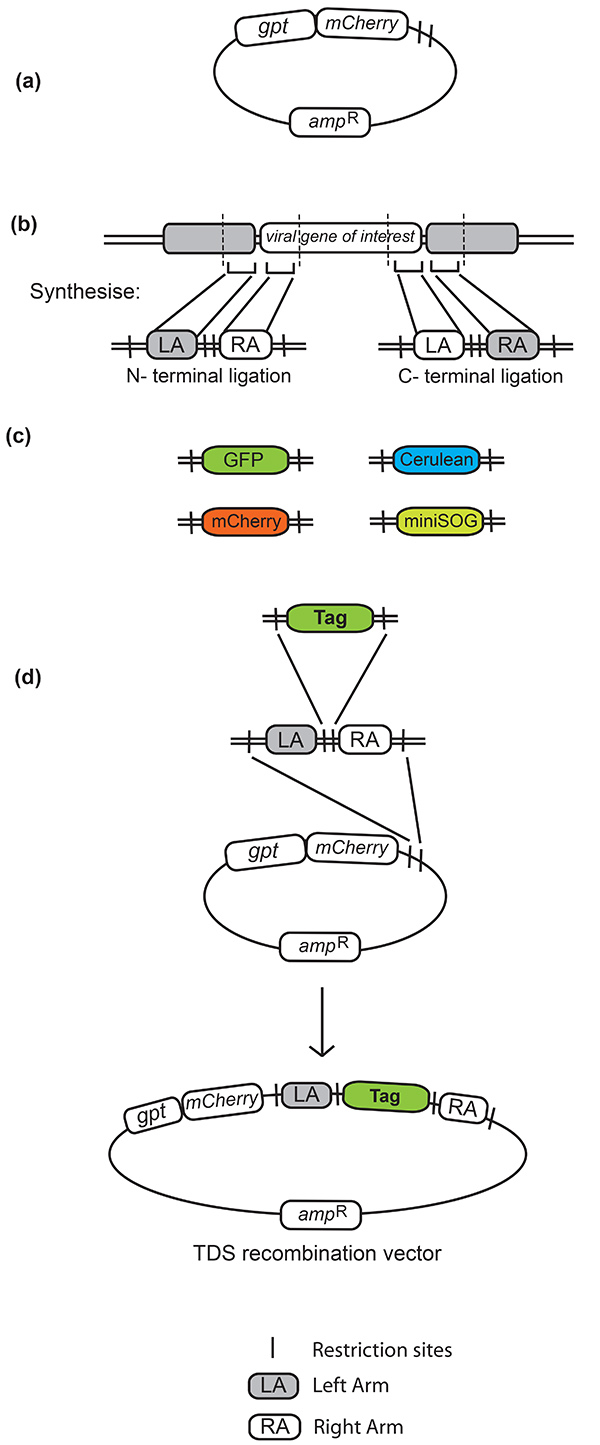
図 1.過渡的選択(TDS)の組換えベクトル。() gptとmCherry選択マーカーを持つ TDS ベクター。(b) ホモロジーの左右の腕は、間に、そして相同性の腕を横たわる特定の制限部位で設計されています。この方法で使用される左右の腕の間の制限部位はNotIとBamHIであり、NotIサイトは遺伝子と蛍光タグとの間のリンカーとしても使用されている。(c)この方法と互換性のある蛍光タグは、対応する制限部位によって横になっている。使用されるいくつかのタグは、GFP(緑色蛍光タンパク質)、RFP(赤色蛍光タンパク質)、セルリアン(ECFP、シアン蛍光タンパク質、サイト指向変異誘発25による改善)およびmini-SOG、およびミニSOG、照明26上のEMによって解決可能な製品を作成するGFPから作り出す蛍光タンパク質である。(d) 最終 TDS 組換えベクトルの生成に関与するクローニング手順。左右の横側の腕を含む合成オリゴヌクレオチドは、まずTDSベクターにクローン化される。これは、左右の腕の間に組み込まれた制限部位にクローニングすることによって、選択した任意のタグを往復できる組み換えベクトルを提供する。ここをクリックすると、より大きな画像を表示できます。
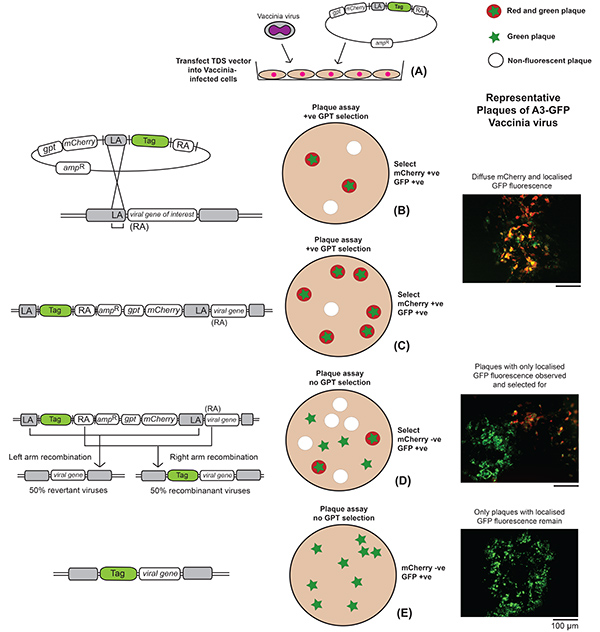
図 2.組換えワクシニアウイルスを作り出す実験手順の概要遺伝的および細胞レベルで起こる事象は、A3-GFP標識蛍光ワクシニアウイルスの作成後のステップを概説する代表的なプラーク画像と共に描かれている。(A)ワクシニアウイルスに感染した細胞は、TDSの組換えベクターにトランスフェクトされる。(B)この図では、左手組換えの結果のみが描かれて、例では選択した蛍光タグとしてGFPを使用しています。右手の組み換えは、TDSプラスミド全体が同様の方法でゲノムに組み込まれることになるが、タグが中間ステップ、すなわちステップCにおいて標的遺伝子全体に融合されることを除いて。プラークアッセイは、再結合ミックスを用いて細胞単層上で行われ、GPT選択を行う。(C)赤と緑の両方の蛍光を呈するプラークは、それぞれmCherryおよびGFP発現に対応し、摘み取られ、増幅される。選択が除去されると、gpt遺伝子とmCherry遺伝子(D)の喪失に対応する赤色蛍光の損失が生じ、緑色蛍光のみを呈するプラークが摘み取られ増幅される(E)。ここをクリックすると、より大きな画像を表示できます。
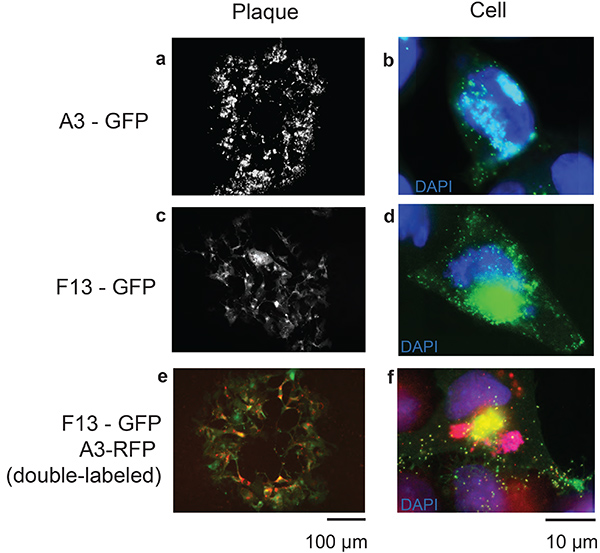
図 3.TDS組換えシステムの代表結果。画像は、48時間後に細胞に感染する組換えVACVの全プラーク(a,c,e;スケールバー100μm)を表し、8時間後に対応する組換えウイルスに感染した単一細胞の画像(b、d、f;スケールバー10μm)を伴う。 ウイルス粒子を可視化するために、ビリオンに局在するタンパク質に対応する遺伝子を選択した。A3は、ワクシニアビリオン(a、b)およびF13(c、d)のコアタンパク質は、ウイルスエンベロープタンパク質である。 蛍光標識A3とF13(e,f)の両方を有する二重タグ付きウイルスも示されている。ここをクリックすると、より大きな画像を表示できます。
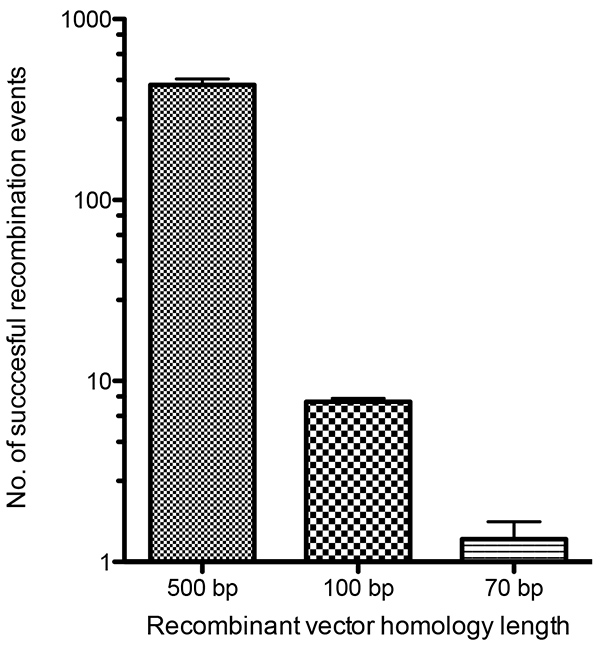
図 4.組換えベクターとVACVゲノムの組換え効率の定量的解析 BS-C-1単層は、VACVに感染し、500bp、100bp、または70bpのいずれかの相同性領域を含む3つの再結合ベクターを持つ1時間の再結合ベクターをVACVゲノムにトランスフェクトした。各ベクターには 、gpt および mCherry 選択遺伝子を含むTDSカセットも含まれていた。細胞を感染後24時間回収し、リセドして形成された組換えウイルスを放出した。プラークアッセイは、GPT選択培地を用いた細胞ライセートに対して行われ、mCherry蛍光を示すプラークは、正常な組換えとしてカウントされた。 ここをクリックすると、より大きな画像を表示できます。
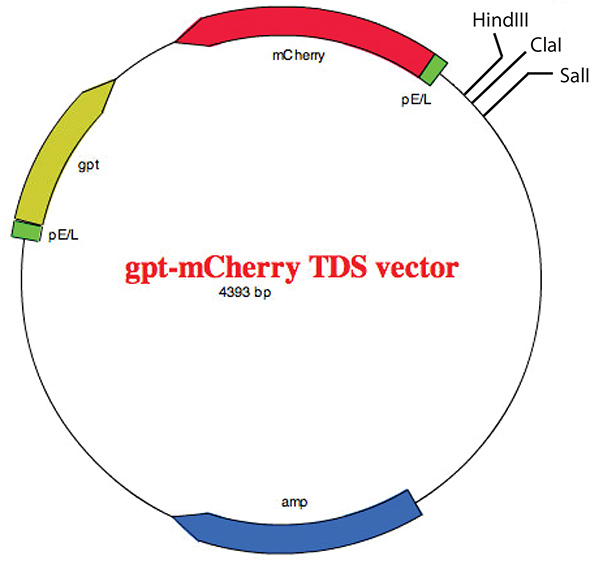
図 5.複数のクローニング部位を示す gpt-mCherry TDSベクトルの地図。 ベクターは、以前に説明されている22 とベクター マップは、EZ プラスミド マップ v1.9 の助けを借りて作成されました、 張研究室グループ (SCU). ここをクリックすると、より大きな画像を表示できます。
ディスカッション
この技術は、蛍光タグ付きウイルスタンパク質を発現する組換えウイルスを作成するための効率的かつモジュール的なプロトコルを記述する。この方法は、ウイルスゲノムへの唯一の変化がタグまたはマーカーの追加であることを保証し、選択マーカーを残さない。相同組換えに必要な短い腕の長さは、その直接合成を可能にし、数回の時間のかかるPCRとクローニングを排除し、mCherryおよび代謝GPT選択の蛍光を使用してウイルス組換え中間体を分離します。これらの中間体は、選択の除去に続いて、タグ付き遺伝子を有するウイルスに対して、または親のタイプに戻って解決することができる。蛍光性と代謝選択の両方の使用を含む同様の方法は、以前に説明された27 の、この研究で使用される方法は、相同性の短い、合成された領域を利用し、目的のタグ付き遺伝子の蛍光を画像化することによって所望の組換えウイルスの同定を可能にする。この二次選択は、プラークアッセイで十分な蛍光を生成する高発現ウイルス遺伝子のタグ付けにのみ適用可能である。あるいは、強力なウイルスプロモーターの下での蛍光タンパク質など、完全発現カセットの挿入を想定することができる。この場合、左右の腕は、タグ付けされるウイルス遺伝子ではなく、挿入点を定義するであろう。
実験手順の間に役立ついくつかの重要なステップがあります。上記のステップ2.3.3の液体オーバーレイは、赤/緑色蛍光プラークの検出と分離にとって極めて重要であることが判明した。GPT選択試薬とアガロースオーバーレイの組み合わせは、組換えウイルスの増殖を抑止し、トランスフェクション後のウイルスを増幅する第一歩のために液体オーバーレイに切り替えたと考えています。また、濃縮および精製のために局所的なタグ色蛍光を示す蛍光プラークを選ぶことも重要であり、左腕の組換えから生じる中間体は、左腕にもプロモーター配列が含まれている場合にプラークに観察される拡散蛍光をもたらす可能性があるためである。TDSベクター中のmCherryマーカー遺伝子は、例えば蛍光タグとしてmCherryを容易に取り込み、選択できるようにするためにgfpに置き換えてもよい。
上記のいくつかの技術は、組換えワクシニアウイルスを作成する確立された方法からわずかに異なります.例えば、組換え剤を作るために用いられるウイルスのMOIは通常128未満であるが、この方法によって組換え性ワクシニアウイルスを作り出すためには、より高いMOIの使用が十分であった。GPT選択試薬の使用は通常、選択試薬18を用いて細胞の前入れを必要とするが、救助段階の感染後に細胞を加えることは、特に蛍光選択マーカーの存在のために、依然として所望の組換え物の十分な選択を提供した。
前述のように、この技術の限界の1つは、二次蛍光選択ステップが、関心のあるタグ付きタンパク質が高発現されていることに依存し、プラークアッセイにおいて目で検出できるレベルにある点である。これがなければ 、mCherry 蛍光のみを示すウイルスを精製することができ、そのうち少なくとも50%は所望の組換えウイルスを含み、上記のステップ2.12で説明したPCRのような分子戦略によって同定することができる。別の制限は、タグ付けの結果として特定のタンパク質の不活性化である可能性があります。.蛍光タグは、経時の経大化を伴う組換えウイルスによって突然変異を受けたり、切除されたりする。そのため、顕微鏡法やPCRによる組換えウイルスストックの定期サンプリングが推奨されます。最後に、単一のウイルスに組み込むことができる蛍光タグ付きタンパク質の数に制限があるかもしれません。この 1 つの側面は、それらをすべて同時に視覚化する機能です。利用可能な蛍光タグの発光スペクトルの重複する性質を考えると、最小限のスペクトルブリードスルーを確実にするためにそれらを慎重に選択することが重要です。さらに、GFPやセルリアンなどの密接に関連するタグを使用すると、組み換えゲノム内の位置に応じて、両者の間に再結合の可能性が開かれます。
この技術のモジュール性は他の染色および/またはタグの選択との互換性に基づいて蛍光タグの簡単な置換を可能にする。選択マーカーを切除することにより、TDS法は、様々な蛍光タンパク質の連続付加、またはTDSベースのタグ付けと、フェロチ法によるTDSベースの遺伝子欠失の組み合わせを可能にする29。このアプローチの有用性の一例として、ウイルスコアとWV膜に標識する二重タグ付き蛍光ウイルスが生成された。このウイルスによるイメージング研究は、ウイルス複製中のウイルスの動き、形態形成およびラッピングを研究するために使用することができる。まだ特徴のないワクシニアウイルスタンパク質として、この技術によってタグ付けおよび研究することもできる。
ワクシニアウイルスは、生細胞顕微鏡に好ましいウイルスの多くの特性のためにイメージング研究で広く使用されています。蛍光タグはウイルスゲノムから発現し、トランスフェクションの必要性を排除し、感染動物または非トランスフェクター細胞に由来する一次細胞を容易に分析することを可能にする。当初、蛍光VVはウイルス運動30の単純な細胞内追跡に使用されたが、より最近のアプローチはFRET研究31、単一ウイルス粒子32でのFRAP、プロモーターレポーター33、生体内イメージング34、および構造研究35-37を含むようにその有用性を拡大している。これらの技術はすべて、組換え蛍光ウイルスを作成するこの方法と相まって、より簡単で近い範囲内にある可能性があります。
開示事項
利益相反は宣言されていません。
謝辞
この作品は、オーストラリア研究評議会連盟ディスカバリープロジェクト助成金#1096623によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Mycophenolic acid | Sigma-Aldrich | M3536-50MG | Dissolve in 0.1 N NaOH |
| Xanthine | Sigma-Aldrich | X0626-5G | Dissolve in 0.1 N NaoH |
| FuGENE HD transfection reagent | Promega | E2311 | |
| Fluorescence microscope fitted with Chroma filters 31001, 31002 | Olympus, Chroma | BX51 (Olympus); 31001, 31002 (Chroma) |
参考文献
- Fenner, F. Adventures with poxviruses of vertebrates. FEMS Microbiol. Rev. 24, 123-133 (2000).
- Goebel, S. J., et al. The Complete DNA-Sequence of Vaccinia Virus. Virology. 179, 247-266 (1990).
- Smith, G. L., Chan, Y. S., Howard, S. T. Nucleotide-sequence of 42 kbp of vaccinia virus-strain WR from near the right inverted terminal repeat. J. Gen. Virol. 72, 1349-1376 (1991).
- Roberts, K. L., Smith, G. L. Vaccinia virus morphogenesis and dissemination. Trends Microbiol. 16, 472-479 (2008).
- Gammon, D. B., Evans, D. H. The 3 '-to-5 ' Exonuclease Activity of Vaccinia Virus DNA Polymerase Is Essential and Plays a Role in Promoting Virus Genetic Recombination. J. Virol. 83, 4236-4250 (2009).
- Yao, X. D., Evans, D. H. Effects of DNA structure and homology length on vaccinia virus recombination. J. Virol. 75, 6923-6932 (2001).
- Ward, B., Isaacs, S. N. . Ch. 16 Vaccinia Virus and Poxvirology Vol. 269 Methods in Molecular Biology. 16, 205-218 (2004).
- Smith, G. L., Moss, B. Infectious Poxvirus Vectors Have Capacity for at Least 25,000. Base-Pairs of Foreign DNA. Gene. 25, 21-28 (1983).
- Heuser, J. Deep-etch EM reveals that the early poxvirus envelope is a single membrane bilayer stabilized by a geodetic "honeycomb" surface coat. J. Cell Biol. 169, 269-283 (2005).
- Schmidt, F. I., Bleck, C. K. E., Mercer, J. Poxvirus host cell entry. Curr. Opin. Virol. 2, 20-27 (2012).
- Ward, B. M. Visualization and characterization of the intracellular movement of vaccinia virus intracellular mature virions. J. Virol. 79, 4755-4763 (2005).
- Carter, G. C., et al. Vaccinia virus cores are transported on microtubules. J. Gen. Virol. 84, 2443-2458 (2003).
- Ward, B. M., Moss, B. Visualization of intracellular movement of vaccinia virus virions containing a green fluorescent protein-B5R membrane protein chimera. J. Virol. 75, 4802-4813 (2001).
- Rodriguez, J. F., Esteban, M. Plaque size phenotype as a selectable marker to generate vaccinia virus recombinants. J. Virol. 63, 997-1001 (1989).
- Blasco, R., Moss, B. Selection of recombinant vaccinia viruses on the basis of plaque-formation. Gene. 158, 157-162 (1995).
- Mackett, M., Smith, G. L., Moss, B. Vaccinia virus - a selectable eukaryotic cloning and expression vector. Proc. Natl. Acad. Sci. U.S.A. 79, 7415-7419 (1982).
- Panicali, D., Grzelecki, A., Huang, C. Vaccinia virus vectors utilizing the beta-galactosidase assay for rapid selection of recombinant viruses and measurement of gene-expression. Gene. 47, 193-199 (1986).
- Falkner, F. G., Moss, B. Escherichia-coli gpt gene provides dominant selection for vaccinia virus open reading frame expression vectors. J. Virol. 62, 1849-1854 (1988).
- Liu, G. Q., et al. Selection of recombinant vaccinia viruses (Tian-Tan strain) expressing hepatitis-B virus surface-antigen by using beta-galactosidase as a marker. Sci. China Ser. B-Chem. 33, 188-197 (1990).
- Domínguez, J., Lorenzo, M. D. M., Blasco, R. Green fluorescent protein expressed by a recombinant vaccinia virus permits early detection of infected cells by flow cytometry. J. Immunol. Methods. 220, 115-121 (1998).
- Falkner, F. G., Moss, B. Transient dominant selection of recombinant vaccinia viruses. J. Virol. 64, 3108-3111 (1990).
- Cordeiro, J. V., et al. F11-Mediated Inhibition of RhoA Signalling Enhances the Spread of Vaccinia Virus In Vitro and In Vivo in an Intranasal Mouse Model of Infection. Plos One. 4, (2009).
- Jensen, O. N., et al. Identification of the major membrane and core proteins of vaccinia virus by two-dimensional electrophoresis. J. Virol. 70, 7485-7497 (1996).
- Hirt, P., Hiller, G., Wittek, R. Localization and Fine-Structure of a Vaccinia Virus Gene Encoding an Envelope Antigen. J. Virol. 58, 757-764 (1986).
- Rizzo, M. A., Springer, G. H., Granada, B., Piston, D. W. An improved cyan fluorescent protein variant useful for. 22, 445-449 (2004).
- Shu, X. K., et al. A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. Plos Biol. 9, (2011).
- Wong, Y. C., Lin, L. C. W., Melo-Silva, C. R., Smith, S. A., Tscharke, D. C. Engineering recombinant poxviruses using a compact GFP-blasticidin resistance fusion gene for selection. J. Virol. Methods. 171, 295-298 (2011).
- Broder, C. C., Earl, P. L. . 62, 173-197 (1997).
- Blasco, R., Moss, B. Extracellular Vaccinia virus formation and cell-to-cell virus transmission are prevented by deletion of the gene encoding the 37,000-dalton outer envelope protein. J. Virol. 65, 5910-5920 (1991).
- Newsome, T. P., Marty, A. J., Lynn, H., Procter, D. J., Diefenbach, R. J., Cunningham, A. L. Ch. Navigating the subcellular space: Lessons from vaccinia virus. Viral Transport, Assembly and Egress. , 155-177 (2011).
- Jeshtadi, A., et al. Interaction of Poxvirus Intracellular Mature Virion Proteins with the TPR Domain of Kinesin Light Chain in Live Infected Cells Revealed by Two-Photon-Induced Fluorescence Resonance Energy Transfer Fluorescence Lifetime Imaging Microscopy. J. Virol. 84, 12886-12894 (2010).
- Weisswange, I., Newsome, T. P., Schleich, S., Way, M. The rate of N-WASP exchange limits the extent of ARP2/3-complex-dependent actin-based motility. Nature. 458, (2009).
- Dower, K., Rubins, K. H., Hensley, L. E., Connor, J. H. Development of Vaccinia reporter viruses for rapid, high content analysis of viral function at all stages of gene expression. Antiviral Res. 91, 72-80 (2011).
- Dénes, B., Fodor, N., Obenaus, A., F, I. Engineering oncolytic Vaccinia viruses for non-invasive optical imaging of tumors. Open Biotechnol. J. 2, 252-261 (2008).
- Humphries, A. C., et al. Clathrin Potentiates Vaccinia-Induced Actin Polymerization to Facilitate Viral Spread. Cell Host Microbe. 12, 346-359 (2012).
- Horsington, J., Turnbull, L., Whitchurch, C. B., Newsome, T. P. Sub-viral imaging of vaccinia virus using super-resolution microscopy. J. Virol. Methods. 186, 132-136 (2012).
- Horsington, J., et al. A36-dependent Actin Filament Nucleation Promotes Release of Vaccinia Virus. PLoS Pathog. 9, (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved