Method Article
有效生成荧光标记疫苗病毒蛋白的方法
* 这些作者具有相同的贡献
摘要
此处描述了一种快速和模块化的协议,用于生成重组疫苗病毒,同时使用瞬时主导选择的方法表达荧光标记的蛋白质。
摘要
用荧光蛋白标记病毒蛋白已被证明是促进我们对病毒宿主相互作用的理解不可或缺的方法。疫苗病毒(VACV)是用于消灭天花的活疫苗,由于其巨大的病毒大小和在基因组水平上易于设计,因此特别容易用于荧光活细胞显微镜。我们在这里报告生成重组病毒的优化协议。确定了疫苗复制期间有针对性的同源重组的最低要求,从而简化了构造生成。这使得瞬时主导选择 (TDS) 与荧光报告器和代谢选择的联盟能够提供快速和模块化的方法来荧光标记病毒蛋白。通过简化荧光重组病毒的生成,我们能够促进下游应用,例如对病毒复制过程中发生的病毒-宿主相互作用的许多方面进行高级成像分析。
引言
疫苗病毒 (VACV) 是原毒痘病毒,与天花的致病剂 Variola 病毒密切相关。这两种病毒都是矫形器属的成员,包括其他著名的病原体,如猴痘和直肠病毒(鼠标痘)1。矫形病毒有大型双链DNA基因组(180-220 kb),编码超过200个预测的开放读数帧2,3。这些病毒的复制涉及形成一个跨核病毒工厂,在那里制造成熟的病毒(MV),以及一个跨戈尔吉网络,其中MV的子集获得两个额外的膜来生成包裹的病毒(WV)(由罗伯茨和史密斯4审查)。矫形器基因组高度适应基因操纵,由于高度的基因重组,这是VACV基因组复制的一个特点,并由病毒DNA聚合酶5调解。产生重组病毒依赖于同源重组和线性DNA分子,同源性小至12bb足以调解疫苗病毒感染细胞6的重组。由于矫形器颗粒体积大,疫苗病毒的荧光标签可以产生极其明亮的病毒颗粒,这使得每个病毒7含有许多荧光蛋白。Vaccinia 有能力携带大量外来 DNA8 的片段,此外,缺乏刚性对称性可能允许在表达病毒蛋白基因融合时具有一定程度的灵活性,从其内源性叶9 。事实证明,VACV蛋白的荧光标记对研究细胞下的宿主-病原体相互作用,特别是在病毒进入10、运输11-13和形态形成领域,特别是包裹病毒7的研究,具有宝贵的价值。
重组病毒可以通过分离衰减生长表型14,15,代谢选择16-18,或通过表示标记基因(如X-gal19或荧光蛋白13,20)来选择。在这里,我们使用荧光和代谢选择的强大组合来描述荧光病毒的选择。由福克纳和莫斯(1990)21开发的瞬态主导选择(TDS)载体,允许标记与所需的荧光标记感兴趣的基因集成。当代谢选择被去除时,可能发生二次重组事件,切除选择基因,但保持荧光标记的病毒蛋白完好无损。下图2概述了实验过程。本研究中采用的选择基因是mCherry和大肠杆菌瓜宁磷脂转移酶(gpt)基因,均表示来自合成的早期/晚病毒促进剂,并曾被科尔代罗等人使用。22此外,还有感兴趣的标记融合蛋白的荧光。删除代谢选择时,可选标记(mCherry和gpt)被切除,只留下标记基因的荧光,从而允许识别正确的重组病毒。选择标记的切除提供了组合多个荧光标签的可能性,使我们能够创建病毒,同时对几个病毒蛋白进行荧光标记。先前的研究已经确定了疫苗重组线性和圆形DNA分子的最小同源要求,这些分子被转化为接种疫苗病毒感染的细胞6。我们希望通过将gpt-mCherry TDS载体纳入疫苗病毒基因组,确定gpt-mCherry TDS载体侧翼手臂不同同源长度的重组效率。经确定,TDS载体中100 bp的同源区域足以通过同源重组(图4)定位和调解将重组DNA插入VACV基因组。虽然较小的同源长度也能够重组,但 100 bp 同源长度提供了足够的重组病毒,这些病毒可以很容易地识别出代谢和荧光选择。这种大小的DNA片段可以以相对较低的成本进行商业合成,并大大促进多个载体的产生,以产生重组病毒。我们选择将同源长度增加到 150 bp,以提供更大的重组频率,同时降低侧翼区域寡核苷酸序列的合成成本。
研究方案
1. 创建重组矢量
- 识别150 bp长侧翼的同源区域(称为左右臂),需要N-或C-最终标记感兴趣的病毒基因(见图1b)。
- 设计一个寡核苷酸序列,由150 bp左右臂组成,由一对选择的限制点分开。整个序列还必须由第二对限制站点(与第一对不同)侧翼,以便在合成后合并到 TDS 矢量中。在设计带有限制位点的寡核苷酸时,请小心,该限制位点的序列与所需的插入位点相框。
- 在设计用于合成的寡核苷酸时,在左右臂之间加入限制位点,该位置必须与选择的荧光标签的开放读取框架两侧的位点相匹配(见 图 1b)。在左臂和荧光标签的开始之间,可以使用 NotI 限制站点作为三个氨基酸链接器。
- 将这些相同的限制站点纳入 PCR 荧光标签的两侧(见图 1c)。
- 将合成片段克隆到 TDS 矢量中。
- 使用同源左臂和右臂区域之间的限制位点将荧光标签克隆到由此产生的重组载体中(见图 1d)。
2. 重组病毒生成
- 根据 图2,在无血清介质中感染 BS-C-1 细胞的单层细胞,在多种感染 (MOI) > 1。
- 感染后1小时,使用Dulbecco的改良鹰介质(DMEM)进行抢救细胞,并在无血清介质中以3:1的比例与重组载体质粒和转染试剂的混合物发生变异。
- 24小时后,刮伤并恢复DMEM中没有胎儿牛血清(FBS)的细胞,并执行三个冷冻-解冻周期,以打破开放细胞并释放病毒颗粒。
- 执行斑块检测,液体覆盖为 10% FBS DMEM 和 GPT 选择试剂肌血酸 (25 μg/ml) 和异氨酸 (250 μg/ml), 如下所示:
- 用单层BS-C-1细胞播种6井板。
- 感染100%的共体细胞单层与含有病毒颗粒的冷冻解冻细胞的连续稀释,以确保单独斑块的充分分离。
- 覆盖含有含有含有 GPT 选择试剂的 10% FBS 的液体 - 支原体酸和异氨酸,最终浓度分别为 25 微克/毫升和 250 微克/毫升。
- 经过24小时的潜伏后,取出液体覆盖,使用荧光显微镜寻找与MCherry从TDS载体加入病毒相对应的扩散红荧光斑块。根据目标基因和选定的荧光标签,标记基因的局部荧光也可以在同一红斑中观察到。
- 通过使用移液器尖端局部刮拭和含有 DMEM 的 5% FBS 的 100 μl 将细胞转移到 Eppendorf 管中,为每个重组病毒挑选多个斑块,然后用三轮刮伤的细胞冷冻解冻以释放重组病毒。
- 将含有冷冻病毒的 DMEM 添加到 12 井板中的单层细胞中,以便用生长介质中的 GPT 选择试剂放大重组病毒。刮成功放大 24 小时后感染。
- 执行成功放大的展示红色荧光斑块的斑块检测,这次具有 agarose 覆盖和 GPT 选择,具体如下:
- 用单层BS-C-1细胞播种6井板。
- 对重组病毒进行连续稀释,并在 FBS 免费 DMEM 中感染病毒的日益稀释。
- 感染后1小时,取出液体介质,用0.5%的阿加罗斯覆盖在最小基本介质(MEM)中,含有2.5%FBS、292微克/毫升L-谷氨酰胺、100个U/ml青霉素和100微克/毫升链霉素,以及GPT选择试剂。
- 感染后2-3天,挑选显示荧光的斑块,该斑块是红色和所选荧光标签的颜色再次放大,这一次没有GPT选择。
- 执行下一个斑块分析与阿加罗斯覆盖没有选择。
- 挑选失去漫射红色荧光但保留了与选择标签相对应的局部荧光的斑块。
- 继续斑块纯化,无需选择,以获得一个纯粹的重组病毒库存,这些病毒已经失去了 mCherry 和 gpt 选择基因,但保留了与所选标签相对应的局部荧光。检查库存是纯斑块检测,所有斑块应该有一个类似的斑块表型。
- 使用PCR筛选基因组DNA,以确保病毒库存是纯净的。
- 设计荧光基因插入部位和引物两侧的引物,放大插入的荧光基因本身。这些引物的不同组合将产生PCR放大器,检测基因插入并指示纯度。
- 放大病毒库存,在BS-C-1细胞的12井板单层的一口井中筛选PCR。
- 感染后24小时,将受感染的细胞刮成250μl的DMEM。
- 离心受感染细胞(18,000 x g 10分钟,4 °C),去除超自然体,并以0.1%(v/v)SDS重新注入细胞颗粒。涡流解酶细胞。
- 加入500微克酚-氯仿-异丙醇,倒置混合。离心机(18,000 x g 4 分钟,4 °C)。拿超自然者重复一遍。
- 通过添加 1 毫升 100% 乙醇(冷藏)和 50 微升醋酸钠,倒置混合,在超自然物上执行乙醇沉淀。
- 在-20°C过夜或-80°C离开1小时。离心机(18,000 x g 30分钟,4 °C),去除所有液体,让沉淀的DNA空气干燥。在50μl TE中恢复。
- 使用此作为基因组DNA PCR筛查的模板。
3. 携带多个标签的重组病毒的生成
- 用荧光重组病毒将同一细胞单层感染,以创建双标记或三标记病毒或从协议 1)中重复使用不同标签的程序。
- 根据斑块表型或 PCR 筛查病毒分离基因组 DNA 来净化病毒。
结果
图1列出了此过程所需的各种构造,这些构造要么合成(图 1b和1c),要么由克隆步骤创建(图 1d)。图 2提供了实验过程的轮廓,其中包含 A3-GFP 重组 VACV 的代表性荧光斑块图像,该图像用于选择过程的每一步。图3中,显示与荧光标记标记的蛋白质的重组疫苗病毒A3和F13,它们分别是内病毒核心23和外信封24的一部分。描述了对所创建的每个重组病毒的病毒斑块和受感染细胞的观察。对载体与VACV基因组的同源重组效率进行了测试,该图4中描述了该病媒与同源基因组的同源性重组,其同源区域低至70bb。通过与含有100 bp同源的载体重组而形成的病毒斑块的相对成功,是选择将150 bp长度的同源左臂和右臂合成目标基因背后的原因。
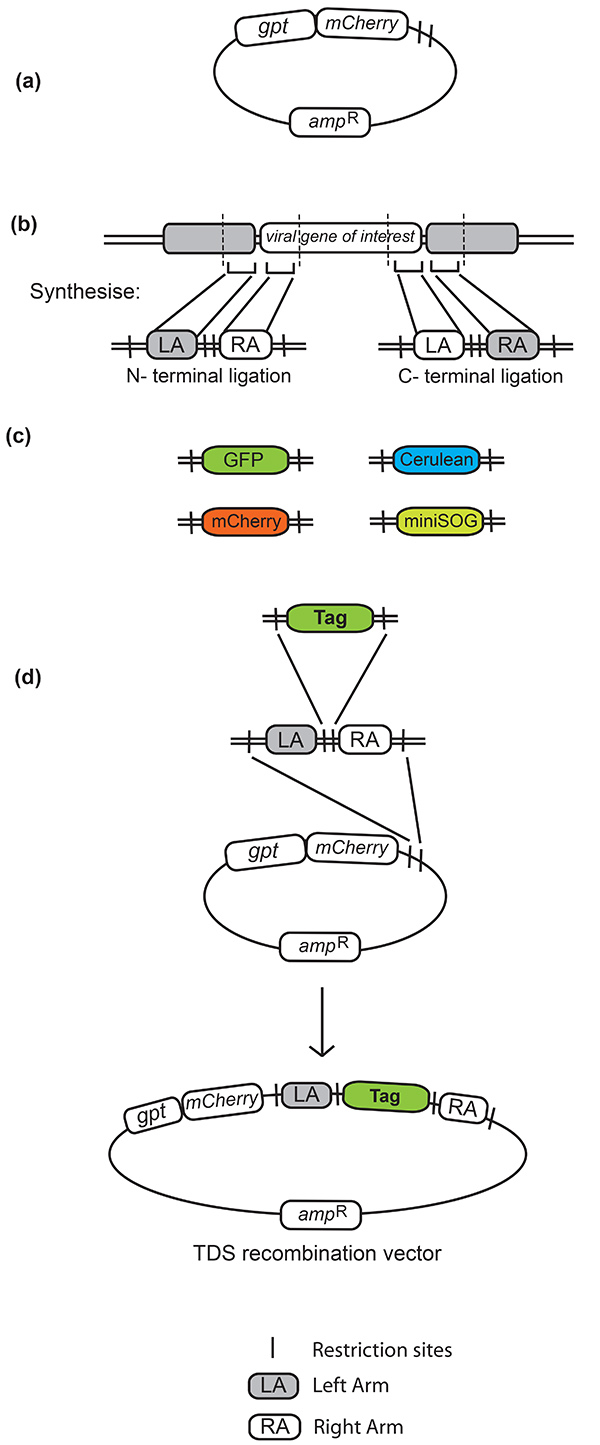
图1。瞬态主导选择 (TDS) 重组矢量。 (a) 带有 gpt 和 m 樱桃 选择标记的 Tds 矢量。(b) 同源的左右臂设计在同源武器之间和侧翼有特定的限制点。此方法中使用的左右臂之间的限制位点是 NotI 和 BamHI,NotI 站点也被用作基因和荧光标签之间的连接器。(c) 与此方法兼容的荧光标签由相应的限制站点侧翼。使用的一些标签是GFP(绿色荧光蛋白)、RFP(红色荧光蛋白)、Cerulean(ECFP的改进,一种青色荧光蛋白,由现场定向突变25)和迷你SSOG,一种由GFP设计的荧光蛋白,它创造了一种由EM在照明26上解决的产品。(d) 克隆步骤涉及生成最终的 TDS 重组载体。含有左右侧臂的合成寡核苷酸首先克隆到TDS载体中。这提供了一个重组载体,通过克隆进入左右臂之间合并的限制点,任何选择的标签都可以穿梭进出。 单击此处查看更大的图像。
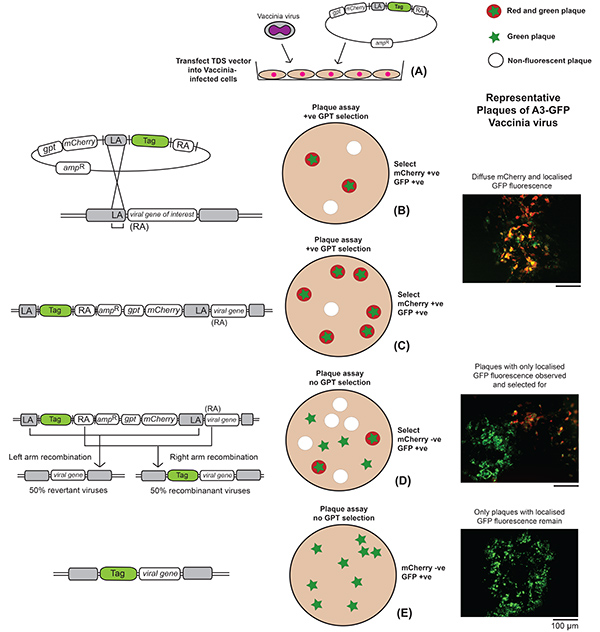
图2。创建重组疫苗病毒的实验程序大纲。描绘了发生在遗传和细胞水平的事件,以及代表斑块图像,概述了A3-GFP标记的荧光疫苗病毒产生后的步骤。(A) 感染疫苗病毒的细胞与TDS重组载体发生变形。(B) 在这个数字中,只描述左侧重组的结果,示例使用 GFP 作为首选荧光标签。右侧重组将导致整个 TDS 质粒以类似的方式被纳入基因组,但标签将融合到中间步骤中的整个目标基因,即步骤 C。斑块检测在具有重组组合的细胞单层上执行,并接受 GPT 选择。(C) 分别与 mCherry 和 GFP 表达相对应的红色和绿色荧光斑块被拾取和放大。一旦选择被删除,将失去红荧光对应的gpt和mCherry基因(D)的损失和斑块表现出完全绿色荧光被挑选和放大(E)。单击此处查看更大的图像。
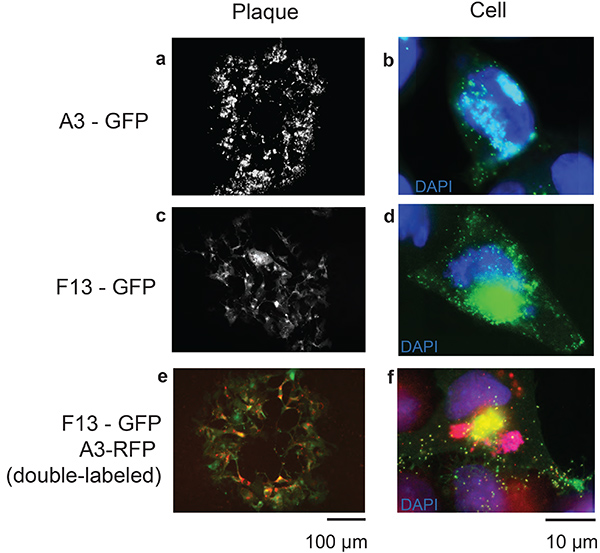
图3。TDS 重组系统的代表性结果。图像描绘了重组的VACV在48小时后感染细胞的整个斑块(a,c, e;比例杆100μm),并附有8小时后被相应重组病毒感染的单个细胞的图像(b, d, f;比例杆10 μm)。选择与病毒局部蛋白相对应的基因来可视化病毒颗粒。A3是疫苗病毒的核心蛋白质(a,b)和F13(c,d)是一种病毒包络蛋白。 还显示了一种双标签病毒,同时带有荧光标签的A3和F13(e, f)。单击此处查看更大的图像。
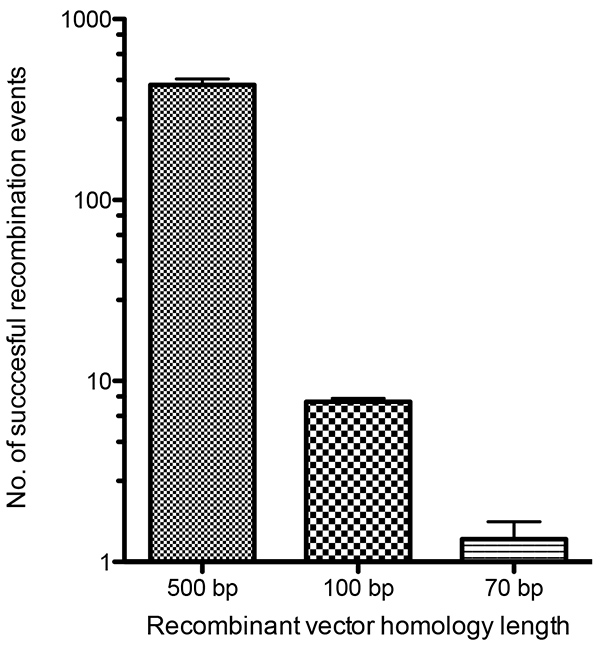
图4。重组载体和VACV基因组之间重组效率的定量分析。 BS-C-1单层感染VACV,感染后1小时与3个重组载体发生感染,其中700 bp、100 bp或70bcV基因组的同源区域。每个载体还包含TDS盒式磁带,包括 gpt 和 mCherry 选择基因。细胞在感染后24小时被恢复并解体,以释放形成的重组病毒。用 GPT 选择介质对细胞赖苏进行了斑块检测,显示 mCherry 荧光的斑块被算作成功的重组剂。 单击此处查看更大的图像。
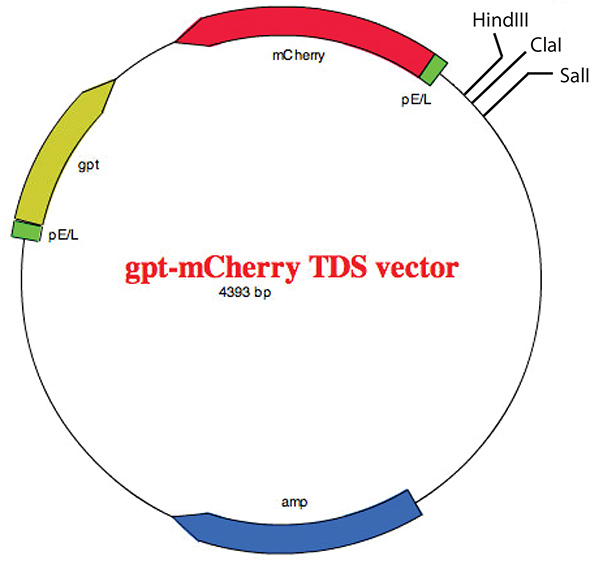
图5。显示多个克隆站点的 gpt-m 樱桃 TDS 矢量的地图。 矢量已描述之前22 和矢量映射图创建的帮助下,EZ 质粒地图 v1.9 从张实验室组 (SCU)。 单击此处查看更大的图像。
讨论
该技术描述了一种高效和模块化的协议,用于创建重组病毒,以表达荧光标记的病毒蛋白。该方法确保病毒基因组的唯一变化是添加标签或标记,不留下任何选择标记。同源重组所需的短臂长使其能够直接合成,消除数轮耗时的 PCR 和克隆,同时使用 mCherry 和代谢 GPT 选择的荧光来隔离病毒重组中间体。这些中间体可以在选择删除后,解决给带有标记基因的病毒或返回到父型的病毒。先前曾 描述过一种涉及荧光和代谢选择的类似方法,尽管本研究中使用的方法利用了较短的合成同源区域,通过成像标记的兴趣基因的荧光来识别所需的重组病毒。这种二次选择仅适用于标记在斑块测定中产生足够荧光的高度表达的病毒基因。或者,人们可以设想插入一个完整的表达盒,例如在强大的病毒促进剂下的荧光蛋白。在这种情况下,左右臂将定义插入点,而不是标记病毒基因。
在实验过程中,有一些关键步骤被证明是有帮助的。上述步骤 2.3.3 中的液体覆盖物对于检测和隔离红/绿荧光斑至关重要。我们认为,GPT选择试剂和阿加罗斯叠加的组合洗涤了重组病毒的生长,因此在转染后,转向液体覆盖,以扩大病毒的第一步。挑选显示局部标记彩色荧光的荧光牌也很重要,因为左臂重组产生的中间体如果左臂还包含促进器序列,则可能导致斑块中观察到的弥漫荧光。TDS载体中的 mCherry 标记基因也可能被 gfp所取代,例如,允许将 mCherry 作为荧光标签进行简单的整合和选择。
上述一些技术与创建重组疫苗病毒的既定方法略有不同。例如,用于制造重组剂的病毒的MOI通常小于128,但使用较高的MOI已足以通过这种方法产生重组疫苗病毒。使用 GPT 选择试剂通常需要用选择试剂18预孵化细胞,但在感染后的抢救阶段添加它们仍然提供了足够的选择所需的重组剂,特别是由于存在荧光选择标记。
如前所述,该技术的局限性之一是,二次荧光选择步骤依赖于高度表达的兴趣标记蛋白,其水平能够在斑块检测中通过眼睛检测。如果没有这一点,就有可能净化只表现出 mCherry 荧光的病毒,其中至少50%将含有所需的重组病毒,这些病毒可以通过分子策略(如上图第2.12步所述的PCR)来识别。另一个限制可能是某些蛋白质由于标记而失活。荧光标签可能会发生突变或被重组病毒切除,并随着时间的推移而传播。因此,建议通过显微镜和 PCR 定期抽取重组病毒库存。最后,可以纳入单一病毒的荧光标记蛋白质的数量可能会受到限制。其中一个方面是能够同时可视化它们:鉴于现有荧光标签的排放光谱重叠,必须仔细选择它们,以确保最小的光谱出血。此外,使用密切相关的标签,如GFP和Cerulean,根据它们在重组基因组中的位置,打开了两者重组的可能性。
该技术的模块化性质使荧光标签能够基于与其他染色和/或标签选择的兼容性进行简单的替代。通过切除可选标记,TDS 方法允许连续添加各种荧光蛋白,或将基于 TDS 的标记与基于 TDS 的基因删除相结合,用于表型分析29。作为此方法的效用的一个例子,生成了一种双标记荧光病毒,该病毒标记了病毒核心和 WV 膜。这种病毒的成像研究可用于研究病毒复制过程中病毒的运动、形态形成和包装。尚未特有疫苗病毒蛋白也可能被标记和研究的这项技术。
由于该病毒的许多特征有利于活细胞显微镜,疫苗病毒在成像研究中得到了广泛的应用。荧光标签来自病毒基因组,无需转染,使从受感染动物或不可传播细胞中提取的原细胞能够轻松分析。最初,荧光VACV用于简单的细胞内病毒运动30跟踪,但最近的方法已经扩大其效用,包括FRET研究31,FRAP在单个病毒粒子32,促进记者33,内在成像34,结构研究35-37。所有这些技术都可以更容易和更接近,再加上这种方法,创造重组荧光病毒。
披露声明
未声明任何利益冲突。
致谢
这项工作由澳大利亚研究理事会联合会发现项目赠款资助,#1096623。
材料
| Name | Company | Catalog Number | Comments |
| Mycophenolic acid | Sigma-Aldrich | M3536-50MG | Dissolve in 0.1 N NaOH |
| Xanthine | Sigma-Aldrich | X0626-5G | Dissolve in 0.1 N NaoH |
| FuGENE HD transfection reagent | Promega | E2311 | |
| Fluorescence microscope fitted with Chroma filters 31001, 31002 | Olympus, Chroma | BX51 (Olympus); 31001, 31002 (Chroma) |
参考文献
- Fenner, F. Adventures with poxviruses of vertebrates. FEMS Microbiol. Rev. 24, 123-133 (2000).
- Goebel, S. J., et al. The Complete DNA-Sequence of Vaccinia Virus. Virology. 179, 247-266 (1990).
- Smith, G. L., Chan, Y. S., Howard, S. T. Nucleotide-sequence of 42 kbp of vaccinia virus-strain WR from near the right inverted terminal repeat. J. Gen. Virol. 72, 1349-1376 (1991).
- Roberts, K. L., Smith, G. L. Vaccinia virus morphogenesis and dissemination. Trends Microbiol. 16, 472-479 (2008).
- Gammon, D. B., Evans, D. H. The 3 '-to-5 ' Exonuclease Activity of Vaccinia Virus DNA Polymerase Is Essential and Plays a Role in Promoting Virus Genetic Recombination. J. Virol. 83, 4236-4250 (2009).
- Yao, X. D., Evans, D. H. Effects of DNA structure and homology length on vaccinia virus recombination. J. Virol. 75, 6923-6932 (2001).
- Ward, B., Isaacs, S. N. . Ch. 16 Vaccinia Virus and Poxvirology Vol. 269 Methods in Molecular Biology. 16, 205-218 (2004).
- Smith, G. L., Moss, B. Infectious Poxvirus Vectors Have Capacity for at Least 25,000. Base-Pairs of Foreign DNA. Gene. 25, 21-28 (1983).
- Heuser, J. Deep-etch EM reveals that the early poxvirus envelope is a single membrane bilayer stabilized by a geodetic "honeycomb" surface coat. J. Cell Biol. 169, 269-283 (2005).
- Schmidt, F. I., Bleck, C. K. E., Mercer, J. Poxvirus host cell entry. Curr. Opin. Virol. 2, 20-27 (2012).
- Ward, B. M. Visualization and characterization of the intracellular movement of vaccinia virus intracellular mature virions. J. Virol. 79, 4755-4763 (2005).
- Carter, G. C., et al. Vaccinia virus cores are transported on microtubules. J. Gen. Virol. 84, 2443-2458 (2003).
- Ward, B. M., Moss, B. Visualization of intracellular movement of vaccinia virus virions containing a green fluorescent protein-B5R membrane protein chimera. J. Virol. 75, 4802-4813 (2001).
- Rodriguez, J. F., Esteban, M. Plaque size phenotype as a selectable marker to generate vaccinia virus recombinants. J. Virol. 63, 997-1001 (1989).
- Blasco, R., Moss, B. Selection of recombinant vaccinia viruses on the basis of plaque-formation. Gene. 158, 157-162 (1995).
- Mackett, M., Smith, G. L., Moss, B. Vaccinia virus - a selectable eukaryotic cloning and expression vector. Proc. Natl. Acad. Sci. U.S.A. 79, 7415-7419 (1982).
- Panicali, D., Grzelecki, A., Huang, C. Vaccinia virus vectors utilizing the beta-galactosidase assay for rapid selection of recombinant viruses and measurement of gene-expression. Gene. 47, 193-199 (1986).
- Falkner, F. G., Moss, B. Escherichia-coli gpt gene provides dominant selection for vaccinia virus open reading frame expression vectors. J. Virol. 62, 1849-1854 (1988).
- Liu, G. Q., et al. Selection of recombinant vaccinia viruses (Tian-Tan strain) expressing hepatitis-B virus surface-antigen by using beta-galactosidase as a marker. Sci. China Ser. B-Chem. 33, 188-197 (1990).
- Domínguez, J., Lorenzo, M. D. M., Blasco, R. Green fluorescent protein expressed by a recombinant vaccinia virus permits early detection of infected cells by flow cytometry. J. Immunol. Methods. 220, 115-121 (1998).
- Falkner, F. G., Moss, B. Transient dominant selection of recombinant vaccinia viruses. J. Virol. 64, 3108-3111 (1990).
- Cordeiro, J. V., et al. F11-Mediated Inhibition of RhoA Signalling Enhances the Spread of Vaccinia Virus In Vitro and In Vivo in an Intranasal Mouse Model of Infection. Plos One. 4, (2009).
- Jensen, O. N., et al. Identification of the major membrane and core proteins of vaccinia virus by two-dimensional electrophoresis. J. Virol. 70, 7485-7497 (1996).
- Hirt, P., Hiller, G., Wittek, R. Localization and Fine-Structure of a Vaccinia Virus Gene Encoding an Envelope Antigen. J. Virol. 58, 757-764 (1986).
- Rizzo, M. A., Springer, G. H., Granada, B., Piston, D. W. An improved cyan fluorescent protein variant useful for. 22, 445-449 (2004).
- Shu, X. K., et al. A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. Plos Biol. 9, (2011).
- Wong, Y. C., Lin, L. C. W., Melo-Silva, C. R., Smith, S. A., Tscharke, D. C. Engineering recombinant poxviruses using a compact GFP-blasticidin resistance fusion gene for selection. J. Virol. Methods. 171, 295-298 (2011).
- Broder, C. C., Earl, P. L. . 62, 173-197 (1997).
- Blasco, R., Moss, B. Extracellular Vaccinia virus formation and cell-to-cell virus transmission are prevented by deletion of the gene encoding the 37,000-dalton outer envelope protein. J. Virol. 65, 5910-5920 (1991).
- Newsome, T. P., Marty, A. J., Lynn, H., Procter, D. J., Diefenbach, R. J., Cunningham, A. L. Ch. Navigating the subcellular space: Lessons from vaccinia virus. Viral Transport, Assembly and Egress. , 155-177 (2011).
- Jeshtadi, A., et al. Interaction of Poxvirus Intracellular Mature Virion Proteins with the TPR Domain of Kinesin Light Chain in Live Infected Cells Revealed by Two-Photon-Induced Fluorescence Resonance Energy Transfer Fluorescence Lifetime Imaging Microscopy. J. Virol. 84, 12886-12894 (2010).
- Weisswange, I., Newsome, T. P., Schleich, S., Way, M. The rate of N-WASP exchange limits the extent of ARP2/3-complex-dependent actin-based motility. Nature. 458, (2009).
- Dower, K., Rubins, K. H., Hensley, L. E., Connor, J. H. Development of Vaccinia reporter viruses for rapid, high content analysis of viral function at all stages of gene expression. Antiviral Res. 91, 72-80 (2011).
- Dénes, B., Fodor, N., Obenaus, A., F, I. Engineering oncolytic Vaccinia viruses for non-invasive optical imaging of tumors. Open Biotechnol. J. 2, 252-261 (2008).
- Humphries, A. C., et al. Clathrin Potentiates Vaccinia-Induced Actin Polymerization to Facilitate Viral Spread. Cell Host Microbe. 12, 346-359 (2012).
- Horsington, J., Turnbull, L., Whitchurch, C. B., Newsome, T. P. Sub-viral imaging of vaccinia virus using super-resolution microscopy. J. Virol. Methods. 186, 132-136 (2012).
- Horsington, J., et al. A36-dependent Actin Filament Nucleation Promotes Release of Vaccinia Virus. PLoS Pathog. 9, (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。