Method Article
最適化と利用の
要約
アグロバクテリウムは、(タバコモザイクウイルスベース)の起動ベクタを運ぶと真空浸透に基づいてタバコ植物での一過性のタンパク質生産は、ワクチン抗原および治療 用タンパク質を生産するための迅速かつ経済的なアプローチです。我々は、手順を簡略化し、細菌培養の条件を最適化する宿主種の選択、RNAサイレンシング抑制因子を共導入することにより、目標蓄積を改善した。
要約
植物におけるアグロバクテリウム媒介性一過性タンパク質産生は、短時間のうちに、ワクチン抗原および治療 用タンパク質を産生するための有望なアプローチである。しかし、この技術は単にスケールアップするために多くの技術的障害が克服されている現在の大規模生産に適用され始めている。ここでは、発射ベクターを有するアグロバクテリウムを有するタバコ植物の真空浸潤に基づいて、工業規模の一過性タンパク質生産のための単純かつ再現性のある方法を示す。 AB培地中のアグロバクテリウム培養の最適化は、浸透プロセスを簡素化、ミリQ水中の細菌培養物の直接希釈を可能にする。 ニコチアナ、Nの3試験を種間でexcelsiana(N.エクセルシオール×N.ベンタミアナ ) が原因浸透のしやすさに最も有望なホストとして選ば れた、高レポータータンパク質の産生のレベル、および約2-F制御された環境条件の下で、古い高バイオマス生産。例えば、アセトシリンゴン及び単糖等の化学薬品を使用してpBID4-GFP( タバコモザイクウイルス系)を保有するアグロバクテリウムの誘導は、タンパク質産生レベルに影響を及ぼさなかった。 30または60秒間の50〜100ミリバール下浸潤植物は、植物の葉組織の約95%の浸潤をもたらした。 アグロバクテリウム実験室株のGV3101との浸潤はアグロバクテリアの実験室株LBA4404とC58C1と野生型アグロバクテリアは at77とA4、AT10、AT6菌株に比べて最も高いタンパク質産生を示した。 NにウイルスRNAサイレンシングサプレッサー、P23やP19の共発現、 ベンサミアナタバコは、標的タンパク質(インフルエンザウイルス血球凝集素)の以前の蓄積および増産(15〜25%)が得られた。
概要
植物は現在、異種組換え生物医薬品を製造するための、安全で信頼性が高く、拡張性の高い、安価なプラットフォームとして認識され、工業用タンパク質1-3及び微生物や動物細胞発現系4を介して重要な利点を持っている。植物は、組み立てられた多量体抗体5-7を含む翻訳後修飾、と正しく折り畳まれたタンパク質を発現することができる。いくつかの植物由来の組換え医薬タンパク質は、臨床評価8を受けている。これらは、非ホジキンリンパ腫9、赤血球凝集素ベースのパンデミックと季節性インフルエンザワクチン候補10,11(カミングスら、Vaccineに提出)、抗連鎖球菌表面抗原Iの治療のための患者特異的組換えイディオタイプワクチン(scFv)を含む糖尿病の治療のために13虫歯12、およびヒトインスリンの治療のために/ II抗体。さらに、ヒトRECOゴーシェ病患者の酵素補充療法のためのmbinantグルコセレブロシダーゼは、イスラエルと米国で承認され、米国の14,15の外に拡大アクセスプログラムの下で提供されています。
異種タンパク質は、安定的に形質転換(トランスジェニックまたはtransplastomic)または一過性に形質転換植物で生産することができる。一過性のタンパク質産生、発現および蓄積16を達成するために、短い時間枠を含む、トランスジェニック植物において産生に比べていくつかの利点を提供し、植物組織4内細菌バイナリーベクターまたは組換え植物ウイルスベクターを導入することによって達成することができる。最も先進的な一過性発現系は、植物ウイルスおよびバイナリプラスミドの成分を組み合わせ、アグロインフィルト17,18によって送達される「発射ベクター」の使用に基づいている。 タバコモザイクウイルス (TMV)に基づいて、発射ベクターのアグロ浸潤が正常に研究室で適用されている例えば、ヒトパピローマウイルス19、 ペスト菌 20などの病原体に対するワクチン抗原を産生するように拡張、インフルエンザは21,22、 炭疽菌 23をウイルス、およびNに天然痘ウイルス24 ベンタミアナの葉。 アグロバクテリウムによる一過性発現は、複数のタンパク質2,25-27の同時生産のための有望な方法である。例えば、植物一過性発現系は、腫瘍特異的な組換え抗体28,29、上皮細胞増殖因子受容体30に対するグリコシル化組換え抗体、および炭疽菌防御抗原31,32に特異的なモノクローナル抗体を産生するために使用されてきた。標的遺伝子および強化標的タンパク質発現33,34における遺伝子サイレンシングのサプレッサー結果とベンサミアナタバコ植物の同時浸潤。
アグロ浸潤が均一introduするための一般的な方法です。植物組織35〜37に目的の遺伝子を保有するcing細菌。無傷の植物における一過性の遺伝子発現のための葉のアグロバクテリウム減圧浸潤は、トランスジェニック植物38-41を生成する必要なく、外来タンパク質の産生のために、迅速なスケーラブル、かつ有用な方法である。真空アグロ浸潤の間に、植物が逆さまに反転され、地上部は、 アグロバクテリウム懸濁液中に沈め。その後、真空をガスが気孔を通して葉細胞間隙から避難させる適用されます。葉へのアグロバクテリウム懸濁液の注入の真空結果の迅速な再加圧以下のリリース。 アグロバクテリウムの減圧浸潤に続いて、植物はさらに栽培されており、ターゲット式が監視されている。ターゲット発現の最高レベルは、通常、2〜3日は、バイナリーベクターと発射ベクターと4-7解像度と浸潤(DPI)、後の発現量、通常decreaを投稿観測されるゲ17,18,42-45。 アグロバクテリウム·ツメファシエンスは、タンパク質産生のために植物に目的の遺伝子を送達するための最も広く使用されている車両である。アグロ浸潤はNに非常によく動作しますベンサミ比較的貧弱シロイヌナズナ 46を含む他のほとんどの植物にある。
本研究では、5〜6週齢のN.過渡タンパク質生産のための、単純、効率的、かつ経済的な方法を開発A.を用いてベンサミアナ浸潤ツメファシエンス 。 (N-モルホリノ) -アグロインフィルトレーション法の工業的スケールの主な欠点は、採取し、細菌および4'-ヒドロキシ-3 '、5'-ジメトキシアセトフェノン(アセトシリンゴン)、単糖類、および2を含む培地で細菌ペレットの再懸濁、遠心分離である-エタンスルホン酸(MES)vir遺伝子の誘導のためのバッファ。我々は、 アグロバクテリウムを最適化することによりこれらの問題を克服することができたのAB培地(最小培地)での増殖を直接のMilli-Q水に浸潤時間と条件を制御することによって希釈した。また、野生型タバコ宿主種のN.中の標的タンパク質の産生を比較しました。 ベンサミアナとNエクセルシオールだけでなく、ハイブリッドNにexcelsiana。
プロトコル
1。植物栽培
その後のアグロ浸潤のために我々は2つの野生型タバコ種(N.ベンタミアナおよびN.エクセルシオール )と室内施設でロックウールで水耕栽培ハイブリッド( 髄膜excelsiana)を評価した。
- 植物肥料溶液中でロックウールスラブを浸す。
- 野生型Nの種をまくベンサミアナ、N.エクセルシオールとN栄養素に関するexcelsiana(N.エクセルシオール×N.ベンタミアナのハイブリッド)ロックウールの表面を浸した。
- のために制御された条件(24℃、40から65パーセントの相対湿度)の下で種子から植物や(130〜150μEmの照明で14時間の明および10時間の暗闇、-2秒-1)、長日光周期を育てるNの4-5週間ベンサミアナとN excelsiana、およびNの5-6週間エクセルシオール。
Agroinfiltratのためのベクターの2。建設イオン
- インフルエンザウイルス(HAC1)のA/California/04/2009株から合成レポーター遺伝子(緑色蛍光タンパク質[GFP])、フルレングスの赤血球凝集素(HA)を挿入し、再設計リケナーゼ酵素(LicKM)18を別々にpBID4-GFP、pBID4-HAC1とpBID4-LicKM、それぞれ18,32,41,47を取得するために打ち上げベクトルpBID4 18(TMVに基づいたベクトル)。
- Aのエレクトロ細胞内にGFPまたはHAC1を運ぶpBID4 10〜50 ngのご紹介Aのエレクトロ細胞へツメファシエンス GV3101株とLicKM ツメファシエンスは、遺伝子MicroPulserのエレクトロとGV3101、C58C1、GLA4404、AT06、AT10、At77とA4菌株。
- 特に断りのない限り、浸透実験のために変換されたアグロバクテリウムを使用してください。
3。 タバコ植物にアグロバクテリウムの浸潤を掃除
- A.を育てるLB培地、YEB MED IN(O / N)の株を一晩ツメファシエンスイウムまたはAB培地は、200〜250 rpmで振盪しながら28℃でカナマイシンを50mg / L添加。
- 4,000倍で又はYEB若しくはLBで増殖させたAB 0.5又は遠心アグロバクテリウム細胞の600nmの光学密度のMilli-Q水(600mL)中の希薄なアグロバクテリウム 4℃で10分間、gは0.5〜600誘導培地(1×MS塩、10mMのMES、200μMのアセトシリンゴン、2%スクロース[MMA])に再懸濁し、1〜3を室温で撹拌人事、いない限りは、特に記載がない。
- アグロバクテリウム懸濁液中にタバコ植物の空中組織を浸すと30または60秒間50〜400ミリバールの真空を印加することにより真空チャンバ内の植物を浸潤する。最適な浸潤は、日常的に60秒間50〜100ミリバールで適用される。
- 真空が破壊されると、水中ですすぎ、真空チャンバから植物を取り外し、プレ浸透成長のために使用されるのと同じ成長条件下で5-7日間増殖。
- 有効性をテストするにはアグロバクテリウムのvir遺伝子は、アセトシリンゴンの異なる濃度(0、100、200または400μM)誘導化学物質の浸潤バッファー(1×MS、10mMのMES、2%グルコース)に懸濁アグロバクテリウムに添加した。のvir遺伝子は、グルコースの異なるパーセンテージ(0,1,2、または4%)の誘導に対する単糖の影響を浸潤緩衝液(1×MS、10mMのMES、200μMのアセトシリンゴン)中に懸濁アグロバクテリウムに添加した。N.ステップ3.3および3.4)で上記のようにベンサミ植物を浸透させた。
- アグロバクテリウムの研究室では、GV3101、C58C1とLBA4404菌株とpBID4-LicKMベクターを有する野生株、A4、AT06、AT10、そしてAt77は0.5の600にミリQ水で希釈した。N.ベンサミ植物は、ステップ3.3および3.4で前述したように、それぞれ特定の株を浸潤させた。
ウイルスサイレンサプレッサのため4。共同アグロインフィルトレーション手順
- MGFP遺伝子と1:1、2:1,3:1および4:1の比率でトマトブッシースタントウイルス (TBSV)のウイルスサイレンシングサプレッサーP19を運ぶミリQ水で薄めたアグロバクテリウム GV3101培養IX。 N.潜入上記のようにベンサミアナ植物 。
- N.潜入 2ミリQ水で薄めたアグロバクテリウム GV3101培養の混合物とベンサミアナ植物:pBID4-HAC1のプラスミドを有する第一及びサイレン抑制のいずれかを運ぶ二- TBSVのP19やシトラストリステザウイルスのP23、pCasspプラスミド中の( pCassp19)と比4:1でそれぞれ35Sプロモーター(PGR-P23)の下でPGRバイナリープラスミド、で。
5。ウエスタンブロット分析
- Nからランダム葉のサンプルを収集ベンサミアナ、N.エクセルシオールまたはN excelsianaの 4-7 dpiで植物や微粉末に液体窒素中で粉砕。
- 0.5%のトリトンを含有する1×PBS緩衝液の3つのボリュームの追加X-100を各サンプルに。
- 静かに4℃で15分間抽出したサンプルを振る
- 5分間の抽出物をスピンし、清潔なエッペンドルフチューブに全可溶性タンパク質を収集します。
- 1×PBS抽出緩衝液中で適当に希釈した(1:50〜1:100)に抽出物を希釈し、5×試料緩衝液(250mMのトリス-HCl [pHを6.8]、10%SDS、0.5%ブロモフェノールブルー、50%グリセロールを追加最終1×濃度にV / V、および500のDTT)。
- 5分間沸騰サンプル。
- 10%SDS-PAGEによってタンパク質を分離するには、イモビロン-Pトランスファーメンブレンに転写し、0.5%I-ブロックにブロックする。
- 1時間ブロッキング溶液で1:1000に、マウス抗ポリヒスチジンモノクローナル抗体を用いて1:5,000およびHAC1でウサギポリクローナル抗GFP抗血清を用いてGFPを検出する。
- 一次抗体標識後、1×PBST-20で膜を10分間各3回洗浄し、西洋ワサビペルオキシダーゼと共にインキュベート(HRP) - 結合1:5000の抗ウサギ抗体またはHRP-コンジュゲートD抗マウス抗体1:10,000でそれぞれGFP及びHAC1検出のための1時間、のため。
- スーパーシグナルウェスト·ピコ化学発光基質を用いてウエスタンブロットを処理します。
- タンパク質のバンド強度を分析し、バンドに校正量を得るために、GeneToolsソフトウェアを使用してください。
タンパク質生産:(サンプルの校正済み数量×希釈)/ロードしたサンプルの量)が4 = mg / kgでのX。
式:タンパク質産生(P)、キャリブレーション量(C)、試料の希釈(D)とサンプル装填(S)の量。
6。ザイモグラムアッセイ
- pBID4-LicKM浸潤Nを集めるベンサミランダム組織サンプル。
- ウェスタンブロット分析のために上述したのと同じ方法を用いてタンパク質を抽出した後、0.1%リケナンで10%SDS-PAGEによって分析し、ゲルに含まれる。
- 電気泳動後、100mMのトリス-HCl [pH8.0の]及び0.1%トリトンX(洗浄緩衝液中で10分間ずつ2回ゲルを洗浄-100)、次いで1時間65℃で洗浄緩衝液中でインキュベートする。
- インキュベーション後、洗浄緩衝液を廃棄し、室温で5分間、0.5%コンゴーレッドでゲルを染色する。
- ミリQ水にゲルを10分間ずつ3回すすぎ、そしてリケナーゼ活動を可視化するために1MのNaClを追加します。精製された細菌リケナーゼ蛋白質は、酵素活性の陽性対照として使用した。
7。のGFPイメージング
- ハンドヘルド長波長UVランプを用いて全体の一過性形質転換植物におけるGFP蛍光の視覚的検出を行う。
- 写真は一過性黄8を介してデジタルカメラで植物を形質転換し、52フィルタ(露光時間、15秒)ES。
- ウエスタンブロットの画像を取得するGeneGnomeにGeneSnapソフトウェアを用いて解析し、精製したGFP規格に基づいて検量線と、GeneToolsソフトウエアを使用して結果を定量化する。
- purifiに基づく検量線を使用して、HAC1タンパク質を定量するインフルエンザウイルスのA/Indonesia/05/05株由来HACタンパク質標準エド。
- 3から4の平均値を計算するには、すべての実験のために複製されます。
結果
植物の成長のための栄養要件。水耕植物成長培地(ロックウール)及び栄養溶液の使用は、N.の均一性を確実にするベンタミアナ成長と植物栽培用の土を使用することに関連する複雑さ(機械的規制や効率)がなくなります。我々はNの増加となりましたロックウールスラブ上ベンタミアナ植物の成長およびバイオマス蓄積のための最適条件を決定するために、市販の肥料に浸漬した。我々はの95〜100%の種子発芽を観察した。我々は、リンを欠いた栄養液を発芽およびNの成長をサポートするために失敗したことがわかったので、一つは、リンを含む発芽を達成するために重要であることに注意してくださいベンサミアナタバコ種子( 図1A)。
アグロバクテリウムの成長と植物の健康とタンパク質産生に浸透メディアの影響は。我々は、Tの効率を最適化するために、いくつかのメディアの状態をテストした大規模生産のために、彼はアグロインフィルトレーション法。細菌(A.は GV3101株ツメファシエンス )pBID4-GFP構築を保有するが、異なる培地条件(YEB、LBまたはAB)でO / Nを培養し、(1×ムラシゲ&を含む遠心分離し、誘導培地(MMA)に再懸濁のいずれかであったスクーグ[MS]基礎塩混合物、10 mMのMES pHは5.6、20グラム/ Lスクロース及び200μMのアセトシリンゴン)または植物の浸透のために使用する前に、0.5の600にミリQ水で希釈した。私たちは、水で希釈した細菌と植物の真空浸潤は以前の報告42,48内の任意の浸透メディアで達成されたものに匹敵するタンパク質生産をもたらしたことを観察した。これとは対照的に、YEBまたはLB培地で増殖させた希釈していないアグロバクテリアとの浸潤がNの完全しおれの結果AB培地で増殖させた未希釈のアグロバクテリウム浸潤植物の健康に影響を及ぼさなかったが 、一方ベンタミアナダット(未満、24時間後の浸潤葉)示されていない。 図1Bに示すように、(0.6〜0.8又は1:10 1:5 600、0.3〜0.4の600)を示したYEB、LB又はAB培地で増殖させたアグロバクテリウム培養物で浸潤およびミリQ水で希釈した植物症状および。 アグロバクテリウムを遠心分離し、誘導培地(MMA)中に再懸濁し、それぞれ、1645、1520および1839の平均GFP産生を示したが、症状を示さず、タンパク質産生に有意差はアグロバクテリウムに比べていない直接(Milli-Q水で希釈したそれぞれ1671±102および1667±131 mg / kgで、)。そのため、ミリQ水は、植物の浸透のためのアグロバクテリウム培養を希釈するために推奨されており、日常的に0.5の600を達成するために私たちの、その後の実験に使用した。
標的発現に対するアグロバクテリウム懸濁液の細胞密度及び経時変化の影響は、我々 は 、次の場合を調べ、細菌細胞密度浸潤および標的発現のレベルの効率に影響を与える。この目的のために、我々は、pBID4-GFPを担持するアグロバクテ 4つの異なる細胞懸濁液の密度、600 1.0、0.5、0.1および0.05を評価した。次の浸潤、N.ベンサミアナ植物を4,7および10 dpiでサンプルを収集することによって目に見える症状の発生および標的発現の時間経過をモニターした。 4 dpiで、我々はない(GFP発現は0.05の600で観察されなかった)、アグロバクテリウムの異なる細胞懸濁液密度で浸潤植物間でGFP蛍光の顕著な違いを観察した。 7 dpiで、GFP蛍光は600 1.0、0.5および0.1の細胞懸濁液密度で浸潤植物において類似していたが、0.05のA 600で浸透させた植物に低かった。 図1Cに示すように、これらのデータは、ウエスタンブロットによって確認された600で、非常に低いタンパク質産生を示し、4 dpiで採取したサンプルの分析 0.05(5 mg / kg)を1.0の600(1739 mg / kg)の少なくとも最高。 0.05の600は、下のGFP生産(1,199 mg / kgの)を示しながら、7 dpiで、植物は、(それぞれ1662、1870および1890、)1.0、0.5と0.1の600で推定GFPの生産に有意な差は認められなかった。これとは対照的に、10 dpiでのGFPの生産に差は4細胞懸濁液密度(1,218、1,181、1,197および1304)のいずれかを浸透させた植物の中では観察されなかった。
アグロバクテリウムの別の株と浸潤。一過性タンパク質生産のための利用可能なアグロバクテリウム株の多様性を増大させるために、我々は、野生型単離株を試験した。自然宿主のクラウンゴールから分離され、これらの株は、親切に博士Gelvin(パデュー大学、ウェストラファイエット、インディアナ州)から提供された。一過性タンパク質生産におけるそれらの有用性を調べるために、我々はNに潜入以下の株·カーとベンサミ英pBID4-LicKM 18:A.リゾゲネス (A4)とA.ツメファシエンス野生型巣作りをする鳥は、A348、A208、およびA281(それぞれ、AT6、AT10、およびAt77という名前)だけでなく、Aの設計実験室株を株ツメファシエンス GV3101、C58C1、およびLBA4404。浸潤葉は7 dpiで集めた後、LicKM発現のレベルは、ウェスタンブロットアッセイによって推定した。 図2Aに示すように、LicKM産生の最高レベルは、わずかな違いが、(それぞれ、163〜1,750±1,650±1,450±26及び117 mg / kg)の菌株GV3101、A4およびLBA4404で達成することができ; C58C1を持つ式の最低レベル(〜900±102 mg / kg)を; (それぞれ〜1250±19、1100±42および1200±111 mg / kgで、)AT6、AT10とAt77中間生産。リケナーゼ酵素活性は、ザイモグラムアッセイを用いて実証された。 図2Bのいずれかを使用して、浸潤植物組織において産生さリケナーゼことを示しているアグロバクテリウム株は、酵素的に活性であった。一つには、A4およびAt77株で浸潤することN.benthamiana植物に注意してくださいAT10と症状を痛めながら軽度であった、(発育阻害、葉柄の伸長やカーリング、葉のカーリング)病理学的症状を示した。症状は、実験室株のGV3101( 図2C)を浸透させたN.benthamiana植物観察されなかった。
代替タバコ種の浸潤。我々はN、ニコチアナ属(N.ベンタミアナおよびN.エクセルシオール )の2つの野生型の種で、ハイブリッド種でバイオマス発電とタンパク質生産の速度を比較したexcelsiana(N.エクセルシオール×N.ベンタミアナ )。テスト種、Nのベンサミアナタバコ 、 アグロバクテリウムベースまたはウイルスベースの発現系を用いた一過性タンパク質産生のために広く使用されているホスト2,34,49、発芽の4〜5週間以内に浸潤準備に達する。バイオマスの最適なレベルを生成するために必要な成長期間もN. 4-5週間であるexcelsianaしかしNの(6-7週間)長いエクセルシオール 。また、植物の節間は、N.ために比較的短いエクセルシオールは、他のタバコ種に比べて。
さらに、我々は、N.の減圧浸潤を観察したベンサミアナとN N.ながら60秒間、50〜250ミリバールでexcelsianaは 、全体の葉のアグロインフィルトレーションのための非常に効率的であるエクセルシオールは、真空は、例えばSillwet-77またはS240のような非イオン性界面活性剤の存在下で1分間ずつ3回適用した場合であっても、それらの下側キャノピと革の葉に浸潤することは困難である。また、Nの発芽率excelsianaとNエクセルシオール種子は〜40から50パーセントであった。 90〜100%に発芽率を増加させるために、種子を10%bleaで処理しなければならない播種前に1時間CH。同一の成長条件、N.から生成することができる最高の葉バイオマスの下excelsianaは約2倍高いNと比較され、 ベンサミ ( 表1)。
タンパク質産生は、N.において調べたベンサミアナ、N.エクセルシオールとN pBID4-GFPを保有するアグロバクテリウム株 GV3101で浸潤excelsiana。 GFPの蓄積は、ウェスタンブロット分析、続いてUV光を用いて全体の浸潤葉における7 dpiで評価した。 図3Aは、N.におけるGFPの均一な分布を示してベンサミアナとN. excelsianaとNに偏在(原因N.エクセルシオールの全葉面積を浸透させることの難しさに) エクセルシオール 。 図3Bは、7 dpiで3 タバコ種から収集された浸潤葉にUV光を照射することによって推定GFP産生のレベルを示しています。 GFPを培っlationレベルはNに高かったNに比べてベンサミ (〜2.23グラム/キログラム) excelsianaとNエクセルシオール (〜1.89及び1.54グラム/ kgで、それぞれ)。 N.におけるタンパク質産生の低レベルエクセルシオールは、不均一な浸潤と収集、葉に蓄積されたGFPの分布に起因している。
私たちは、直接光に露出された上部の葉は、多くの場合、天蓋の下葉より(2-4 dpiで)一過性のGFPの蓄積の初期の最高レベルを示すことを観察した。しかし、我々の研究では、GFPの蓄積は7 dpiで最も高かったとはGFPの蓄積を示さないuninfiltrated新たに成長した葉を除いて、ほとんどの葉が均等に分布していた。
一過性のタンパク質産生。真空浸潤に対する真空圧力および持続時間の効果が有意に無針注射器42に手による注入により適用される圧力と比較し、一過性発現レベルを増加させる。の適用真空が水没工場から排出するガスが気孔を通して葉が発生します。真空が破壊され、圧力が急激に増加すると、 アグロバクテリウムの懸濁液を排気ガス50を置き換えるために、葉へ駆動される。
N.の葉の真空圧力の効果を試験するためにベンサミ 、我々は30または60秒のための様々な真空圧(50-400ミリバール)でpBID4-GFPを保有するアグロバクテリウム株 GV3101を植物に浸透さ。これは、(50ミリバール未満)、より強い真空がまもなく浸潤(24〜48時間)後の組織しおれや植物の死につながる、浸透させた葉の機械的損傷に30または60秒の結果に適用することが示された。一方、わずか50葉面積の%とGFPの生産(303±90 mg / kg)を( 図4A)の減少したレベルの浸潤の穏やかな真空(400ミリバール)の結果を適用する。重要なのは、我々は50、10の下に、GFPの生産に差が認められなかっ0と200ミリバール(1,651±107、1688±40、1594±26 mg / kgで、それぞれ)( 図4A)と軽度のない、植物の健康に有害な影響50-200ミリバールから真空圧を30または60に適用した秒。そのため、真空圧力の50〜100ミリバールが浸透実験のために推奨されます。
ターゲット式の真空の期間の効果はNの1平らな浸潤することによって評価したベンサミ工場 pBID4を保有GV3101の0.5 Aの600で毎時間- 。同じアグロバクテリウム培養液中の8時間GFPは、 図4Bは、GFP産生のレベルは同じようにすべての時間を示唆し、8時間後までのポイントであったことを示して、このオーバー期間アグロバクテリウムは、一本鎖DNAを起動する能力を維持する。
タンパク質生産上の化学的誘導の効果。特定の植物のフェノール性代謝物および糖は、indはできAのUCE病原性遺伝子1,52 ツメファシエンス 。結果として、多くの化学物質およびmonosaccharaidesは、種々の植物種における一過性タンパク質産生を増強することが報告されている。アセトシリンゴンは、最も一般的にはA.の培養物に添加するアグロ浸潤40,53-57前VIRオペロンを誘導するためにツメファシエンス 。
我々は、N.における過渡GFPタンパク質の産生に対するシリンゴンの異なる濃度(0、100、200、および400μM)およびグルコース(0〜4%)の効果を評価しているGFP - pBID4を保有するアグロバクテリウム株 GV3101で浸潤ベンサミ 。この目的のために、我々は、浸潤前に1-3時間アセトシリンゴンおよびグルコースの異なる濃度を含有するMMA誘導培地中のアグロバクテリウム細胞を再懸濁した。両方の目視観察した(データは示さず)およびウエスタンブロット分析( 図4C)、試験した濃度のいずれの結果によれば、これらの化合物から誘導培地は、アセトシリンゴンないまたはグルコースを含有しない対照と比較してGFP蛍光またはタンパク質産生の有意な増加を誘導した。
N.におけるGFPおよびHAC1遺伝子の一時的生産へのサイレンシングサプレッサーの共同浸潤の効果ベンサミアナタバコ葉 。それは、以前にレポータータンパク質34の増強された産生をもたらす、サイレンシングサプレッサー( トマトブッシースタントウイルスのp19 [TBSV])転写後遺伝子サイレンシング(PTGS)と干渉の共発現が実証されている。
我々は、N.の共浸潤の効果を評価したGFPレポーター遺伝子(pBID4-GFP)およびp19の発射を担持するベクターでベンタミアナ 。浸潤、Aの600 0.5の希釈に先立ちpBID4-GFPおよびP19を保有ツメファシエンス GV3101培養物を、それぞれ1:1,2:1,3:1および4:1。エクスプレスの割合で混合したサイレンシングサプレッサーのイオンは、 カリフラワーモザイクウイルス 35Sプロモーターにより制御した。 7解像度( 図5A)でのウェスタンブロット分析の結果によって示されるように、p19の存在下では、N. GFP産生を増加または減少させなかったベンサミ 、2 アグロバクテリウム懸濁液の任意の割合で。
p23andのP19 - - HAC1のためのPTGSの防止に関する我々はまた、2つのウイルスの遺伝子サイレンシング抑制の効果を比較しました。発射ベクターpBID4-HAC1(H1N1 A/California/04/2009)および2つのウイルスのサイレンシングサプレッサープラスミドのいずれかを保有するアグロバクテリウムの培養物は、それぞれ、0.5のA 600に希釈した4:1の比率で混合し、そして4〜5週齢のN.に共浸潤ベンサミ 。 AのサスペンションpBID4を運ぶツメファシエンス- HAC1を一人でコントロールとして浸透させた。浸潤葉試料を、3〜8個の解像度から収集した。実験はREPEたHAC1発現のated 3回の平均レベルは、ウェスタンブロット分析によって決定した。
図5B、Nの共同浸潤で実証されるようにP23やP19とベンサミアナ (それぞれ、642±157および764±108 mg / kg)をもたらした6 dpiでないサイレンシングサプレッサー(それぞれ約15から25パーセント)を用いていないと比較HAC1生産の増加。これはP23とP19は、我々のシステムで効率的であることを示唆している。しかし、pBID4-HAC1はP19と同じ場所に浸透させたときのHAC1の蓄積は日早く発生したことに留意すべきである。したがって、我々の結果は、HAC1上のサイレンシングサプレッサーp19およびGFPの蓄積の効果は一過性の発現および/ またはN.におけるいくつかのタンパク質の安定性の選択的増強を示唆して異なっていることを証明するベンサミ 。
我々はまた、その存在下およびサイレンシングサプレッサーの不在HAC1タンパク質prodにレベルの両方において観察されはじめは、7 dpiで減少し始めた。これは発射ベクターで浸透させたN.benthamianaの一過性タンパク質生産の減少のタイミングは、標的特異的であることを示している。
発射ベクターを有するアグロバクテリウムの細胞バンクは、標的遺伝子の安定性、 アグロバクテリウムの生存率およびタンパク質の蓄積のレベルについて毎年評価した。 -80℃で保存したpBID4-HAC1で形質転換GV3101株の細胞バンクのグリセロールストックを浸潤N.における一過性タンパク質産生のレベルの変化なしで3年以上非常に安定であることが示されている。 図5Cは、HAC1タンパク質の生産は2010年、2011年、2012年および2013年の年間でウエスタンブロット法により推定されたことを示してベンサミアナ植物は、それぞれ、670、685、566および683 mg / kgであった。 N.平均HAC1生産ベンサミアナ植物を、651±49.4 mg / kgであった。
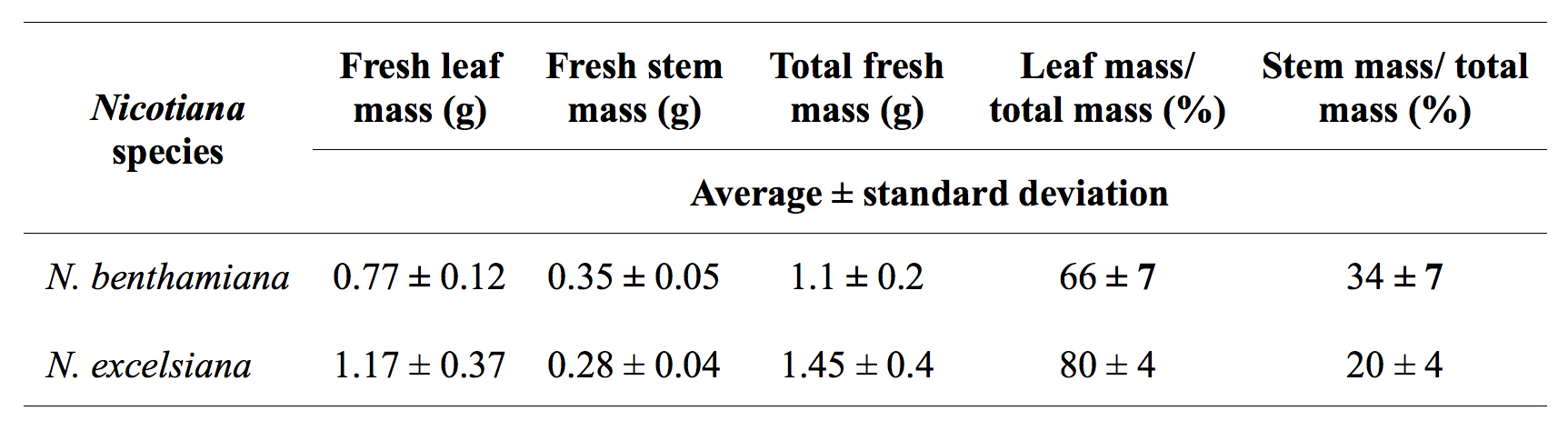
表1。Nの比較ベンサミアナとN excelsiana植物バイオマス生産。
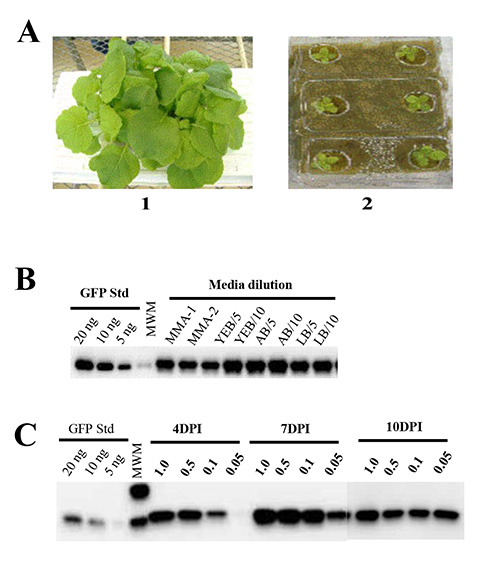
図1 N.における一過性の遺伝子発現のウェスタンブロット分析ベンサミ。(A)6週齢のN.ベンサミアナ 1)4.8%のリンを含有する肥料溶液中で生育する植物及び2)植物は0%のリンを含有する肥料溶液で成長する。新鮮な葉の重量と同等の二十5μgのレーン毎にロードした。GFP生産の(B)の比較pBIDを浸透させた植物の真空中で3別の培地で増殖させた4-GFP-宿すアグロバクテリウム GV3101培養:YEB、ABとLB。 YEB若しくはLB培地中でO / N増殖さGV3101培養物を低速で遠心分離し、誘導培地(MMA)中に再懸濁した(レーン:MMA-1とMMA-2のそれぞれ)した、又はYEBにO / Nを成長させ、LB又はAB型のメディアと直接1:5ミリQ水で1:10に希釈した(レーン:YEB / 5とYEB/10、AB級/ 5とAB/10、LB / 5とLB/10)(C)の比較。 A.種々の濃度の(600 1.0、0.5、0.1および0.05)を有する真空浸潤次の4,7および10 dpiでGFP発現のpBID4-GFPを運ぶGV3101株ツメファシエンス 。
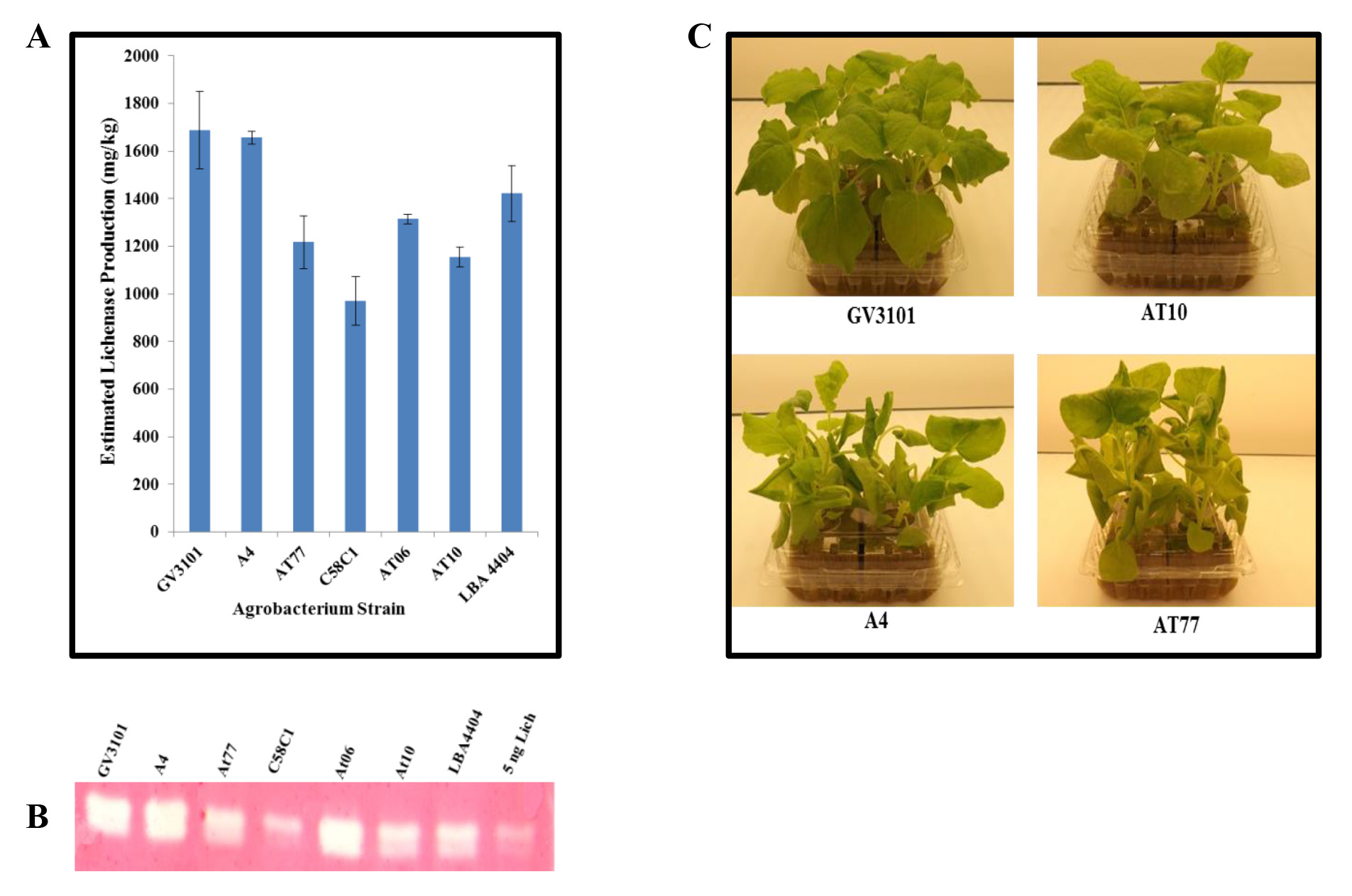
図2。Nの真空浸透次過渡リケナーゼの生産と活性の比較diffeとベンサミ工場アグロバクテリウムの株を借りる。 アグロバクテリウム株 (GV3101、A4、At77、C58C1、AT6、AT10とLBA4404)の文化pBID4-LicKMがNの葉に個々に浸透させた発射ベクターを有するベンサミ 。浸潤葉は7解像度で収集した。ウェスタンブロッティングによって定量化(A)リケナーゼ製造。(B)ザイモグラムアッセイ法、酵素活性を介してリケナーゼ産生を実証する。(C)、アグロバクテリウムの効果(野生型A4、AT10、At77および実験室株GV3101) N上の浸潤7 dpiでベンタミアナ植物の健康。新鮮な葉の重量と同等の二十5μgのレーン毎にロードした。
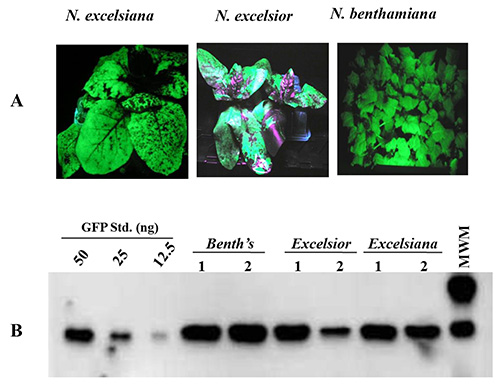
図3。Nの葉において一過性GFP発現benthamiaAと真空浸潤後7 dpiでのN. excelsianaおよびN.エクセルシオール、NA GFP -発射ベクトルpBID4を保有·ツメファシエンス 。 GFPの蓄積のUV光下での(A)GFP発現の目視検査。(B)ウエスタンブロット分析。
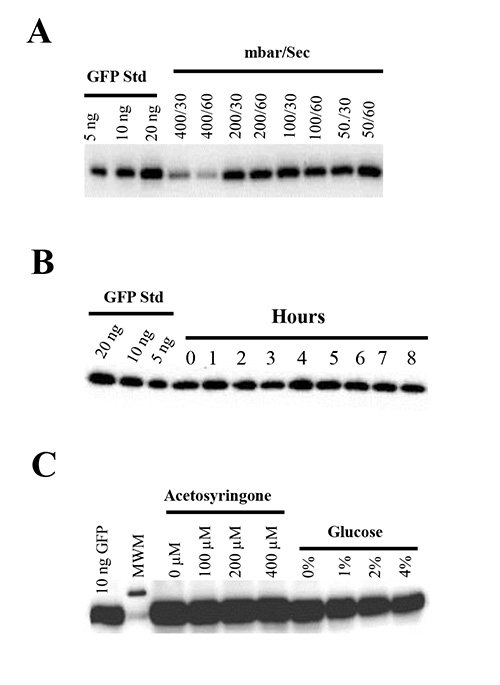
図4一過性GFP発現および植物の健康上の真空圧の(A)効果。N. 30または60秒の真空保持時間で、400、200、100または50ミリバールの真空圧力下でGFP A.の(B)安定性および感染性-ベンサミアナ植物をpBID4で浸潤した。 Nにツメファシエンスベンサミアナタバコ、アグロバクテリウム GV3101をpBID4-GFPをAB培地で増殖させ、0.5のA 600に希釈宿すで浸潤。 AgroinfiltrationはNの1平らな浸潤することにより行った同じ希釈されたアグロバクテリウム培養中のベンサミ工場毎時間(レーン0-8)。(C)GFPの一過性の発現に及ぼすシリンゴンとグルコースの異なる濃度の影響。 pBID4を保有するアグロバクテリウム株 GV3101は- GFPは総合格闘技で0,100、200または400μMでゴン2%グルコースを含む、あるいはMMAで200を含むいずれかの0.5のA 600に遠心分離し、再懸濁し、YEB培地でのO / Nを成長させたμMアセトシリンゴン、0,1,2又は4%のグルコースを含む。 アグロバクテリウム懸濁液は、浸透前に室温で3時間保持した。
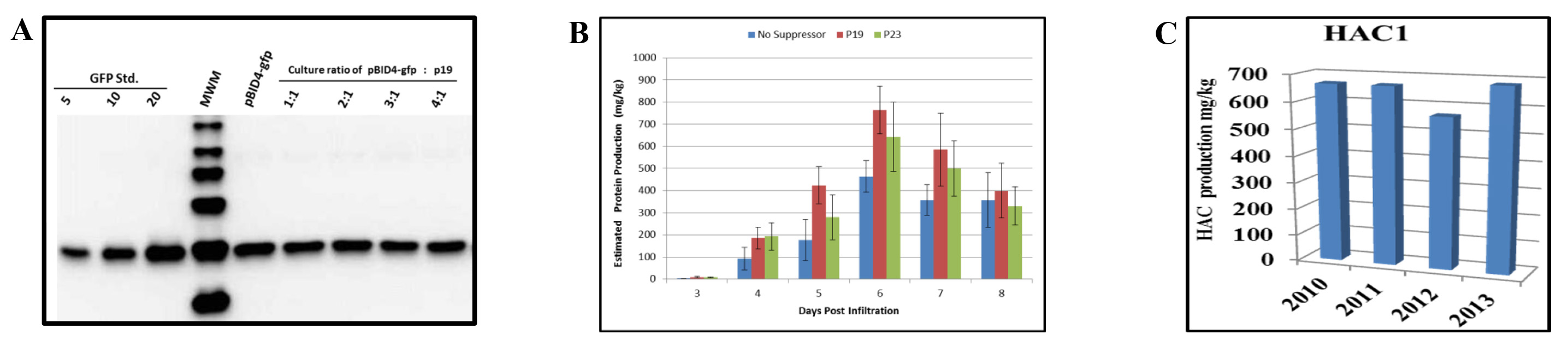
図5。N.における過渡タンパク質生産上のサイレン抑制の影響ベンタミアナの葉。 (pBID4-GFPの共浸潤と異なる比でのp19の後GFPタンパク質の)ウェスタンブロット分析。 7解像度(新鮮葉重量当量25μgのは、レーン毎にロードされた)。(B)pBID4-HAC1を運ぶアグロバクテリウムの文化で採取したサンプルは、個々にP19やP23サイレンサプレッサを運ぶ文化4:1の割合で混合したプラスミド。 アグロバクテリウム培養の結果の組み合わせは、植物内に真空浸透した。 HAC1の浸透した組織は、組換えタンパク質定量のための8解像度まで毎日収集した。 アグロバクテリウム細胞バンク(C)の安定性。植物は、タンパク質の蓄積を評価するために、毎年、アグロバクテリウム細胞バンクの同じバッチを浸潤させた。新鮮な葉の重量に相当50μgのは、レーン毎にロードされました。 目の拡大版を表示するには、こちらをクリックしてください。この図である。
ディスカッション
本研究では、発射ベクターを有するアグロバクテリウム株を使用して、選択Nicotiana種におけるルーチン一過性タンパク質生産のための単純なアグロインフィルトレーションプロトコルを開発した。加えて、我々は、一過植物発現系で最も高い組換えタンパク質生産レベルを達成するための最適な条件を同定した。
希釈されたAの真空浸透はNに打ち上げベクトルpBID4を保有する菌株GV3101 ツメファシエンスベンサミアナ、N. excelsianaおよびN.木毛は、例えば、アルファルファモザイクウイルスを宿すGV3101で浸潤エンドウなどの他の植物種と比較して7解像度内の標的タンパク質産生のより高いレベルをもたらした-又はキュウリモザイク 35Sプロモーター下にGFPレポーター遺伝子を発現するウイルスベースのベクター41、またはレタス 、 ナスlycoAのC58C1株で浸潤persicumとシロイヌナズナベータ-グルクロニダーゼレポーター遺伝子57。N.を担持ツメファシエンスベンサミアナとN excelsiana 90〜95%の浸透効率で、30〜60秒間、50ミリバールで潜入真空に容易であった。葉面積の残りの5から10パーセントがあるため、真空の適用中にアグロバクテリウム懸濁液の表面上の葉のいくつかの浮遊浸透していなかった。発射ベクターは細胞間移行能力18を有しているため、一過性タンパク質の蓄積は、全体の葉並びに7 dpiで葉柄で起こる。 pBID4発現ベクターが細胞から細胞へ移動可能であるが、全身18は移動しないので、10 dpiで、推定されたGFP産生がわずかに低かった;従って、新たに成長した葉がベクターを含まないターゲットの生産に寄与しない。加えて、組換えタンパク質の分解以上の時間mAY 10 dpiで還元されたタンパク質レベルに貢献しています。我々の結果は、Aと浸潤を示したN.における一過性タンパク質生産のツメファシエンス株 GV3101媒介高レベルベンサミ 。さらに、標的タンパク質は、リケナーゼするN-末端、C末端または内部融合物(LicKM)、β-1 ,3-1、4 -グルカナーゼ、 クロストリジウム·サーモセラム由来の熱安定性酵素であり、多くの標的に耐熱性を付与するように操作することができるタンパク質融合18。 Nの浸潤Aとベンサミ目的の遺伝子を保有するツメファシエンス野生株(AT6、AT10とat77)は、軽度または重度の症状を誘発:葉のカーリング、葉柄の伸長、およびカーリング。病理学的症状は、Nは観察されなかったいくつかの遺伝子がpBID4に挿入し、研究室に変身しながら、空のpBID4ベクターを有する実験室株のGV3101で浸潤ベンサミが GV3101を株C58C1またはLBA4404は、軽度の壊死性応答と葉を誘発クロロシス/葉の浸潤地域で症状を黄変。ナス科の植物で、野生型アグロバクテリウムや武装解除の株によって引き起こされる壊死性の症状は、以前に56,57に報告されている。壊死性応答は、III型分泌系、IV型分泌系によって植物細胞に移し、細菌タンパク質、および/ またはフラジェリン58-60に対する感受性の病原性因子に起因する可能性がある。我々は、異種タンパク質の一過性産生はまた、病原性を誘発することができ、浸潤植物における過敏感反応が出ることを見出した。多くの研究者が、過渡タンパク質産生の5〜20倍高いレベルまで産植物バイナリーベクターを有する異なる植物種のアグロ浸潤は、安定に形質転換された植物28,57と比較したことを報告した。我々のデータは、N.ことを示しているpBID4-GFPを保有するGV3101で浸潤ベンタミアナは一過に対して報告GFP収量に似て、GFPの高いレベルで発現し(全可溶性タンパク質の80%まで)PICH-GFPSYSウイルスベクターを有するアグロバクテリウム 44を浸透させたN.benthamiana。我々の発射ベクターを用いてアグロインフィルトレーション、熱安定性蛋白質LicKMの高い生産をもたらし、標準的なバイナリープラスミド18を用いて観察されるよりも高い50倍。
Aの感染性をテストするにはツメファシエンス及び発射ベクトルの安定性は、我々はNの1フラットに潜入ベンサミ pBID4-GFPプラスミドを保有するGV3101同じミリQ水で薄めたカルチャを使用して、最大8時間の1時間ごと。我々のデータは、GV3101株を効率的に少なくとも8時間、感染性れ、pBID4(発射ベクター)は8時間にわたる浸潤の間に非常に安定である。ことを示した
-80℃で保存発射ベクターpBID4-HAC1(細胞バンク)を宿すGV3101株のグリセロールストックを、過渡proteを変更せずに三年間非常に安定であることが示されている浸透させ、植物の生産において。
最適な条件下で増殖させたN.benthamiana植物と35〜42日後に播種は、真空浸透媒介一過性遺伝子発現40のための最適であった。 (3-4週齢)の若い植物は、真空を適用するための機械的な影響から細胞懸濁液表面および組織損傷に浮かぶ葉完全に浸透させることができない。 45日以上経過した植物では、N.ベンサミアナタバコを用いる最適な光条件の下で、ステージをボルト締め、一過性の発現のレベルは低い。
低分子フェノール化合物(アセトシリンゴン)およびmonosaccharaides(グルコース)55,61はA. ツメファシエンスにvir遺伝子を誘導することが知られている。 N.はまた、浸潤50〜600μMの濃度のシリンゴンの存在下で、バイナリーベクターpCAMBIA(GFP)とベンサミわずかに一過性に増加させることが示された遺伝子発現40。私たちは、3時間のMMAでpBID4-GFPを保有するGV3101培養物にこれらの化合物を添加することにより、我々のシステムにおけるシリンゴンとグルコースの異なる濃度の効果を研究し、GFPの発現に差は認められなかった。興味深いことに、GV3101培養pBID4-GFPを保有し、0.5の600にミリQ水で希釈し、VIR遺伝子誘導なしに浸潤し、誘導された培養液を浸透させたものとGFPの同じ量を表明した。 A.ツメファシエンスのvirの遺伝子は、潜在的に植物フェノール化合物(アセトシリンゴンおよびシナピン酸)および葉組織中に存在する植物monosaccharaides(グルコース及びフルクトース)によって誘導することができる。したがって、我々は、外因性のvir遺伝子誘導物質の存在下または非存在下でGFP発現の同様のレベルは、植物細胞におけるGFP発現発射ベクターの複製の間に存在し、細胞質のvir遺伝子誘導物質の作用の結果であり得ると推測している。
野生型N.ベンタミアナは、過渡タンパク質産49のモデルを宿主として使用されてきた。しかしながら、N.ベンタミアナの比較的低いバイオマス収量は、組換えタンパク質の大規模生産への応用を妨げる。最適なホストは、一過性の高レベルの発現を組み合わせ、温室内の容易な成長、およびアグロバクテリウム浸潤2の影響を受けやすくする必要があります。代替ホストを選択するために、我々は2 タバコ(N.ベンサミアナ及びN.エクセルシオール )の異なる野生型種とハイブリッドNを浸透させAとexcelsiana(N.エクセルシオール×N.ベンタミアナ ) pBID4-GFPプラスミドを保有する菌株GV3101 ツメファシエンス 。これら三つの種の中でも、GFP発現のレベルは、N.でわずかに高かったベンサミアナ。N.エクセルシオール植物は、それらの革のリーフに真空アグロインフィルトレーションの難しさを示し、N. excelsianaほぼ同一の増殖条件下よりバイオマスを2倍生じた。 7 dpiでGFPの一過性の生産は、Nに比較的似ていますベンサミアナとN excelsiana。したがって、N. excelsianaは、組換えタンパク質生産のためのより適切な宿主であり得る。
アグロバクテリウム媒介性一過性のタンパク質産生は、植物ウイルス由来の62遺伝子サイレンシングサプレッサーの共発現によって克服することができるPTGS 26によって制限される。一過性のタンパク質産生は、以前に浸潤組織34でPTGSを抑制するTBSVのp19のタンパク質の存在下で50倍に増強することが示されている。私たちの研究では、別々に打ち上げベクトルpBID4-HAC1との共浸潤し2つのウイルスサイレンサプレッサー(p19およびP23)の効果を評価した。これらのサイレンシング抑制因子の共同浸潤はHAC1のわずかな増加と、HAC1の一過性の発現にはほとんど影響を持っているように見えた共同浸潤P23やP19の存在下でのタンパク質の蓄積(15〜25%)。正にタンパク質産生に影響を与えるために、サイレンシングサプレッサーを特異的に標的植物種およびウイルスベクター63に有効であるように選択される必要があり得る。 TMVヘリカーゼは、RNAサイレンシング活性64,65の抑制因子を持っています。 pBID4-HAC1とP23やP19の共同浸潤がGFP無しの増加や一過性のHAC1タンパク質産生のわずかな増加をもたらしたように我々のデータは、この観察を確認する。
結論として、我々は、修飾された、最適化された植物およびアグロバクテリウム増殖条件および真空浸透の効率が改善されている。この技術は、数時間で植物材料のキロ数百人を成長させ、浸透させることができました。我々は成功し、現在の適正製造基準(cGMP)の条件の下で、工業規模での高スループットのワクチン生産のための植物の一過性発現技術を自動化しました。 ABO詳細についてut個の自動化およびcGMP条件下でのサブユニットワクチン候補を含む組換えタンパク質の生産のためのプラント過渡タンパク質産生システムの利用は、読者がウェブサイトと呼ばれるwww.fhcmb.org/ 。
開示事項
我々は、開示することは何もありません。
謝辞
この作品は、分子バイオテクノロジー、iBio社と米国防総省の国防高等研究計画庁(助成金#のHDTRA1-07-C-0054)のためのフラウンホーファーアメリカセンターによってサポートされていました。著者は、博士によって寛大な贈り物を認める。生物科学専攻、パデュー大学( アグロバクテリウムツメファシエンス株 )、大規模バイオ株式会社( 髄膜excelsiana種子 )のウェイン·フィッツモーリス、ならびに米国ニコチアナ ·コレクションのジェニファー·ニコルソン、ノースカロライナ州立大学(N.エクセルシオール種子のスタントンGelvin )。著者らは、植物や優れた技術支援を提供するためのマーガレット·シリングフォードとクリストファー船体に感謝します。著者らはまた、博士に感謝します。編集上の支援のためのスティーブン·ストレトフィールドとナターシャKushnir。
資料
| Name | Company | Catalog Number | Comments |
| Nicotiana benthamiana | Tobacco Germplasm Collection, Crop Science Dept., North Carolina State University | PI 555478 TW16 | Infiltration |
| Nicotiana excelsior | Tobacco Germplasm Collection, Crop Science Dept., North Carolina State University | PI 555685 TW47 | Infiltration |
| Nicotiana excelsiana | Dr. Wayne Fitzmaurice, Large Scale Biology Corporation, Vacaville, CA | LSBC EBA 042304.02 | Infiltration |
| Vacuum skid | Abbas, Ashland, MA | Custom made | Plant infiltration |
| Rockwool | Grodan Inc., Ontario, Canada | AO 50/40 | Hydroponic media for growing plant |
| 2-(N-Morpholino) ethanesulfonic acid | Acros Organics, Thermo Fisher Scientific, NJ | 172595000 | Buffer |
| Murashige & Skoog salt (MS salt) | Phyto Technology Lab | M524 | Tissue culture media |
| Acetosyringone | Sigma-Aldrich, St. Louis, MO | D134406-5G | Agrobacterium induction |
| Immobilon-P transfer membrane | Millipore, Billerica, MA | IPVH00010 | Western blotting |
| I-block | Applied Biosystems, Foster City, CA | T2015 | Western blotting |
| Rabbit polyclonal anti-GFP antiserum | Washington Biotechnology, Baltimore, MD | Western blotting | |
| Mouse anti–poly-histidine monoclonal antibody | Qiagen GmbH, Hilden | 34670 | Western blotting |
| Horseradish peroxidase-conjugated anti-rabbit antibody | Jackson ImmunoResearch, West Grove, PA | 111-035-003 | Western blotting |
| Horseradish peroxidase-conjugated anti-mouse antibody | Jackson ImmunoResearch, West Grove, PA | 115-035-003 | Western blotting |
| SuperSignal® West Pico chemiluminescent substrate | Thermo Scientific Pierce, Rockford, IL | 34078 | Western blotting |
| Lichenan (1-3: 1-4-beta-D-glucan) | Megazyme, Bray, Co. Wicklow, Ireland | P-LICHN | Lichenase Activity |
| Congo Red | Sigma-Aldrich, St. Louis, MO | C6277 | Gel staining |
| Digital camera | Olympus, Center Valley, PA | C-8080 | Chemiluminescence imaging |
| GeneGnome | Syngene, Frederick, MD | Chemiluminescence imaging | |
| GFP standard | Made in house | Chemiluminescence imaging | |
| Plant fertilizer solution | Griffin Greenhouse Nursery Supplies, Newark, DE | 67-23-20 | Plant growing |
| Lichenase Standard | Purified in house | Western blotting | |
| MicroPulser Electroporator | BioRad, Hercules, CA | 165-2100 | Agrobacterium transformation |
参考文献
- Ma, J. K., Drake, P. M., Christou, P. The production of recombinant pharmaceutical proteins in plants. Nature Reviews Genetics. 4, 794-805 (2003).
- Sheludko, Y. V., Sindarovska, Y. R., et al. Comparison of several Nicotiana species as hosts for high-scale agrobacterium-mediated transient expression. Biotechnology and Bioengineering. 96, 608-614 (2007).
- Mett, V., Farrance, C. E., Green, B. J., Yusibov, V. Plants as biofactories. Biologicals. 36, 354-358 (2008).
- Yusibov, V., Rabindran, S. Recent progress in the development of plant derived vaccines. Expert Review of Vaccines. 7, 1173-1183 (2008).
- Stoger, E., Sack, M., Fischer, R., Christou, P. Plantibodies: Applications, advantages and bottlenecks. Current Opinion in Biotechnology. 13, 161-166 (2002).
- Mahmoud, K. Recombinant Protein Production: Strategic Technology and a Vital Research Tool. Research Journal of Cell and Molecular Biology. 1, 9-22 (2007).
- Rai, M. P. H. Expression systems for production of heterologous proteins. Current Science. 80, 1121-1128 (2001).
- Yusibov, V., Streatfield, S. J., Kushnir, N. Clinical development of plant-produced recombinant pharmaceuticals: vaccines, antibodies and beyond. Human Vaccines. 7, 313-321 (2011).
- McCormick, A. A., Reddy, S., et al. Plant-produced idiotype vaccines for the treatment of non-Hodgkin's lymphoma: Safety and immunogenicity in a phase I clinical study. Proceedings of the National Academy of Sciences of the United States of America. 105, 10131-10136 (2008).
- Medicago Inc, . . , (2013).
- Medicago Inc, . . , (2013).
- Planet Biotechnology Inc, . . , (2013).
- Sys Genetics, S. e. m. B. i. o. . , (2013).
- Protalix, . , (2013).
- Protalix, . , (2013).
- Plesha, M. A., Huang, T. -. K., et al. Optimization of the bioprocessing conditions for scale-up of transient production of a heterologous protein in plants using a chemically inducible viral amplicon expression system). Biotechnology Progress. 25, 722-734 (2009).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Magnification - A new platform for expressing recombinant vaccines in plants. Vaccine. 23, 2042-2048 (2005).
- Musiychuk, K., Stephenson, N., et al. A launch vector for the production of vaccine antigens in plants. Influenza and Other Respiratory Viruses. 1, 19-25 (2007).
- Massa, S., Franconi, R., et al. Anticancer activity of plant-produced HPV16 E7 vaccine. Vaccine. 25, 3018-3021 (2007).
- Mett, V., Lyons, J., et al. A plant-produced plague vaccine candidate confers protection to monkeys. Vaccine. 25, 3014-3017 (2007).
- Mett, V., Musiychuck, K., et al. A plant-produced influenza subunit vaccine protects ferrets against virus challenge. Influenza and Other Respiratory Viruses. 2, 33-40 (2008).
- Shoji, Y., Chichester, J. A., et al. Plant expressed HA as a seasonal influenza vaccine candidate. Vaccine. 26, 2930-2934 (2008).
- Chichester, J. A., Musiychuk, K., et al. Immunogenicity of a subunit vaccine against Bacillus anthracis. Vaccine. 25, 3111-3114 (2007).
- Golovkin, M., Spitsin, S., et al. Smallpox subunit vaccine produced in Planta confers protection in mice. Proceedings of the National Academy of Sciences of the United States of America. 104, 6864-6869 (2007).
- Porta, C., Lomonossoff, G. Use of viral replicons for the expression of genes in plants. Molecular Biotechnology. 5, 209-221 (1996).
- Johansen, L. K., Carrington, J. C. Silencing on the spot: induction and suppression of RNA silencing in the Agrobacterium-mediated transient expression system. Plant Physiology. 126, 930-938 (2001).
- Vézina, L. P., Faye, L., et al. Transient co-expression for fast and high-yield production of antibodies with human-like N-glycans in plants. Plant Biotechnology Journal. 7, 442-455 (2009).
- Vaquero, C., Sack, M., et al. Transient expression of a tumor-specific single-chain fragment and a chimeric antibody in tobacco leaves. Proceedings of the National Academy of Sciences of the United States of America. 96, 11128-11133 (1999).
- Galeffi, P., Lombardi, A., et al. Expression of single-chain antibodies in transgenic plants. Vaccine. 23, 1823-1827 (2005).
- Rodríguez, M., Ramírez, N. I., et al. Transient expression in tobacco leaves of an aglycosylated recombinant antibody against the epidermal growth factor receptor. Biotechnology and Bioengineering. 89, 188-194 (2004).
- Hull, A., Criscuolo, C. J., et al. plant-produced monoclonal antibody for the treatment of anthrax. Vaccine. 23, 2082-2086 (2005).
- Roy, G., Weisburg, S., Rabindran, S., Yusibov, V. A novel two-component Tobacco mosaic virus-based vector system for high-level expression of multiple therapeutic proteins including a human monoclonal antibody in plants. Virology. 405, 93-99 (2010).
- Silhavy, D., Molnar, A., et al. A viral protein suppresses RNA silencing and binds silencing-generated, 21-to 25-nucleotide double-stranded RNAs. EMBO Journal. 21, 3070-3080 (2002).
- Voinnet, O., Rivas, S., Mestre, P., Baulcombe, D. An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus. Plant Journal. 33, 949-956 (2003).
- Bechtold, N., Pelletier, G. In planta Agrobacterium-mediated transformation of adult Arabidopsis thaliana plants by vacuum infiltration. Methods in Molecular Biology. 82, 259-266 (1998).
- Bechtold, N., Ellis, J., Pelletier, G. In planta Agrobacterium mediated gene transfer by infiltration of adult Arabidopsis thaliana plants. C. R. Academy of Science Paris, Life Sciences. 316, 1194-1199 (1993).
- Tague, B., Mantis, J. In planta Agrobacterium-mediated transformation by vacuum infiltration. Methods in Molecular Biology. 323, 223-215 (2006).
- Fischer, R., Vaquero-Martin, C., et al. Towards molecular farming in the future: transient protein expression in plants. Biotechnology and Applied Biochemistry. 30, 113-116 (1999).
- Horn, M. E., Woodard, S. L., Howard, J. A. Plant molecular farming: systems and products. Plant Cell Reports. 22, 711-720 (2004).
- Wydro, M., Kozubek, E., Lehmann, P. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana. Acta Biochimica Polonica. 35, 289-298 (2006).
- Green, B. J., Fujiki, M., et al. Transient protein expression in three Pisum sativum (green pea) varieties. Biotechnology Journal. 4, 1-8 (2009).
- Kapila, J., DeRycke, R., Van Montagu, M., Angenon, G. An Agrobacterium-mediated transient gene expression system for intact leaves. Plant Science. 122, 108-101 (1997).
- Yang, Y., Li, R., Qi, M. In vivo analysis of plant promoters and transcription factors by agroinfiltration of tobacco leaves. Plant Journal. 22, 543-551 (2000).
- Marillonnet, S., Thoeringer, C., Kandzia, R., Klimyuk, V., Gleba, Y. Systemic Agrobacterium tumefaciens-mediated transfection of viral replicons for efficient transient expression in plants. Nature Biotechnology. 23, 718-723 (2005).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants. Current Opinion in Biotechnology. 18, 134-141 (2007).
- Goodin, M. M., Zaitlin, D., Naidu, R. A., Lommel, S. A. Nicotiana benthamiana: Its history and future as a model for plant-pathogen interactions. Molecular Plant-Microbe Interactions. 21, 1015-1026 (2008).
- Shoji, Y., Bi, H., et al. Plant-derived hemagglutinin protects ferrets against challenge infection with the A/Indonesia/05/05 strain of avian influenza. Vaccine. 27, 1087-1092 (2009).
- Llave, C., Kasshau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97, 13401-13406 (2000).
- McCormick, A. A., Kumagai, M. H., et al. Rapid production of specific vaccines for lymphoma by expression of the tumor-derived single-chain Fv epitopes in tobacco plants. Proceedings of the National Academy of Sciences of the United States of America. 96, 703-708 (1999).
- Simmons, C. W., VanderGheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102, 965-970 (2009).
- Ankenbauer, R. G., Nester, E. W. Sugar-mediated induction of Agrobacterium tumefaciens virulence genes: structural specificity and activities of monosaccharides. Journal of Bacteriology. 172, 6442-6446 (1990).
- Cangelosi, G. A., Ankenbauer, R. G., Nester, E. W. Sugars induce the Agrobacterium virulence genes through a periplasmic binding protein and a transmembrane signal protein. Proceedings of the National Academy of Sciences of the United States of America. 87, 6708-6712 (1990).
- Stachel, S. E., Nester, E. W., Zambryski, P. C. A plant cell factor induces Agrobacterium tumefaciens vir gene expression. Proceedings of the National Academy of Sciences of the United States of America. 83, 379-383 (1986).
- Rogowsky, P. M., Close, T. J., Chimera, J. A., Shaw, J. J., Kado, C. I. Regulation of the vir genes of Agrobacterium tumefaciens plasmid pTiC58. Journal of Bacteriology. 169, 5101-5112 (1987).
- Hiei, Y., Ohta, S., Komari, T., Kumashiro, T. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant Journal. 6, 271-282 (1994).
- Vander Hoorn, J. A. L., Laurent, F., Roth, R., De Wit, P. J. G. M. Agroinfiltration is a versatile tool that facilitates comparative analyses of Avr9/cf-9-induced and Avr4/Cf-4-induced necrosis. Molecular Plant-Microbe Interactions. 13, 439-446 (2000).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assay of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3, 259-273 (2005).
- Salmond, G. P. C. Secretion of extracellular virulence factors by plant pathogenic bacteria. Annual Review of Phytopathology. 32, 181-200 (1994).
- Felix, G., Duran, J. D., Volko, S., Boller, T. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin. Plant Journal. 18, 265-276 (1999).
- Goodner, B., Hinkle, G., et al. Genome sequence of the plant pathogen and biotechnology agent Agrobacterium tumefaciens C58. Science. 294, 2323-2328 (2001).
- Lee, Y. -. W., Jin, S., Sims, W. -. S., Nester, E. W. Genetic evidence for direct sensing of phenolic compounds by the vir A protein of Agrobacterium tumefaciens. Proceedings of the National Academy of Sciences of the United States of America. 92, 12245-12249 (1995).
- Voinnet, O., Pinto, Y. M., Baulcombe, D. C. Suppression of gene silencing: a general strategy used by diverse DNA and RNA viruses. Proceedings of the National Academy of Sciences of the United States of America. 96, 14147-14152 (1999).
- Voinnet, O. RNA silencing as a plant immune system against viruses. Trends in Genetics. 17, 449-459 (2001).
- Ding, X. S., Liu, J., et al. The Tobacco mosaic virus 126-kDa protein associated with virus replication and movement suppresses RNA silencing. Molecular Plant-Microbe Interactions. 17, 583-592 (2004).
- Harries, P. A., Palanichelvam, K., Bhat, S., Nelson, R. S. Tobacco mosaic virus 126-kDa protein increases the susceptibility of Nicotiana tabacum to other viruses and its dosage affects virus-induced gene silencing. Molecular Plant-Microbe Interactions. 21, 1539-1548 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved