Method Article
Otimização e Utilização de
Neste Artigo
Resumo
Produção de proteína transiente em plantas de Nicotiana baseado na infiltração de vácuo com Agrobacterium levando vetores de lançamento (Tobacco mosaic vírus-base) é uma abordagem rápida e econômica para a produção de antígenos vacinais e proteínas terapêuticas. Nós simplificamos o processo e melhorado acumulação alvo, otimizando as condições de cultivo de bactérias, a seleção de espécies hospedeiras, e co-introdução de RNA silenciar supressores.
Resumo
Produção de proteína transiente mediada por Agrobacterium, em plantas é uma abordagem promissora para a produção de antigénios de vacina e proteínas terapêuticas dentro de um curto período de tempo. No entanto, esta tecnologia está apenas começando a ser aplicado a produção como muitos obstáculos tecnológicos de grande escala para expandir agora estão sendo superados. Aqui, nós demonstramos um método simples e reprodutível para a produção de proteína transitória em escala industrial baseado na infiltração de vácuo de plantas de Nicotiana com Agrobacterium levando vetores de lançamento. Optimização do cultivo de Agrobacterium em meio AB permite diluição directa da cultura bacteriana em água Milli-Q, simplificando o processo de infiltração. Entre três espécies testadas de Nicotiana, N. excelsiana (N. benthamiana × N. Excelsior) foi seleccionada como o hospedeiro mais promissor, devido à facilidade de infiltração, elevado nível de produção de proteína repórter, e cerca de dois-fidade mais elevada produção de biomassa sob condições ambientais controladas. Indução de Agrobacterium abrigando pBID4-GFP (baseado no vírus do mosaico do tabaco) utilizando produtos químicos, tais como aceto-siringona e monossacárido não teve nenhum efeito sobre o nível de produção de proteína. Infiltrando planta em 50 a 100 mbar para 30 ou 60 segundos resultou em cerca de 95% de infiltração de tecidos foliares de plantas. Infiltração com GV3101 cepa de laboratório Agrobacterium apresentou a maior produção de proteína em comparação com estirpes laboratoriais Agrobacterium LBA4404 e C58C1 e do tipo selvagem Agrobacteria cepas AT6, AT10, at77 e A4. A co-expressão de um vírus de ARN de silenciamento supressor, p23 ou p19, em N. benthamiana resultou em acumulação anterior e aumento da produção de (15-25%) de proteína alvo (hemaglutinina do vírus da gripe).
Introdução
As plantas são agora reconhecidos como uma plataforma segura, confiável, escalável e de baixo custo para a produção de biofármacos recombinantes heterólogas e proteínas industriais 1-3 e ter vantagens importantes sobre microbianos e animais sistemas de expressão de célula 4. As plantas são capazes de expressar proteínas corretamente dobradas com modificações pós-traducionais, incluindo anticorpos multiméricas montados 5-7. Várias proteínas farmacêuticas recombinantes derivadas de plantas são submetidos a avaliação clínica 8. Estes incluem vacinas específicas do paciente recombinantes idiotype (scFv) para o tratamento de linfoma não-Hodgkin 9, pandemia baseada hemaglutinina e sazonais vacinas influenza 10,11 (Cummings et al., Submetida a Vaccine), anti-Streptococcus antígeno de superfície I / anticorpo II para o tratamento de cáries dentárias de 12, e a insulina humana para o tratamento de diabetes 13. Além disso, reco humanoglucocerebrosidase mbinant para a terapia de reposição enzimática em pacientes com doença de Gaucher foi aprovada em Israel e os EUA e é fornecido sob o programa de acesso expandido fora de os EUA 14,15.
Proteínas heterólogas podem ser produzidos em transformadas de forma estável (transgénico ou transplastômicas) ou plantas transformadas de forma transiente. Produção de proteína transiente oferece várias vantagens sobre a produção de plantas transgénicas, incluindo prazo curto para atingir a expressão e acumulação 16, e pode ser alcançada através da introdução de vectores binários bacterianos ou vectores virais recombinantes de plantas em tecidos de plantas 4. O sistema de expressão transiente mais avançada é baseado na utilização de "vectores de lançamento", que combinam componentes de vírus de plantas e plasmídeos binários, e são entregues por agroinfiltration 17,18. Agroinfiltration de um vetor de lançamento com base em Tobacco mosaic virus (TMV) foi aplicada com sucesso em laboratórioescala para a produção de antígenos vacinais contra patógenos como o vírus do papiloma humano 19, Yersinia pestis 20, influenza vírus A 21,22, Bacillus anthracis 23, e vírus da varíola 24 em N. benthamiana folhas. expressão transiente mediada por Agrobacterium, também é um método promissor para a produção simultânea de várias proteínas 2,25-27. Por exemplo, os sistemas de expressão transiente de plantas foram usadas para produzir anticorpos recombinantes específicos de tumores 28,29, um anticorpo recombinante glicosilada contra o receptor do factor de crescimento epidérmico de 30, e um anticorpo monoclonal específico para o antigénio protector antraz 31,32. Co-infiltração de plantas de Nicotiana benthamiana com um gene alvo e um supressor de resultados silenciamento gênico em aumento da expressão da proteína-alvo 33,34.
Agroinfiltration é um método comum para a introdu uniformementebactérias Cing abrigando um gene de interesse em tecidos vegetais 35-37. Infiltração de vácuo de Agrobacterium para a expressão gênica transitória na intacto folhas de plantas é um método rápido, escalável e útil para a produção de proteínas estranhas, sem a necessidade de gerar plantas transgênicas 38-41. Durante agroinfiltration vácuo, as plantas são viradas de cabeça para baixo e partes aéreas submerso em suspensão Agrobacterium. Em seguida, o vácuo é aplicado causando gases de evacuação de espaços intercelulares folha através dos estômatos. Re-pressurização após a libertação rápida dos resultados de vácuo na infusão da suspensão de Agrobacterium para a folha. Seguindo infiltração por vácuo de Agrobactérias, as plantas são depois cultivados e expressão do alvo é monitorizada. Os maiores níveis de expressão alvo são normalmente observadas 2-3 dias após a infiltração (dpi) com um vetor binário e 4-7 dpi com um vetor de lançamento, após o qual o nível de expressão tipicamente dimises 17,18,42-45. Agrobacterium tumefaciens é o veículo mais largamente usado para a entrega de um gene de interesse em uma planta para a produção de proteína. Agroinfiltration funciona excepcionalmente bem em N. benthamiana mas relativamente mal na maioria das outras plantas, incluindo Arabidopsis thaliana 46.
Neste estudo, foi desenvolvido um método simples, eficaz e económico para a produção da proteína transiente em 5-6 semanas de idade, N. benthamiana usando A. tumefaciens infiltração. A principal desvantagem da escamação industrial da técnica agroinfiltration é centrifugação das bactérias colhidas e a ressuspensão do sedimento bacteriano em meio contendo 4 '-hidroxi-3', 5'-dimetoxiacetofenona (acetosiringona), monossacarídeos, e 2 - (N-morfolino) ácido-etanossulfónico (MES), tampão para a indução de genes vir. Temos sido capazes de superar estes problemas através da otimização do Agrobacterium o crescimento em meio AB (meio mínimo) seguido por diluição directa em água Milli-Q e controlando o tempo e as condições de infiltração. Também foram comparados a produção de proteínas-alvo no N. de tipo selvagem de espécies hospedeiras tabaco benthamiana e N. aparas de madeira, bem como em N. híbrida excelsiana.
Protocolo
1. Planta cresce
Para agroinfiltration subseqüente avaliamos dois do tipo selvagem Nicotiana espécies (N. benthamiana e N. maravalhas) e um híbrido (N. excelsiana) cultivo hidropônico em lã de rocha em instalações internas.
- Mergulhe lã de vidro em uma solução de fertilizante de plantas.
- Semear tipo selvagem N. benthamiana, N. Excelsior e N. excelsiana (híbrido de N. benthamiana × N. excelsior) nos nutrientes embebido superfície lã de rocha.
- Cultive plantas das sementes em condições controladas (24 ° C e 40-65% de umidade relativa) e fotoperíodo longo dia (14 horas de luz e 10 horas escuro, com iluminação de 130-150 μE m -2 s -1) para 4-5 semanas para N. benthamiana e N. excelsiana, e 5-6 semanas para N. Excelsior.
2. Construção de Vetores para Agroinfiltratíon
- Inserir um gene repórter sintético (proteína fluorescente verde [GFP]), de comprimento completo da hemaglutinina (HA) a partir da estirpe do vírus da gripe A/CALIFORNIA/04/2009 (HAC1), e enzima liquenase reengenharia (LicKM) 18 separadamente em o vetor de lançamento pBID4 18 (vector-based TMV) para obter pBID4-GFP, pBID4-HAC1 e pBID4-LicKM, respectivamente 18,32,41,47.
- Introduzir 10-50 ng de pBID4 realização GFP ou HAC1 em células electrocompetentes de A. tumefaciens GV3101 estirpe e LicKM em células electrocompetentes de A. Agrobacterium estirpes GV3101, C58C1, GLA4404, AT06, AT10, At77 e A4 com o electroporador MicroPulser gene.
- Use o Agrobacterium transformado por experiências de infiltração salvo indicação em contrário.
3. Vácuo Infiltração de Agrobacterium em Nicotiana Plantas
- Crescer A. Agrobacterium cepas durante a noite (O / N) em meio LB, med Yebium ou meio AB suplementado com 50 mg / l de canamicina a 28 ° C com agitação a 200-250 rpm.
- Diluir Agrobacterium em água Milli-Q a uma densidade óptica a 600 nm (A 600) de 0,5 ou centrífuga Agrobacterium células cultivadas em meio LB ou YEB ou AB a 4000 × g durante 10 min a 4 ° C, re-suspensão em meio de indução (sal 1x MS, MES 10 mM, 200 ^ M de acetosiringona, 2% de sacarose [MMA]) a A 600 de 0,5, e agita-se à temperatura ambiente durante 1-3 hr, salvo indicação em contrário.
- Infiltrar plantas em uma câmara de vácuo, submergindo Nicotiana plantas tecidos aéreos em suspensão Agrobacterium e aplicação de um vácuo 50-400 mbar por 30 ou 60 seg. A infiltração ideal é rotineiramente aplicada em 50-100 mbar por 60 seg.
- Uma vez que o vácuo é quebrado, remover as plantas da câmara de vácuo, lavar com água, e crescer durante 5-7 dias, sob as mesmas condições de crescimento usadas para o crescimento de pré-infiltração.
- Para testar a eficáciade produtos químicos indutores do gene vir Agrobacterium, diferentes concentrações de acetossiringona (0, 100, 200 ou 400 pM) foram adicionados para o Agrobacterium suspenso em tampão de infiltração (1x MS, MES 10 mM, 2% de glicose). Para o efeito de monossacárido na indução de genes vir, percentagens diferentes de glicose (0, 1, 2 ou 4%) foram adicionados a Agrobacteria suspenso no tampão de infiltração (1x MS, MES 10 mM, 200 ^ M de acetosiringona). N. plantas benthamiana foram infiltradas como mencionado acima em passos 3.3 e 3.4).
- Laboratório estirpes GV3101 de Agrobacterium, C58C1 e LBA4404 e as estirpes do tipo selvagem A4, AT06, AT10, At77 e abrigando o vector pBID4-LicKM foram diluídos em água Milli-Q a A 600 de 0,5. N. plantas benthamiana foram infiltradas com cada estirpe particular, como mencionado acima, em passos 3.3 e 3.4.
4. Processo de co-agroinfiltration para o silenciamento do supressor Viral
- Mix as diluído em água Milli-Q culturas Agrobacterium GV3101 portadores do gene GFP eo silenciamento viral p19 supressor de tomate vírus enfezamento vermelho (TBSV) em 1:1, 2:1, 3:1 e 4:1 rácios. Infiltrar N. benthamiana plantas, como descrito acima.
- Infiltrar N. benthamiana plantas com uma mistura de dois diluída em água GV3101 de Agrobacterium culturas Milli-Q: a primeira portadora do plasmídeo pBID4-HAC1 e a segunda realização um dos eliminadores de silenciamento - p19 de TBSV ou p23 do vírus da tristeza dos citrinos, no plasmídeo pCassp ( pCassp19) e no plasmídeo binário PGR sob o promotor 35S (PGR-P23), respectivamente, na proporção de 4:1.
5. Ocidental Análise Blot
- Coletar amostras de folhas aleatórias de N. benthamiana, N. excelsior ou N. plantas excelsiana em 4-7 dpi e pulverizar em nitrogênio líquido a um pó fino.
- Adicionar três volumes de tampão de PBS 1x contendo 0,5% de TritonX-100 a cada uma das amostras.
- Agite suavemente as amostras extraídas por 15 min a 4 ° C.
- Gire o extrato por 5 min e recolher proteínas solúveis totais em um tubo Eppendorf limpo.
- Dilui-se os extractos a uma diluição adequada (1:50 a 1:100) em tampão de extracção de 1x PBS, e adicionar 5 × tampão de amostra (250 mM Tris-HCl [pH 6,8], 10% de SDS, 0,5% de azul de bromofenol, 50% de glicerol v / v, e DTT a 500 mM) a uma concentração final de 1 ×.
- Amostras ferva por 5 min.
- Proteínas separadas por 10% SDS-PAGE, transferência para membrana de transferência Immobilon-P, e bloqueá-lo com 0,5% I-bloco.
- Detectar GFP utilizando anticorpo policlonal de coelho anti-anti-soro de 1:5000 GFP e HAC1 usando o rato de anticorpo monoclonal anti-poli-histidina na 1:1000 em solução de bloqueio durante 1 hr.
- Após marcação com anticorpos primários, lavar as membranas três vezes durante 10 minutos cada um com 1 × PBST-20 e incubar com uma peroxidase de rábano (HRP) conjugado com anticorpo anti-coelho a 1:5000 ou um HRP-conjugadod anticorpo anti-rato 1:10000 durante 1 hora, para GFP e detecção HAC1, respectivamente.
- Processe Western blot utilizando o substrato quimioluminescente SuperSignal West Pico.
- Usar o Software GeneTools analisar intensidade da banda da proteína e obter a quantidade calibrada banda.
Produção de proteínas: (Calibrado quantidade x de diluição da amostra) / quantidade de amostra carregada) x = 4 mg / kg.
Equação: produção de proteína (P), a quantidade calibrada (C), A diluição da amostra (D) e a quantidade de amostra carregados (S).
6. Zimograma Ensaio
- N. Colete pBID4-LicKM-se infiltrado benthamiana amostras de tecido aleatório.
- Extrair proteínas utilizando os mesmos métodos acima descritos para análise de Western blot e, em seguida, analisar por 10% de SDS-PAGE com 0,1% liquenano incluídos nos géis.
- Após a electroforese, os géis de lavar duas vezes durante 10 minutos cada em tampão de lavagem (Tris-HCl 100 [pH 8,0] e 0,1% de Triton X-100) E depois incubar, em tampão de lavagem a 65 ° C durante 1 hora.
- Após incubação, eliminar o tampão de lavagem e manchar os geles com 0,5% de Vermelho do Congo, durante 5 min à temperatura ambiente.
- Lavar os géis em água Milli-Q três vezes durante 10 minutos cada, e adicionar 1 M de NaCl para visualizar a actividade liquenase. A liquenase purificada de proteína bacteriana foi utilizado como um controlo positivo para a actividade da enzima.
7. GFP Imagem
- Realizar a detecção visual de fluorescência da GFP em plantas transformadas transitoriamente inteiros usando um longo comprimento de onda da lâmpada UV de mão.
- Fotografia transitoriamente transformado plantas com uma câmera digital através de um Amarelo 8, ES 52 filtro (tempo de exposição, 15 seg).
- Obter imagens de Western blot usando o software GeneSnap em um GeneGnome e quantificar os resultados usando o software GeneTools, com uma curva de calibração com base no padrão GFP purificada.
- Quantificar proteína HAC1 usando uma curva de calibração baseada em purificaçãoed HAC padrão de proteína a partir da estirpe do vírus da gripe A/Indonesia/05/05.
- Calcule os valores médios 3-4 replica para todos os experimentos.
Resultados
Necessidades de nutrientes para o crescimento das plantas. O uso de meio hidropônico crescimento da planta (lã de rocha) e solução nutritiva garante uniformidade de N. crescimento benthamiana e elimina as complexidades (mecânica, regulamentar e eficiência) associados ao uso do solo para o cultivo da planta. Nós crescemos N. benthamiana em lã de vidro embebidas em fertilizantes disponíveis no mercado para determinar as condições ótimas para o crescimento da planta e acúmulo de biomassa. Observou-se a germinação de sementes de 95-100%. Note-se que a inclusão de fósforo é fundamental para alcançar a germinação, porque descobrimos que solução nutritiva sem fósforo não conseguiu suportar a germinação e crescimento de N. sementes benthamiana (Figura 1A).
Efeitos do crescimento Agrobacterium e mídia infiltração na produção de saúde e proteína vegetal. Nós testamos várias condições de mídia para otimizar a eficiência de tele agroinfiltration técnica para produção em larga escala. As bactérias (estirpe GV3101 de A. tumefaciens) que albergam o construto pBID4-GFP foram cultivadas S / N em diferentes meios de cultura (YEB, LB ou AB), e quer centrifugadas e re-suspensas em meio de indução (MMA) (contendo 1 × Murashige & Skoog [MS] Mistura de sal basal, 10 mM MES pH 5,6, 20 g / L de sacarose e 200 ^ M de acetosiringona), ou diluído em água Milli-Q a A 600 de 0,5 antes de o utilizar para a planta de infiltração. Observou-se que a infiltração de vácuo de plantas com bactérias diluídos em água resultou em produção de proteína comparáveis aos obtidos com qualquer mídia infiltração em relatórios anteriores 42,48. Em contraste, a infiltração com Agrobacterium não diluído crescido em YEB ou mídia LB resultou na murcha completa de N. benthamiana sai em menos de 24 horas pós-infiltração, enquanto Agrobacteria não diluídas cultivadas em meio AB não teve efeito sobre a saúde das plantas infiltrados (datum não mostrado). Como ilustrado na Figura 1B, as plantas infiltrada com culturas de Agrobacterium cultivadas em YEB, LB ou AB mídia e diluiu-se com água Milli-Q (1:5, A 600 de 0.6-0.8, ou 1:10, A 600 de 0,3-0,4) mostrou sem sintomas e exibiram uma produção média de GFP de 1645, 1520 e 1839, respectivamente. Agrobacteria centrifugadas e re-suspensas em meio de indução (MMA) não apresentaram sintomas e não houve diferença significativa em comparação com a produção de proteínas Agrobacteria directamente diluído em água Milli-Q ( 1671 ± 102 e 1667 ± 131 mg / kg, respectivamente). Portanto, a água Milli-Q é recomendado para diluir as culturas de Agrobacterium para plantas infiltração e foi utilizada rotineiramente em nossas experiências subsequentes para atingir um A 600 de 0,5.
Efeitos da densidade de células em suspensão de Agrobacterium e naturalmente o tempo de expressão do alvo. Nós seguida examinou-se a densidade celular bacterianaafecta a eficiência da infiltração e os níveis de expressão do alvo. Para esta finalidade, foi avaliada quatro densidades diferentes de células em suspensão de Agrobacterium transportando pBID4-GFP, A 600 de 1,0, 0,5, 0,1 e 0,05. Seguindo infiltração, N. plantas benthamiana foram monitorados para o desenvolvimento de sintomas visíveis e curso de tempo de expressão alvo através da recolha de amostras a 4, 7 e 10 dpi. Às 4 dpi, observou-se diferenças notáveis em GFP fluorescência entre plantas infiltrados com diferentes densidades de células em suspensão de Agrobacterium (sem expressão GFP foi observada em 600 de 0,05). Aos 7 dpi, fluorescência da GFP era semelhante em plantas infiltradas em densidades de suspensão de células de A 600 1.0, 0.5 e 0.1, mas foi inferior nas plantas infiltradas em um A 600 de 0,05. Como mostrado na Figura 1C, estes dados foram confirmados por Western blot análises de amostras coletadas em 4 dpi, mostrando a produção muito baixa proteína no A 600 de 0,05 (5 mg / kg) e mais elevado em A 600 de 1,0 (1,739 mg / kg). Aos 7 dpi, as plantas não apresentaram diferenças significativas em produção estimada GFP em A 600 de 1,0, 0,5 e 0,1 (1.662, 1.870 e 1.890, respectivamente), enquanto que um 600 de 0,05 apresentaram menor produção de GFP (1.199 mg / kg). Em contraste, em 10 dpi não foram observadas diferenças na produção de GFP entre plantas infiltrados com qualquer um dos quatro densidades de suspensão celular (1.218, 1.181, 1.197 e 1.304).
Infiltração com estirpes alternativas de Agrobacterium. Para aumentar a diversidade de estirpes de Agrobacterium disponíveis para a produção de proteína transiente, testámos de tipo selvagem isolados. Essas cepas, isoladas da coroa-fel de hospedeiros naturais, foram gentilmente cedidas pelo Dr. Gelvin (Universidade Purdue, West Lafayette, Indiana). Para examinar a sua utilidade na produção de proteína transitória, que se infiltrou N. benthamiana com as seguintes estirpes carrying pBID4-LicKM 18: A. rhizogenes (A4) e A. tumefaciens do tipo selvagem Nester estirpes A348, A208, e A281 (chamado AT6, AT10, At77 e, respectivamente), bem como as estirpes de laboratório de engenharia de A. tumefaciens GV3101, C58C1, e LBA4404. As folhas foram infiltradas recolhidas aos 7 ppp e o nível de expressão LicKM foi estimada pelo ensaio de mancha de Western. Como mostrado na Figura 2A, o maior nível de produção LicKM pode ser alcançado com as estirpes GV3101, A4 e LBA4404 (~ 1750 ± 163, 1650 ± 26 e 117 ± 1,450 mg / kg, respectivamente), com ligeiras diferenças; o nível mais baixo de expressão (~ 900 ± 102 mg / kg) com C58C1; e a produção de intermediários com AT6, AT10 e At77 (~ 1250 ± 19, 1100 ± 42 e 111 ± 1,200 mg / kg, respectivamente). A actividade enzimática liquenase foi demonstrada utilizando o ensaio de zimograma. Figura 2B mostra que a liquenase produzidos em tecidos de plantas infiltradas usando qualquer um dosCepas Agrobacterium foi enzimaticamente ativa. Deve-se notar também que as plantas de N. benthamiana infiltrados com cepas A4 e At77 apresentaram sintomas patológicos (nanismo, alongamento pecíolo e ondulação, e folha de frisar), enquanto com AT10 esticar os sintomas foram leves. Sem sintomas foram observados em plantas de N. benthamiana infiltrados com cepa de laboratório GV3101 (Figura 2C).
Infiltração de espécies alternativas Nicotiana. Foram comparadas as taxas de geração de biomassa e produção de proteínas em duas espécies do tipo selvagem do gênero Nicotiana (N. benthamiana e N. excelsior) e em uma espécie híbrida, N. excelsiana (N. benthamiana × N. Excelsior). Das espécies testadas, N. benthamiana, um hospedeiro utilizado para a produção da proteína transiente utilizando sistemas de expressão baseados em Agrobacterium ou baseados em viral 2,34,49, chega a prontidão infiltração dentro de 4-5 semanas de germinação. O período de crescimento necessário para gerar o nível ótimo de biomassa também é 4-5 semanas para N. excelsiana mas é mais longo (6-7 semanas) para N. Excelsior. Além disso, os entrenós da planta são relativamente curtos para N. Excelsior em comparação com outras espécies de Nicotiana.
Além disso, observou-se que a infiltração de vácuo de N. benthamiana e N. excelsiana em 50-250 mbar por 60 seg é altamente eficiente para agroinfiltration de folhas inteiras, enquanto N. aparas de madeira é difícil infiltrar devido às suas copas e couro inferiores folhas, mesmo quando o vácuo foi aplicado três vezes, durante 1 minuto cada, na presença de agentes tensioactivos não-iónicos, tais como Sillwet-77 ou S240. Além disso, a taxa de germinação de N. excelsiana e N. sementes Excelsior foi de ~ 40-50%; , a fim de aumentar a taxa de germinação de 90-100%, as sementes devem ser tratadas com 10% bleach por 1 hora antes da semeadura. Sob as mesmas condições de crescimento, a folha mais elevada de biomassa que pode ser gerada a partir de N. excelsiana é aproximadamente duas vezes mais elevada em comparação com a N. benthamiana (Tabela 1).
A produção da proteína foi analisada em N. benthamiana, N. Excelsior e N. excelsiana infiltrada com o GV3101 tensão Agrobacterium abrigar pBID4-GFP. Acumulação GFP foi avaliada em 7 dpi em folhas infiltradas inteiros usando a luz UV seguido por análise de Western blot. Figura 3A mostra uma distribuição uniforme da GFP em N. benthamiana e N. excelsiana e distribuição desigual em N. Excelsior (devido a uma dificuldade de se infiltrar em uma área folha inteira de N. Excelsior). Figura 3B mostra o nível de produção de GFP estimado pela iluminação de luz UV em folhas infiltradas recolhidos das três espécies de Nicotiana em 7 dpi. A acumulação GFPnível mento foi maior em N. benthamiana (~ 2,23 g / kg) do que no N. excelsiana e N. Excelsior (~ 1,89 e 1,54 g / kg, respectivamente). O baixo nível de produção de proteína em N. Excelsior é devido à infiltração e distribuição de GFP acumulado na folha coletada desigual.
Observou-se que as folhas superiores diretamente expostas à luz muitas vezes apresentam os primeiros e os mais altos níveis de acumulação GFP transitório (a 2-4 dpi) do que folhas sob o dossel. No entanto, em nossos estudos, o acúmulo de GFP foi a maior em 7 dpi e foi distribuído uniformemente em toda a maioria das folhas, exceto em folhas não infiltrados recém crescentes que mostram nenhuma acumulação GFP.
Efeitos da pressão de vácuo e duração sobre a produção de proteína transitória. Vácuo infiltração aumenta significativamente os níveis de expressão transiente, comparando a pressão aplicada por injeção mão com uma seringa sem agulha 42. A aplicação de umvácuo provoca gases para evacuar de planta através dos estômatos das folhas submersas. Quando o vácuo é quebrado e a pressão aumenta rapidamente, a suspensão de Agrobacterium é conduzida em folhas para substituir os gases evacuados 50.
Para testar o efeito da pressão de vácuo sobre as folhas de N. benthamiana, infiltra-se as plantas com o GV3101 tensão Agrobacterium abrigar pBID4-GFP sob diferentes pressões de vácuo (50-400 mbar) para 30 ou 60 seg. Demonstrou-se que o vácuo forte (abaixo de 50 mbar), aplicada durante 30 ou 60 sec resultados em dano mecânico de folhas infiltradas, levando a murchidão tecido e morte da planta logo após infiltração (24-48 h). Por outro lado, a aplicação do vácuo mais suave (400 mbar) resulta em infiltração de apenas 50% da superfície da folha e uma diminuição do nível de produção de GFP (303 ± 90 mg / kg) (Figura 4A). É importante ressaltar que não observamos diferenças na produção de GFP em 50, 100 e 200 mbar (1.651 ± 107, 1688 ± 40, 1594 ± 26 mg / kg, respectivamente) (Figura 4A) e leve a não, impactos negativos para a saúde das plantas, quando pressões de vácuo 50-200 mbar foram aplicadas por 30 ou 60 seg. Portanto, 50-100 mbar de pressão de vácuo é recomendada para ensaios de infiltração.
O efeito da duração do vácuo na expressão do alvo foi avaliada por infiltração de um plano de N. plantas benthamiana cada hora com um A 600 de 0,5 de GV3101 abrigando pBID4 -. GFP durante 8 horas na mesma cultura de Agrobacterium A Figura 4B mostra que o nível de produção de GFP foi semelhante de todos os tempos de pontos até 8 horas, sugerindo que, ao longo desta período de tempo que o Agrobacterium mantém a sua capacidade para iniciar um ADN de cadeia simples.
Efeito da indução química na produção de proteína. Certos metabólitos planta fenólicos e açúcares pode indgenes de virulência uce de A. tumefaciens 1,52. Como consequência, muitos produtos químicos e monosaccharaides têm sido relatados para aumentar a produção de proteína transiente em várias espécies de plantas. Acetosiringona é mais frequentemente adicionados a culturas de A. tumefaciens para induzir o operon vir antes agroinfiltration 40,53-57.
Nós avaliamos o efeito de diferentes concentrações de acetoseringona (0, 100, 200 e 400 mm) e glicose (0-4%) na produção de proteína GFP transitória em N. benthamiana infiltrada com o GV3101 tensão Agrobacterium abrigar pBID4 - GFP. Para este fim, nós re-suspenso células Agrobacterium no MMA mídia indução contendo diferentes concentrações de acetoseringona e glicose para 1-3 horas antes da infiltração. De acordo com os resultados de ambos observação visual (dados não mostrados) e análise Western blot (Figura 4C), nenhuma das concentrações testadasdestes compostos induziram um aumento significativo na fluorescência da GFP, ou a produção da proteína em comparação com o controlo que os meios de indução não continha acetosiringona ou glicose.
Efeito do co-a infiltração de um supressor de silenciamento de produção transiente de genes de GFP e HAC1 em N. benthamiana sai. Já foi demonstrado que a co-expressão de um supressor de silenciamento (p19 de tomate vírus enfezamento vermelho [TBSV]) interfere com silenciamento gênico pós-transcricional (PTGS), resultando em aumento da produção de proteínas repórter 34.
Nós avaliamos o efeito da co-infiltração de N. benthamiana com o vector de lançamento que transporta o gene repórter da GFP (pBID4-GFP) e p19. Antes de infiltração, um A 600 de 0,5 diluições de A. culturas tumefaciens GV3101 albergando pBID4-GFP e p19 foram respectivamente misturados a razões de 1:1, 2:1, 3:1 e 4:01. expressoião do supressor de silenciamento foi controlada pelo promotor da couve-flor 35S do vírus do mosaico. Tal como indicado pelos resultados de uma análise de Western blot em 7 dpi (Figura 5A), a presença de p19 não aumentar ou diminuir a produção de GFP na N. benthamiana, em qualquer proporção das duas suspensões de Agrobacterium.
Temos também comparou os efeitos de dois genes supressores de silenciamento viral - p23and p19 - na prevenção de PTGS para HAC1. As culturas de Agrobacterium portadoras do vector de lançamento pBID4-HAC1 (H1N1 A/CALIFORNIA/04/2009) e um dos dois plasmídeos supressores de silenciamento virais foram diluídas para um A 600 de 0,5, misturado a uma proporção de 4:1, respectivamente, e co-infiltrada em N. 4-5 semanas de idade benthamiana. Uma suspensão de R. tumefaciens transportando pBID4 - HAC1 sozinho foi infiltrado como controle. As amostras de folhas infiltradas foram recolhidos de 3 a 8 dpi. O experimento foi repeated três vezes e os níveis médios da expressão HAC1 determinado por análise de Western blot.
Como demonstrado na Figura 5B, a co-infiltração de N. benthamiana com p23 ou p19 resultou em (642 ± 157 e 764 ± 108 mg / kg, respectivamente) e um aumento na produção HAC1 comparado com o uso de qualquer supressor de silenciamento (cerca de 15-25%, respectivamente) em 6 dpi. Isto sugere que a p23 e p19 são eficientes em nosso sistema. No entanto, deve notar-se que a acumulação de HAC1 ocorreu um dia antes, quando pBID4-HAC1 foi co-infiltrada com p19. Por conseguinte, os nossos resultados demonstram que os efeitos do supressor p19 silenciamento em HAC1 e acumulação GFP são diferentes, sugerindo melhoria selectiva da expressão e / ou a estabilidade de algumas proteínas em N. transiente benthamiana.
Também foi observado que ambos na presença e na ausência de um supressor de silenciamento do nível da proteína prod HAC1ução começou a declinar em 7 dpi. Isso indica que o momento da queda da produção de proteína transitória em N. benthamiana infiltrada com o vetor de lançamento é específico do alvo.
O banco de células de Agrobacterium abrigando o vector de lançamento foi avaliada todos os anos para a estabilidade do gene alvo, a viabilidade de Agrobacterium e o nível de acumulação da proteína. O stock de glicerol do banco de células de estirpe GV3101 transformada com pBID4-HAC1 que foi armazenado a -80 ° C foi mostrado ser muito estável durante mais de três anos, sem alterações no nível de produção de proteína transiente em N. infiltrada plantas benthamiana. Figura 5C demonstra que a produção de proteína HAC1 estimado por Western Blot nos anos de 2010, 2011, 2012 e 2013 foi de 670, 685, 566 e 683 mg / kg, respectivamente. A produção média HAC1 em N. benthamiana plantas era 651 ± 49,4 mg / kg.
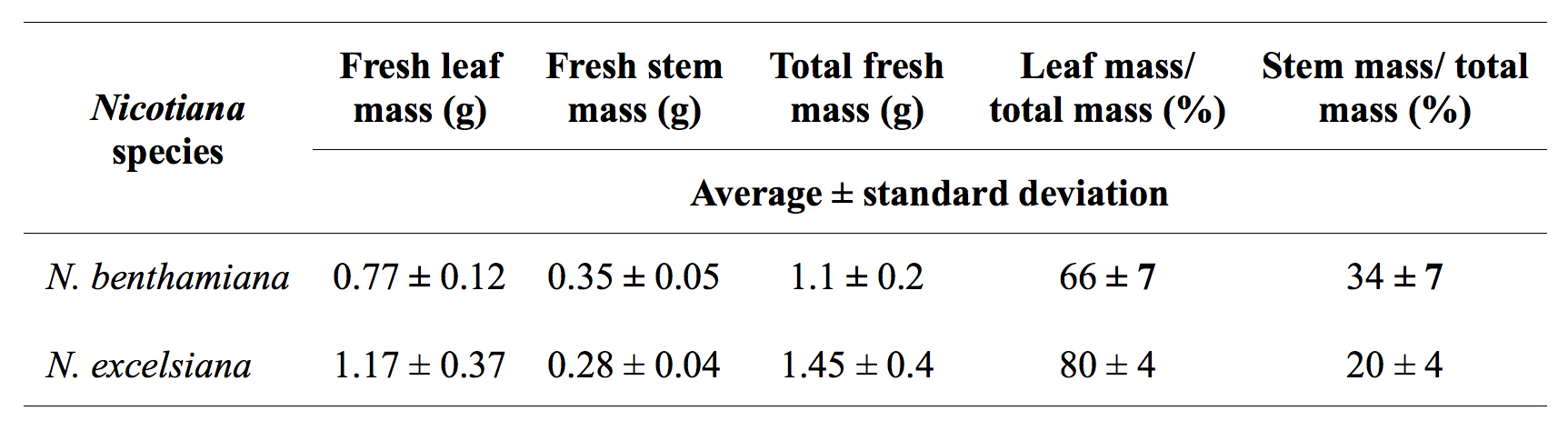
Tabela 1. Comparação de N. benthamiana e N. excelsiana planta de produção de biomassa.
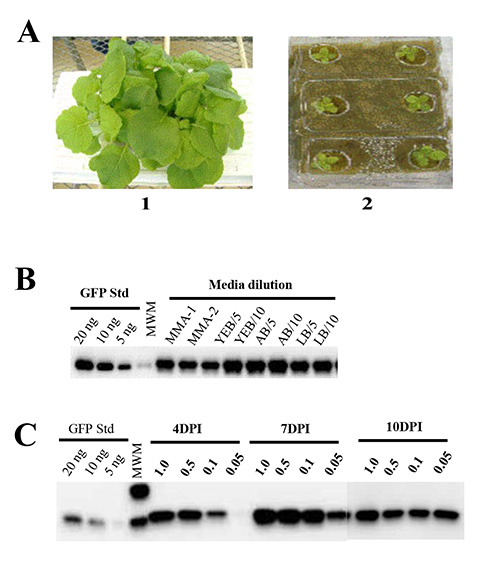
Figura 1. Análise por Western blot da expressão de gene transiente em N. benthamiana. (A) N. de seis semanas de idade benthamiana 1) plantas que crescem em uma solução de adubo que contenha 4,8% de fósforo e 2) plantas que crescem em uma solução de fertilizante que contém 0% de fósforo. Vinte e cinco mg de peso fresco equivalente folha foi carregado por pista. (B) Comparação da produção de GFP em plantas vácuo infiltrada com pBID4-GFP abrigar culturas Agrobacterium GV3101 cultivadas em três meios diferentes: YEB, AB e LB. Culturas cultivadas GV3101 S / N na YEB ou meio LB foram centrifugadas a baixa velocidade e re-suspensas em meio de indução (MMA) (pistas: MMA-1 e MMA-2, respectivamente), ou cultivadas S / N na YEB, LB ou media AB e diretamente diluído a 1:5 ou 1:10 com água Milli-Q (pistas: YEB / 5 e YEB/10; AB / 5 e AB/10; LB / 5 e LB/10) (C) comparação. de expressão da GFP em 4, 7 e 10 dpi seguintes infiltração por vácuo com diferentes concentrações de (A 600 de 1,0, 0,5, 0,1 e 0,05) de A. tumefaciens GV3101 tensão levando pBID4-GFP.
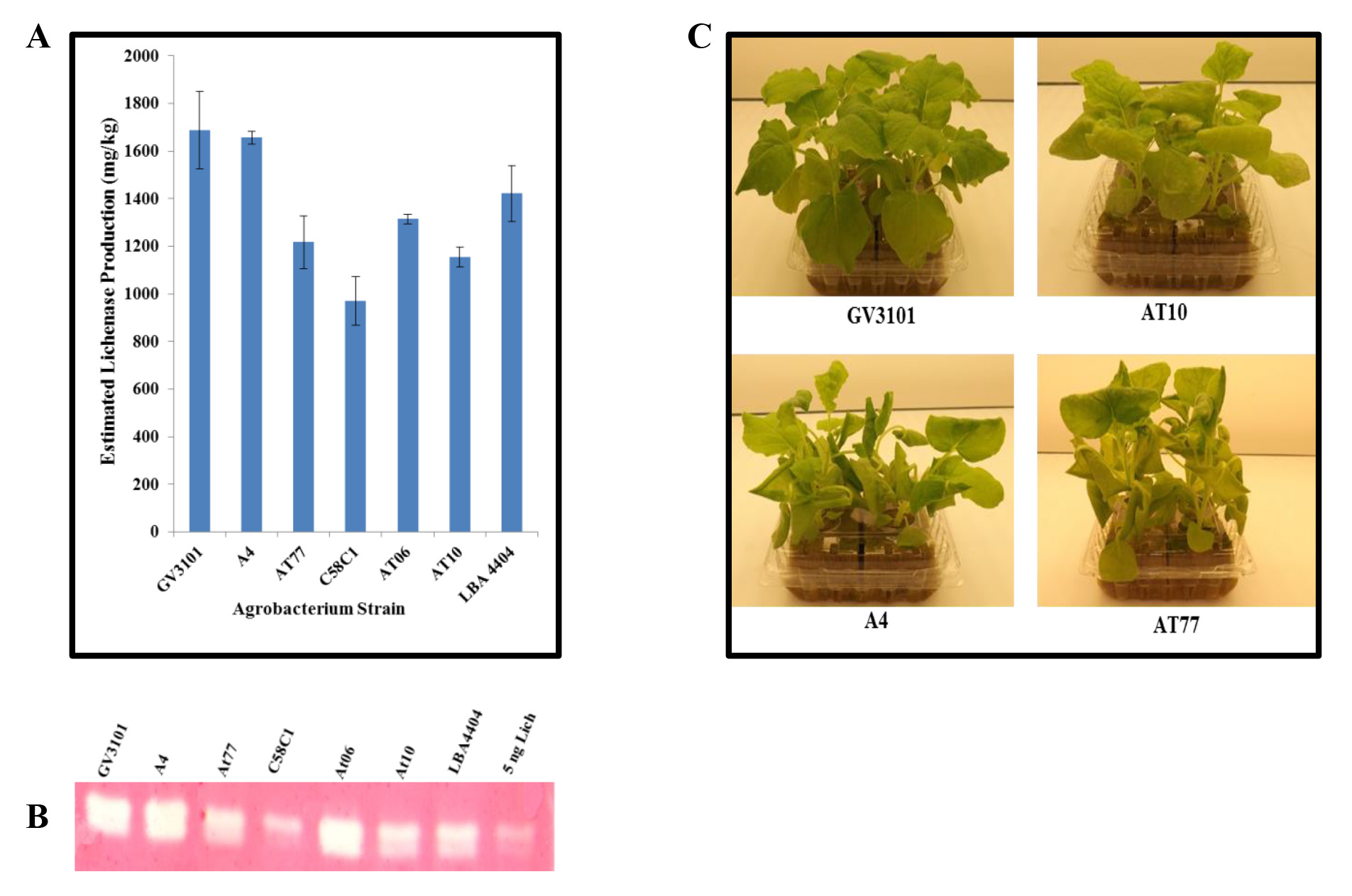
Figura 2. Comparação da produção liquenase transiente e actividade após infiltração por vácuo de N. plantas benthamiana com diferenalugar linhagens de Agrobacterium. culturas de cepas de Agrobacterium (GV3101, A4, At77, C58C1, AT6, AT10 e LBA4404) abrigando o vetor lançamento pBID4-LicKM foram infiltradas individualmente em folhas de N. benthamiana. Folhas infiltradas foram coletadas em sete dpi. (A) liquenase produção quantificados por Western Blot. (B) ensaio zimograma demonstrando produção liquenase através da atividade enzimática. (C) Efeito da Agrobacterium (tipo selvagem A4, AT10, At77 e tensão laboratório GV3101) infiltração em N. benthamiana fitossanitária às 7 dpi. Vinte e cinco mg de peso fresco equivalente folha foi carregado por pista.
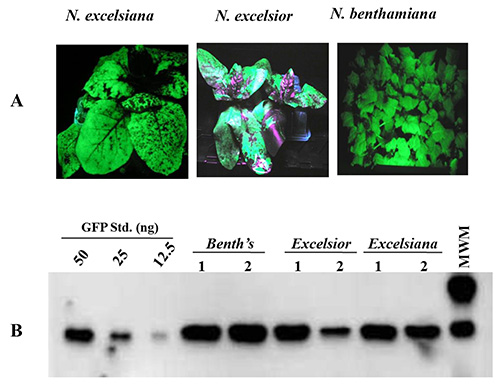
Figura 3. Transiente a expressão da GFP em folhas de N. benthamiana, N. excelsiana e N. Excelsior em 7 dpi após a infiltração de vácuo com A. tumefaciens abrigar o lançamento vetor pBID4 - GFP. (A) O exame visual de expressão GFP sob luz UV. (B) análise de Western blot de acumulação de GFP.
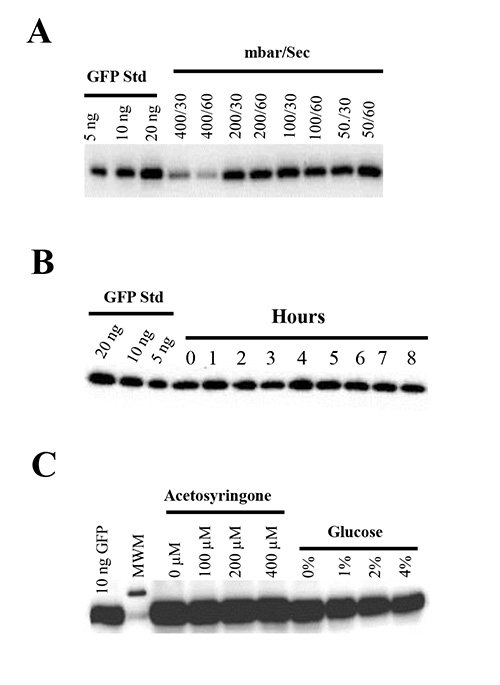
Figura 4. (A) Efeitos da pressão de vácuo na expressão GFP transitória e fitossanidade. N. benthamiana plantas foram infiltradas com pBID4 -. GFP sob pressões de vácuo de 400, 200, 100 ou 50 mbar, no vácuo, tempo de retenção de 30 ou 60 seg (B) Estabilidade e infectividade de A. Agrobacterium em N. benthamiana infiltrada com GV3101 de Agrobacterium abrigando pBID4-GFP cultivadas em meio AB e diluiu-se para um A 600 de 0,5. Agroinfiltration foi realizada por infiltração de um plano de N. plantas benthamiana cada hora na mesma cultura diluída Agrobacterium (pistas 0-8). (C) Efeito de diferentes concentrações de acetossiringona e glicose em expressão transitória da GFP. A estirpe de Agrobacterium abrigando GV3101 pBID4 - GFP foi crescido S / N em meio YEB, centrifugadas e ressuspensas para um A 600 de 0,5, quer em MMA contendo 2% de glucose, com aceto-siringona, a 0, 100, 200 ou 400 | iM, ou, em MMA contendo 200 iM de acetosiringona com glicose a 0, 1, 2 ou 4%. As suspensões de Agrobacterium foram mantidas durante 3 horas à temperatura ambiente antes da infiltração.
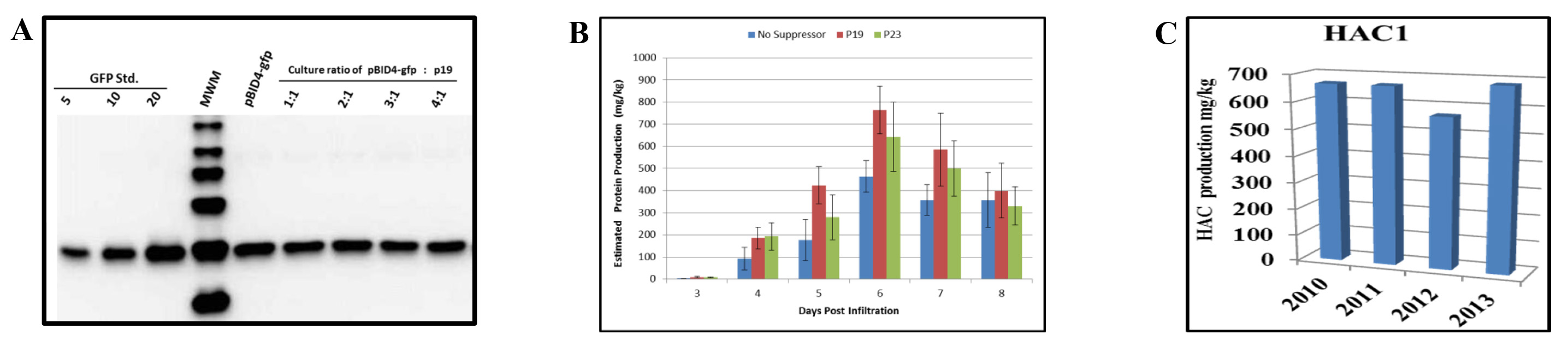
Figura 5. Efeitos de silenciamento supressores sobre a produção da proteína transiente em N. benthamiana sai. (A) Análise Western blot da proteína GFP após co-infiltração de pBID4-GFP e p19 em diferentes proporções. As amostras recolhidas em 7 dpi (25 ug de peso fresco equivalente folha foi carregada por pista). (B) Uma cultura de Agrobacterium levando pBID4-HAC1 foi misturada individualmente, na proporção de 04:01, com uma cultura levando a p19 ou p23 supressor de silenciamento plasmídeos. As combinações resultantes de culturas de Agrobacterium foram infiltradas a vácuo em plantas. Tecidos infiltrados de HAC1 foram coletados diariamente até 8 dpi para a quantificação de proteínas recombinantes. (C) Estabilidade do banco de células de Agrobacterium. As plantas foram infiltradas com o mesmo lote de banco de células de Agrobacterium cada ano para avaliar a acumulação de proteínas. Cinquenta mg de peso fresco equivalente folha foi carregado por pista. Clique aqui para ver uma versão maior do thé figura.
Discussão
No presente estudo, nós desenvolvemos um protocolo agroinfiltration simples para a produção de proteína transiente rotina em espécies de Nicotiana seleccionados utilizando estirpes de Agrobacterium portadoras do vector de lançamento. Além disso, identificamos as melhores condições para atingir o mais alto nível de produção de proteínas recombinantes em nosso sistema de expressão transitória da planta.
Infiltração de vácuo do A. diluído tumefaciens GV3101 tensão abrigar os pBID4 vetores de lançamento em N. benthamiana, N. excelsiana e N. Excelsior resultou em níveis mais elevados de produção da proteína alvo dentro de 7 dpi em comparação com outras espécies de plantas, tais como Pisum sativum infiltrada com GV3101 abrigando vírus do mosaico da alfafa - ou mosaico do pepino vectores à base de vírus que expressam o gene repórter da GFP sob o promotor 35S 41, ou Lactuca sativa, Solanum LycoPersicum e Arabidopsis thaliana infiltrada com a cepa C58C1 de A. tumefaciens transportando o gene repórter beta-glucuronidase 57. N. benthamiana e N. excelsiana eram fáceis de aspirar infiltrar a 50 mbar para 30-60 segundos, com 90-95% de eficiência de infiltração. Os restantes 5-10% de área foliar não foi infiltrado por causa de alguma flutuação das folhas na superfície da suspensão de Agrobacterium durante a aplicação do vácuo. Uma vez que o vector de lançamento tem capacidade para célula-a-célula de circulação 18, a acumulação de proteína transiente ocorre em folhas inteiras, bem como em pecíolos 7 dpi. Aos 10 dpi, a produção estimada GFP foi um pouco menor, porque o vetor de expressão pBID4 é capaz de se mover de uma célula para outra, mas não se mover sistemicamente 18; por conseguinte, as folhas recentemente cultivadas não contêm o vector e não contribuem para a produção de alvo. Além disso, a degradação da proteína recombinante com o tempo may contribuir para o nível de proteína reduzida a 10 dpi. Os nossos resultados mostraram que a infiltração do A. elevados níveis de Agrobacterium estirpe GV3101 mediadas de produção de proteína transiente em N. benthamiana. Além disso, a proteína alvo pode ser manipulada como, fusões N-terminais C-terminais ou internos para liquenase (LicKM), β-1 ,3-1 ,4-glucanase, que é uma enzima termoestável de Clostridium thermocellum e confere termoestabilidade a muitos alvo proteína de fusão 18. Infiltração de N. benthamiana com A. tumefaciens cepas do tipo selvagem (AT6, AT10 e at77) abrigando o gene de interesse provocou sintomas leves ou graves: ondulação, pecíolo de alongamento, e curling. Sem sintomas patológicos foram observadas em N. benthamiana infiltrada com o GV3101 cepa de laboratório abrigar vazio vetor pBID4, enquanto que alguns genes inseridos em pBID4 e transformado em laboratório cepas GV3101, C58C1 ou LBA4404 provocou reações necróticas suaves e folhaclorose / sintomas de amarelecimento nas regiões infiltradas de folhas. Sintomas necróticas causadas por tipo selvagem Agrobacterium ou cepas desarmados em solanáceas foram relatados anteriormente 56,57. A resposta necrótica pode resultar a partir de factores de virulência do sistema de secreção de tipo III, proteínas de bactérias transferidas para a célula da planta por o sistema de secreção de tipo IV, e / ou sensibilidade de flagelina 58-60. Verificou-se que a produção transiente de proteínas heterólogas podem também induzir patogenicidade e uma resposta de hipersensibilidade em planta infiltrada folhas. Muitos pesquisadores relataram que agroinfiltration de diferentes espécies de plantas com vetores binários de plantas produzidas até 5-20 vezes maiores níveis de produção de proteína transitória, em comparação com as plantas estavelmente transformadas 28,57. Nossos dados mostram que N. benthamiana infiltrada com GV3101 abrigando pBID4-GFP elevados níveis expressos transitoriamente de GFP, a qual é semelhante à relatada para a produção de GFPN. benthamiana infiltrada com Agrobacterium transportando o vector viral Pich-GFPSYS (até 80% da proteína solúvel total) 44. Agroinfiltration usando o lançamento vector resultou em elevada produção da proteína LicKM termoestável, 50 vezes mais elevada do que a observada usando um plasmídeo binário padrão 18.
Para testar a capacidade de infecção de A. tumefaciens e a estabilidade do vector de lançamento, infiltra-se um plano de N. benthamiana a cada hora durante até 8 horas, utilizando o mesmo Milli-Q cultura diluído em água de GV3101 albergando o plasmídeo pBID4-GFP. Nossos dados mostraram que a cepa GV3101 é eficientemente infectante por pelo menos 8 horas e pBID4 (o vetor de lançamento) é muito estável durante o longo 8 hr-infiltração.
Stock de glicerol da estirpe GV3101 abrigando o vector de lançamento pBID4-HAC1 (banco de células), armazenado a -80 ° C foi mostrado ser muito estável durante três anos, sem alterações da prote transientena produção de plantas infiltradas.
Plantas N. benthamiana cultivadas sob condições ideais e entre 35 e 42 dias após a semeadura foram ideal para expressão transitória mediada por infiltração a vácuo gene 40. Plantas jovens (3-4 semanas de idade) não pode ser infiltrada inteiramente devido a folhas que flutuam na superfície da suspensão celular e danos nos tecidos dos efeitos mecânicos de aplicação de um vácuo. Em plantas com mais de 45 dias, a N. benthamiana gazes fase, sob as condições de luz óptimas utilizadas, o nível de expressão transiente é baixo.
Compostos de baixo peso molecular fenólicos (acetoseringona) e monosaccharaides (glicose) são conhecidos por induzir genes vir em A. tumefaciens 55,61. Além disso, a infiltração de N. benthamiana com o vector binário pCAMBIA (GFP), na presença de acetossiringona nas concentrações de 50-600 uM foram mostrados para aumentar ligeiramente transientea expressão do gene 40. Foram estudados os efeitos de diferentes concentrações de acetoseringona e glicose em nosso sistema, adicionando estes compostos para culturas GV3101 abrigando pBID4-GFP no MMA, durante 3 horas, e não encontraram nenhuma diferença na expressão GFP. Curiosamente, as culturas GV3101 albergando pBID4-GFP e diluído em água Milli-Q para um A 600 de 0,5 e infiltradas sem a indução do gene vir expressa as mesmas quantidades de GFP como aqueles infiltrada com culturas induzidas. A A. do gene vir Agrobacterium (s) poderia potencialmente ser induzida por compostos fenólicos de plantas (acetosiringona e ácido sinapinico) e monosaccharaides vegetais (glucose e frutose) presentes no tecido da folha. Portanto, especula-se que os níveis semelhantes de expressão da GFP na presença ou ausência de indutores de genes vir exógenos pode ser um resultado de o efeito de indutores de gene vir citoplasmáticos presentes durante a replicação do vector de lançamento que expressam GFP em células de plantas.
de tipo selvagem N. benthamiana tem sido utilizada como um modelo hospedeiro para a produção da proteína transiente 49. No entanto, relativamente baixa produção de biomassa N. benthamiana 's dificulta a sua aplicação para a produção em larga escala de proteínas recombinantes. O hospedeiro ideal deve combinar um elevado nível de expressão transiente, fácil de crescimento numa estufa, e ser susceptível de Agrobacterium infiltração 2. Para selecionar um hospedeiro alternativo, infiltra-se duas espécies do tipo selvagem diferentes de Nicotiana (N. benthamiana e N. excelsior) e um híbrido N. excelsiana (N. benthamiana × N. Excelsior) com a A. tumefaciens GV3101 estirpe portadora do plasmídeo pBID4-GFP. Entre estas três espécies, o nível de expressão da GFP era ligeiramente maior em N. benthamiana. N. plantas maravalhas mostrou dificuldade em agroinfiltration vácuo, devido às suas folhas coriáceas, e N. excelsianaproduziu aproximadamente duas vezes mais a biomassa sob as mesmas condições de crescimento. A produção transitória da GFP em 7 ppp é relativamente semelhante em N. benthamiana e N. excelsiana. Portanto, N. excelsiana pode ser um hospedeiro mais adequado para produção de proteína recombinante.
Produção de proteína transiente mediada por Agrobacterium é limitado por PTGS 26, que pode ser superada através da co-expressão de silenciamento de genes supressores de origem vírus de planta 62. A produção de proteínas de transientes tem sido mostrado previamente para ser aumentada 50 vezes, na presença da proteína p19 de TBSV, que inibe PTGS em tecidos infiltrados 34. Em nosso estudo, avaliou-se o efeito de dois supressores de silenciamento viral (p19 e p23) separadamente co-infiltrados com o vetor de lançamento pBID4-HAC1. A co-infiltração desses eliminadores de silenciamento pareceu ter pouca influência sobre a expressão transitória de HAC1, com apenas um ligeiro aumento na HAC1acumulação de proteína (15-25%), na presença de co-p23 ou p19 infiltrada. Para efeito positivo na produção de proteína, os supressores de silenciamento pode precisar de ser especificamente seleccionados para ser eficaz para as espécies de plantas alvo e do vetor viral 63. TMV helicase tem um supressor da actividade de RNA silenciamento 64,65. Nossos dados confirmam essa observação como co-infiltração de p23 ou p19 com pBID4-HAC1 não resultou em aumento da GFP ou um ligeiro aumento na produção de proteína HAC1 transitória.
Em conclusão, podemos ter modificado e optimizado para as condições de crescimento da planta e Agrobacterium e melhorou a eficácia de infiltração por vácuo. Esta tecnologia possibilitou a crescer e se infiltrarem de centenas de quilogramas de material de planta em algumas horas. Nós automatizado com sucesso a planta técnica expressão transitória para a produção de vacinas de alto rendimento em escalas industriais sob as Boas Práticas de Fabricação (cGMP) Condições. Para mais informações aboautomação e utilização do transitório sistema de produção de proteína para a produção de proteínas recombinantes, incluindo candidatos a vacinas de subunidades, em condições de cGMP ut, os leitores são encaminhados para o site www.fhcmb.org/ .
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Fraunhofer EUA Centro de Biotecnologia Molecular, iBio, Inc. e de Projetos de Pesquisa Avançada Agência de Defesa (concessão # HDTRA1-07-C-0054). Os autores reconhecem as generosas doações por drs. Stanton Gelvin de Ciências Biológicas Departamento da Universidade Purdue (Agrobacterium tumefaciens cepas) e Wayne Fitzmaurice de Large Scale Biology Corp (N. excelsiana sementes), assim como Jennifer Nicholson of EUA Coleção Nicotiana, North Carolina State University (N. sementes maravalhas ). Os autores agradecem a Margaret Shillingford e Christopher casco para fornecer plantas e excelente assistência técnica. Os autores também agradecer as Dras. Stephen Streatfield e Natasha Kushnir de assistência editorial.
Materiais
| Name | Company | Catalog Number | Comments |
| Nicotiana benthamiana | Tobacco Germplasm Collection, Crop Science Dept., North Carolina State University | PI 555478 TW16 | Infiltration |
| Nicotiana excelsior | Tobacco Germplasm Collection, Crop Science Dept., North Carolina State University | PI 555685 TW47 | Infiltration |
| Nicotiana excelsiana | Dr. Wayne Fitzmaurice, Large Scale Biology Corporation, Vacaville, CA | LSBC EBA 042304.02 | Infiltration |
| Vacuum skid | Abbas, Ashland, MA | Custom made | Plant infiltration |
| Rockwool | Grodan Inc., Ontario, Canada | AO 50/40 | Hydroponic media for growing plant |
| 2-(N-Morpholino) ethanesulfonic acid | Acros Organics, Thermo Fisher Scientific, NJ | 172595000 | Buffer |
| Murashige & Skoog salt (MS salt) | Phyto Technology Lab | M524 | Tissue culture media |
| Acetosyringone | Sigma-Aldrich, St. Louis, MO | D134406-5G | Agrobacterium induction |
| Immobilon-P transfer membrane | Millipore, Billerica, MA | IPVH00010 | Western blotting |
| I-block | Applied Biosystems, Foster City, CA | T2015 | Western blotting |
| Rabbit polyclonal anti-GFP antiserum | Washington Biotechnology, Baltimore, MD | Western blotting | |
| Mouse anti–poly-histidine monoclonal antibody | Qiagen GmbH, Hilden | 34670 | Western blotting |
| Horseradish peroxidase-conjugated anti-rabbit antibody | Jackson ImmunoResearch, West Grove, PA | 111-035-003 | Western blotting |
| Horseradish peroxidase-conjugated anti-mouse antibody | Jackson ImmunoResearch, West Grove, PA | 115-035-003 | Western blotting |
| SuperSignal® West Pico chemiluminescent substrate | Thermo Scientific Pierce, Rockford, IL | 34078 | Western blotting |
| Lichenan (1-3: 1-4-beta-D-glucan) | Megazyme, Bray, Co. Wicklow, Ireland | P-LICHN | Lichenase Activity |
| Congo Red | Sigma-Aldrich, St. Louis, MO | C6277 | Gel staining |
| Digital camera | Olympus, Center Valley, PA | C-8080 | Chemiluminescence imaging |
| GeneGnome | Syngene, Frederick, MD | Chemiluminescence imaging | |
| GFP standard | Made in house | Chemiluminescence imaging | |
| Plant fertilizer solution | Griffin Greenhouse Nursery Supplies, Newark, DE | 67-23-20 | Plant growing |
| Lichenase Standard | Purified in house | Western blotting | |
| MicroPulser Electroporator | BioRad, Hercules, CA | 165-2100 | Agrobacterium transformation |
Referências
- Ma, J. K., Drake, P. M., Christou, P. The production of recombinant pharmaceutical proteins in plants. Nature Reviews Genetics. 4, 794-805 (2003).
- Sheludko, Y. V., Sindarovska, Y. R., et al. Comparison of several Nicotiana species as hosts for high-scale agrobacterium-mediated transient expression. Biotechnology and Bioengineering. 96, 608-614 (2007).
- Mett, V., Farrance, C. E., Green, B. J., Yusibov, V. Plants as biofactories. Biologicals. 36, 354-358 (2008).
- Yusibov, V., Rabindran, S. Recent progress in the development of plant derived vaccines. Expert Review of Vaccines. 7, 1173-1183 (2008).
- Stoger, E., Sack, M., Fischer, R., Christou, P. Plantibodies: Applications, advantages and bottlenecks. Current Opinion in Biotechnology. 13, 161-166 (2002).
- Mahmoud, K. Recombinant Protein Production: Strategic Technology and a Vital Research Tool. Research Journal of Cell and Molecular Biology. 1, 9-22 (2007).
- Rai, M. P. H. Expression systems for production of heterologous proteins. Current Science. 80, 1121-1128 (2001).
- Yusibov, V., Streatfield, S. J., Kushnir, N. Clinical development of plant-produced recombinant pharmaceuticals: vaccines, antibodies and beyond. Human Vaccines. 7, 313-321 (2011).
- McCormick, A. A., Reddy, S., et al. Plant-produced idiotype vaccines for the treatment of non-Hodgkin's lymphoma: Safety and immunogenicity in a phase I clinical study. Proceedings of the National Academy of Sciences of the United States of America. 105, 10131-10136 (2008).
- Medicago Inc, . . , (2013).
- Medicago Inc, . . , (2013).
- Planet Biotechnology Inc, . . , (2013).
- Sys Genetics, S. e. m. B. i. o. . , (2013).
- Protalix, . , (2013).
- Protalix, . , (2013).
- Plesha, M. A., Huang, T. -. K., et al. Optimization of the bioprocessing conditions for scale-up of transient production of a heterologous protein in plants using a chemically inducible viral amplicon expression system). Biotechnology Progress. 25, 722-734 (2009).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Magnification - A new platform for expressing recombinant vaccines in plants. Vaccine. 23, 2042-2048 (2005).
- Musiychuk, K., Stephenson, N., et al. A launch vector for the production of vaccine antigens in plants. Influenza and Other Respiratory Viruses. 1, 19-25 (2007).
- Massa, S., Franconi, R., et al. Anticancer activity of plant-produced HPV16 E7 vaccine. Vaccine. 25, 3018-3021 (2007).
- Mett, V., Lyons, J., et al. A plant-produced plague vaccine candidate confers protection to monkeys. Vaccine. 25, 3014-3017 (2007).
- Mett, V., Musiychuck, K., et al. A plant-produced influenza subunit vaccine protects ferrets against virus challenge. Influenza and Other Respiratory Viruses. 2, 33-40 (2008).
- Shoji, Y., Chichester, J. A., et al. Plant expressed HA as a seasonal influenza vaccine candidate. Vaccine. 26, 2930-2934 (2008).
- Chichester, J. A., Musiychuk, K., et al. Immunogenicity of a subunit vaccine against Bacillus anthracis. Vaccine. 25, 3111-3114 (2007).
- Golovkin, M., Spitsin, S., et al. Smallpox subunit vaccine produced in Planta confers protection in mice. Proceedings of the National Academy of Sciences of the United States of America. 104, 6864-6869 (2007).
- Porta, C., Lomonossoff, G. Use of viral replicons for the expression of genes in plants. Molecular Biotechnology. 5, 209-221 (1996).
- Johansen, L. K., Carrington, J. C. Silencing on the spot: induction and suppression of RNA silencing in the Agrobacterium-mediated transient expression system. Plant Physiology. 126, 930-938 (2001).
- Vézina, L. P., Faye, L., et al. Transient co-expression for fast and high-yield production of antibodies with human-like N-glycans in plants. Plant Biotechnology Journal. 7, 442-455 (2009).
- Vaquero, C., Sack, M., et al. Transient expression of a tumor-specific single-chain fragment and a chimeric antibody in tobacco leaves. Proceedings of the National Academy of Sciences of the United States of America. 96, 11128-11133 (1999).
- Galeffi, P., Lombardi, A., et al. Expression of single-chain antibodies in transgenic plants. Vaccine. 23, 1823-1827 (2005).
- Rodríguez, M., Ramírez, N. I., et al. Transient expression in tobacco leaves of an aglycosylated recombinant antibody against the epidermal growth factor receptor. Biotechnology and Bioengineering. 89, 188-194 (2004).
- Hull, A., Criscuolo, C. J., et al. plant-produced monoclonal antibody for the treatment of anthrax. Vaccine. 23, 2082-2086 (2005).
- Roy, G., Weisburg, S., Rabindran, S., Yusibov, V. A novel two-component Tobacco mosaic virus-based vector system for high-level expression of multiple therapeutic proteins including a human monoclonal antibody in plants. Virology. 405, 93-99 (2010).
- Silhavy, D., Molnar, A., et al. A viral protein suppresses RNA silencing and binds silencing-generated, 21-to 25-nucleotide double-stranded RNAs. EMBO Journal. 21, 3070-3080 (2002).
- Voinnet, O., Rivas, S., Mestre, P., Baulcombe, D. An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus. Plant Journal. 33, 949-956 (2003).
- Bechtold, N., Pelletier, G. In planta Agrobacterium-mediated transformation of adult Arabidopsis thaliana plants by vacuum infiltration. Methods in Molecular Biology. 82, 259-266 (1998).
- Bechtold, N., Ellis, J., Pelletier, G. In planta Agrobacterium mediated gene transfer by infiltration of adult Arabidopsis thaliana plants. C. R. Academy of Science Paris, Life Sciences. 316, 1194-1199 (1993).
- Tague, B., Mantis, J. In planta Agrobacterium-mediated transformation by vacuum infiltration. Methods in Molecular Biology. 323, 223-215 (2006).
- Fischer, R., Vaquero-Martin, C., et al. Towards molecular farming in the future: transient protein expression in plants. Biotechnology and Applied Biochemistry. 30, 113-116 (1999).
- Horn, M. E., Woodard, S. L., Howard, J. A. Plant molecular farming: systems and products. Plant Cell Reports. 22, 711-720 (2004).
- Wydro, M., Kozubek, E., Lehmann, P. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana. Acta Biochimica Polonica. 35, 289-298 (2006).
- Green, B. J., Fujiki, M., et al. Transient protein expression in three Pisum sativum (green pea) varieties. Biotechnology Journal. 4, 1-8 (2009).
- Kapila, J., DeRycke, R., Van Montagu, M., Angenon, G. An Agrobacterium-mediated transient gene expression system for intact leaves. Plant Science. 122, 108-101 (1997).
- Yang, Y., Li, R., Qi, M. In vivo analysis of plant promoters and transcription factors by agroinfiltration of tobacco leaves. Plant Journal. 22, 543-551 (2000).
- Marillonnet, S., Thoeringer, C., Kandzia, R., Klimyuk, V., Gleba, Y. Systemic Agrobacterium tumefaciens-mediated transfection of viral replicons for efficient transient expression in plants. Nature Biotechnology. 23, 718-723 (2005).
- Gleba, Y., Klimyuk, V., Marillonnet, S. Viral vectors for the expression of proteins in plants. Current Opinion in Biotechnology. 18, 134-141 (2007).
- Goodin, M. M., Zaitlin, D., Naidu, R. A., Lommel, S. A. Nicotiana benthamiana: Its history and future as a model for plant-pathogen interactions. Molecular Plant-Microbe Interactions. 21, 1015-1026 (2008).
- Shoji, Y., Bi, H., et al. Plant-derived hemagglutinin protects ferrets against challenge infection with the A/Indonesia/05/05 strain of avian influenza. Vaccine. 27, 1087-1092 (2009).
- Llave, C., Kasshau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97, 13401-13406 (2000).
- McCormick, A. A., Kumagai, M. H., et al. Rapid production of specific vaccines for lymphoma by expression of the tumor-derived single-chain Fv epitopes in tobacco plants. Proceedings of the National Academy of Sciences of the United States of America. 96, 703-708 (1999).
- Simmons, C. W., VanderGheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102, 965-970 (2009).
- Ankenbauer, R. G., Nester, E. W. Sugar-mediated induction of Agrobacterium tumefaciens virulence genes: structural specificity and activities of monosaccharides. Journal of Bacteriology. 172, 6442-6446 (1990).
- Cangelosi, G. A., Ankenbauer, R. G., Nester, E. W. Sugars induce the Agrobacterium virulence genes through a periplasmic binding protein and a transmembrane signal protein. Proceedings of the National Academy of Sciences of the United States of America. 87, 6708-6712 (1990).
- Stachel, S. E., Nester, E. W., Zambryski, P. C. A plant cell factor induces Agrobacterium tumefaciens vir gene expression. Proceedings of the National Academy of Sciences of the United States of America. 83, 379-383 (1986).
- Rogowsky, P. M., Close, T. J., Chimera, J. A., Shaw, J. J., Kado, C. I. Regulation of the vir genes of Agrobacterium tumefaciens plasmid pTiC58. Journal of Bacteriology. 169, 5101-5112 (1987).
- Hiei, Y., Ohta, S., Komari, T., Kumashiro, T. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant Journal. 6, 271-282 (1994).
- Vander Hoorn, J. A. L., Laurent, F., Roth, R., De Wit, P. J. G. M. Agroinfiltration is a versatile tool that facilitates comparative analyses of Avr9/cf-9-induced and Avr4/Cf-4-induced necrosis. Molecular Plant-Microbe Interactions. 13, 439-446 (2000).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assay of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3, 259-273 (2005).
- Salmond, G. P. C. Secretion of extracellular virulence factors by plant pathogenic bacteria. Annual Review of Phytopathology. 32, 181-200 (1994).
- Felix, G., Duran, J. D., Volko, S., Boller, T. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin. Plant Journal. 18, 265-276 (1999).
- Goodner, B., Hinkle, G., et al. Genome sequence of the plant pathogen and biotechnology agent Agrobacterium tumefaciens C58. Science. 294, 2323-2328 (2001).
- Lee, Y. -. W., Jin, S., Sims, W. -. S., Nester, E. W. Genetic evidence for direct sensing of phenolic compounds by the vir A protein of Agrobacterium tumefaciens. Proceedings of the National Academy of Sciences of the United States of America. 92, 12245-12249 (1995).
- Voinnet, O., Pinto, Y. M., Baulcombe, D. C. Suppression of gene silencing: a general strategy used by diverse DNA and RNA viruses. Proceedings of the National Academy of Sciences of the United States of America. 96, 14147-14152 (1999).
- Voinnet, O. RNA silencing as a plant immune system against viruses. Trends in Genetics. 17, 449-459 (2001).
- Ding, X. S., Liu, J., et al. The Tobacco mosaic virus 126-kDa protein associated with virus replication and movement suppresses RNA silencing. Molecular Plant-Microbe Interactions. 17, 583-592 (2004).
- Harries, P. A., Palanichelvam, K., Bhat, S., Nelson, R. S. Tobacco mosaic virus 126-kDa protein increases the susceptibility of Nicotiana tabacum to other viruses and its dosage affects virus-induced gene silencing. Molecular Plant-Microbe Interactions. 21, 1539-1548 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados