Method Article
一時的または恒久的な脳虚血モデルにおける白血球亜集団の立体解析とフローサイトメトリーキャラクタリゼーション
要約
脳卒中後の脳骨髄細胞の特徴づけは、光分留法を用いて、立体解析によって行う、または脳白血球懸濁液のフローサイトメトリー分析により得ることができる。両方は、虚血性脳に見出さ主骨髄細胞サブセットの正確な表現型の区別を行うために有用な技術である。
要約
ミクログリアの活性化、ならびに血行性マクロファージおよび好中球の血管外遊出は、脳卒中後の脳損傷において極めて重要な役割を果たしていると考えられている。これらの骨髄性細胞亜集団は、異なる表現型および機能を表示し、区別する必要があり、組織損傷に対する規制や寄与を研究するために特徴付けられることができる。正確な立体的アプローチとフローサイトメトリー分析:このプロトコルは、脳の免疫細胞の特性評価のための2つの異なる方法を提供します。立体的なアプローチは、系統的ランダムサンプリングによって推定関心領域内のセルの総数(脳梗塞)を算出する光学分留法に基づいている。第二の特徴付けアプローチは、虚血組織の単球および好中球が浸潤し、ミクログリアの特徴付けを可能にする、脳白血球懸濁液を単離し、フローサイトメトリーによってそれらを特徴付けるために簡単な方法を提供する。さらに、それはまた、dは死亡率の低さ、およびカバリエリ法により梗塞体積を特徴づける学的脳処理の手順で再現性の高い梗塞を生成する、もっぱら脳皮質に影響を与えたマウスにおける脳虚血モデルをetails。
概要
形態学、表現型および遺伝子発現ミクログリアの変化、ならびに血管外遊出及び血行性マクロファージおよび好中球の活性化は、脳損傷1-4以下の病態生理学的カスケードに重要な役割を果たしていると考えられている。このプロトコルは、虚血性脳の異なる骨髄細胞サブセットの数を推定するために、それらの表現型の特徴付けを行うために2つのアプローチを提供する。さらに、それはまた、梗塞を評価する方法を含む、両方の遠位の中大脳動脈(MCA)の一時的または永久的な連結および総頸動脈(CCA)で構成されたマウスにおける脳虚血の実験モデルの説明を提供する立体解析ソフトウェアを使用して、正確なカバリエリ法による。
虚血性脳の骨髄細胞サブセットを特徴付けるための最初のアプローチは、光精留塔のアプローチ5に基づいて、立体的な方法である。これは、最もあり一般的に生命科学の立体解析プローブを使用し、エラー5-7の低い係数の高精度を提供します。それが原因のセクションへの組織の断片化の細胞推定上のバイアスを避けるように組織が、セクションに切断されたときにこれは、細胞定量化のための最良の選択である。この方法は、数字、ダイナミクスと虚血組織8の浸潤した好中球の亜集団の表現型の変化を特徴づけるために非常に強力な方法です。
第二の特徴付けアプローチは、脳白血球懸濁液を分離するために、フローサイトメトリーによってそれらを特徴付けるための簡単な方法を提供カンパネラおよび共同研究9から修正されたプロトコルに基づいている。従来の免疫組織化学法とは対照的に、特徴付けフローサイトメトリミクログリアの間(CD45 見よのCD11b +)を微分可能にし、それらの差分に基づいて、骨髄細胞(CD45 ハイのCD11b +)の浸潤CD45 9-13のerent発現レベル。また、炎症促進性単球(CD45 ハイのCD11b + Lyと-6G - Lyの-6C ハイ )、虚血組織の好中球(CD45 ハイのCD11b + Lyと-6G +)及び他の白血球サブセットを区別することができる。このアプローチは、脳虚血の実験モデルにおいて神経炎症を評価するための信頼性が高く、迅速なアッセイを提供する。しかし、組織の処理は、半定量的な特徴付けを提供する虚血組織に見られる異なる細胞集団の活性化状態と数字に影響を与えることができる。
プロトコル
注:(EU指令609分の86 / CEEと65分の2003 / CE以下)大学コンプルテンセの動物福祉委員会のガイドラインに付着した全ての実験プロトコル。
1.脳虚血モデル
注:この論文で脳虚血モデルは、ナイロン縫合糸との連結によるCCA(総頸動脈)とMCA(中大脳動脈)の両方の永続的または一過性の閉塞を伴う。
- 手術前の準備
- オートクレーブによりまたはガラスビーズ滅菌器ですべての手術器具を滅菌する。 70%エタノールで手術領域を消毒にも。
- 適切な麻酔薬でマウスを麻酔。イソフルラン2.5%誘導を達成し、気化器を使用して、80%空気/ 20%酸素の混合物中に1.5%イソフルランで維持する。麻酔下ながら乾燥を防ぐために、マウスの目に人工涙液を適用します。
- 料にリンクされている加熱パッド上にマウスを置きます温度プローブとDBACK装置が直腸内に配置され、生理学的レベル(36.5±0.5℃)の温度に設定し、外科的処置の間。
- ライゲーションによる総頸動脈閉塞
- 背側横臥位でマウスを置き、テープで固定する。 70%エタノールまたはポビドン - ヨウ化物で皮膚を消毒し、上部の腹部分の毛をカット。
- 手術用顕微鏡下では、首の腹面の周りに1cmの正中切開を作る。
- 離れてすべての軟部組織(サブ上顎、舌下および耳下腺などの腺組織)を引いて、気管に横方向のローカライズされて左総頸動脈(CCA)を、特定する。筋肉を撤回し、左CCAを公開。迷走神経から慎重を解剖。
- 一度6/0ナイロン縫合糸を使用して、合字が残したCCAを閉塞し、解剖した。 (一過性脳虚血モデルが望まれる場合には、再灌流を可能にするために)永続的な結び目またはスリップノットと連結する。
- 元の位置に腺組織を置き、6/0ナイロン縫合糸で首の皮膚に切開を閉じます。
注:偽動物をMCAO動物と同じ手術手順に供されるが、CCAが閉塞されていません。
- ライゲーションによる遠位中大脳動脈閉塞
- その右側にマウスを置き、テープで固定する。 70%エタノールまたはポビドン - ヨウ化物と頭皮を消毒し、マウス頭部の髪をカット(切断後の髪を削除します)。
- 手術用顕微鏡下で、目と耳の間の皮膚切開を作る。離れて皮膚を移動し、テープでそれを保持。
- 右から左に頭筋の水平切開を行います。その後、側頭筋の右側に第二の垂直切開する(カット時間的静脈を避けるように注意してください)。頭蓋骨から側頭筋を離れて引いて、きれいな頭蓋骨の表面を維持するために、縫合糸でそれを保持。
- 頭蓋骨の表面を清掃してください冷滅菌生理食塩水で頭蓋骨の透明性を介して、左中大脳動脈(MCA)の正確な位置を検出する。頬骨弓と鱗骨の間の前頭葉におけるステンレス鋼のバリでラウンド開頭術(直径1mm)を実行します。慎重に頭蓋骨を削除し、MCAを公開。
- 脳の表面に冷滅菌生理食塩水を少量を適用し、ピンセットを使って、髄膜(硬膜とくも膜)を削除。
- ちょうど正面と後部MCAの枝の間に分岐する前に遠位トランク内左MCAの結紮を行います。 9/0ナイロン縫合糸を使用して、合字が残したMCAを閉塞。 (一過性脳虚血モデルが望まれる場合には、再灌流を可能にするために)永続的な結び目またはスリップノットと連結する。 CCAとMCA閉塞の間の期間は、オペレータの経験に応じて、約10〜20分である。
- 元の位置に頭筋を配置し、incisioを閉じる6/0ナイロン縫合糸と首の皮膚上にn。
- 麻酔(一般的には5〜10分)から回復し、ブプレノルフィン腹腔内(IP)(0.3ミリグラム/ kg)でマウスを注入するためにケージにマウスを返します。
- (それは胸骨の横臥位を維持するのに十分な意識を取り戻したまでは無人のマウスを残していない)は、任意の不快感を検出するために、いくつかの時間にマウスを監視します。失われた手術後の重量は、一般的に観察されているため、摂食を促進するためにペトリ皿にマッシュ食品を置く。
- 動物が完全に回復した場合、他の動物の会社に戻る。
- 一過性のMCAOモデルが必要な場合は、再灌流(通常0.5〜2時間の間( 図1))を許可するために、再度マウスを麻酔し、CCAとMCAのスリップノットを削除します。
注:偽動物をMCAO動物と同じ手術手順に供されるが、MCAが閉塞されていません。
2.灌流とSecti脳組織のoning
- MCAO後24または48時間、麻酔薬の致死量( 例えば、ペントバルビタールナトリウム、IP 86ミリグラム/ kgまたはイソフルランとの過剰摂取)でマウスを生け贄に捧げる。
- リン酸緩衝液(pH7.4)中4%パラホルムアルデヒド(PFA)、続いてリン酸緩衝液、0.1M、マウスを灌流。
- 次のように脳を削除します。
- ただ脊髄の上に動物を首を切る。
- 頭蓋骨を露出させるために頭部の皮膚上後部-前方切開を行います。側壁の接合部と頭蓋骨の基部に2の横方向のカットを作成し、骨の小片を取り除く。
- 矢状縫合に沿って頭蓋骨を通してカットを行います。
- 脳を露出するために鉗子を使用して、各半球の上にある頭蓋骨を削除します。頭蓋骨から脳を分離し、4%PFA溶液中にそれを転送するためにへらを使用してください。
- 4ºCで4%PFA溶液中で3時間後の修正。
- PFA液とincubatを削除E 30%のショ糖溶液中で48時間の脳は脳をcryoprotectする。
- スクロース溶液を除去し、冷たいイソペンタン(-40℃)で迅速に脳を凍結。 -80ºCで凍結脳に保管してください。
- 凍結ミクロトームで冠状脳切片(30μm)を取得します。凍結保存液に10シリアル·セットを収集します。各シリアルセットは適切にブレグマに1.94と-2.46後部との間のマウスの脳をサンプリングし300μmのinterslice距離の周りに14-16冠状スライスで構成されている。
3.ニッスル染色および梗塞ボリュームの推定
- クレシルバイオレットによるニッスル染色
- スーパーフロスト顕微鏡スライドにマウント脳切片。 7-8セクションのおよそ、総数、ニッスル染色切片でカバリエリ法による梗塞容積の決定のために、20分の1スライスサンプリング分(ステップ2.7収集10シリアルセットのいずれかの1/2セクションを使用600μのinterslice距離が; m)が用いられている。適切な前後方向を維持するように注意してください(梗塞領域が右側に配置されます)。
- 次のように従来のニッスル染色を実行します。
- スライドマウント型の項では、いくつかの時間のために乾燥することができます。
- スライドマウント切片を再水和し、5分間、0.1%クレシルバイオレット溶液で染色する。
- エタノールの段階的な一連の(;変化当たり5分間、70%、90%、および100%)で脱水する。キシレンでスライドマウント型のセクションを清掃し、distrene-80可塑剤キシレン(DPX)マウントメディアを追加し、カバーガラスでカバーしています。
- ニッスル染色した連続切片でカバリエリ法により梗塞体積を推定する立体解析ソフトウェアを使用して、
- (カバリエリ方法14カメラ、XYZ電動コンピュータステージを取り付けた顕微鏡から成る立体解析システム、および立体解析ソフトウェアにより梗塞体積を定量化するために主に表1に示すパラメータを使用以下で提供方向のPCに関連しているが、方向が他のオペレーティングシステム用に異なる可能性がある)。
- 適切な順序でPC、顕微鏡、ステージコントローラとカメラの電源をオンにします。立体解析ソフトウェアを起動します。
- 所定の場所に10倍の対物レンズを移動し、ダウンメニュー客観dropから10倍を選択します。
- 最初のニッスル染色切片の周りに移動し、適切な基準点を見つける。基準点を確立するために、マウスをクリックして(それはアクティブ喜びフリーボタンに必要であるの周りに移動する)。
- 「取り付けられたセクションの厚さ」(考慮に収縮を取って実際の切片厚)を推定する。 「フォーカス位置メーター」ボタンを押して、セクションの下から上に厚さを計算する。
- contralesionalとipsilesionalエリアの輪郭ツールと梗塞領域を作成します。
- メニューの「表示」をクリックし、「画面の設定」を選択します。これは、Tを開く彼は設定ダイアログを表示します。
- 「輪郭タイプを追加 ""輪郭 "タブを選択し、ボタンをクリックします。
- 定量化し、ダウンメニュー輪郭にそれらが見えるようにするために、各地域の輪郭を作成します。 [OK]をクリックします。
- contralesionalとipsilesional半球梗塞エリアのマーカーツールを作成します。
- メニューの「表示」をクリックして、ディスプレイの設定]ダイアログを開くには、「表示設定」を選択します。
- 「マーカー」タブを選択し、利用可能なマーカーの上をダブルクリックして名前を付けたマーカーを変更します。マーカーバーで、それらが見えるように。 [OK]をクリックします。
- 課長をアクティブにします。
- メニュー「ツール/シリアルセクションマネージャー」をクリックします。 「新しいセクション」ボタンで新しいセクションを追加します。このボタンは、「シリアルセクションの設定]ダイアログ」を開きます。
- 30μmのように「ブロックアドバンス」に設定します。設定しステップ3.2.5で推定値との「取り付けられたセクションの厚さ」。
- 20.使用など「評価間隔」を1/20スライスサンプリング割合を設定します。
- 1.セット0。[OK]をクリックとして「最初のセクションのトップのためのZ軸の値」として「始まるセクション番号」を設定してください。
- 対側半球の輪郭を輪郭を描く。
- Contralesional半球ツールを選択し、メニューダウン輪郭から(以前はステップ3.2.6で作成したもの)。
- 対側半球の輪郭を輪郭を描く。
- contralesional半球をトレース終了するには、マウスを右クリックし、「近い輪郭 "を選択します。
- カバリエリによってcontralesional半球輪郭を推定します。
- メニュー「プローブ」をクリックし、カバリエリエスティを選択します。 100μmのように「グリッドの間隔」を設定してください。 0を「Bセットとして「グリッドローテーション」に設定します30ミクロンとして「アドバンスをロックします。 [OK]をクリックします。
- マーカーバーから「contralesional半球」ボタンを選択します。右Contralesional半球輪郭の内側をクリックします。
- 「ペイントカバリエリマーカーモード」を選択します。右再びcontralesional半球輪郭の内側をクリックし、「輪郭にペイントマーカー」を選択します。
- プローブ及びカバリエリエスティをクリックすることでカバリエリ推定を非アクティブマーカーバーからcontralesionalマーカーボタンを無効にします。
- ipsilesional半球と梗塞領域(ステップ3.2.7および3.2.8)に同じ手順を繰り返します。各断面の面積を推定した後にデータを保存します。
- ニッスル染色したセクションの残りの部分では、対側ipsilesionalと梗塞領域を計算します。
- ステップ3.2.6のように新しいセクションを作成します。 「シリアルセクションの設定」ダイアログで入力した値を変更しないでください。 [OK]をクリックします。
- 手順を繰り返して、3.2.7-3.2.8新しいセクションで。
- スプレッドシートファイルへの定量化の結果をエクスポートします。
- ステレオ調査官メニューの「プローブ」をクリックしてください。 「プローブの実行リストを表示」を選択します。これは "前の立体解析がダイアログを実行します」が開きます。
- それらの上をクリックしてすべてのセクションを選択します。 「結果を見る」ボタンを押してください。これは、各地域の推定面積と体積が表示されている「カバリエリ見積もり結果」をオープンします。
- スプレッドシートファイルに結果をエクスポートするには、各領域( 表2)から得られた主な結果をExcelファイルに「クリップボードにすべての結果をコピー」して貼り付け]をクリックします。
- mm 3のように、または、どこ式15%のIH = InfVol / ContrVol * 100を使用して、(%のIH)梗塞である半球の%としてエクスプレス梗塞容積
ContrVol(Contralesional南半球ボリューム)=ΣContrAreaI
光学フラクによる脳虚血後に浸潤した好中球の4立体解析定量
- 脳切片の染色:
- 光学精留塔16でMCAO後に浸潤した好中球の総数を推定するため、10分の1スライスサンプリング画分を使用しています。自由浮遊切片上でラット抗Ly6G抗体(1A8)と右二次抗体と共に、従来の免疫蛍光技術を使用して、免疫染色、好中球。加えて、DAPIまたはTOPROのような核のメーカーとの対比は、好中球の識別のために必要ではないが、梗塞領域を検出するために容易になります。
- 右側に配置された梗塞領域を持つスーパーフロスト顕微鏡スライドにマウント脳切片。
- Quantific光学分留による虚血性脳に浸潤白血球のATION
- 表3に示す使用パラメータは、立体学系を有する光学分留アプローチによって虚血性脳における浸潤白血球を定量化する。手順を繰り返して、3.2.1-3.2.5部3から。
- それはセクション3のステップ3.2.6で説明したように、梗塞領域に対する輪郭ツールを作成する。
- それはセクション3のステップ3.2.7で説明したように、好中球のマーカーツールを作成する。
- 課長をアクティブにしてステップ3.2.8のように新しいセクションを作成します。この場合には、(1/10スライスサンプリング画分は、好中球数を推定するために使用される)10として「評価間隔」に設定。
- 「梗塞領域「輪郭ツールを選択し、メニューダウン輪郭から(以前はステップ4.2.1で作成したもの)。 10倍の対物レンズでの梗塞領域の輪郭を輪郭を描きます。 neutrophを実行するために100Xに目標を変更しますILの定量化(ダウンメニュー客観dropから100Xを選択することを忘れないでください)。
- メニュー「プローブ」をクリックし、「光学フラク」を選択します。 XとYグリッドサイズの両方のための230のように「フレームをカウントするXYの配置」に設定します。 30μmのように「ブロックアドバンス "0セットとして「グリッドローテーション」に設定します。 [OK]をクリックします。
- マーカーバーから「好中球」ボタンを選択します。マークは、梗塞領域に好中球を染色した。フィニッシュ後は、「プローブ」と「光学フラク "をクリックすることで光精留塔プローブを無効にします。マーカーバーから好中球のボタンを無効にします。
- 各セクション(4.2.4-4.2.9)に対して同じ手順を繰り返します。
- スプレッドシートファイルへの定量化の結果をエクスポートします。
- ステレオ調査官メニューの「プローブ」をクリックしてください。 「前の立体解析実行を "開くために「プローブの実行リストを表示する」を選択ダイアログ。
- それらの上をクリックしてすべてのセクションを選択します。好中球の推定数が表示されている「光精留塔結果」を開くには、「結果を見る」ボタンを押してください。
- 「クリップボードにすべての結果のコピー」をクリックしてスプレッドシートファイルに結果をエクスポートし、スプレッドシートファイルに貼り付けます。
5.脳解離及びフローサイトメトリー分析
注:新鮮な脳組織にフローサイトメトリーによる骨髄亜集団の特徴付けを固定し、免疫染色した脳切片上で実行前の好中球の特性化の代替として使用することができる。
- 脳解離および単一細胞懸濁液を調製
- RPMI 8mlの30%パーコールと10×PBS(リン酸緩衝生理食塩水)を1mlの1 mlを含むRPMI(ロズウェルパーク記念研究所培地)-Percoll溶液10ml /動物を作る。
- Rステップ2.3で説明したように、MCAO後にemoveマウス脳。
- 顕微鏡下で、脳から脳虚血性マウスから同側皮質(または偽とナイーブ動物のための類似の領域)のコアおよび梗塞周囲の領域を解剖する。重量脳組織を、氷冷RPMI-パーコール(重量ステップが実験群間の正規化を行うことができる)5mlにそれを置く。
- テフロン乳棒とポッターエルベージェム型組織グラインダーを使用して単一細胞懸濁液に組織を解離する。
- 50ミリリットル超遠心チューブに細胞懸濁液を移し、サンプルにRPMI-パーコール溶液をさらに5ミリリットルを追加します。
- 遠心分離機25ºCで30分間、7800×gで細胞懸濁液。遠心分離の後、ミエリンに対応することを確認白色層は、溶液の上部に表示されます。
- 40μmのナイロンメッシュstraineを通じて、ペレット化細胞を含む、慎重にミエリン層を除去し、全細胞懸濁液をフィルタリングR。
- すべての細胞がフィルタリングされていることを確認し、50ミリリットルチューブ内の溶液を配置するストレーナにRPMIの10ミリリットルを追加します。室温で10分間600×gで細胞懸濁液の50ミリリットルをRPMIの30ミリリットルを加え、遠心。
- 上清を捨て、1mlのPBSで白血球ペレットを懸濁します。溶解緩衝液(150mMのNH 4 Clを、10mMのNaHCO 3及び0.1mMのEDTA)を4mlを加え、細胞懸濁液から赤血球を溶解するために、室温で2~3分間細胞をインキュベートする。遠心機4ºCで10分間600×gでソリューション。
- 細胞染色およびフローサイトメトリー
- 100のFcブロック、1:40抗CD45-PerCPをラット1:40抗Ly6G-APCのラット1:40抗:PBS-BSA(1%)1200μlのを含む、 フローサイトメトリーのためのラベリングカクテルを準備のCD11b-FITCのラットとサンプルあたり1:40抗LY-6C-PEラット。
- ラベリングカクテルで細胞を再懸濁し、氷上で45分間サンプルをインキュベートする。
- ラベリングカクテルを洗う1冷PBS mlの遠心4ºCで10分間600×gで細胞を用いた。 FACSフロー100μlでペレットを再懸濁し、フローサイトメトリーによる全体の細胞懸濁液を取得する。
- 細胞集団を特徴付けるし、定量化する解析ソフトウェアフローサイトメトリーを使用してください。
- CD45 見よのCD11b +:次のように、このプロトコルで調製した標識化カクテルに対応するメイン白血球サブセットを特徴付けることができる常駐ミクログリア細胞。 CD45 こんにちはのCD11b +のLy-6G +:好中球。 CD45 こんにちはのCD11b +のLy-6G - LY-6C のHi:プロ炎症性単球。
結果
ここに示した脳虚血モデルでは、線条体を灌漑MCAのlenticulostriatalブランチが( 図1)閉塞されていないので、線条体組織に影響を与えることなく、皮質において排他的に見られる梗塞を生成します。ニッスル染色により、損傷領域は淡色皮質領域( 図2)として同定することができる。このモデルは、ニッスル染色した切片でキャバリエ法により推定MCAO(%IH 15.89±0.28)( 図2)の後24時間で再現性の高い梗塞量によって特徴付けられる。カバリエリ法による梗塞容積の推定は、contralesionalとipsilesional半球ならびに梗塞領域( 表2)にグンダーセンのエラー(CE)の係数に反映されている低エラーと正確なアプローチです。損傷を受けた組織体積はmm 3でではなく、セクション3.2.13式を使用して、%IHのように表すことができる。加えて、推定ipsilesionalとcontralesional領域の総体積の浮腫指数の計算は、梗塞体積を補正し、損傷を受けた組織( 表2)の過大評価を回避することが可能になる。
脳組織の連続切片の処理を考えると、これは光学フラクアプローチ(図3および表4)を使用して、虚血領域において、浸潤好中球のような細胞集団の総数の正確な推定を行うことの利点を取ることができる表3に示すパラメータを使用して。このプロトコルは、24時間とpMCAOの後のマウスにおける48時間( 図3D)で82856±8143で23328±3623の梗塞領域における好中球の総数(Ly6G陽性細胞)を推定する。以前の研究と一致して、好中球浸潤を直接的に梗塞サイズ( 図3E)と相関している。 Tの推定光精留塔法による好中球の彼数はグンダーセンのCE( 表4)で反射され、低誤差の正確なアプローチです。
白血球の単離および特徴プロトコルフローサイトメトリー虚血マウスのipsilesional半球の皮質から47922±23174骨髄細胞の単離を可能にする。これは細胞懸濁液で見つかった合計イベント10〜30%を占める。このプロトコルを使用して取得されたイベントの大部分は、細胞破片( 図4)に関連する低FSCパラメータを提示する。のCD11b染色のCD11b +細胞が、細胞破片は、それが200 9でFSC閾値を設定することにより、さらなる分析から除外することができ、前述したように、このマーカーで標識されていないことを示唆し、高いFSC値( 図4)を有することを示している。この方法で得られた細胞の破片の可変量は、サンプルプロセスにおける違いを示唆しているる(タイミング、組織保護、試料温度、効率的なミエリンの除去など ) は 、それを考慮することができる。また、セルストレーナーの使用も試料中の細胞クランプの存在を回避するために必要とされる。このステップは、前の細胞染色を行う必要がある。 CD11bおよびCD45の発現に基づき、 図5に示すゲート戦略を使用して、我々は、虚血組織に常駐し、浸潤し、骨髄細胞を識別することができる。ナイーブこれらの細胞は主にCD45の低発現と関連した偽群では、ミクログリアが虚血( 図4、図5および表5)の後に増殖していることを示すと比較して、虚血性半球におけるこれのCD11b +集団の増加。この差は、虚血性脳( 図4のCD11b + CD45 ハイ細胞亜集団の出現によって証明されるように、周囲から起因する細胞浸潤に起因する可能性が高いナイーブでかつ偽脳内の低い数字で、図5および表5)。脳虚血中のCD11b +細胞集団への浸潤の寄与は非常に動的なプロセスである4。結紮によるMCAOモデルでは、病変の特徴付けとが行われた時のサイズに応じて30%から合計のCD11b +細胞の60%まで変化することができる。それらはハイのCD11b + CD45の70〜80%を含みとしてのLy-6G +細胞として特徴付け好中球は、最も多数の浸潤細胞集団は、脳虚血のこのモデルを使用して虚血性マウスの脳においてMCAO後24時間で見出される。 LY-6C ハイテクプロ炎症性単球-細胞の残りはほとんどのCD11b + CD45 ハイテクのLy-6Gの亜集団である。このモデルでは、この集団は、MCAO後24〜48時間後の虚血性脳の領域で数が増加するであろう。
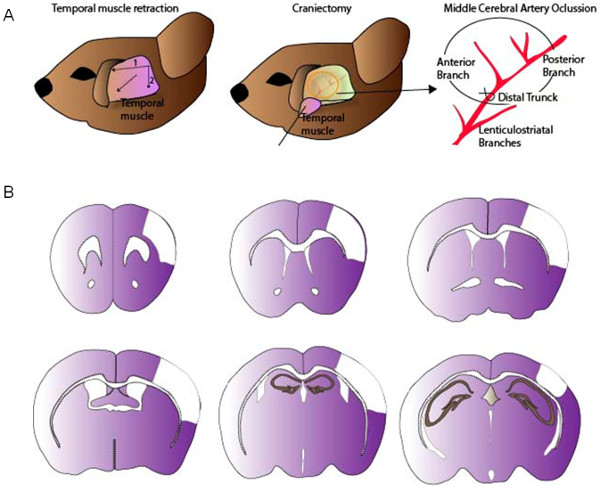
図1:MCA結紮するための外科手順(A)側頭筋の収縮の後、小さな開頭マウスの頭蓋骨で行われる。 MCAは、結び目または9/0縫合糸を使用して、スリップノットて連結されている。(B)MCAOモデルで生成された皮質病変の代表的な画像。 この図の拡大版をご覧になるにはこちらをクリックしてください。
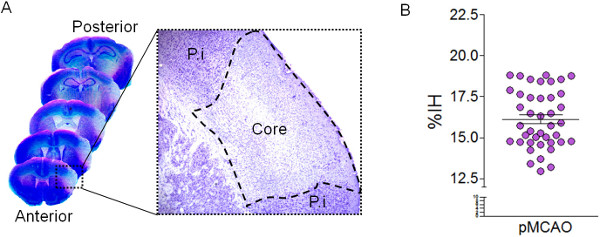
図2:カバリエリによる梗塞容積の定量化。 (A)、ニッスル染色した脳切片の代表的な画像を永久MCA結紮後24時間。高倍率はニッスル染色後hipocromatic領域を示しているMCAO後に損傷領域(コア)を識別します。ペリ-梗塞(PI)領域も示されている。%梗塞半球(%のIH)として表される梗塞体積の(B)定量シリアルニッスル染色した切片でカバリエリ法を用いて、24時間のMCAO後た(n = 50マウス)。
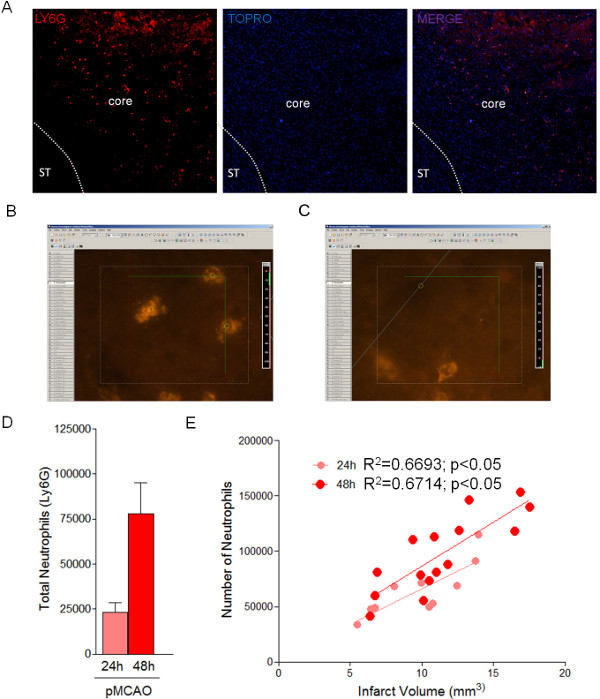
図3:梗塞領域における好中球の立体解析定量24及び48時間ライゲーション後、光学フラク法を用いた。 MCAO後24時間における虚血領域における(A)浸潤好中球(Ly6G陽性細胞)の代表的な画像。区切りは、梗塞面積を示す。(B、C)光分留による好中球の定量化のための光学的解剖器具の例(D)24での梗塞領域における総好中球の定量及び48時間(n = 4のマウス)。(E)梗塞24でのサイズとMCA結紮48時間後に好中球数の相関関係。 この図の拡大版をご覧になるにはこちらをクリックしてください。
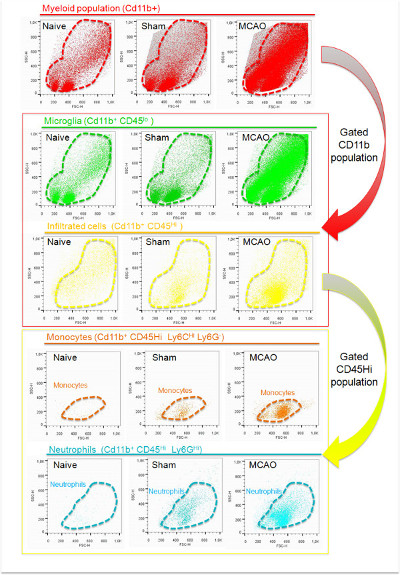
図4:ナイーブ、シャム虚血(MCAO後24時間)から得られた脳の白血球の代表的なドットプロット散乱分析物理的パラメータ(SSCおよびFSC)に基づいて、半球のCD11b(赤)を発現する事象の集団を同定した。すべてのグループで。この集団は、CD45の発現に応じてゲートされ、特徴付けられた。 CD45(緑)の低レベルを発現する細胞は、虚血性および非虚血性大脳皮質に存在し、およびグリア細胞に相当した。対照的に、細胞(黄色)CD45を高レベルで発現するのみであった虚血性半球にし、偽群においてより少ない程度で見つかった。のCD11b + CD45 こんにちは人口のさらなる分析は、脳卒中後24時間に浸透し、好中球(LY-6G +細胞、青)とプロ炎症性単球(LY-6C hi細胞、オレンジ)が脳内で見つかった主な細胞亜集団であることを示しています。 してくださいこの図の拡大版を表示するには、こちらをクリックしてください。
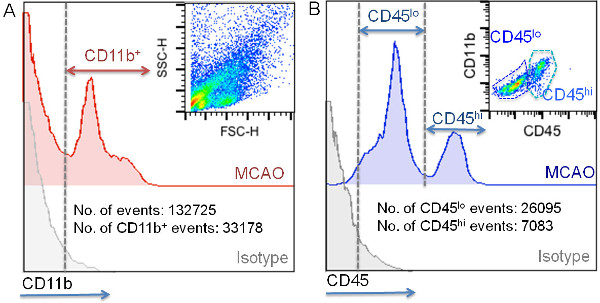
図5:虚血組織に浸潤し、骨髄細胞から居住者を区別するための戦略をゲーはのCD11b +細胞は、まずアイソタイプ蛍光強度(A)に応じてゲートした。虚血性脳の細胞懸濁液の代表的なドットプロットがパネルのアップ右上に示されている。でまた、この技術を用いて取得するイベントの合計数とのCD11b +事象の数の典型的な値は、(図示されない細胞の/虚血脳半球;(A)のCD11b +細胞のCD45蛍光強度解析は、パネルに表示されB.ゲートさのCD11b +亜集団のCD45およびCD11bの表現の代表的なドットプロット解析は、パネルのアップ右上隅に表示されます。また、CD45 LO CD45 hi細胞の典型的な数は、この技術を用いて虚血性脳半球ごとに獲得した(B)に示されている。
| Cavalieriの方法に使用されるパラメータ | |
| 切片厚(T) | 30ミクロン |
| 客観 | 10X |
| スライスサンプリング率(SSF) | 1/ 20 |
| セクション間の距離 | 600ミクロン |
| 格子間隔 | 100ミクロン |
表1:梗塞組織の立体的定量化のために使用されるパラメータ。
| その結果 | Contralesional | Ipsilesional | 梗塞 |
| エリア(μm²) | 151460000 | 155060000 | 2260万 |
| ボリューム(μm³) | 90876000000 | 93036000000 | 135.6億 |
| 音量を補正し プロジェクションオーバー(μm³) | 899.571億 | 92046300000 | の134.166億 |
| エラーの係数(グンダーセン)、 m = 0で | 0.068 | 0.077 | 0.067 |
| エラーの係数(グンダーセン)、 m = 1である | 0.015 | 0.017 | 0.015 |
| エラーの係数(グンダーセン)、 α(q)は | 0.068 | 0.077 | 0.067 |
| %梗塞南半球 | 14.90 | ||
| 脳浮腫(IPS巻/続きの巻) | 1.02 | ||
表2:ステレオ調査官ソフトウェアを使用してカバリエリ法によって、contralesional ipsilesionalおよび梗塞ボリュームの代表的な例。
| 光精留塔のために使用されるスパン= "2"> パラメータ | |
| 切片厚(TSF) | 30ミクロン |
| 客観 | 100X |
| スライスサンプリング率(SSF) | 1/10 |
| フレームの高さを数える | 40ミクロン |
| フレーム幅を数える | 40ミクロン |
| Xグリッドサイズ | 230ミクロン |
| Xグリッドサイズ | 230ミクロン |
| セーフガード | 2ミクロン |
| 光Disector身長 | 14ミクロン |
表3:ステレオ調査官のソフトウェアを用いて光分留プローブと脳虚血後に浸潤した好中球の立体解析定量化のために使用されるパラメータ。
| 光学フラクによる好中球の推定 | |
| サンプリングサイトの数 | 430 |
| ファクター形状 | 6.24 |
| カウント合計マーカー | 166 |
| 光学フラクによって推定好中球 | 117,608.03 |
| エラー(Gundersenの)係数は、m = 0で | 0.22 |
| エラー(Gundersenの)係数はm = 1 | 0.09 |
表4:ステレオ調査官ソフトウェアを使用して、光精留塔プローブを用いた脳虚血後の推定浸潤した好中球の代表的な例。
| のCD11b + | 好中球 | 単球 | 小膠細胞 | |
| 素朴な | 25863±4,575.8 | 473±75.8 | 525±191.4 | 19012±1523 |
| 24時間後にシャム | 24563±5263 | 873±192.5 | 1124±391.5 | 23734±2910 |
| pMCAOの24時間 | 47922±23174 | 4874±748.7 | 4826±1345 | 35395±10833 |
表5:フローサイトメトリーアプローチと脳虚血後の推定骨髄細胞の代表的な結果。
ディスカッション
ここで紹介する脳虚血モデルは、再現性の高い梗塞ボリュームは24〜48時間と異なるアプローチ8,15,17によるMCAの結紮後7日を決定します。このMCAOモデルは、研究で使用された動物の数を最小限に、他と比較して低い死亡率(1%未満)を有する。死亡率のこの低い速度を得るための重要なステップは、卒中誘導後の生存を損なう可能性の感染を避けるために、適切な無菌状態を維持することである。このMCAOモデルができるだけでなく、翻訳の研究18の臨床関連モデルと考えられている永久MCAOモデルとして使用されるだけでなく、スリップノットと後部再灌流とCCAとMCAの一過性のライゲーションによる一過性モデルのような所望の時点で19。この方法は、正常にマウスおよびラット17,20で使用されている。このすべての証拠は、連結によるMCAOは、複数のアプリケーションとの脳虚血の高い汎用性モデルであることを示している。 critiこの技術の校正ステップは、実体顕微鏡下に侵襲的手術を必要とすることである。開頭術は頬骨だけでなく、MCAを損傷しないように、非常に慎重に行われるべきである。しかし、(手術手順に供されるが、CCAとMCA結紮を行わない)偽動物の使用は、外科的処置依存効果を識別するための便利なツールを提供します。この技術は、次の脳損傷の程度は、いくつかの方法によって定量することができる。脳切片、ニッスル染色およびカバリエリによるボリュームの後続の推定の我々のプロトコルは、損傷領域の正確な定量を可能にし、連続脳切片は、異なる免疫組織化学的分析のために使用することができるので、研究のこのタイプに使用されるマウスの数を最小化する。この方法論のパフォーマンスを向上させるために、それは目を推定するために必要となる立体学ソフトウェア( 表1)で使用される適切なパラメータを選択することが重要ですの式により、異なる領域の電子容積:V = 1 / SSFは、* のf *トン*のΣPiが (Ssfをtは切片の平均厚さは、スライスサンプリング画分で、fは格子間隔の領域であり、 ΣP構造に当たる点の数)。
ライゲーションによる遠位MCAOは浸潤白血球および免疫細胞の亜集団脳損傷1-4以下の炎症プロセスに関与8,13を特徴付けるために有用であることができる。ここでは、脳の免疫細胞の特徴付け、正確な立体的アプローチより優れ複数の白血球亜集団を特徴付けるためのフローサイトメトリー分析のための2つの異なる方法を提案する。
連続脳切片を利用して、好中球の総数の定量化は、細胞サンプリング機知の数から細胞の総数を推定する光分留法16によって達成することができるhaの体系的なランダム方向X、YとZの公平な仮想カウント空間の間の一定の間隔でこのメソッドは、に正確なツールを提供し、我々の場合梗塞領域における関心領域全体をカバーする公平な仮想カウントスペースの(SRS)のセットを、サンプリング結紮後の異なる時点での虚血性脳における総好中球数を推定する。それは、本研究で示されていないが、このプロトコルは、虚血21後および他浸潤白血球(単球/マクロファージ)のような虚血性脳で検出された他の細胞集団の正確な定量化のための別の好中球の亜集団を推定するためにも使用することができるまた、生き残った神経細胞を推定するための、さらには脳卒中後の神経新生の定量化のために。ものは、虚血領域における好中球の定量化のために、表3に示すように、所望の領域における正確な推定のための最も重要なステップは、適切なパラメータの選択である。これらのパラメータは、(ΣQ-を用いて計数した細胞の総数N =ΣQ-×1 / SSF×1 / ASFの×1 / TSFの式を用いて、総陽性細胞数(N)を計算するために立体学ソフトウェアのために使用される精留塔は、SSFはASFのサンプリング画領域であり、TSFはサンプリング分の厚さ)5である、節サンプリング率である。この方法は、他の定量化技術よりも遅いものの(例えば、組織、代表的な画像またはフィールド当りの好中球の数の濃度測定の投与による好中球マーカーの分析)は、それが公平かつ正確に提供する固体技法であるという利点を有している細胞数の定量化。
脳白血球分離法は、 インビボでの染色または遺伝子操作することによって、システムのバイアスを必要とすることなく、いくつかの免疫細胞のサブタイプの同時同定及び定量を可能にする。特徴と骨髄Pからソーティングその後の細胞opulationsまたはそれらの免疫磁気分離は、遺伝子又はタンパク質発現に対するさらなる研究のような複数の下流の用途に使用することができる。この方法で得られた好中球、単球及びミクログリアの正確な特性は、免疫組織化学的研究は、脳の先天性免疫応答を媒介する別の骨髄細胞に特定の機能を割り当てることができます利点として、既存の方法に対して高い特異性を提供する。加えて、さらに血液由来マクロファージ(のCD11b + CD45 ハイ CD68 +)のような、適切なラベルと他の脳集団を特徴づけるために拡張することができ、それは、他のCNS 病理または傷害を研究するために適用することができる。したがって、この技術は、脳内の炎症反応の不均一性を探求するために不可欠なツールを提供しています。この技術の主な制限は、変更することができ、新鮮な脳組織から白血球懸濁液の調製に常駐細胞の活性化状態またはそれらの抗原変質。この技術は、免疫組織化学的研究に比べてより詳細な定性的な特性評価を可能にするが、それは細胞の単離に基づいて、より少ない正確な定量を提供しています。それにもかかわらず、我々の細胞単離プロトコルの効率は、他の公開された方法論9と同様であり、それは効率的に制御し、MCAO群の間、あるいは異なる処理8を施しMCAOグループ間の脳の免疫細胞の数の差を検出するために使用することができる。
このプロトコルの重要なステップは、組織切開、組織破壊手順、およびミエリンの除去である。組織収集に関しては、正規化ステップは、異なる解剖性能に起因するばらつきを回避するために、(採取した組織を秤量することによって)を含めることができる。さらに、異なるMCAOグループ間の正規化はまた、梗塞容積を介して起こり得る(以前磁気Rによって決定esonance)。この問題を解決する別の方法は、両方の虚血性群と対照群の全同側半球を使用し、あるいは使用される動物の数を最小化するための対照として、虚血マウスの対側半球を使用することである。このアプローチは、各解剖の違いを回避するが、それは主な欠点を有する。希釈係数は、細胞の総数排他的ではないが、同側皮質のコアおよび梗塞周囲の領域に位置している骨髄細胞の数を増加させることによって付加される。組織破壊に関しては、このプロトコルは、酵素処理を回避し、表面抗原変質9,22、炎症性細胞亜集団の更なる定性的および定量的分析のための必須の問題を防止し、脳細胞の機械的破壊のためのステップを示す図である。目的の細胞懸濁液の調製に加えて、脳試料からミエリン除去downstとの干渉を避けるために非常に推奨されるステップであるそのような免疫細胞分離などの連アプリケーション、またはフローサイトメトリー23,24を流れる。これは、異なる方法、例えば、スクロースまたはパーコール勾配、または抗ミエリンビーズを用いて達成することができる。ここで、および脳細胞懸濁液を単離するための異なる方法を比較した以前の研究に基づいて、ミエリンを除去するパーコールの使用と組み合わせて、機械的な破壊は、細胞収量および生存率25を改善するために使用される。
開示事項
The authors declare that they have no competing financial interests.
謝辞
This work was supported by grants from the Spanish Ministry of Economy and Competitiveness CSD2010-00045 (MAM), SAF2012-33216 (MAM), SAF2011-23354 (IL) and RENEVAS RD06/0026/0005 (IL), and from the Local Government of Madrid S2010/BMD-2336 (MAM) and S2010/BMD-2349 (IL). IB and MIC are fellows of the Spanish Ministry of Economy and Competitiveness.
資料
| Name | Company | Catalog Number | Comments |
| Photonic Led F1 | WPI | 571329-8 | Equipment |
| Temp Controller | Panlab | HB 101/2 | Equipment |
| Volvere GX | NSK | Ne22L | Equipment |
| Microscope | WPI | PZMIII-BS | Equipment |
| Stainless Steel Burrs | FST | 19007-14 | Surgical material |
| Forceps Dumont #5/45 | FST | 11251-35 | Surgical material |
| Forceps Dumont #5SF | FST | 11252-30 | Surgical material |
| Suture 6/0 | LorcaMarin | 55108 | Surgical material |
| Suture 9/0 | LorcaMarin | 61966 | Surgical material |
| Nikon Eclipse | Nikon | TE300 | Equipment |
| Isoflurane | Esteve | 571329-8 | Chemical |
| Sodium Pentobarbital | Vetoquinol | 570681 | Chemical |
| Freezing microtome | Leica Microsystems GmbH | SM2000R | Equipment |
| Superfrost slides | Thermo Scientific | 2014-07 | Lab material |
| Cresyl violet acetate | Sigma | C5042 | Chemical |
| Microscope | Nikon | Nikon Eclipse TE300 | Equipment |
| XYZ motorized computer stage and controller | Ludl electronics Products | Equipment | |
| Stereo Investigator System | Microbrightfield | Version 7.003 software | Software |
| 5 ml Tissue Grinder, Potter-Elv with teflon pestle | Thomas Scientific | 0913X70 | Lab Material |
| Polypropylene 50 ml Oak Ridge Centrifuge Tube | Nalgene | 3119-0050 | Lab material |
| Percoll | Sigma | p1644-100 | Chemical |
| RPMI 1640 | Lonza | BE12-702F | Chemical |
| Beckman Ultracentrifugue | Beckman Coulter | Equipment | |
| Beckman Coulter ultracentrifuge rotor 45 Ti | Beckman Coulter | Equipment | |
| BD Sterile Cell Strainer, 40 Micron | BD | BD 352340 | Lab Material |
| Bovine Serum Albumin | Sigma | A3733-500G | Reagment |
| FcR Blocking Reagent, mouse | Miltenyi | 130-092-575 | Antibody |
| CD11b-FITC, human and mouse | Miltenyi | 130-098-085 | Antibody |
| CD45-PE, mouse | Miltenyi | 130-102-596 | Antibody |
| Anti-Ly-6G-APC, mouse | Miltenyi | 130-102-936 | Antibody |
| PerCP/Cy5.5 anti-mouse Ly-6C | Biolegend | 128012 | Antibody |
| BD FACS Flow | BD | 342003 | Reagment |
| BD FACSCalibur; 4-color | BD | 342975 | Equipment |
| BD Cell Quest Pro Software | BD | Software | |
| FlowJo software | Treestar inc. | Software |
参考文献
- Chamorro, A., et al. The immunology of acute stroke. Nature Reviews. Neurology. 8, 401-410 (2012).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nat Med. 17, 796-808 (2011).
- Ramlackhansingh, A. F., et al. Inflammation after trauma: microglial activation and traumatic brain injury. Annals of Neurology. 70, 374-383 (2011).
- Jin, R., Yang, G., Li, G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells. J Leukoc Biol. 87, 779-789 (2010).
- West, M. J., Slomianka, L., Gundersen, H. J. Unbiased stereological estimation of the total number of neurons in thesubdivisions of the rat hippocampus using the optical fractionator. The Anatomical Record. 231, 482-497 (1991).
- Charleston, J. S. Estimating cell number in the central nervous system by stereological methods: the optical disector and fractionator. Current Protocols in Toxicology. 12 (Unit 12.6), (2001).
- Begega, A., et al. Unbiased estimation of the total number of nervous cells and volume of medial mammillary nucleus in humans. Experimental Gerontology. 34, 771-782 (1999).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARgamma Agonist Rosiglitazone. Stroke; a. Journal of Cerebral Circulation. 44 (12), 3498-3508 (2013).
- Campanella, M., Sciorati, C., Tarozzo, G., Beltramo, M. Flow cytometric analysis of inflammatory cells in ischemic rat brain. Stroke. 33, 586-592 (2002).
- Carson, M. J., Reilly, C. R., Sutcliffe, J. G., Lo, D. Mature microglia resemble immature antigen-presenting cells. Glia. 22, 72-85 (1998).
- Perego, C., Fumagalli, S., De Simoni, M. G. Temporal pattern of expression and colocalization of microglia/macrophage phenotype markers following brain ischemic injury in mice. J Neuroinflammation. 8, 174 (2011).
- Denker, S. P., et al. Macrophages are comprised of resident brain microglia not infiltrating peripheral monocytes acutely after neonatal stroke. Journal of Neurochemistry. 100, 893-904 (2007).
- Ballesteros, I., et al. Rosiglitazone-induced CD36 up-regulation resolves inflammation by PPARgamma and 5-LO-dependent pathways. Journal of Leukocyte Biology. 95 (4), 587-598 (2013).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. J Microsc. 150, 117-136 (1988).
- Hernández-Jiménez, M., et al. Silent Information Regulator 1 Protects the Brain Against Cerebral Ischemic Damage. Stroke. 44 (8), 2333-2337 (2013).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96, 857-881 (1988).
- Godino, M. E. C., et al. Amelioration of ischemic brain damage by peritoneal dialysis. J Clin Invest. 123, 4359-4363 (2013).
- Hossmann, K. A. The two pathophysiologies of focal brain ischemia: implications for translational stroke research. J Cereb Blood Flow Metab. 32, 1310-1316 (2012).
- García-Yébenes, I., et al. Iron overload, measured as serum ferritin, increases brain damage induced by focal ischemia and early reperfusion. Neurochem Int. 61, 1364-1369 (2012).
- Sobrado, M., et al. Synthesis of lipoxin A4 by 5-lipoxygenase mediates PPARgamma-dependent, neuroprotective effects of rosiglitazone in experimental stroke. J Neurosci. 29, 3875-3884 (2009).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARγ Agonist Rosiglitazone. Stroke. 44, 3498-3508 (2013).
- Ford, A. L., Foulcher, E., Goodsall, A. L., Sedgwick, J. D. Tissue digestion with dispase substantially reduces lymphocyte and macrophage cell-surface antigen expression. Journal of Immunological Methods. 194, 71-75 (1996).
- Pfenninger, C. V., et al. CD133 is not present on neurogenic astrocytes in the adult subventricular zone, but on embryonic neural stem cells, ependymal cells, and glioblastoma cells. Cancer Research. 67, 5727-5736 (2007).
- Tham, C. S., Lin, F. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. International Journal of Developmental Neuroscience : the Official Journal of the International Society for Developmental Neuroscience. 21, 431-443 (2003).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9, 147 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved