Method Article
Stereo und Durchflusszytometrie Charakterisierung von Leukozyten-Subpopulationen in Models der vorübergehend oder bleibend zerebrale Ischämie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Gehirn Myeloidzellen Charakterisierung nach Schlaganfall kann durch Stereologie unter Verwendung des optischen Fraktionator Verfahren durchgeführt werden, oder durch eine durchflusszytometrische Analyse von Gehirn Leukozyten Suspensionen. Beide sind nützliche Techniken, um eine genaue phänotypische Unterscheidung der Haupt myeloischen Zellen-Untergruppen in der ischämischen Gehirn führen.
Zusammenfassung
Mikroglia-Aktivierung sowie Austritt von hämatogenen Makrophagen und Neutrophile, wird angenommen, dass eine zentrale Rolle bei Hirnverletzung nach einem Schlaganfall zu spielen. Diese myeloiden Zellpopulationen können verschiedene Phänotypen und Funktionen angezeigt und unterschieden werden müssen und dadurch ihre Regelung und den Beitrag zu Gewebeschäden zu untersuchen. Dieses Protokoll bietet zwei verschiedene Methoden zur Gehirnimmunzellcharakterisierung: eine präzise stereo Ansatz und eine durchflusszytometrische Analyse. Die stereo Ansatz basiert auf der optischen Fraktionator Methode, die die Gesamtzahl der Zellen in einem Bereich von Interesse (infarzierten Gehirn) berechnet durch eine systematische Stichproben geschätzt basiert. Die zweite Charakterisierung Ansatz bietet eine einfache Möglichkeit, Gehirnsuspensionen Leukozyten zu isolieren und durch Strömungs charakterisieren Zytometrie, so dass für die Charakterisierung von Mikroglia infiltriert Monozyten und Neutrophilen des ischämischen Gewebes. Darüber hinaus ist es auch details eine zerebrale Ischämie-Modell bei Mäusen, die ausschließlich betrifft Hirnrinde, die Erzeugung in hohem Maße reproduzierbar Infarkten mit einer niedrigen Rate der Sterblichkeit, und das Verfahren zur histologischen Gehirnverarbeitung Infarktvolumen durch die Cavalieri Methode zu charakterisieren.
Einleitung
Morphologischen, phänotypischen und Genexpression Veränderungen der Mikroglia sowie Extravasation und Aktivierung von hämatogenen Makrophagen und Neutrophile werden geglaubt, um eine zentrale Rolle bei der pathophysiologische Kaskade folgenden Hirnverletzung 1-4 zu spielen. Dieses Protokoll stellt zwei Ansätze, um die Anzahl der verschiedenen myeloiden Zellmengen des ischämischen Hirn schätzen und ihre phänotypische Charakterisierung auszuführen. Darüber hinaus bietet es auch eine Beschreibung von einem experimentellen Modell der zerebralen Ischämie in Mäusen, die der transienten oder permanenten Ligatur der beiden distalen Middle Cerebral Artery (MCA) und der Arteria carotis communis (CCA) besteht, wie es die Infarkt evaluieren durch die genaue Cavalieri Verfahren unter Verwendung eines stereo Software.
Der erste Ansatz zu der ischämischen Hirn charakterisieren myeloischen Zellen-Untergruppen ist ein stereo Methode, die auf der optischen Fraktionator Ansatz 5. Dies ist diegängigen stereo Sonde in den Biowissenschaften und bietet ein hohes Maß an Präzision bei niedrigen Koeffizienten der Fehler 5-7. Dies ist die beste Wahl für die Zell Quantifizierung, wenn das Gewebe in einzelne Abschnitte geschnitten wird, wie es aufgrund der Fragmentierung des Gewebes in Abschnitte vermeidet die Vorspannung an Zellschätzung. Diese Methode ist ein sehr guter Weg, um Zahlen, Dynamik und phänotypischen Veränderungen der Neutrophilen infiltriert Subpopulationen der ischämischen Gewebe 8 zu charakterisieren.
Die zweite Charakterisierung Ansatz basiert auf einem modifizierten Protokoll von Campanella und Mitarbeiter 9, die einen einfachen Weg, um Gehirnsuspensionen Leukozyten zu isolieren und mittels Durchflusszytometrie charakterisiert vorsieht. Im Gegensatz zu herkömmlichen immunhistochemischen Techniken, Durchflusszytometrie charakterisierenden Differenzierung Mikroglia (CD45 lo CD11b +) und infiltrierten myeloiden Zellen (CD45 hallo CD11b +) auf der Grundlage ihrer diffErent Expression von CD45 9-13. Zusätzlich proinflammatorischen Monozyten (CD45 hallo CD11b + Ly-6G - Ly-6C hallo), Neutrophile (CD45 hallo CD11b + Ly-6G +) und andere Leukozyten Teilmengen von dem ischämischen Gewebe unterschieden werden. Dieser Ansatz bietet eine zuverlässige und schnelle Assay Neuroinflammation in experimentellen Modellen der Hirnischämie bewerten. Allerdings kann der Gewebeverarbeitung den Aktivierungszustand und Nummern der verschiedenen Zellpopulationen im ischämischen Gewebe die eine semi-quantitative Charakterisierung gefunden zu beeinflussen.
Protokoll
HINWEIS: Alle Versuchsprotokolle den Richtlinien des Tierschutzkomitee der Universidad Complutense eingehalten (nach EU-Richtlinien 86/609 / EWG und 2003/65 / EG).
1. zerebrale Ischämie Modell
HINWEIS: Der zerebrale Ischämie-Modell in diesem Papier handelt dauerhafte oder vorübergehende Okklusion beider CCA (Arteria carotis communis) und MCA (A. cerebri media) durch Ligation mit einem Nylonfaden.
- Präoperative Vorbereitungen
- Sterilisieren Sie alle chirurgischen Instrumente durch Autoklavieren oder mit einer Glasperle Sterilisator. Desinfizieren Sie den OP-Bereich mit 70% Ethanol als auch.
- Anesthetize Maus mit geeigneten Anästhetika. Erreichen Induktion durch Isofluran 2,5% und Aufrechterhaltung von Isofluran mit 1,5% in einer Mischung aus 80% Luft / 20% Sauerstoff unter Verwendung eines Verdampfers. Künstliche Tränen in die Augen der Mäuse bis zur Trockenheit während der Narkose zu verhindern.
- Platzieren Sie die Maus auf einem Heizkissen, die gegen eine Gebühr verbunden istDBACK Gerät mit während des chirurgischen Eingriffs eine Temperatursonde in das Rektum platziert und Solltemperatur in physiologischen Konzentrationen (36,5 ± 0,5 ° C).
- Arteria carotis communis Okklusion durch Ligation
- Platzieren Sie die Maus in Rückenlage und Immobilisierung mit Klebeband. Desinfizieren Sie die Haut mit 70% Ethanol oder Povidon-Iodid und die Haare des oberen ventralen Teil.
- Unter einem Operationsmikroskop, einen 1 cm Mittellinieninzision ganzen ventralen Oberfläche des Halses.
- Auseinander ziehen alle Weichteile (Drüsengewebe einschließlich der Unterkiefer, sublingual und Ohrspeicheldrüse) und identifizieren Sie die linke A. carotis communis (CCA), die auf die Luftröhre Seiten lokalisiert ist. Fahren Sie die Muskeln und setzen linken CCA. Sorgfältig aus Vagusnerv sezieren.
- Sobald seziert, verschließen Sie die linke CCA durch eine Ligatur mit einem 6/0 Nylonfaden. Ligation mit einer permanenten Knoten oder einem slipknot (Reperfusion ermöglichen, wenn ein transienter zerebraler Ischämie Modell gewünscht wird).
- Stellen Sie das Drüsengewebe in seine ursprüngliche Position und schließen Sie den Schnitt an der Halshaut mit einem 6/0 Nylonfaden.
HINWEIS: Sham Tiere dem gleichen chirurgischen Eingriffs nach MCAO Tieren unterworfen, aber die CCA nicht verstopft.
- Distal mittleren Hirnarterie durch Ligation
- Bewegen Sie die Maus auf der rechten Seite und Immobilisierung mit Klebeband. Desinfizieren Sie die Kopfhaut mit 70% Ethanol oder Povidon-Iodid und die Haare des Mauskopf (entfernen Haare nach dem Schneiden).
- Unter einem Operationsmikroskop, einen Hautschnitt zwischen Auge und Ohr. Bewegen Sie die Haut weg und halten Sie ihn mit Klebeband.
- Einen horizontalen Schnitt auf der Schläfenmuskel von rechts nach links. Dann machen Sie einen zweiten vertikalen Schnitt auf der rechten Seite des M. temporalis (achten Sie darauf, Schnitt zeitlichen Vene zu vermeiden). Auseinander ziehen Schläfenmuskel aus dem Schädel und halten Sie sie mit einer Naht, um eine saubere Kopfoberfläche zu halten.
- Die Schädeloberfläche reinigenmit kalter steriler Kochsalzlösung, um die genaue Position der linken A. cerebri media (MCA) über Schädel Transparenz zu erkennen. Führen Sie eine Runde Kraniotomie (1 mm Durchmesser) mit einem Edelstahl-Grat im Frontallappen zwischen dem Jochbogen und der Schuppenbein. Entfernen Sie vorsichtig den Schädel und setzen die MCA.
- Tragen Sie eine kleine Menge an kaltem sterilen Kochsalzlösung auf die Oberfläche des Gehirns und entfernen Sie die Hirnhaut (Dura und Arachnoidea) mit einer Pinzette.
- Führen Ligatur der linken MCA im distalen Stamm kurz vor der Verzweigung zwischen der frontalen und dorsalen MCA Zweigen. Verschließen Sie den linken MCA durch eine Ligatur mit einem 9/0 Nylonfaden. Ligation mit einer permanenten Knoten oder einem slipknot (Reperfusion ermöglichen, wenn ein transienter zerebraler Ischämie Modell gewünscht wird). Die Zeitspanne zwischen CCA und MCA-Okklusion etwa 10-20 Minuten je nach Erfahrung des Bedieners.
- Setzen Sie den Schläfenmuskel in seine ursprüngliche Position und schließen Sie die incision an der Halshaut mit einem 6/0 Nylonfaden.
- Bringen Sie die Maus, um den Käfig, um aus der Narkose (in der Regel 5 bis 10 min) zu erholen und injizieren Sie die Maus mit Buprenorphin intraperitoneale (IP) (0,3 mg / kg).
- Überwachen Sie die Maus für mehrere Stunden, um alle Beschwerden zu erkennen (nicht die Maus, unbeaufsichtigt lassen, bis er wieder zu sich kam, um ausreichende Brustlage zu halten). Da nach einer Operation an Gewicht verloren wird allgemein beobachtet, legen zerdrückte Nahrung in einer Petrischale zu essen zu erleichtern.
- Wenn das Tier vollständig wiederhergestellt wird, für das Unternehmen von anderen Tieren zurück.
- Wenn eine vorübergehende MCAO-Modell gewünscht wird, betäuben die Maus wieder und entfernen Sie die slipknot des CCA und der MCA der Reperfusion zu ermöglichen (in der Regel zwischen 0,5 bis 2 h (Abbildung 1)).
HINWEIS: Sham Tiere dem gleichen chirurgischen Eingriffs nach MCAO Tieren unterworfen, aber der MCA nicht verstopft.
2. Perfusion und Abschnitenantrieb von Hirngewebe
- 24 oder 48 Stunden nach MCAO, opfern Sie die Maus mit einer letalen Dosis des Anästhetikums (zB Natrium-Pentobarbital, IP 86 mg / kg oder einer Überdosis mit Isofluran).
- Perfundieren der Maus mit Phosphatpuffer 0,1 M, gefolgt von 4% Paraformaldehyd (PFA) in Phosphatpuffer (pH 7,4).
- Entfernen Sie das Gehirn, wie folgt:
- Enthaupten das Tier gerade über dem Rückenmark.
- Machen Sie eine posterior-anterioren Schnitt auf der Haut des Kopfes, um den Schädel freizulegen. Machen Sie zwei seitliche Schnitte an der Kreuzung von den Seitenwänden und der Basis des Schädels und entfernen Sie das Stückchen Knochen.
- Machen Sie einen Schnitt durch den Schädel entlang der Pfeilnaht.
- Entfernen Sie den Schädel über jeder Hemisphäre mit Hilfe einer Pinzette, um das Gehirn aus. Verwenden Sie einen Spachtel, um das Gehirn aus dem Schädel zu trennen und übertragen sie in 4% PFA-Lösung.
- Post-Fix für 3 Stunden in 4% PFA Lösung bei 4 ° C.
- Entfernen PFA-Lösung und INCUBATE das Gehirn 48 Stunden in 30% Saccharose-Lösung, um das Gehirn cryoprotect.
- Entfernen Saccharoselösung und frieren das Gehirn schnell in kaltem Isopentan (-40 ° C). Shop froren Gehirn bei -80 ºC.
- Erhalten koronalen Hirnschnitten (30 um) mit einem Gefriermikrotom. Sammle zehn Seriensätze in einer Kryokonservierungslösung. Jeder serielle Satz von rund 14 bis 16 koronalen Scheiben mit einem Schichtabstand von 300 um, die das Gehirn der Maus ausreichend Probe zwischen 1,94 und -2,46 hinter Bregma zusammen.
3. Nissl Färbung und Infarktvolumen Schätzung
- Nissl-Färbung von Kresylviolett
- Berg Hirnschnitten in eine Superfrost Objektträger. Für das Infarktvolumen durch die bestimmungs Cavalieri Verfahren in Nissl-gefärbte Schnitte, verwenden Sie einen 1/20 Scheibe-Auswahlsatz (1/2 Abschnitte eines der zehn Seriensätze in Schritt 2.7 gesammelt, etwa, eine Gesamtzahl von 7-8 Abschnitten mit einem Schichtabstand von 600 μ; M verwendet werden). Achten Sie darauf, die richtige Vorwärts-Rückwärts-Ausrichtung zu halten (Infarktareal befindet sich in der rechten Seite platziert).
- Führen konventionellen Nissl-Färbung wie folgt:
- Zulassen gleitgelagert Abschnitte für mehrere Stunden trocknen.
- Rehydrieren Objektträger angebrachten Abschnitte und Fleck mit 0,1% Kresylviolett Lösung für 5 min.
- Entwässern mit einer abgestuften Reihe von EtOH (70%, 90% und 100%, 5 Minuten pro Wechsel). Reinigen Sie die Objektträger angebrachten Schnitte mit Xylol, fügen distrene-80 Weichmacher Xylol (DPX) Befestigungsmittel und mit einem Deckglas.
- Mit stereo Software, um das Infarktvolumen durch die Cavalieri Methode schätzen Nissl-gefärbten Schnittserien
- Verwenden in Tabelle 1 gezeigten Parameter Infarktvolumen vom Cavalieri Verfahren 14 und eine Stereologie-System, das von einem Mikroskop mit einer Kamera, einem XYZ motorisierte Rechnerstufe gefügt ist und stereo Software quantifiziert (der HauptAnweisungen unten zur Verfügung gestellt werden, um PCs verwandt, aber die Richtungen könnte für andere Betriebssysteme unterscheiden sich).
- Schalten Sie PC, Mikroskop, Tischsteuerung und Kamera in der richtigen Reihenfolge. Starten Sie den stereo Software.
- Bewegen Sie den 10X Objektiv ein und wählen Sie die 10X vom Ziel Dropdown-Menü.
- Bewegen Sie sich im ersten Nissl-gefärbten Abschnitt und einen geeigneten Bezugspunkt. Klicken Sie auf die Maus, um den Bezugspunkt festzulegen (zu bewegen ist es notwendig, aktiv die Freude freien Taste).
- Schätzen Sie die "montiert Schnittdicke" (die tatsächliche Schnittdicke unter Berücksichtigung der Schrumpfung). Drücken Sie die Taste "Focus Position Meter" und berechnen Sie die Dicke von unten nach oben in der Sektion.
- Erstellen Sie eine Kontur Werkzeug für die kontraläsionalen und ipsilesional Bereiche und der Infarktareal.
- Klicken Sie auf das Menü "Anzeige" und wählen Sie "Anzeigeeinstellungen". Dies eröffnet ter Anzeige Einstellungsdialog.
- Wählen Sie die Registerkarte "Konturen" und klicken Sie auf die Schaltfläche "Hinzufügen Konturtyp".
- Erstellen Sie eine Kontur für jede Region zu quantifizieren und sie in der Kontur-Down-Menü sichtbar. Klicken Sie auf OK.
- Erstellen Sie eine Marker-Tool für die kontraläsionalen und ipsilesional Hemisphären und der Infarktareal.
- Klicken Sie auf das Menü "Anzeige" und wählen Sie "Anzeigeeinstellungen", um das Dialoganzeigeeinstellungen zu öffnen.
- Wählen Sie die Registerkarte "Markierungen" und ändern Sie die Markierungen durch einen Doppelklick auf die verfügbaren Marker zu nennen. Machen Sie in der Marker-Bar sichtbar. Klicken Sie auf OK.
- Aktivieren Sie den Bereich Manager.
- Klicken Sie auf das Menü "Extras / Serielle Section Manager". Fügen Sie einen neuen Abschnitt mit dem "neuen Abschnitt" Taste. Diese Schaltfläche öffnet das "Serial Abschnitt Setup-Dialog".
- Stellen Sie den "Block Voraus" als 30 um. Stellen Sie die"Montiert Schnittdicke" mit dem in dem Schritt 3.2.5 Schätzwert.
- Stellen Sie die "Evaluation Interval" als 20. Verwendung eines 1/20 Scheibe Auswahlsatz.
- Set "den Startabschnittsnummer" als 1. Stellen Sie die "Z-Achse Wert für den oberen Rand des ersten Abschnitts" als 0. Klicken Sie auf OK.
- Zeichnen Sie eine Kontur, die kontralateralen Hemisphäre zu skizzieren.
- Wählen Sie das kontraläsionalen Hemisphäre Werkzeug die Kontur Down-Menü (die zuvor in dem Schritt 3.2.6 erstellt).
- Zeichnen Sie eine Kontur, die kontralateralen Hemisphäre zu skizzieren.
- Zum Abschluss Verfolgung der kontraläsionalen Hemisphäre der rechten Maustaste der Maus und wählen Sie "Kontur schließen".
- Schätzen Sie die kontraläsionalen Hemisphäre Kontur durch Cavalieri.
- Klicken Sie auf das Menü "Probes" und wählen Cavalieri Estimator. Stellen Sie "Rasterabstand" als 100 um. Stellen Sie "Grid Rotation" als 0. Setzen Sie den "BVoraus sperren "als 30 um. Klicken Sie auf OK.
- Wählen Sie "The kontraläsionalen Hemisphäre" -Taste aus dem Marker Bar. Rechtsklick innerhalb der Kontur kontraläsionalen Hemisphäre.
- Wählen Sie "Paint Cavalieri Marker-Modus". Direkt im kontraläsionalen Hemisphäre Kontur klicken Sie erneut auf und wählen Sie "Paint-Marker in die Kontur".
- Deaktivieren Cavalieri Estimator, indem Sie auf Sonden und Cavalieri Estimator und deaktivieren Sie die kontraläsionalen Marker-Taste aus der Markerleiste.
- Wiederholen Sie diesen Vorgang für die ipsilesional Hemisphäre und der Infarktareal (Schritte 3.2.7 und 3.2.8). Speichern der Daten nach der Schätzung der Fläche von jedem Abschnitt.
- Berechnen Sie die Gegenseite, ipsilesional und Infarktbereiche in den Rest der Nissl-gefärbten Abschnitt.
- Erstellen Sie einen neuen Abschnitt, wie in Schritt 3.2.6. Die in der "Serial Abschnitt Setup" Dialogfeld eingegebenen Werte nicht verändern. Klicken Sie auf OK.
- Wiederholen Sie die Schritte 3.2.7-3.2.8 im neuen Teil.
- Exportieren Sie die Ergebnisse der Quantifizierung in ein Tabellenkalkulationsdatei.
- Klicken Sie auf "Probes" im Stereo Investigator Menü. Wählen Sie "Display Sonde Run List". Es öffnet sich der "Vorherige stereo Läuft Dialog".
- Wählen Sie alle Abschnitte, indem Sie über sie. Drücken Sie die "Ergebnisse" Button. Dies eröffnet "das Cavalieri Estimator Ergebnisse", wo die geschätzte Fläche und das Volumen für jede Region werden angezeigt.
- Um die Ergebnisse in eine Tabellenkalkulation-Datei zu exportieren, klicken Sie auf "Kopieren Sie alle Ergebnisse in die Zwischenablage" und fügen Sie in eine Excel-Datei mit den aus jeder Region (Tabelle 2) wichtigsten Ergebnisse.
- Express Infarktvolumen mm 3 oder als% der Halbkugel, die mit der Formel 15% IH = InfVol / ContrVol * 100, wobei Infarkt ist (% IH)
ContrVol (kontraläsionalen Hemisphäre Volume) = ΣContrArea i
4. stereo Quantifizierung der infiltrierte Neutrophile nach zerebraler Ischämie durch die Optical Fractionator
- Färbung der Gehirnschnitte:
- Für die Schätzung der Gesamtzahl der Neutrophilen infiltriert nach MCAO durch die optische Fraktionator 16, mit einem 1/10 Scheibe Auswahlsatz. Immunostain Neutrophilen unter Verwendung von herkömmlichen Immunfluoreszenztechniken mit der Ratte anti-Ly6G Antikörper (1A8) und der rechten sekundären Antikörpers auf frei schwebenden Abschnitte. Zusätzlich ist eine Gegenfärbung mit einem Kernhersteller wie DAPI oder TOPRO, obwohl es nicht für die Neutrophilen Identifikations Bedarf erleichtern können, um die Infarktbereichs zu detektieren.
- Halterung Hirnschnitten in einen Superobjektträger mit dem Infarktbereich in der rechten Seite angeordnet.
- Quantification des infiltrierten Leukozyten in der ischämischen Hirn durch die optische Fraktionator
- In Tabelle 3 gezeigten Nutzungskenngrößen zu infiltrierenden Leukozyten im ischämischen Gehirn durch die optische Fraktionator Ansatz mit einer stereo System quantifizieren. Wiederholen Sie die Schritte aus dem Abschnitt 3.2.1-3.2.5 3.
- Erstellen Sie eine Kontur Werkzeug für die Infarktareal, wie es in dem Schritt 3.2.6 des Abschnitts 3 beschrieben.
- Erstellen Sie eine Marker-Tool für Neutrophile, wie es in dem Schritt 3.2.7 des Abschnitts 3 beschrieben.
- Aktivieren Sie den Bereich Manager und erstellen Sie einen neuen Abschnitt wie in dem Schritt 3.2.8. In diesem Fall stellen Sie die "Evaluation Interval", wie in 10 (a 1/10 Scheibe Auswahlsatz wird zur Schätzung der Neutrophilen-Nummer verwendet wird).
- Wählen Sie den "Infarktareal" Kontur Werkzeug die Kontur Down-Menü (die zuvor in dem Schritt 4.2.1 erstellt). Zeichnen Sie eine Kontur um das Infarktareal zu 10X-Objektiv zu skizzieren. Ändern Sie das Ziel, 100X, um neutroph führenil Quantifizierung (vergessen Sie nicht, um die 100X vom Ziel im Dropdown-Menü auswählen).
- Klicken Sie auf den Menüpunkt "Probes" und wählen Sie die "Optical Fractionator". Stellen Sie die "XY Platzierung Zählen Frames" als 230 sowohl für die X- und Y-Rastergröße. Stellen Sie "Grid Rotation" als 0 Stellen Sie den "Block Voraus" als 30 um. Klicken Sie auf OK.
- Wählen Sie den "Neutrophilen" -Taste aus der Markierung Bar. Mark befleckt Neutrophilen im Infarktareal. Sobald Finish, deaktivieren Sie die Optical Fractionator Sonde, indem Sie auf "Probes" und "Optical Fractionator". Deaktivieren Sie die Neutrophilen-Schaltfläche aus der Markerleiste.
- Wiederholen Sie diesen Vorgang für jeden Abschnitt (4.2.4-4.2.9).
- Exportieren Sie die Ergebnisse der Quantifizierung in ein Tabellenkalkulationsdatei.
- Klicken Sie auf "Probes" im Stereo Investigator Menü. Wählen Sie "Anzeige Sonde Run List", um die "Vorherige stereo Runs" zu öffnenDialog.
- Wählen Sie alle Abschnitte, indem Sie über sie. Drücken Sie die "Ergebnisse" Button zu öffnen "die optische Fractionator Ergebnisse", wo die geschätzte Zahl der Neutrophilen wird angezeigt.
- Exportieren Sie die Ergebnisse in eine Tabellenkalkulationsdatei mit der Schaltfläche "Kopieren Sie alle Ergebnisse in die Zwischenablage" und fügen Sie in ein Tabellenkalkulationsdatei.
5. Hirn Dissoziation und Durchflusszytometrie-Analyse
HINWEIS: Myeloid Subpopulation Charakterisierung mittels Durchflusszytometrie auf frischen Hirngewebe kann als Alternative zu der vorherigen Neutrophilen Charakterisierung auf feste und immunGehirnSchnitte, verwendet werden sollen.
- Gehirn-Dissoziation und Einzelzellsuspension Vorbereitung
- Make 10 ml / Tier einer RPMI (RPMI) -Percoll Lösung, die 8 ml RPMI, 1 ml von 30% Percoll und 1 ml einer 10x PBS (phosphatgepufferte Salzlösung).
- Remove Mausgehirn nach MCAO wie in Schritt 2.3 beschrieben.
- Unter dem Mikroskop seziert aus Kern und peri-Infarktbereiche des ipsilateralen Kortex von ischämischen Gehirn der Maus (oder einer ähnlichen Region für Schein und naive Tiere) aus dem Gehirn. Gewicht Hirngewebe und legen Sie sie in 5 ml eiskaltem RPMI-Percoll (das Gewicht Schritt kann zur Normalisierung zwischen experimentellen Gruppen durchgeführt werden).
- Distanzieren das Gewebe in eine Einzelzellsuspension mit einer Gewebemühle Potter-Elvehjem-Typ mit Teflon-Pistill.
- Übertragen Zellsuspensionen auf eine 50 ml Ultrazentrifugenröhrchen eingewogen und 5 weitere ml RPMI-Percoll-Lösung zu den Proben.
- Zentrifugiere die Zellsuspension bei 7.800 g für 30 min bei 25 ºC. Nach dem Zentrifugieren sicherzustellen eine weiß gefärbte Schicht entsprechend Myelin an der Oberfläche der Lösung angezeigt.
- Entfernen Sie die Myelinschicht sorgfältig und filtern Sie die gesamte Zellsuspensionen, darunter die pelletierten Zellen, durch 40 & mgr; m Nylon-Mesh strainer.
- 10 ml RPMI auf dem Sieb, um sicherzustellen, dass alle Zellen filtriert und setzen die Lösung in ein 50 ml Röhrchen. 30 ml RPMI und die Zentrifuge 50 ml Zellsuspension bei 600 · g für 10 min bei RT.
- Überstand verwerfen und resuspendieren Leukozyten-Pellet mit 1 ml PBS. 4 ml Lysepuffer (150 mM NH 4 Cl, 10 mM NaHCO 3 und 0,1 mM EDTA) und Inkubieren der Zellen für 2-3 Minuten bei Raumtemperatur an die Erythrozyten aus der Zellsuspension zu lysieren. Zentrifugieren der Lösung bei 600 · g für 10 min bei 4 ° C.
- Zellfärbung und Durchflusszytometrie
- Bereiten Sie eine Kennzeichnung Cocktail für die Durchflusszytometrie, das 200 ul PBS-BSA (1%) 1: 100 Fc-Block, 01.40 Anti-CD45-PercP Ratte, 01.40 Anti Ly6G-APC Ratte, 01.40 Anti CD11b-FITC Ratte und 01.40 anti-Ly-6C-PE Ratte pro Probe.
- Die Zellen in der Kennzeichnung Cocktail und die Proben unter 45 min in Eis.
- Waschen Sie die Kennzeichnung Cocktailmit 1 ml kaltem PBS und Zentrifugation der Zellen bei 600 g für 10 min bei 4 ºC. Das Pellet mit 100 ul FACS Fluss und erwerben die gesamte Zellsuspension durch Durchflusszytometrie.
- Verwenden Sie eine Durchflusszytometrie-Analyse-Software zu charakterisieren und zu quantifizieren Zellpopulationen.
- CD45 lo CD11b +:: Haupt Leukozyten-Untergruppen entsprechend der Kennzeichnung Cocktail in diesem Protokoll hergestellt werden, können wie folgt charakterisiert werden ansässigen Mikroglia-Zellen; CD45 hallo CD11b + Ly-6G +: Neutrophile; CD45 hallo CD11b + Ly-6G - Ly-6C hallo: pro-inflammatorischen Monozyten.
Ergebnisse
Die hier gezeigte zerebrale Ischämie-Modell erzeugt Infarkte ausschließlich in der Hirnrinde zu sehen, ohne die striatalen Gewebe, da die lenticulostriatal Zweige der MCA, die das Striatum zu bewässern sind nicht verschlossen (Abbildung 1). Nissl-Färbung, kann der beschädigte Bereich als hypo kortikalen Bereich (Figur 2) identifiziert werden. Dieses Modell wird von in hohem Maße reproduzierbar Infarktvolumen bei 24 h nach MCAO (% IH 15,89 ± 0,28) von Cavalieri Verfahren in Nissl-gefärbten Schnitten geschätzt (Abbildung 2) aus. Schätzung der Infarktvolumen nach Cavalieri Verfahrens ist eine genaue Vorgehensweise mit geringem Fehler, der in dem Koeffizienten der Fehler (CE) von Gundersen in kontraläsionalen und ipsilesional Hemisphären sowie im Infarktareal (Tabelle 2) reflektiert wird. Geschädigte Gewebe Volumen in mm 3, sondern auch als% IH unter Verwendung der Formel in dem Abschnitt 3.2.13 ausgedrückt werden. Darüber hinaus ist die Abschätzungdes Gesamtvolumens der ipsilesional und kontraläsionelle Regionen ermöglicht die Berechnung der Ödemindex um das Infarktvolumen zu korrigieren und eine Überschätzung des geschädigten Gewebes (Tabelle 2) zu vermeiden.
Angesichts der Serienschnitt Verarbeitung des Gehirngewebe, kann dies ausgenutzt werden, um eine genaue Schätzung der Gesamtzahl der Zellpopulationen durchzuführen, wie infiltrierten Neutrophilen in den ischämischen Bereich, unter Verwendung des optischen Fractionator Ansatz (Abbildung 3 und Tabelle 4) mit den in Tabelle 3 gezeigten Parameter. Dieses Protokoll schätzt eine Gesamtzahl der Neutrophilen (Ly6G-positive Zellen) in der Infarktfläche von 23.328 ± 3.623 bei 24 h und 82.856 ± 8.143 bei 48 h bei Mäusen nach pMCAO (Figur 3D). In Übereinstimmung mit früheren Studien wird Neutrophilinfiltration direkt mit der Infarktgröße (3E) korreliert. Die Einschätzung der ter Anzahl der Neutrophilen von der Optical Fractionator Verfahrens ist eine genaue Vorgehensweise mit geringem Fehler, der durch das CE von Gundersen (Tabelle 4) reflektiert wird.
Die Leukozyten-Isolierung und Durchflusszytometrie Charakterisierung Protokoll erlaubt die Isolierung von 47.922 ± 23.174 myeloischen Zellen aus der Rinde der ipsilesional Hemisphäre ischämischer Mäusen. Diese 10-30% der gesamten Ereignisse in der Zellsuspension vorhanden. Der Großteil der erfassten Ereignisse mit diesem Protokoll gegenwärtig eine niedrige FSC-Parameter, um Zelltrümmer zu (Abbildung 4) assoziiert. CD11b-Färbung zeigt, dass CD11b + Zellen eine höhere FSC Wert (Figur 4), was darauf hindeutet, dass Zelltrümmern wird mit diesem Marker markiert und, wie zuvor angegeben, daß sie von einer weiteren Analyse durch Setzen des FSC Schwelle bei 200 9 ausgeschlossen. Der variable Anteil der Zelltrümmer mit diesem Verfahren erhalten lässt vermuten, dass Unterschiede auf Beispielprozessing (Timing, Gewebeschutz, Probentemperatur, effiziente Myelinentfernung, etc.) können zur Rechenschaft ziehen. Darüber hinaus wird die Verwendung von Zellsiebe auch notwendig, um das Vorhandensein von zellulären Klemmen in den Proben zu vermeiden; Dieser Schritt muss vor Zellfärbung durchgeführt werden. Mit der Gating-Strategie in der Abbildung 5, die an CD11b und CD45-Expression auf der Grundlage angezeigt wird, können wir zwischen gebietsansässigen und infiltriert myeloischen Zellen im ischämischen Gewebe zu unterscheiden. Diese CD11b + Bevölkerungszunahme im ischämischen Hemisphäre, wenn sie mit der naiven und mit der Scheingruppe, in der diese Zellen sind meist auf einer niedrigen Expression des CD45 assoziiert anzeigt, dass Mikroglia nach Ischämie proliferierenden (Figur 4, Figur 5 und Tabelle 5) verglichen wird . Dieser Unterschied ist wahrscheinlich auf die Zellinfiltration von dem Umfang, wie durch das Erscheinen einer CD11b + CD45 hallo Zellsubpopulation im ischämischen Gehirn nachgewiesen (Abbildung 4, Abbildung 5 und Tabelle 5), die geringe Anzahl in naiv und in Schein Gehirn ist. Der Beitrag der Infiltrate zum CD11b + Zellpopulation in Hirnischämie ist ein sehr dynamischer Prozess 4. Im MCAO-Modell durch die Ligatur, kann es von 30% bis 60% der Gesamt CD11b + Zellen in Abhängigkeit von der Größe der Läsion und der Zeit, wenn die Charakterisierung wurde getan variieren. Neutrophile, gekennzeichnet als Ly-6G + Zellen am stärksten vertreten sind infiltriert Zellpopulation bei 24 h nach MCAO gefunden in der ischämischen Gehirn der Maus mit diesem Modell von zerebraler Ischämie, da sie die 70-80% des CD11b + CD45 umfassen hallo. Der Rest der Zellen sind meist eine Subpopulation von CD11b + CD45 hallo Ly-6G - Ly-6C hallo pro-inflammatorischen Monozyten. In diesem Modell, diese Population wird in Reihe in den ischämischen Gehirnbereichen 24 bis 48 h nach MCAO erhöhen.
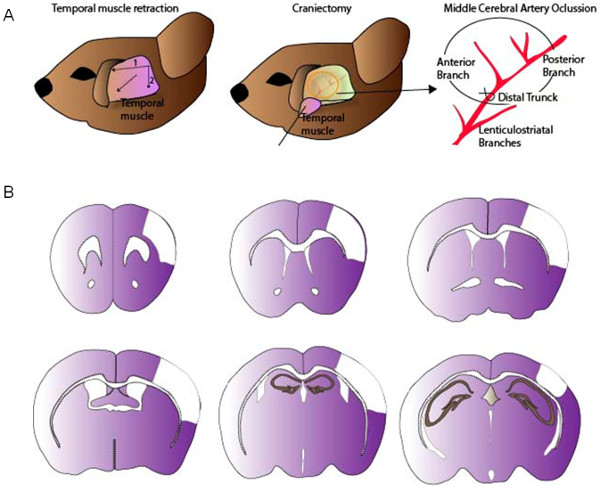
Abb. 1: Die chirurgische Verfahren für die MCA-Ligation (A) nach dem Zurückziehen des Schläfenmuskels wird eine kleine Kraniotomie im Mausschädelgeführt. MCA wird durch einen Knoten oder eine slipknot mit einem 9/0 Naht ligiert. (B) Repräsentative Bilder der kortikalen Läsionen durch die MCAO-Modell generiert. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
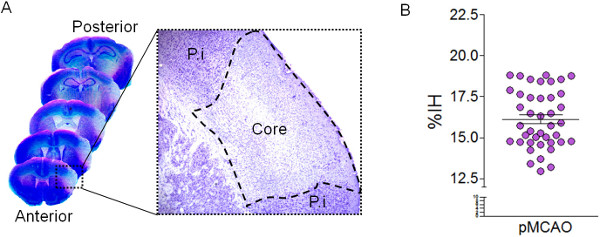
Abbildung 2: Quantifizierung der Infarktvolumen von Cavalieri. (A) Repräsentative Bilder der Nissl-gefärbten Hirnschnitten 24 Stunden nach der Dauer MCA Ligation. Die hohe Vergrößerung zeigt die hipocromatic Bereich nach Nissl-Färbung dieidentifiziert den beschädigten Bereich (Kern) nach MCAO. Die (PI) Region Peri-Infarkt ist ebenfalls dargestellt. (B) Quantifizierung der Infarktvolumen mit der Cavalieri Verfahren in Serien Nissl-gefärbten Schnitten, 24 h nach MCAO (n = 50 Mäuse als% Infarkt Hemisphäre (% IH) vertreten ).
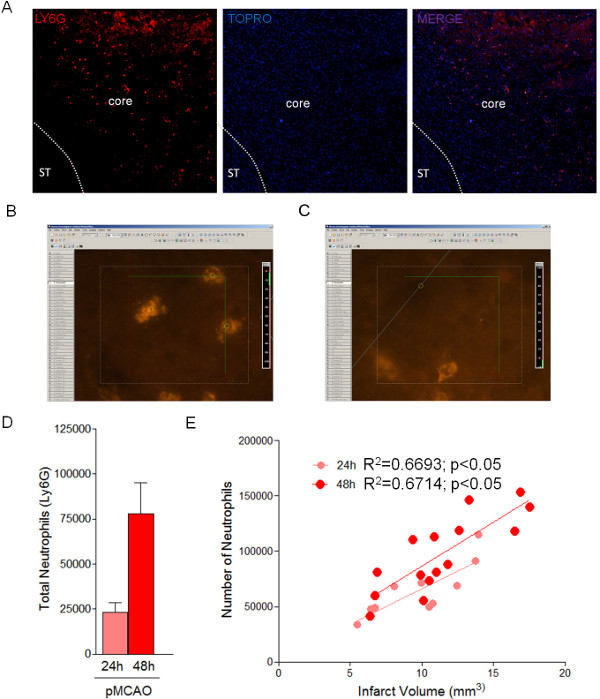
Abbildung 3: stereo Quantifizierung von Neutrophilen im Infarktareal 24 und 48 Stunden nach der Ligation mit dem Optical Fractionator Verfahren. (A) Repräsentatives Bild infiltriert Neutrophilen (Ly6G-positiven Zellen) in den ischämischen Bereich bei 24 h nach MCAO. Abgrenzung zeigt die Infarktareal. (B, C) Beispiele eines optischen Dissektor für neutrophile Quantifizierung mittels optischen Fraktionator. (D) Quantifizierung der gesamten Neutrophilen im Infarktbereich 24 und 48 h (n = 4 Mäuse). (E)Die Korrelation der Zahl der Neutrophilen mit der Infarktgröße 24 und 48 Stunden nach MCA Ligation. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
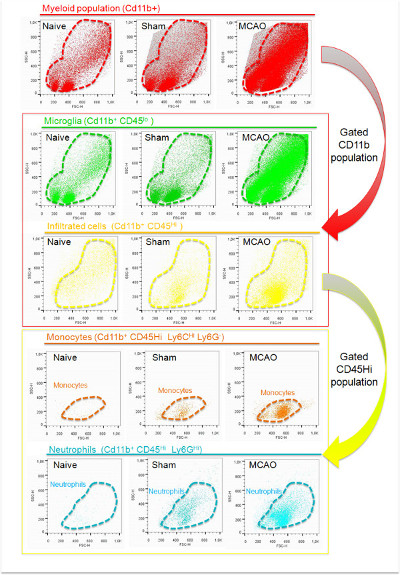
Abb. 4: Repräsentative Dot-Plot Scatter Analyse der Gehirn Leukozyten aus naiven, Schein und ischämische (24 h nach MCAO) Halbkugeln auf der Basis von physikalischen Parametern (SSC und FSC) erreicht eine Population von Ereignissen, die CD11b (rot) zum Ausdruck identifiziert in allen Gruppen. Diese Population wurde nach der Expression von CD45 gated und charakterisiert. Zellen exprimieren geringe Mengen an CD45 (grün) wurden in den ischämischen und nicht-ischämischen Hirnkortex vorhanden und entsprach Mikrogliazellen. Im Gegensatz dazu zeigten Zellen, die große Mengen von CD45 (gelb) nurin der ischämischen Hemisphäre und in geringerem Maße in der Sham-Gruppe gefunden. Die weitere Analyse der CD11b + CD45 hallo Population zeigt an, dass Neutrophile (Ly-6G + Zellen, blau) und pro-inflammatorische Monozyten (Ly-6C hallo Zellen, Orange) sind die Hauptzellpopulationen in Gehirn eindringt 24 Stunden nach dem Schlaganfall. Bitte Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
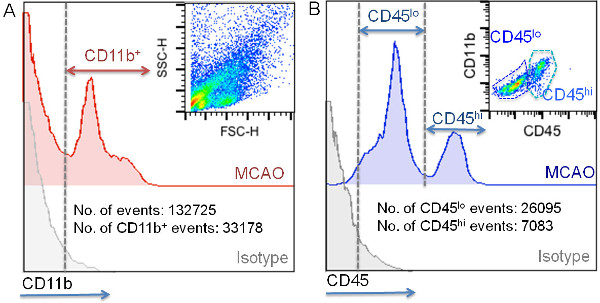
Abb. 5: Gating Strategien Wohnsitz aus infiltriert myeloischen Zellen im ischämischen Gewebe zu unterscheiden CD11b + Zellen wurden zunächst nach Isotyp Fluoreszenzintensität (A) sucht. Eine repräsentative Punktdiagramm von Zellsuspensionen des ischämischen Hirn in der oben rechts auf der Tafel angezeigt. InZusätzlich typische Werte für die Gesamtzahl von Ereignissen und für die Anzahl von CD11b + Ereignisse unter Verwendung dieser Technik erworben gezeigt (keine der Zellen / ischämischer Hirnhemisphäre;. (A) CD45 Fluoreszenzintensitätsanalyse der CD11b + Zellen ist in Panel gezeigt B. Ein Vertreter Dot-Plot-Analyse von CD45 und CD11b Ausdruck der gated CD11b + Subpopulation in der oben rechts auf der Tafel angezeigt. Darüber hinaus ist die typische Anzahl von CD45 lo CD45 pro ischämischen Gehirnhälfte erworben hallo Zellen mit dieser Technik gezeigt ist (B).
| Parameter für Cavalieri Methode | |
| Schnittdicke (t) | 30 & mgr; |
| Ziel | 10X |
| Scheibe Auswahlsatz (SSF) | 1/ 20 |
| Die Entfernung zwischen Abschnitten | 600 um |
| Rasterabstand | 100 um |
Tabelle 1: Parameter für die stereo Quantifizierung der Infarktgewebe verwendet.
| Ergebnisse | Kontraläsionalen | Ipsilesional | Infarkt |
| Area (um²) | 151.460.000 | 155.060.000 | 22.600.000 |
| Volume (um³) | 90,876 Mrd. | 93036000000 | 13,56 Mrd. |
| Volume für Korrigierte Über Projection (um³) | 89,9571 Mrd. | 92046300000 | 13,4166 Mrd. |
| Coefficient of Error (Gundersen) m = 0 | 0,068 | 0,077 | 0,067 |
| Coefficient of Error (Gundersen) m = 1 | 0,015 | 0,017 | 0,015 |
| Coefficient of Error (Gundersen) alpha (q) | 0,068 | 0,077 | 0,067 |
| % Infarkt Hemisphäre | 14,90 | ||
| Gehirn-Ödem (Ips Vol / Cont Vol) | 1.02 | ||
Tabelle 2: Typische Beispiele für kontraläsionalen, ipsilesional und der Infarktvolumen durch die Cavalieri Verfahren unter Verwendung des Stereo Investigator Software.
| Parameter für die optische Fraktionator verwendet | |
| Schnittdicke (TSF) | 30 & mgr; |
| Ziel | 100X |
| Scheibe Auswahlsatz (SSF) | 1/10 |
| Zählen Rahmenhöhe | 40 um |
| Zählen Rahmenbreite | 40 um |
| X Rastergröße | 230 um |
| X Rastergröße | 230 um |
| Safe Guard | 2 um |
| Optische disector Höhe | 14 & mgr; m |
Tabelle 3: Parameter mit Hilfe der Stereo Investigator Software für die stereo Quantifizierung von Neutrophilen infiltriert nach Hirnischämie mit dem optischen Fraktionator Sonde verwendet.
| Die Einschätzung der Neutrophilen von der Optical Fractionator | |
| Anzahl der Probenahmeflächen | 430 |
| Formfaktor | 6.24 |
| Insgesamt Marker gezählt | 166 |
| Geschätzte Neutrophile von Optical Fractionator | 117,608.03 |
| Coefficient of Error (Gundersen), m = 0 | 0,22 |
| Coefficient of Error (Gundersen), m = 1 | 0,09 |
Tabelle 4: Repräsentatives Beispiel der geschätzten infiltriert Neutrophilen nach Hirnischämie mit dem Optical Fractionator Sonde mit Hilfe der Stereo Investigator Software.
| CD11b + | Neutrophile | Monozyten | Mikroglia | |
| Naiv | 25.863 ± 4,575.8 | 473 ± 75,8 | 525 ± 191,4 | 19.012 ± 1523 |
| Sham 24-Stunden- | 24.563 ± 5263 | 873 ± 192,5 | 1124 ± 391,5 | 23.734 ± 2910 |
| pMCAO 24-Stunden- | 47.922 ± 23.174 | 4874 ± 748,7 | 4826 ± 1345 | 35.395 ± 10.833 |
Tabelle 5: Repräsentative Ergebnisse der geschätzten Knochenmarkzellen nach Hirnischämie mit der Durchflusszytometrie Ansatz.
Diskussion
Die zerebrale Ischämie-Modell hier vorgestellten gibt hoch reproduzierbare Infarktvolumen bestimmt 24 bis 48 h und 7 Tage nach der MCA Ligation durch verschiedene Ansätze 8,15,17. Diese MCAO-Modell hat eine geringe Sterblichkeit (weniger als 1%) im Vergleich zu anderen, die Minimierung der Anzahl der Tiere in Studien verwendet. Ein entscheidender Schritt, um diese niedrige Rate der Sterblichkeit zu erhalten, ist die richtige aseptischen Bedingungen zu halten, um Infektionen, die das Überleben nach Schlaganfallinduktion beeinträchtigen könnten, zu vermeiden. Diese MCAO-Modell kann nicht nur als Dauer MCAO-Modell, das als ein klinisch relevanten Modell für translationale Forschung 18 verwendet werden, sondern auch als Übergangsmodell durch vorübergehende Unterbindung der CCA und MCA mit einem slipknot und hinteren Reperfusion zum gewünschten Zeitpunkt 19. Dieses Verfahren wurde erfolgreich bei Mäusen und Ratten 17,20 verwendet. All dies deutet darauf hin, dass MCAO durch Ligation ist ein hochvielseitiges Modell der zerebralen Ischämie mit mehreren Anwendungen. Ein kritical Schritt dieses Verfahrens besteht darin, dass sie invasive Chirurgie unter einem Stereomikroskop erfordert; die Kraniotomie sollte sehr sorgfältig durchgeführt werden, um nicht die Jochbein sowie die MCA beschädigen. Allerdings ist die Verwendung von Scheintiere (wird die zu der Operation, aber CCA und MCA Ligation unterzogen, nicht durchgeführt werden) stellt ein nützliches Instrument zur chirurgischen Eingriff abhängige Effekte zu unterscheiden. Das Ausmaß der Hirnschädigung nach dieser Technik kann durch verschiedene Verfahren quantitativ bestimmt werden. Unser Protokoll von Gehirn Sektionierens Nissl-Färbung und anschließende Bestimmung des Volumens von Cavalieri ermöglicht eine genaue Quantifizierung des beschädigten Bereich und die Anzahl der Mäuse in dieser Art von Untersuchungen verwendet, da die Seriengehirnschnitte können auch für verschiedene immunohistochemische Analyse verwendet werden minimiert. Für eine bessere Leistung dieser Methodik, wichtig, die in der Software verwendet stereology Parameterwahl ist (Tabelle 1), die zum Schätzen th erforderlich sein werden,e Volumen der verschiedenen Regionen durch die Formel: V = 1 / SSF * a * f t * & Sgr; P i (SSF ist die Scheibe Auswahlsatz, t ist die mittlere Dicke der Abschnitte, ist eine f die Fläche der Gitterabstand und & Sgr; P die Anzahl der Punkte Schlagen der Struktur).
Das distale MCAO durch Ligation kann nützlich sein, die infiltrierten Leukozyten und Immunzellpopulationen, die 8,13 im Entzündungsprozess nach Hirnverletzung 1-4 teilnehmen charakterisieren. Hier schlagen wir zwei verschiedene Methoden für die Hirnimmunzellcharakterisierung, eine präzise stereo Ansatz und eine durchflusszytometrische Analyse für eine bessere Charakterisierung mehrere Leukozyten-Subpopulationen.
Unter Ausnutzung der seriellen Gehirn Schnitte kann die Quantifizierung der Anzahl von Neutrophilen durch den optischen Fraktionator Verfahren 16, das die Gesamtzahl der Zellen, die von der Anzahl der Zellen abgetastet wit schätzt erreicht werdenha Systematische Zufallsstichprobe (SRS) Satz unvoreingenommene virtuellen Räumen Zählung, die die gesamte Region von Interesse, in unserem Fall den Infarktbereich, mit gleichmäßigen Abstand zwischen unvoreingenommene virtuellen Räumen Zählung in Richtungen X, Y und Z. Diese Methode liefert eine genaue Werkzeug abzuschätzen Gesamt neutrophilen Zahl im ischämischen Gehirn an verschiedenen Zeitpunkten nach der Ligation. Obwohl nicht in dieser Studie gezeigt wurde, dieses Protokoll auch für die Abschätzung der verschiedenen Neutrophilen Subpopulationen nach Ischämie 21 und für eine genaue Quantifizierung von jeder anderen Zellpopulation im ischämischen Gehirn wie andere infiltrierten Leukocyten gefunden werden (Monozyten / Makrophagen) und auch für die Schätzung überlebenden Nervenzellen oder auch für die Neurogenese Quantifizierung nach Schlaganfall. Der wichtigste Schritt für eine genaue Schätzung in dem gewünschten Bereich ist die Auswahl der entsprechenden Parameter, wie die, die in der Tabelle 3 für die Neutrophilen-Quantifizierung in den ischämischen Bereich gezeigt.Diese Parameter werden für die stereo Software verwendet, um die gesamte positive Zellzahl (N) unter Verwendung der Gleichung N = ΣQ- x 1 / SSF x 1 / asf x 1 / tsf (ΣQ- ist die Gesamtzahl von Zellen mit gezählt berechnen die Fraktionator ist ssf der Abschnitt Auswahlsatz, ASF ist die Auswahlsatz Bereich und TSF ist der Auswahlsatz Dicke) 5. Obwohl diese Methodik ist langsamer als andere Quantifizierungstechniken (beispielsweise Analyse von neutrophilen Markern mg Gewebe, Densitometrie von repräsentativen Bildern oder die Anzahl von Neutrophilen pro Feld), den Vorteil, eine neutrale und eine feste Technik, die eine genaue stellt sein muss es Quantifizierung der Zellzahlen.
Das Gehirn Leukozyten Isolierung Ansatz erlaubt eine gleichzeitige Identifizierung und Quantifizierung von mehreren Immunzelltypen ohne die Notwendigkeit zur Vorspannung des Systems durch in vivo-Färbung oder genetische Manipulationen. Nachfolgende Zellsortierung vom gekennzeichnet myeloische populations oder deren immunmagnetische Trennung kann für mehrere Downstream-Anwendungen, wie beispielsweise weitere Studien zur Gen- oder Protein-Expression verwendet werden. Die genaue Charakterisierung von Neutrophilen, Monozyten und Mikroglia mit diesem Verfahren erzielt wird, führt eine hohe Spezifität gegenüber den bestehenden Verfahren, wie der immunhistochemische Untersuchungen, ein Vorteil, der die Bildung von Einzelfunktionen zu den verschiedenen myeloischen Zellen, Gehirn angeborenen Immunantwort auslösen können. Zusätzlich kann es ferner erweitert werden, um andere Gehirn Populationen mit dem entsprechenden Label kenn wie Blut geboren Makrophagen (CD11b + CD45 hallo CD68 +), und es kann für die Untersuchung von anderen ZNS Erkrankungen oder Verletzungen, die angewendet werden. Daher ist diese Technik stellt ein wichtiges Instrument, um die Heterogenität der Entzündungsreaktion im Gehirn zu erforschen. Eine wesentliche Einschränkung dieses Verfahrens beruht auf der Herstellung der Leukozyten-Suspensionen aus frischen Hirngewebe, was das ändern kann,Aktivierungszustand der Zellen oder deren Antigen-Veränderung. Obwohl diese Technik ermöglicht eine genauere qualitative Charakterisierung verglichen immunhistochemischen Studien liefert sie eine weniger genaue Quantifizierung basierend auf der Zellisolierung. Dennoch ist die Effizienz der Zellisolierungsprotokoll ähnlich zu anderen veröffentlichten Methoden 9 und kann effizient genutzt werden, um Unterschiede in der Anzahl von Gehirnimmunzellen zwischen Kontrolle und MCAO-Gruppen oder sogar zwischen MCAO Gruppen unterschiedlichen Behandlungen unterzogen 8 detektieren.
Kritische Schritte dieses Protokolls sind die Gewebedissektion die Gewebezerstörung Verfahren und die Myelinentfernung. Bezüglich der Gewebesammel kann ein Normierungsschritt (durch Wiegen des gesammelten Gewebes), um die Variabilität zu vermeiden aufgrund unterschiedlicher Dissektion Leistungsberechnung einbezogen werden. Darüber hinaus kann eine Normalisierung zwischen verschiedenen MCAO Gruppen auch durch Infarktvolumen auf (zuvor von Magnetic R bestimmtesonance). Eine weitere Möglichkeit, dieses Problem zu lösen, ist, den gesamten ipsilateralen Hemisphäre beider ischämischen und Kontrollgruppen zu verwenden, oder sogar die kontralateralen Hemisphäre des ischämischen Maus als Kontrolle, um die Anzahl der verwendeten Tiere zu minimieren. Dieser Ansatz vermeidet Unterschiede zwischen jedem Dissektion, hat es einen Nachteil; ein Verdünnungsfaktor wird durch die Erhöhung der Gesamtzahl der Zellen, nicht aber die Anzahl der myeloiden Zellen, die ausschließlich in den Kern und peri-Infarktbereiche des ipsilateralen Kortex zugegeben. In Bezug auf Gewebe-Zerstörung, veranschaulicht dieses Protokoll die Schritte für die mechanische Zerstörung von Gehirnzellen, die Vermeidung enzymatische Behandlungen und Vorbeugung von Oberflächenantigen Veränderung 9,22, ein wesentlicher Faktor für die weitere qualitative und quantitative Analyse der inflammatorischen Zell-Subpopulationen. Neben der Herstellung der Zellsuspension von Interesse ist Myelin Entfernung aus Gehirnproben ein empfehlens Schritt, um Interferenzen mit downst vermeidenRies Anwendungen wie immunomagnetischen Zelltrennung oder Durchflusszytometrie 23,24. Dies kann unter Verwendung verschiedener Verfahren, wie Saccharose oder Percoll-Gradienten, oder Anti-Myelin-Perlen erreicht werden. Hier und auf Basis von früheren Studien, die verschiedene Verfahren zur Hirnzellsuspension Isolierung, mechanische Störung in Kombination Vergleichen mit Percoll Nutzung Myelin Entfernen verwendet wird, um die Zellausbeute zu verbessern und die Lebensfähigkeit 25.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by grants from the Spanish Ministry of Economy and Competitiveness CSD2010-00045 (MAM), SAF2012-33216 (MAM), SAF2011-23354 (IL) and RENEVAS RD06/0026/0005 (IL), and from the Local Government of Madrid S2010/BMD-2336 (MAM) and S2010/BMD-2349 (IL). IB and MIC are fellows of the Spanish Ministry of Economy and Competitiveness.
Materialien
| Name | Company | Catalog Number | Comments |
| Photonic Led F1 | WPI | 571329-8 | Equipment |
| Temp Controller | Panlab | HB 101/2 | Equipment |
| Volvere GX | NSK | Ne22L | Equipment |
| Microscope | WPI | PZMIII-BS | Equipment |
| Stainless Steel Burrs | FST | 19007-14 | Surgical material |
| Forceps Dumont #5/45 | FST | 11251-35 | Surgical material |
| Forceps Dumont #5SF | FST | 11252-30 | Surgical material |
| Suture 6/0 | LorcaMarin | 55108 | Surgical material |
| Suture 9/0 | LorcaMarin | 61966 | Surgical material |
| Nikon Eclipse | Nikon | TE300 | Equipment |
| Isoflurane | Esteve | 571329-8 | Chemical |
| Sodium Pentobarbital | Vetoquinol | 570681 | Chemical |
| Freezing microtome | Leica Microsystems GmbH | SM2000R | Equipment |
| Superfrost slides | Thermo Scientific | 2014-07 | Lab material |
| Cresyl violet acetate | Sigma | C5042 | Chemical |
| Microscope | Nikon | Nikon Eclipse TE300 | Equipment |
| XYZ motorized computer stage and controller | Ludl electronics Products | Equipment | |
| Stereo Investigator System | Microbrightfield | Version 7.003 software | Software |
| 5 ml Tissue Grinder, Potter-Elv with teflon pestle | Thomas Scientific | 0913X70 | Lab Material |
| Polypropylene 50 ml Oak Ridge Centrifuge Tube | Nalgene | 3119-0050 | Lab material |
| Percoll | Sigma | p1644-100 | Chemical |
| RPMI 1640 | Lonza | BE12-702F | Chemical |
| Beckman Ultracentrifugue | Beckman Coulter | Equipment | |
| Beckman Coulter ultracentrifuge rotor 45 Ti | Beckman Coulter | Equipment | |
| BD Sterile Cell Strainer, 40 Micron | BD | BD 352340 | Lab Material |
| Bovine Serum Albumin | Sigma | A3733-500G | Reagment |
| FcR Blocking Reagent, mouse | Miltenyi | 130-092-575 | Antibody |
| CD11b-FITC, human and mouse | Miltenyi | 130-098-085 | Antibody |
| CD45-PE, mouse | Miltenyi | 130-102-596 | Antibody |
| Anti-Ly-6G-APC, mouse | Miltenyi | 130-102-936 | Antibody |
| PerCP/Cy5.5 anti-mouse Ly-6C | Biolegend | 128012 | Antibody |
| BD FACS Flow | BD | 342003 | Reagment |
| BD FACSCalibur; 4-color | BD | 342975 | Equipment |
| BD Cell Quest Pro Software | BD | Software | |
| FlowJo software | Treestar inc. | Software |
Referenzen
- Chamorro, A., et al. The immunology of acute stroke. Nature Reviews. Neurology. 8, 401-410 (2012).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nat Med. 17, 796-808 (2011).
- Ramlackhansingh, A. F., et al. Inflammation after trauma: microglial activation and traumatic brain injury. Annals of Neurology. 70, 374-383 (2011).
- Jin, R., Yang, G., Li, G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells. J Leukoc Biol. 87, 779-789 (2010).
- West, M. J., Slomianka, L., Gundersen, H. J. Unbiased stereological estimation of the total number of neurons in thesubdivisions of the rat hippocampus using the optical fractionator. The Anatomical Record. 231, 482-497 (1991).
- Charleston, J. S. Estimating cell number in the central nervous system by stereological methods: the optical disector and fractionator. Current Protocols in Toxicology. 12 (Unit 12.6), (2001).
- Begega, A., et al. Unbiased estimation of the total number of nervous cells and volume of medial mammillary nucleus in humans. Experimental Gerontology. 34, 771-782 (1999).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARgamma Agonist Rosiglitazone. Stroke; a. Journal of Cerebral Circulation. 44 (12), 3498-3508 (2013).
- Campanella, M., Sciorati, C., Tarozzo, G., Beltramo, M. Flow cytometric analysis of inflammatory cells in ischemic rat brain. Stroke. 33, 586-592 (2002).
- Carson, M. J., Reilly, C. R., Sutcliffe, J. G., Lo, D. Mature microglia resemble immature antigen-presenting cells. Glia. 22, 72-85 (1998).
- Perego, C., Fumagalli, S., De Simoni, M. G. Temporal pattern of expression and colocalization of microglia/macrophage phenotype markers following brain ischemic injury in mice. J Neuroinflammation. 8, 174(2011).
- Denker, S. P., et al. Macrophages are comprised of resident brain microglia not infiltrating peripheral monocytes acutely after neonatal stroke. Journal of Neurochemistry. 100, 893-904 (2007).
- Ballesteros, I., et al. Rosiglitazone-induced CD36 up-regulation resolves inflammation by PPARgamma and 5-LO-dependent pathways. Journal of Leukocyte Biology. 95 (4), 587-598 (2013).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. J Microsc. 150, 117-136 (1988).
- Hernández-Jiménez, M., et al. Silent Information Regulator 1 Protects the Brain Against Cerebral Ischemic Damage. Stroke. 44 (8), 2333-2337 (2013).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96, 857-881 (1988).
- Godino, M. E. C., et al. Amelioration of ischemic brain damage by peritoneal dialysis. J Clin Invest. 123, 4359-4363 (2013).
- Hossmann, K. A. The two pathophysiologies of focal brain ischemia: implications for translational stroke research. J Cereb Blood Flow Metab. 32, 1310-1316 (2012).
- García-Yébenes, I., et al. Iron overload, measured as serum ferritin, increases brain damage induced by focal ischemia and early reperfusion. Neurochem Int. 61, 1364-1369 (2012).
- Sobrado, M., et al. Synthesis of lipoxin A4 by 5-lipoxygenase mediates PPARgamma-dependent, neuroprotective effects of rosiglitazone in experimental stroke. J Neurosci. 29, 3875-3884 (2009).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARγ Agonist Rosiglitazone. Stroke. 44, 3498-3508 (2013).
- Ford, A. L., Foulcher, E., Goodsall, A. L., Sedgwick, J. D. Tissue digestion with dispase substantially reduces lymphocyte and macrophage cell-surface antigen expression. Journal of Immunological Methods. 194, 71-75 (1996).
- Pfenninger, C. V., et al. CD133 is not present on neurogenic astrocytes in the adult subventricular zone, but on embryonic neural stem cells, ependymal cells, and glioblastoma cells. Cancer Research. 67, 5727-5736 (2007).
- Tham, C. S., Lin, F. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. International Journal of Developmental Neuroscience : the Official Journal of the International Society for Developmental Neuroscience. 21, 431-443 (2003).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9, 147(2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten