Method Article
Стереологический и проточной цитометрии Характеристика субпопуляций лейкоцитов в моделях переходных или Постоянного церебральной ишемии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мозга миелоидных клеток характеристика следующие инсульта может быть выполнена стереологии с использованием метода оптического ректификационной колонны, или с помощью проточной цитометрии анализа мозга лейкоциты суспензии. Оба полезные методы, чтобы выполнить точную фенотипическое различие основных миелоидных подмножеств клеток, найденных в ишемической мозга.
Аннотация
Активация микроглии, а также экстравазация кроветворных макрофагов и нейтрофилов, как полагают, играет ключевую роль в черепно-мозговой травмой после инсульта. Эти миелоидной субпопуляции клеток могут отображать различные фенотипы и функции и должны быть выделены и охарактеризованы изучить их регулирования и вклад в повреждение тканей. Этот протокол обеспечивает два различных методологий для мозга иммунной характеристик клеток: точное стереологической подход и анализ проточной цитометрии. Стереологический подход основан на методе ректификационной оптической, которая вычисляет общее количество клеток в области интереса (инфаркта мозга) оценивается путем систематического случайного отбора. Второй подход характеристика обеспечивает простой способ, чтобы изолировать мозг лейкоцитов суспензий и охарактеризовать их с помощью проточной цитометрии, позволяющий для характеристики микроглии, проникли моноциты и нейтрофилы ишемической ткани. Кроме того, он также дetails мозговой модель ишемии у мышей, что исключительно влияет коры головного мозга, создавая высокую воспроизводимость инфаркты с низким уровнем смертности, а также порядок гистологической обработки мозга, чтобы охарактеризовать объем инфаркта методом Кавальери.
Введение
Морфологические, фенотипические и экспрессии генов изменения микроглии, а также кровоизлияние и активация кроветворных макрофагов и нейтрофилов, как полагают, играют ключевую роль в патофизиологических каскада после травмы головного мозга 1-4. Этот протокол обеспечивает два подхода для оценки количества различных миелоидный клеток подмножеств ишемической мозга и выполняют свою фенотипическую характеристику. Кроме того, он также предоставляет описание экспериментальной модели ишемии головного мозга у мышей, которая состоит из переходного или постоянной перевязкой как дистальной средней мозговой артерии (СМА) и общей сонной артерии (ОСА), в том числе, как оценивать инфаркт по точным методом Кавальери, используя стереологической программного обеспечения.
Первый подход, чтобы охарактеризовать миелоидных клеток подмножества ишемического мозга стереологического метод, основанный на ректификационной подход оптического 5. Это наиболееобычно используется стереологической зонд в области наук о жизни и обеспечивает высокую степень точности, с низким коэффициентом ошибок 5-7. Это лучший выбор для мобильного количественного когда ткань разрезают на отрезки, как это позволяет избежать предвзятости оценки клеток из-за фрагментации ткани в разделах. Этот метод является очень мощным средством для характеристики номера, динамику и фенотипические изменения проникли нейтрофилов субпопуляций ишемического ткани 8.
Второй подход характеристика основана на модифицированной протокола от Кампанеллы и соавторов 9, что обеспечивает простой способ, чтобы изолировать мозга лейкоцитов суспензий и охарактеризовать их с помощью проточной цитометрии. В отличие от обычных иммуногистохимических методов, проточной цитометрии характеристика позволяет дифференцировать микроглии (CD45 ло CD11b +) и проникли миелоидных клеток (CD45 Привет CD11b +) в зависимости от их разлУровни экспрессии отличны от CD45 9-13. Кроме того, про-воспалительных моноциты (CD45 привет CD11b + Ly-6G - Ly-6C привет), нейтрофилы (CD45 привет CD11b + Ly-6G +) и другие лейкоциты подмножества ишемической ткани можно выделить. Этот подход обеспечивает надежный и быстрый анализ, чтобы оценить нейровоспаления в экспериментальных моделях ишемии головного мозга. Однако, обработка ткани может влиять на состояние активации и численность различных клеточных популяций, найденных в ишемической ткани, обеспечивающей полу-количественных характеристик.
протокол
ПРИМЕЧАНИЕ: Все экспериментальные протоколы придерживается руководящих принципов Благотворительного комитета животных при Университете Комплутенсе (в соответствии с указаниями ЕС 86/609 / CEE и 2003/65 / CE).
1. церебральной ишемии Модель
ПРИМЕЧАНИЕ: церебральный модель ишемии в этой статье предполагает постоянное или кратковременное окклюзии как ОСО (общая сонная артерия) и СМА (средней мозговой артерии) перевязкой с нейлоновой нити.
- Pre-хирургические препараты
- Стерилизацию всех хирургических инструментов в автоклаве или в стекл нных шариков стерилизатора. Лечить хирургическую область с 70% этанола, а также.
- Обезболить мышь с соответствующими анестетиков. Обеспечение индукции изофлуран 2,5% и поддерживать с помощью изофлуран 1,5% в смеси 80% воздуха / 20% кислорода с использованием испарителя. Применить искусственные слезы мышам глаза, чтобы предотвратить сухость в то время как под наркозом.
- Наведите на грелку, которая связана с платнойdback устройство с датчиком температуры, помещенного в прямой кишке и заданной температуры в физиологических уровней (36,5 ± 0,5 ° C) в течение хирургической процедуры.
- Общие окклюзия сонной артерии путем лигирования
- Наведите в спинной лежачее положение и иммобилизации с лентой. Лечить кожу с 70% этанола или повидон-йода и постричь верхней вентральной части.
- Под операционным микроскопом, сделать 1 см срединный разрез вокруг вентральной поверхности шеи.
- Растащить все мягкие ткани (железистой ткани, включая суб-верхнечелюстной, подъязычного и околоушных желез) и определить левой общей сонной артерии (CCA), локализованный сбоку от трахеи. Уберите мышцы и подвергать левую CCA. Осторожно рассекают из блуждающего нерва.
- После того, как рассеченные, закрывают левую ОСО по лигатуры, используя 6/0 нейлон шва с. Лигировать с постоянным узлом или удавки (чтобы реперфузии при переходных церебральной ишемии модель желательно).
- Поместите железистой ткани в исходное положение и закройте разрез на коже шеи с 6/0 нейлона шва в.
Примечание: Sham животных подвергали той же хирургической процедуры, как MCAO животных, но ССА не окклюзии.
- Дистальный окклюзии средней мозговой артерии путем лигирования
- Наведите указатель мыши на правый бок и иммобилизации с лентой. Лечить кожу головы с 70% этанола или повидон-йодида и сократить волосы головы мыши (удалить волосы после стрижки).
- Под хирургическим микроскопом, сделать разрез кожи между глазом и ухом. Перемещение кожу в сторону и удерживайте его лентой.
- Сделайте горизонтальную разрез на височной мышцы справа налево. Затем сделать второй вертикальный разрез на правой стороне височной мышцы (соблюдать осторожность, чтобы избежать резки временной вену). Растащить височной мышцы из черепа и удерживайте ее швом для поддержания чистоты поверхности черепа.
- Очистите поверхность черепас холодной стерильного физиологического раствора, чтобы определить точное положение левой средней мозговой артерии (СМА) через прозрачности черепа. Выполните круглый трепанации черепа (1 мм в диаметре) с заусенцев нержавеющей стали в лобной доле между скуловой дугой и чешуйчатой кости. Осторожно снять череп и выставить MCA.
- Нанесите небольшое количество холодной стерильным физиологическим раствором с поверхностью мозга и мозговых оболочек удалить (Dura и паутинной мозговой оболочки) с помощью щипцов.
- Выполните перевязка левой СМА в дистальных туловища непосредственно перед бифуркации между лобной и заднюю ветви MCA. Закупоривать левой СМА по лигатуры, используя 9/0 нейлон шва с. Лигировать с постоянным узлом или удавки (чтобы реперфузии при переходных церебральной ишемии модель желательно). Период времени между ОСО и MCA окклюзии составляет примерно 10-20 минут, в зависимости от опыта оператора.
- Поместите височной мышцы в исходное положение и закройте incisioн на коже шеи с 6/0 нейлона шва в.
- Верните мышь в клетку, чтобы оправиться от наркоза (как правило, 5-10 мин) и ввести мышь с бупренорфин внутрибрюшинно (IP) (0,3 мг / кг).
- Монитор мыши в течение нескольких часов, чтобы обнаружить никакого дискомфорта (не оставляйте мышь без присмотра, пока он не пришел в достаточной сознание поддерживать грудины лежачее положение). С послеоперационные потеря веса, как правило, наблюдается, поместите пюре еду в чашке Петри, чтобы облегчить питания.
- Когда животное полностью выздоровел, вернуться в компанию других животных.
- Если переходный модель MCAO желательно, обезболить мышь снова и удалить удавку из ОАС и MCA, чтобы реперфузии (обычно между 0,5-2 ч (рис 1)).
Примечание: Sham животных подвергали той же хирургической процедуры, как MCAO животных, но MCA не окклюзии.
2. перфузии и Sectiческими мозговой ткани
- 24 или 48 ч после MCAO, пожертвовать мыши с летальной дозой анестетика (например, фенобарбитала натрия, IP 86 мг / кг или передозировки изофлураном).
- Заливать мышь с фосфатным буфером 0,1 М последующим 4% параформальдегида (PFA) в фосфатном буфере (рН 7,4).
- Удалить мозга следующим образом:
- Обезглавьте животное чуть выше спинного мозга.
- Сделайте задне-передней разрез на коже головы, чтобы подвергать черепа. Сделать две боковые разрезы на стыке с боковыми стенками и основанием черепа и удалить небольшой кусочек кости.
- Сделайте надрез через череп вдоль стреловидного шва.
- Удалить череп, покрывающий каждое полушарие с помощью пинцета, чтобы разоблачить мозга. Использование шпателя, чтобы отделить мозг от черепа и передавать его в 4% -ном растворе PFA.
- После исправления в течение 3 ч в 4% -ном растворе PFA при 4 ° С.
- Удалить решение PFA и incubatЕ мозг в течение 48 ч в 30% -ном растворе сахарозы в cryoprotect мозг.
- Удалить раствор сахарозы и заморозить мозг быстро в холодной изопентана (-40 ° C). Хранить замороженные мозг при -80 ° С.
- Получить корональные разделы мозга (30 мкм) с микротоме замерзания. Соберите десять последовательных наборов в криоконсерванта решения. Каждый последовательный набор состоит из около 14-16 корональных ломтиками с interslice расстоянии 300 мкм, которые адекватно отведать мозг мыши между 1,94 и -2,46 задней брегмы.
3. Nissl Окрашивание и инфаркта Объем Оценка
- Nissl окрашивание по крезиловым фиолетовый
- Mount срезы головного мозга в SUPERFROST предметное стекло. Для определения объема инфаркта методом Cavalieri в Нисслю-окрашенных участках, используют фракцию 1/20 срез-выборки (1/2 секций одна из десяти последовательных наборов собранных на этапе 2,7, и примерно, общее количество секций 7-8 с interslice расстоянии 600 μ; М используются). Будьте осторожны, чтобы поддерживать надлежащее передне-задней ориентацию (зоны инфаркта находится в правой части).
- Выполните обычную окраску Ниссля следующим образом:
- Разрешить слайд-смонтирован разделы высохнуть в течение нескольких часов.
- Увлажняет слайд-монтажа секций и окрашиваются 0,1% раствора крезил фиолетового в течение 5 мин.
- Высушить с градуированной серии EtOH (70%, 90% и 100%; 5 мин на изменения). Очистите слайд-монтажа секций с ксилола, добавить distrene-80 пластификатор ксилола (DPX) Монтажные средства массовой информации и накройте покровным стеклом.
- Использование стереологической программное обеспечение, чтобы оценить объем инфаркта методом Cavalieri в Ниссля окрашенных серийных срезов
- Использование параметров, указанных в таблице 1, чтобы количественно объем инфаркта методом Cavalieri 14 и системой стереологии, который состоит из микроскопа, снабженного камерой, XYZ моторизованные компьютерной стадии, и стереологического программного обеспечения (Основноймаршрут, приведенные ниже, относятся к ПК, но направления могут отличаться для других операционных систем).
- Включите компьютер, микроскоп, контроллер стадии и камеры в соответствующем порядке. Начните стереологической программного обеспечения.
- Перемещение цели 10X на месте и выберите 10X с объективной выпадающего меню.
- Перемещение по первой Нисслю окрашенных разделе и найти подходящую точку отсчета. Щелкните мышью, чтобы установить точку отсчета (передвигаться надо к активному помощью бесплатного радости).
- Оцените, «установленное толщину профиля" (фактическую толщину части с учетом усадки). Нажмите кнопку "Положение фокуса метр" и рассчитать толщину от основания до верхней части раздела.
- Создать контурного инструмента для contralesional и ipsilesional районов и зоны инфаркта.
- Нажмите на меню "Дисплей" и выберите "Настройки дисплея". Это открывает тон Дисплей диалоговом окне Параметры.
- Выберите вкладку "Контуры" и нажмите кнопку "добавить тип контура".
- Создать контур для каждого региона количественно и сделать их видимыми в контуре меню. Нажмите OK.
- Создать инструмент Маркер для contralesional и ipsilesional полушарий и зоны инфаркта.
- Нажмите на меню "Дисплей" и выберите "Настройки дисплея", чтобы открыть диалоговое окно Параметры экрана.
- Выберите вкладку «маркеры» и изменить маркеры имя, выполнив двойной щелчок по имеющимся маркерам. Сделайте их видимыми в маркер-баре. Нажмите OK.
- Активируйте менеджер раздел.
- Нажмите на меню "Tools / Серийный раздела Управление". Добавить новый раздел с помощью кнопки "Новый раздел". Эта кнопка открывает окно "Серийный Раздел диалог Setup".
- Установите "блокировать продвижение», как 30 мкм. Установите"Установлен в разделе толщина" с оцененной на этапе 3.2.5.
- Установите "Оценка интервал", как 20. Использование выборки фракция в 1/20 ломтик.
- Установите "стартовый номер секции" как 1. Установите "значение по оси Z для верхней части первой секции" как 0. Нажмите кнопку ОК.
- Нарисуйте контур, чтобы обозначить контралатерального полушария.
- Выберите Contralesional инструмент полушария (ранее созданный в шаге 3.2.6) от контура меню.
- Нарисуйте контур, чтобы обозначить контралатерального полушария.
- Для завершения трассировки contralesional полушарие, щелкните правой кнопкой мыши и выберите "закрыть контур".
- Оцените contralesional полушария контур Кавальери.
- Нажмите на меню "Зонды" и выберите Кавальери оценщик. Установите "Шаг сетки", как 100 мкм. Установите "сетке вращения", как 0. Установить "Bзаблокировать Advance "в 30 мкм. Нажмите OK.
- Выбор "contralesional полушария" кнопку из маркеров Bar. Щелкните правой кнопкой мыши внутри Contralesional контура полушария.
- Выберите "Paint Кавальери режим маркеров". Щелкните правой кнопкой мыши внутри contralesional контура полушария еще раз и выберите "Краска Маркеры в КОНТУР".
- Отключить Кавальери оценщик, нажав на зондов и Кавальери оценщик и отключить кнопку contralesional маркер в строке маркера.
- Повторите ту же процедуру для ipsilesional полушарии и области инфаркта (шаги 3.2.7 и 3.2.8). Сохранение данных после измерения площади каждой секции.
- Рассчитать контралатеральной, ipsilesional и инфаркта области, в остальной части Nissl окрашенных разделе.
- Создать новый раздел в шаге 3.2.6. Не изменяйте значения, введенные в диалоговом окне "Последовательный раздел Настройка". Нажмите ОК.
- Повторите шаги 3.2.7-3.2.8 в новом разделе.
- Экспорт результатов количественного к файлу таблицы.
- Нажмите «пробников» в стерео следователь меню. Выберите "Показать Probe Run List". Это открывает "Предыдущая Стереологический Работает Диалог".
- Выберите все разделы, нажав на них. Нажмите "Просмотр результатов" Кнопка. Это открывает "Кавальери Оценщик Результаты", где отображаются оценкам площадь и объем для каждого региона.
- Чтобы экспортировать результаты в файл электронной таблицы, нажмите "Копировать все результаты в буфер обмена" и вставьте на Excel файл с основными результатами, полученными от каждого региона (таблица 2).
- Экспресс объем инфаркта в мм 3 или в% от полусферы, которая инфаркта (% Ih) с использованием формулы 15% IH = InfVol / ContrVol * 100, где
ContrVol (Contralesional полушарие Volume) = ΣContrArea я
4. Стереологический Количественное проникли нейтрофилов, перенесших мозговой ишемии по оптической ректификационной колонны
- Окрашивание срезов головного мозга в:
- Для оценки общего количества внедренных нейтрофилов после МСАО оптической ректификационной колонны 16, используют фракцию отбора проб 1/10 среза. Immunostain нейтрофилы с помощью обычных методов иммунофлуоресценции с использованием крыс анти-антитела (Ly6G 1A8) и правой вторичного антитела на свободно плавающих секций. Кроме того, counterstaining с ядерным производителя, как DAPI или TOPRO, хотя это не является необходимым для идентификации нейтрофилов, может сделать легче обнаружить зоны инфаркта.
- Mount срезы головного мозга в SUPERFROST предметное стекло с инфарктом области размещены в правой части.
- Quantificция из проникли лейкоцитов в ишемической мозга с помощью оптического ректификационной колонны
- Использовать параметры, приведенные в таблице 3, чтобы количественно невидимые лейкоцитов в ишемической мозга с помощью оптического ректификационной подход системой стереологии. Повторите шаги 3.2.1-3.2.5 из раздела 3.
- Создание контурного инструмента для зоны инфаркта, как это было описано в шаге 3.2.6 раздела 3.
- Создание маркера инструмент для нейтрофилов, как было описано в шаге 3.2.7 раздела 3.
- Активируйте менеджер раздел и создать новый раздел на стадии 3.2.8. В этом случае, установите "Оценка Interval", как 10 (выборочная доля 1/10 ломтик используется для оценки количества нейтрофилов).
- Выберите "зоны инфаркта" контурного инструмента (ранее созданный в шаге 4.2.1) от контура меню. Нарисуйте контур, чтобы обозначить зоны инфаркта в 10 раз цели. Измените цель 100X выполнять neutrophIL количественное (не забудьте выбрать 100X с объективной выпадающего меню).
- Нажмите на меню "зондов" и выберите "Оптический фракционатором". Установите "XY Размещение подсчета кадров", как 230 для Х и Y размера сетки. Установите "сетке вращения", как 0. Установка "блокировать продвижение», как 30 мкм. Нажмите OK.
- Нажмите кнопку "нейтрофилов" от маркера Bar. Отметить окрашивали нейтрофилов в области поврежденного. После финиша, отключите оптического зонда фракционатором нажав на кнопку "зондов" и "Оптические ректификационной колонны". Отключить кнопку нейтрофилов из панели маркеров.
- Повторите ту же процедуру для каждой секции (4.2.4-4.2.9).
- Экспорт результатов количественного к файлу таблицы.
- Нажмите «пробников» в стерео следователь меню. Выберите "Показать Probe Run List", чтобы открыть "предыдущий Стереологический бежит"Диалог.
- Выберите все разделы, нажав на них. Нажмите "Просмотр результатов", чтобы открыть "на оптические результаты фракционатором", в котором отображается расчетное число нейтрофилов.
- Экспорт результатов в файл электронной таблицы, нажав "Копировать все результаты в буфер обмена" и вставьте в файл электронной таблицы.
5. Анализ мозга диссоциации и проточной цитометрии
Примечание: миелоидный субпопуляции характеристики проточной цитометрией на свежей ткани мозга могут быть использованы в качестве альтернативы предыдущему нейтрофилов характеристики выполненного на неподвижных и иммунному срезов головного мозга.
- Мозг диссоциации и один клеточный препарат подвеска
- Сделайте 10 мл / животное из (среды Roswell Park Memorial Institute) RPMI -Percoll раствор, содержащий 8 мл RPMI, 1 мл 30% перколлом и 1 мл 10x PBS (фосфатным буферным раствором).
- Rалить мозга мыши после МСАО, как описано на стадии 2.3.
- Под микроскопом, рассекать из основных и пригородных инфаркта области ипсилатеральном коры от мозга ишемического мыши (или аналогичной области для притворства и наивных животных) из головного мозга. Вес ткани мозга и поместить его в 5 мл ледяной RPMI-перколлом (шаг веса может быть выполнена для нормализации между экспериментальными группами).
- Разбить ткани в суспензии отдельных клеток с использованием Поттер Elvehjem типа тканей мясорубку с тефлоновым пестиком.
- Передача клеточных суспензий в 50 мл ультрацентрифужную пробирку и добавить еще 5 мл раствора RPMI-Перколла к образцам.
- Центрифуга клеточные суспензии в 7800 х г в течение 30 мин при 25 ° С. После центрифугирования обеспечить белого цвета слой, соответствующий миелина появляется в верхней части раствора.
- Тщательно Удалить миелиновые слой и фильтрации суспензии целых клеток, в том числе осажденные клетки, через нейлоновые сетки straine 40 мкмр.
- Добавить 10 мл RPMI на сито, чтобы убедиться, что все клетки фильтровали и поместить раствор в 50 мл пробирку. Добавить 30 мл RPMI и центрифугируют 50 мл клеточной суспензии в 600 мкг в течение 10 мин при комнатной температуре.
- Удалите супернатант и ресуспендируют лейкоцитов гранул с 1 мл PBS. Добавить 4 мл лизирующего буфера (150 мМ NH 4 Cl, 10 мМ NaHCO 3 и 0,1 мМ ЭДТА) и инкубируют клетки в течение 2-3 мин при комнатной температуре, чтобы лизировать эритроциты из клеточной суспензии. Центрифуга раствора при 600 х г в течение 10 мин при 4 ° С.
- Окрашивание клеток и проточной цитометрии
- Подготовка маркировки коктейль для проточной цитометрии, содержащий 200 мкл PBS-BSA (1%) 1: 100 FC-блока, 1:40 анти-CD45-PerCP крысы, 1:40 анти-Ly6G-APC крысы, 1:40 против CD11b-FITC крыса и 1:40 анти-Ly-6C-PE крысы в образце.
- Ресуспендируют клеток в маркировке коктейль и инкубировать образцов в течение 45 мин во льду.
- Вымойте маркировки коктейльс 1 мл холодного PBS и центрифуги клетки при 600 мкг в течение 10 мин при 4 ° С. Ресуспендируют гранул с 100 мкл FACS потока и получить всю суспензию клеток при помощи проточной цитометрии.
- Используйте проточной цитометрии программного обеспечения для анализа, чтобы охарактеризовать и количественно клеточных популяций.
- Основные лейкоцитов подмножества, соответствующие маркировки коктейль, подготовленный в этом протоколе можно охарактеризовать следующим образом: CD45 вот CD11b +: Клетки микроглии резидентов; CD45 привет CD11b + Ly-6G +: нейтрофилы; CD45 привет CD11b + Ly-6G - Ly-6C привет: провоспалительных моноциты.
Результаты
Церебральная ишемия модель, показанная здесь создает инфаркты видели исключительно в коре головного мозга, не влияя на полосатой ткани, так как lenticulostriatal ветви СМА, орошающие стриатуме не окклюзии (рис 1). Окрашиванием Нисслю, поврежденной области могут быть идентифицированы в качестве гипохромного области коры (Рис.2). Эта модель характеризуется высокой воспроизводимостью объем инфаркта на 24 часов после MCAO (% IH 15,89 ± 0,28) оценивается методом Кавальери в Nissl-окрашенных срезов (рис 2). Оценка объема инфаркта методом Cavalieri является точным подход с малой ошибкой, что отражено в коэффициенте ошибок (СЕ) от Gundersen в contralesional и ipsilesional полушарий, а также в области поврежденного (таблица 2). Поврежденные объем ткани может быть выражено в мм 3, но и в виде% IH, используя формулу в разделе 3.2.13. Кроме того, оценкаот общего объема ipsilesional и contralesional регионах позволяет для расчета индекса отека исправить объем инфаркта и чтобы избежать переоценки поврежденной ткани (таблица 2).
Учитывая последовательной обработке срезов мозговой ткани, это может быть воспользовались, чтобы выполнить точную оценку общего числа клеток субпопуляций, как проникли нейтрофилов, в ишемической зоне, используя подход Оптический ректификационной колонны (фиг.3 и в таблице 4) с параметрами, показанными в таблице 3. Этот протокол оценивает общее число нейтрофилов (Ly6G-положительных клеток) в области поврежденного из 23328 ± 3623 в 24 ч и 82856 ± 8143 в 48 ч у мышей после pMCAO (рисунок и 3D). В соответствии с предыдущими исследованиями, нейтрофильной инфильтрации прямо коррелирует с размером инфаркта (рис 3Е). Оценка ТОн количество нейтрофилов методом оптической ректификационной колонны является точным подход с низкой погрешности, который отражается от КВ Gundersen (Таблица 4).
Изоляция лейкоцитов и проточной цитометрии протокол характеризации позволяет изоляцию 47922 ± 23174 миелоидных клеток из коры ipsilesional полушарии ишемических мышей. Это включает в себя 10-30% от общего количества событий, найденных в клеточной суспензии. Подавляющее большинство захваченных событий, используя этот протокол присутствует низкий параметр FSC, связанный с клеточной мусора (Рисунок 4). Окрашивание CD11b показывает, что CD11b + клетки имеют более высокое значение FSC (фиг.4), предполагая, что клеточный дебрис не помечены с этим маркером и, как указывалось ранее, что он может быть исключен из дальнейшего анализа, установив порог FSC 200 9. Некоторое количество остатков клеток получены с помощью этого метода предполагает, что разногласия по процессу образцаING (время, сохранение ткани, температура образца, эффективное удаление миелина, и т.д.) могут объяснить. Кроме того, использование клеточных фильтров также необходима, чтобы избежать присутствия сотовой зажимами в образцах; Этот шаг необходимо сделать до окрашивания клеток. Использование стратегии стробирования показано на рисунке 5, которая основана на CD11b и экспрессии CD45, мы можем различать резидентов и проникли миелоидных клеток в ишемизированной ткани. Это увеличивает население CD11b + в ишемической полушарии по сравнению с наивным и с мнимой группы, в которых эти клетки в основном, связанных с низкой экспрессией CD45, указывающий, что микроглии в пролиферирующих после ишемии (фиг.4, 5 и фиг таблице 5) , Это различие, вероятно, из-за клеточной инфильтрации от периферии, о чем свидетельствует появление CD11b + CD45 хай субпопуляции клеток в головном мозге ишемической (фиг.4, Рисунок 5 и в таблице 5), который является малое количество в наивным и в бутафорских мозгов. Вклад инфильтратов в клеточной популяции CD11b + ишемии головного мозга в очень динамический процесс 4. В модели MCAO по лигатуры, она может варьироваться от 30% до 60% от общего объема CD11b + -клеток в зависимости от размера очага поражения и о времени, когда характеристика была проделана. Нейтрофилы, характеризующиеся как Ly-6G + клеток, являются наиболее многочисленным населением проникли клетки найдены в 24 ч после MCAO в ишемической мозга мыши с помощью этой модели церебральной ишемии, так как они содержат 70-80% CD11b + CD45 привет. Остальные клетки являются в основном субпопуляции CD11b + CD45 привет Ly-6G - Ly-6C привет провоспалительных моноцитов. В этой модели, это население будет увеличиваться в номер в ишемических областях мозга от 24 до 48 ч после MCAO.
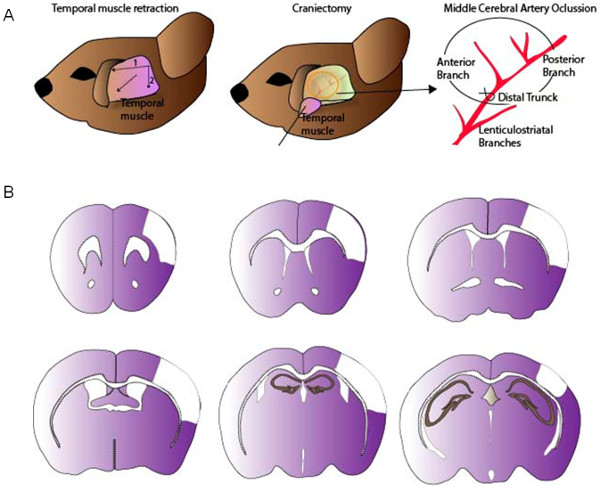
Рисунок 1:. Хирургическая процедура для лигирования MCA (А) После втягивания височной мышцы, небольшое краниотомия выполняется в черепа мыши. MCA лигируют с помощью узла или удавки с помощью 9/0 шов. (B) Типичные изображения коркового поражения, порожденной модели MCAO. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
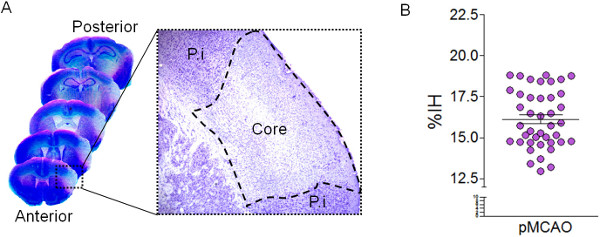
Рисунок 2: Количественная оценка объема инфаркта Кавальери. () Типичные изображения Nissl окрашенных срезах мозга через 24 часа после постоянного MCA труб. Высокое увеличение показывает hipocromatic области после окрашивания Нисслю, которыеопределяет поврежденную область (ядро) после MCAO. Peri-инфаркта (PI) Область также показано на рисунке. (Б) Количественная оценка объема инфаркта представлены в виде% инфарктом полушарии (%) IH с помощью метода Кавальери в серийных Нисслю-окрашенных участках, 24 часа после МСАО (п = 50 мышей ).
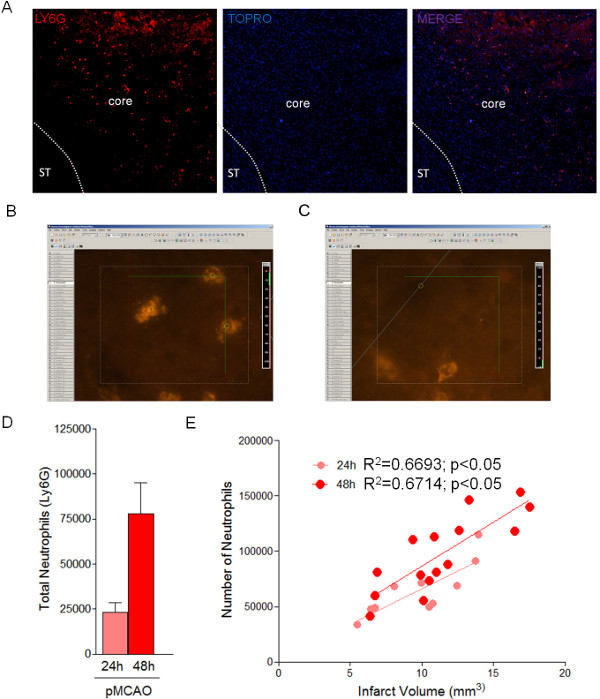
Рисунок 3: Стереологический количественное нейтрофилов в области поврежденного 24 и 48 ч после лигировани с использованием метода оптического ректификационной колонны. () Представитель образ проникли нейтрофилов (Ly6G-положительные клетки) в зоне ишемии на 24 ч после MCAO. Разграничение показывает зоны инфаркта. (B, C) Примеры оптического диссектора для нейтрофилов количественного по оптической ректификационной колонны. (D) Количественное определение общего нейтрофилов в области инфаркта на 24 и 48 ч (п = 4 мышей). (Е)Соотношение числа нейтрофилов с размером инфаркта на 24 и 48 ч после MCA труб. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
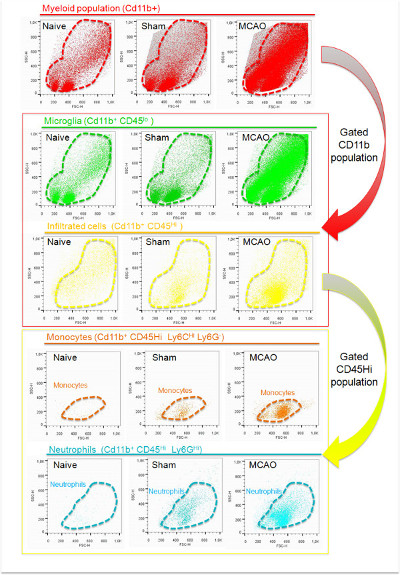
Рисунок 4:. Представитель анализ дот-график разброс лейкоцитов мозга получены из наивного, обман и ишемическая (24 ч после MCAO) полушарий на основе физических параметров (SSC и FSC) население о событиях, которые выражают CD11b (красный) был идентифицирован во всех группах. Это население было закрытого типа, и характеризуется в соответствии с выражением CD45. Клетки, экспрессирующие низкие уровни CD45 (зеленый) присутствовали в ишемической и неишемической коры головного мозга и соответствовал клеток микроглии. В отличие от этого, клетки, экспрессирующие высокие уровни CD45 (желтый) были тольконайдено в ишемической полушарии и в меньшей степени в мнимой группы. Дальнейший анализ хай популяции CD11b + CD45 показывает, что нейтрофилы (LY-6G + клетки, синий) и провоспалительных моноциты (LY-6C Hi-клетки, оранжевые) основные клеточные субпопуляции, найденные в мозге проникает через 24 часа после инсульта. Пожалуйста, Нажмите здесь, чтобы посмотреть большую версию этой цифры.
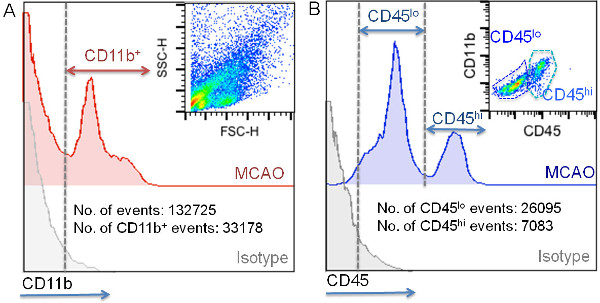
Рисунок 5:. Стробирования стратегии дифференцировать житель из миелоидных клеток, внедренных в ишемической ткани CD11b + клеток были впервые закрытого соответствии с интенсивностью флуоресценции изотипа (A). Представитель точка участок клеточных суспензий ишемического мозга показано в верхнем правом углу панели. ВКроме того, типичные значения для общего количества событий и для количества CD11b-событий, полученные с использованием этого метода показан (кол-во клеток / ишемического полушарие головного мозга;. (А) Анализ CD45 флуоресценции интенсивность CD11b + клеток показан на панели Б. представителем точка участка анализ CD45 и CD11b экспрессии в закрытом CD11b + субпопуляции показано в верхнем правом углу панели. Кроме того, типичный количество CD45 CD45 ло хай клеток, полученных за ишемической полушарии головного мозга с помощью этого метода Показано (В).
| Параметры, используемые для метода Кавальери | |
| Раздел толщина (Т) | 30 мкм |
| Цель | 10X |
| Фрагмент выборки фракция (SSF) | 1/ 20 |
| Расстояние между секциями | 600 мкм |
| Шаг сетки | 100 мкм |
Таблица 1: Параметры, используемые для количественного определения стереологического инфаркта ткани.
| Результаты | Contralesional | Ipsilesional | Инфаркт |
| Площадь (μm²) | 151460000 | 155060000 | 22600000 |
| Объем (μm³) | 90876000000 | 93036000000 | 13560000000 |
| Объем поправкой на За Projection (μm³) | 89957100000 | 92046300000 | 13416600000 |
| Коэффициент ошибок (Gundersen), м = 0 | 0,068 | 0.077 | 0,067 |
| Коэффициент ошибок (Gundersen), м = 1 | 0,015 | 0,017 | 0,015 |
| Коэффициент ошибок (Gundersen), альфа (Q) | 0,068 | 0.077 | 0,067 |
| % Инфарктом полушария | 14.90 | ||
| Мозг Отек (IPS об / Продолжение Vol) | 1.02 | ||
Таблица 2: Характерные примеры contralesional, ipsilesional и инфаркта объемов методом Кавальери, используя стерео следователь программного обеспечения.
| Параметры, используемые для оптических ректификационной колонны | |
| Раздел Толщина (TSF) | 30 мкм |
| Цель | 100X |
| Фрагмент выборки фракция (SSF) | 1/10 |
| Подсчет Высота оправы | 40 мкм |
| Подсчет кадров Ширина | 40 мкм |
| Размер X сетки | 230 мкм |
| Размер X сетки | 230 мкм |
| Безопасный Guard | 2 мкм |
| Оптический Disector Высота | 14 мкм |
Таблица 3: Параметры, используемые для стереологического количественного проникли нейтрофилов после ишемии головного мозга с оптическим ректификационной зонда с помощью стерео следователь программного обеспечения.
| Оценка нейтрофилов по оптической ректификационной колонны | |
| Количество отбора проб сайты | 430 |
| Фактор формы | 6.24 |
| Всего маркеры Счетный | 166 |
| Оценочные Нейтрофилы с помощью оптических ректификационной колонны | 117,608.03 |
| Коэффициент ошибок (Gundersen), т = 0 | 0,22 |
| Коэффициент ошибок (Gundersen), т = 1 | 0,09 |
Таблица 4: типичный пример оцененных проникли нейтрофилов после ишемии головного мозга с оптическим зондом ректификационной колонны с помощью стерео Investigator программного обеспечения.
| CD11b + | Нейтрофилы | Моноциты | Микроглия | |
| Наивный | 25863 ± 4,575.8 | 473 ± 75,8 | 525 ± 191,4 | 19012 ± 1523 |
| Sham 24 ч | 24563 ± 5263 | 873 ± 192,5 | 1124 ± 391,5 | 23734 ± 2910 |
| pMCAO 24 ч | 47922 ± 23174 | 4874 ± 748,7 | 4826 ± 1345 | 35395 ± 10833 |
Таблица 5: Представитель результаты оценочных миелоидных клеток после ишемии головного мозга с проточной цитометрии подхода.
Обсуждение
Церебральный модель ишемии представленные здесь дает очень воспроизводимые объемы инфаркта определяются через 24-48 ч и 7 дней после MCA лигирование различных подходов 8,15,17. Эта модель MCAO имеет низкая смертность (менее 1%) по сравнению с другими, сводя к минимуму количество животных, используемых в исследованиях. Важным шагом для получения этого низкий уровень смертности является поддержание надлежащих условий асептики, чтобы избежать инфекций, которые могут ухудшить выживания после индукции инсульта. Эта модель MCAO не может быть использован только в качестве постоянного модели MCAO, который считается клинически значимых модель для трансляционных исследований 18, но и в качестве временной модели транзиторной перевязки ОСО и MCA с удавкой и задней реперфузии в нужное время 19. Этот метод был успешно использован для мышей и крыс 17,20. Все это свидетельства того, что MCAO перевязкой является высокая универсальная модель церебральной ишемии с несколькими приложениями. Critiкал шаг этого метода является то, что он требует инвазивной хирургии под стереомикроскопом; краниотомия должна быть выполнена очень тщательно, чтобы не повредить скуловой кости, а также MCA. Тем не менее, использование фиктивных животных (которые подвергаются хирургической процедуры, но ОСО и MCA лигирования не выполняется) обеспечивает полезный инструмент для различения хирургической процедуры в зависимости от эффекта. Степень повреждения головного мозга Следуя этой технологии может быть определена количественно несколькими способами. Наш протокол мозга секционирование, прокрашивание Нисслю и последующей оценки объема Кавальери позволяет точного количественного определения поврежденной области и сводит к минимуму количество мышей, используемых в этом типе исследований, поскольку участки последовательного мозга также может быть использован для различных иммуногистохимического анализа. Для лучшего выполнения этой методологии, важно, чтобы выбрать соответствующие параметры, используемые в программном обеспечении стереологии (Таблица 1), которые будут необходимы для оценки йе объем различных регионах по формуле: V = 1 / SSF * F * T * Ер я (SSF является выборочная доля ломтик, Т средняя толщина секций, F является площадь шагом сетки и Ер количество точек, попадающих на структуру).
Дистальный MCAO перевязкой могут быть полезны для характеристики проникли лейкоцитов и клеток субпопуляции иммунных 8,13, что участие в воспалительном процессе после повреждения головного мозга 1-4. Здесь мы предлагаем две различные методики для мозга иммунных клеток характеристики, точного стереологического подхода и анализа проточной цитометрии для более подробной характеристики несколько лейкоциты субпопуляции.
Воспользовавшись серийным срезов головного мозга, количественное определение общего числа нейтрофилов может быть достигнуто с помощью метода оптической ректификационной 16, который оценивает общее количество клеток с количеством клеток пробы остроумиега Систематическое случайной выборки (SRS) набор объективных виртуальных подсчета пространств, охватывающих всю интересующую нас область, в нашем случае область инфаркта, с равномерным расстоянием между объективными виртуальных Подсчет пробелов в направлениях X, Y и Z. Этот метод обеспечивает точный инструмент для оценки общего числа нейтрофилов в ишемических мозга в разное время после перевязки. Хотя это не показано в данном исследовании, этот протокол также может быть использован для оценки различных субпопуляций нейтрофилов после ишемии и 21 для точного количественного определения любой другой клеточной популяции, найденной в ишемической мозга, как и другие проникли лейкоцитов (моноциты / макрофаги) а также для оценки выживших нейронов или даже нейрогенез количественного после инсульта. Самый важный шаг для точной оценки в необходимой области Выбор соответствующих параметров, как те, показано в таблице 3 для нейтрофилов количественного в зоне ишемии.Эти параметры будут использоваться для обеспечения стереологии рассчитать общее количество позитивных клеток (N) с помощью уравнения N = ΣQ- х 1 / SSF х 1 / ASF х 1 / TSF (ΣQ- является общее количество подсчитанных клеток с ректификационной колонны, SSF является раздел выборки фракция, ASF является пробная площадь фракция, и ФБО толщина доля выборки) 5. Хотя эта методика медленнее, чем другие методы количественного (например, анализ нейтрофилов маркеров на мг ткани, денситометрия представительных изображений или числа нейтрофилов в поле зрения), он имеет преимущество, чтобы быть беспристрастным и прочную технику, которая обеспечивает точное количественная оценка количества клеток.
Подход выделение мозга лейкоцитов позволяет одновременно идентификации и количественной оценки нескольких подтипов иммунных клеток без необходимости смещения системы окрашиванием в естественных или генетических манипуляций. После сортировки клеток от характеризуется миелоидной рopulations или их иммуномагнитный разделение может быть использован для нескольких последующих приложений, таких как дальнейших исследований по гена или экспрессии белка. Точную характеристику нейтрофилы, моноциты и микроглии получены с помощью этого метода обеспечивает высокую специфичность по отношению к существующим методам, таким как иммуногистохимических исследований, то преимущество, что позволяет выделить специфические функции в различных миелоидных клеток, которые обеспечивают мозг врожденного иммунного ответа. Кроме того, она может быть дополнительно расширен, чтобы характеризовать других групп мозга с соответствующей меткой, как кровь родилась макрофагов (CD11b + CD45 + CD68 Привет), и он может быть применен для изучения других патологий ЦНС или травмы. Поэтому этот метод обеспечивает необходимый инструмент для изучения неоднородности воспалительной реакции в мозге. Основным ограничением этого метода заключается в подготовке лейкоцитов суспензий из свежих мозговой ткани, которые могут изменитьсостояние активации клеток или их антиген изменения. Хотя этот метод позволяет более подробно качественную характеристику по сравнению с иммуногистохимических исследований, она обеспечивает более точную количественную оценку, основанную на выделении клеток. Несмотря на это, эффективность нашего протокола изолятор похож на других опубликованных методов 9, и он может быть эффективно использован для определения различий в количестве иммунных клеток головного мозга между контролем и MCAO групп или даже между MCAO групп, подвергнутых различных обработок 8.
Основные этапы этого протокола рассечения тканей, процедура разрушение ткани, и удаление миелина. Что касается коллекции тканей, шаг нормализации могут быть включены (путем взвешивания ткани, собранной), чтобы избежать изменчивости в связи с различными рассечение выступлений. Кроме того, нормализация между различными группами MCAO также может происходить через объем инфаркта (ранее определяется магнитной Resonance). Другой способ решения этой проблемы заключается в использовании всей ипсилатерального полушария обоих ишемических и контрольных групп, или даже использовать контралатерального полушария ишемического мыши в качестве контроля, чтобы свести к минимуму количество животных, используемых. Хотя такой подход позволяет избежать различий между каждой вскрытия, он имеет главный недостаток; коэффициент разбавления добавляется за счет увеличения общего количества клеток, но не количество миелоидных клеток, которые исключительно расположенных в основных и пригородных инфаркта областях ипсилатеральном мозга. Что касается разрушение ткани, этот протокол иллюстрирует шаги для механического разрушения клеток головного мозга, избегая ферментативные методы лечения и предотвращения поверхностного антигена изменения 9,22, что является важным вопросом для дальнейшего качественного и количественного анализа воспалительных клеток субпопуляций. В дополнение к подготовке клеточной суспензии интереса, удаление миелина из образцов мозга является настоятельно рекомендуется шаг, чтобы избежать помех downstполосный приложения, такие как разделение иммуномагнитной клеток или проточной цитометрии 23,24. Это может быть достигнуто с использованием различных методов, например сахароза или Перколла градиенты, или анти-миелина шарики. Вот и на основе предыдущих исследований, сравнивающих различные методы выделения подвески клеток головного мозга, механическое разрушение в сочетании с использованием Перколла удалить миелина используется для повышения урожайности клеток и жизнеспособность 25.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was supported by grants from the Spanish Ministry of Economy and Competitiveness CSD2010-00045 (MAM), SAF2012-33216 (MAM), SAF2011-23354 (IL) and RENEVAS RD06/0026/0005 (IL), and from the Local Government of Madrid S2010/BMD-2336 (MAM) and S2010/BMD-2349 (IL). IB and MIC are fellows of the Spanish Ministry of Economy and Competitiveness.
Материалы
| Name | Company | Catalog Number | Comments |
| Photonic Led F1 | WPI | 571329-8 | Equipment |
| Temp Controller | Panlab | HB 101/2 | Equipment |
| Volvere GX | NSK | Ne22L | Equipment |
| Microscope | WPI | PZMIII-BS | Equipment |
| Stainless Steel Burrs | FST | 19007-14 | Surgical material |
| Forceps Dumont #5/45 | FST | 11251-35 | Surgical material |
| Forceps Dumont #5SF | FST | 11252-30 | Surgical material |
| Suture 6/0 | LorcaMarin | 55108 | Surgical material |
| Suture 9/0 | LorcaMarin | 61966 | Surgical material |
| Nikon Eclipse | Nikon | TE300 | Equipment |
| Isoflurane | Esteve | 571329-8 | Chemical |
| Sodium Pentobarbital | Vetoquinol | 570681 | Chemical |
| Freezing microtome | Leica Microsystems GmbH | SM2000R | Equipment |
| Superfrost slides | Thermo Scientific | 2014-07 | Lab material |
| Cresyl violet acetate | Sigma | C5042 | Chemical |
| Microscope | Nikon | Nikon Eclipse TE300 | Equipment |
| XYZ motorized computer stage and controller | Ludl electronics Products | Equipment | |
| Stereo Investigator System | Microbrightfield | Version 7.003 software | Software |
| 5 ml Tissue Grinder, Potter-Elv with teflon pestle | Thomas Scientific | 0913X70 | Lab Material |
| Polypropylene 50 ml Oak Ridge Centrifuge Tube | Nalgene | 3119-0050 | Lab material |
| Percoll | Sigma | p1644-100 | Chemical |
| RPMI 1640 | Lonza | BE12-702F | Chemical |
| Beckman Ultracentrifugue | Beckman Coulter | Equipment | |
| Beckman Coulter ultracentrifuge rotor 45 Ti | Beckman Coulter | Equipment | |
| BD Sterile Cell Strainer, 40 Micron | BD | BD 352340 | Lab Material |
| Bovine Serum Albumin | Sigma | A3733-500G | Reagment |
| FcR Blocking Reagent, mouse | Miltenyi | 130-092-575 | Antibody |
| CD11b-FITC, human and mouse | Miltenyi | 130-098-085 | Antibody |
| CD45-PE, mouse | Miltenyi | 130-102-596 | Antibody |
| Anti-Ly-6G-APC, mouse | Miltenyi | 130-102-936 | Antibody |
| PerCP/Cy5.5 anti-mouse Ly-6C | Biolegend | 128012 | Antibody |
| BD FACS Flow | BD | 342003 | Reagment |
| BD FACSCalibur; 4-color | BD | 342975 | Equipment |
| BD Cell Quest Pro Software | BD | Software | |
| FlowJo software | Treestar inc. | Software |
Ссылки
- Chamorro, A., et al. The immunology of acute stroke. Nature Reviews. Neurology. 8, 401-410 (2012).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nat Med. 17, 796-808 (2011).
- Ramlackhansingh, A. F., et al. Inflammation after trauma: microglial activation and traumatic brain injury. Annals of Neurology. 70, 374-383 (2011).
- Jin, R., Yang, G., Li, G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells. J Leukoc Biol. 87, 779-789 (2010).
- West, M. J., Slomianka, L., Gundersen, H. J. Unbiased stereological estimation of the total number of neurons in thesubdivisions of the rat hippocampus using the optical fractionator. The Anatomical Record. 231, 482-497 (1991).
- Charleston, J. S. Estimating cell number in the central nervous system by stereological methods: the optical disector and fractionator. Current Protocols in Toxicology. 12 (Unit 12.6), (2001).
- Begega, A., et al. Unbiased estimation of the total number of nervous cells and volume of medial mammillary nucleus in humans. Experimental Gerontology. 34, 771-782 (1999).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARgamma Agonist Rosiglitazone. Stroke; a. Journal of Cerebral Circulation. 44 (12), 3498-3508 (2013).
- Campanella, M., Sciorati, C., Tarozzo, G., Beltramo, M. Flow cytometric analysis of inflammatory cells in ischemic rat brain. Stroke. 33, 586-592 (2002).
- Carson, M. J., Reilly, C. R., Sutcliffe, J. G., Lo, D. Mature microglia resemble immature antigen-presenting cells. Glia. 22, 72-85 (1998).
- Perego, C., Fumagalli, S., De Simoni, M. G. Temporal pattern of expression and colocalization of microglia/macrophage phenotype markers following brain ischemic injury in mice. J Neuroinflammation. 8, 174(2011).
- Denker, S. P., et al. Macrophages are comprised of resident brain microglia not infiltrating peripheral monocytes acutely after neonatal stroke. Journal of Neurochemistry. 100, 893-904 (2007).
- Ballesteros, I., et al. Rosiglitazone-induced CD36 up-regulation resolves inflammation by PPARgamma and 5-LO-dependent pathways. Journal of Leukocyte Biology. 95 (4), 587-598 (2013).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. J Microsc. 150, 117-136 (1988).
- Hernández-Jiménez, M., et al. Silent Information Regulator 1 Protects the Brain Against Cerebral Ischemic Damage. Stroke. 44 (8), 2333-2337 (2013).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96, 857-881 (1988).
- Godino, M. E. C., et al. Amelioration of ischemic brain damage by peritoneal dialysis. J Clin Invest. 123, 4359-4363 (2013).
- Hossmann, K. A. The two pathophysiologies of focal brain ischemia: implications for translational stroke research. J Cereb Blood Flow Metab. 32, 1310-1316 (2012).
- García-Yébenes, I., et al. Iron overload, measured as serum ferritin, increases brain damage induced by focal ischemia and early reperfusion. Neurochem Int. 61, 1364-1369 (2012).
- Sobrado, M., et al. Synthesis of lipoxin A4 by 5-lipoxygenase mediates PPARgamma-dependent, neuroprotective effects of rosiglitazone in experimental stroke. J Neurosci. 29, 3875-3884 (2009).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARγ Agonist Rosiglitazone. Stroke. 44, 3498-3508 (2013).
- Ford, A. L., Foulcher, E., Goodsall, A. L., Sedgwick, J. D. Tissue digestion with dispase substantially reduces lymphocyte and macrophage cell-surface antigen expression. Journal of Immunological Methods. 194, 71-75 (1996).
- Pfenninger, C. V., et al. CD133 is not present on neurogenic astrocytes in the adult subventricular zone, but on embryonic neural stem cells, ependymal cells, and glioblastoma cells. Cancer Research. 67, 5727-5736 (2007).
- Tham, C. S., Lin, F. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. International Journal of Developmental Neuroscience : the Official Journal of the International Society for Developmental Neuroscience. 21, 431-443 (2003).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9, 147(2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены