Method Article
Geçici veya kalıcı Serebral İskemi Modelinde lökosit alt popülasyonlarının Stereolojik ve Sitometrisi Karakterizasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Inme sonrası beyin miyeloid hücreler karakterizasyonu optik parçalama yöntemi kullanılarak stereolojinin tarafından gerçekleştirilen, ya da beynin bir akım sitometri ile süspansiyonları lökosit olabilir. Her ikisi de iskemik beyin bulundu ana miyeloid hücre alt doğru fenotipik ayrımı gerçekleştirmek için yararlı teknikler vardır.
Özet
Mikroglia aktivasyonu, aynı zamanda kan oluşumu, makrofajların ve nötrofillerin ekstravazasyon, felç sonrası beyin hasarına önemli bir rol oynadığına inanılmaktadır. Bu miyeloid hücre alt popülasyonlar farklı fenotipleri ve işlevleri görüntülemek ve seçkin olması gerekir ve doku hasarına onların düzenleme ve katkı çalışma özelliği olabilir. Kesin stereolojik yaklaşım ve bir akım sitometri analizi: Bu protokol beyin bağışıklık hücre karakterizasyonu için iki farklı metodolojiler sağlar. stereolojik yaklaşım sistematik rastgele örnekleme yöntemi ile hesaplanan tahmini faiz (enfarkte beynin) bir alanda hücrelerin toplam sayısını hesaplar optik parçalama yöntemine dayanmaktadır. İkinci karakterizasyon yaklaşımı beyin lökosit süspansiyonları izole etmek ve mikroglianın karakterizasyonu için izin flow sitometri onları karakterize için basit bir yol sunar, monositler ve iskemik doku nötrofillerin sızmış. Buna ek olarak, aynı zamanda, dözel bir ölüm oranı düşük ve Cavalieri yöntemi ile enfarktüs hacmini tanımlamak için histolojik beyin işleme prosedürü ile yüksek oranda tekrarlanabilir infarkt üretilmesi, beyin korteksi etkiler farelerde serebral iskemi modeli etails.
Giriş
Morfolojik, fenotipik ve gen ifadesi mikrogliya değişiklikler yanı sıra ekstravazasyon ve hematojen makrofajlar ve nötrofillerin aktivasyonu beyin hasarı 1-4 aşağıdaki patofizyolojik kaskad bir rol oynadığına inanılmaktadır. Bu protokol iki yaklaşım iskemik beyin farklı miyeloid hücre alt sayısını tahmin etmek ve onların fenotipik karakterizasyonu gerçekleştirmek için sağlar. Buna ek olarak, aynı zamanda, nasıl infarkt değerlendirmek için de dahil olmak üzere, her iki distal Orta Serebral Arter geçici veya kalıcı ligasyonu (MCA) ve ortak karotid arter (CCA) oluşur farelerde serebral iskemi deneysel modelinde, bir açıklamasını sağlar stereolojik yazılımı kullanarak doğru Cavalieri yöntemi ile.
iskemik beyin miyeloid hücre alt kümelerini karakterize ilk yaklaşım optik parçalama yaklaşımı 5 dayalı bir stereolojik yöntemdir. Bu en çokyaygın yaşam bilimleri stereolojik sonda kullanılan ve hata 5-7 düşük katsayılı hassas bir yüksek derecede sağlar. Çünkü bölüme dokusunun parçalanması hücre tahminine önyargı önler gibi doku, bölümler halinde kesilir Bu hücre ölçümü için en iyi seçimdir. Bu yöntem numaraları, dinamikleri ve iskemik dokuda 8 sızmış nötrofil alt popülasyonlarının fenotipik değişiklikleri tanımlamak için çok güçlü bir yoludur.
İkinci karakterizasyon yaklaşımı beyin lökosit süspansiyonları izole etmek ve akış sitometri onları karakterize etmek basit bir yol sağlar Campanella ve ortak 9 bir modifiye protokol dayanmaktadır. Geleneksel imünohistokimyasal teknikler aksine, bunların diff göre miyeloid hücreler (CD45 yüksek CD11b +) Özellikleri (CD45 lo CD11b +) mikroglia arasında ayrım sağlar akış sitometrisi ve infiltreCD45 9-13 erent ifade seviyeleri. Buna ek olarak, pro-enflamatuar monositler (CD45 yüksek CD11b + Ly-6G - Ly-6C yüksek), nötrofil (CD45 yüksek CD11b + Ly-6G +) ve iskemik doku ve diğer lökositler alt grupları ayırt edilebilir. Bu yaklaşım, beyin iskemisi deneysel modellerinde nöro-inflamasyonu değerlendirmek için güvenilir ve hızlı bir deney sağlar. Bununla birlikte, doku işleme aktivasyon durumunu ve bir yarı-kantitatif karakterizasyonu sağlayan iskemik doku içinde bulunan farklı hücre popülasyonlarının numaraları etkileyebilir.
Protokol
NOT: Universidad Complutense Hayvan Refahı Komitesi kurallarına uyulması tüm deneysel protokolleri (AB direktifleri 86/609 / CEE 2003/65 / CE takip).
1. Serebral iskemi Modeli
NOT: Bu yazıda serebral iskemi modeli naylon sütür ile ligasyon ile CCA (karotis arter) ve MCA (orta serebral arter) hem de daimi veya geçici oklüzyonu içerir.
- Ameliyat öncesi preparasyonlar
- Otoklav veya bir cam boncuk sterilizatör tüm cerrahi aletler sterilize. De% 70 etanol ile cerrahi alan dezenfekte edin.
- Uygun anestezik ile fare anestezisi. Izofluran% 2.5 ile uyarılmasını elde ve bir buharlaştırıcı kullanılarak% 80 hava /% 20 oksijen karışımı içinde izofloran ile birlikte% 1.5 korur. Anestezi altında iken kuruluğu önlemek için fareler gözlerine yapay gözyaşı uygulayın.
- Bir ücret bağlantılı bir ısıtma yastığı üzerinde fare yerleştirincerrahi işlem sırasında fizyolojik düzeyde bir sıcaklık rektum yerleştirilir sonda ve ayarlanan sıcaklığa (36.5 ± 0.5 ºC) ile dback cihaz.
- Ligasyonu ile karotid arter tıkanıklığı
- Sırt yatma fare koyun ve bant ile hareketsiz. % 70 etanol veya povidon-iyodür ile cildi dezenfekte ve üst karın kısmının saçlarını kesti.
- Bir cerrahi mikroskop altında, boynun ventral yüzeyi etrafında 1 cm orta hat kesi yapmak.
- Dışında tüm yumuşak dokuları (sub maksiller, dilaltı ve parotis bezleri dahil bez dokusu) çekin ve trakea lateral lokalize sol karotis arter (CCA), tespit. Kasları geri çekin ve sol CCA maruz. Dikkatle vagus sinirinden teşrih.
- Bir kez 6/0 naylon dikiş kullanılarak dikilen bıraktığı CCA tıkamak, disseke. (Geçici serebral iskemi modeli isteniyorsa reperfüzyona izin verecek şekilde), sürekli bir düğüm veya hareketli düğüm Arter.
- Orijinal konumuna bez doku yerleştirin ve bir 6/0 naylon sütür ile boyun cilt üzerinde kesi kapatın.
Not: Sahte hayvanlar MCAO hayvanlarla aynı cerrahi prosedürüne tabi tutulur, ancak CCA engellenmemiştir.
- Ligasyonu ile distal orta serebral arter tıkanıklığı
- Sağ tarafta fare yerleştirin ve bant ile hareketsiz. % 70 etanol veya povidon-iyodür ile kafa cildi dezenfekte ve fare kafasının saç kesmek (kestikten sonra saç kaldırmak).
- Bir cerrahi mikroskop altında, göz ve kulak arasındaki bir cilt kesi yapmak. Uzakta cilt taşıyın ve bantla tutun.
- Sağdan sola doğru zamansal kas yatay bir kesi yapmak. Ardından, zamansal kas sağ tarafında ikinci bir düşey kesi yapmak (kesme zamansal ven önlemek için dikkatli olun). Kafatası zamansal kas dışında çekin ve temiz bir kafatası yüzeyi korumak için bir dikiş ile tutun.
- Kafatası yüzeyi temizleyinsoğuk steril serum fizyolojik ile kafatası şeffaflık yoluyla sol Orta Serebral Arter (MCA) tam konumunu algılamak için. Elmacık kemiği kemer ve skuamöz kemik arasındaki frontal lobda bir paslanmaz çelik çapak ile bir yuvarlak kraniyotomi (çapı 1 mm) gerçekleştirin. Dikkatle kafatası çıkarın ve MCA maruz.
- Beynin yüzeyine soğuk steril tuzlu su çözeltisi küçük bir miktar uygulayın ve forseps kullanarak meninksler (dura ve araknoid mater) çıkarın.
- Sadece frontal ve posterior MCA dalları arasındaki çatallanma önce uzak gövde sol MCA ligasyonu gerçekleştirin. Bir 9/0 naylon dikiş kullanılarak dikilen tarafından sol MCA tıkamak. (Geçici serebral iskemi modeli isteniyorsa reperfüzyona izin verecek şekilde), sürekli bir düğüm veya hareketli düğüm Arter. CCA ve MCA oklüzyonu arasındaki süre, operatör deneyimine bağlı olarak yaklaşık 10-20 dakikadır.
- Orijinal konumuna zamansal kas yerleştirin ve incisio kapatınBir 6/0 naylon sütür ile boyun cilt üzerinde n.
- Anestezi (genellikle 5-10 dk) kurtarmak ve buprenorfin intraperitoneal (IP) (0.3 mg / kg) ile fare enjekte kafes fare dönün.
- Herhangi bir rahatsızlık tespit birkaç saat için fare Monitör (sternal yatma korumak için yeterli bilinci yerine kadar gözetimsiz fare bırakmayın). Kayıp ameliyat sonrası kilo, genel olarak görülmektedir, çünkü yemek kolaylaştırmak için bir Petri kabındaki püresi gıda yerleştirin.
- Hayvan tamamen iyileşti olduğunda, diğer hayvanların şirkete dönmek.
- Bir geçici MCAO modeli isteniyorsa, yine fare uyutmak ve (genellikle 0.5-2 saat (Şekil 1) arasında) reperfüzyon izin CCA ve MCA slipknot çıkarın.
Not: Sahte hayvanlar MCAO hayvanlarla aynı cerrahi prosedürüne tabi tutulur, ancak MCA engellenmemiştir.
2. Perfüzyon ve sectiBeyin Doku oning
- 24 veya MCAO'dan sonra 48 saat, ölümcül bir anestezik dozu (örneğin, sodyum pentobarbital, IP 86 mg / kg veya izofluran ile bir doz aşımı) ile fare feda.
- Fosfat tamponu içinde% 4 paraformaldehit (PFA) (pH 7.4) ve ardından fosfat tamponu, 0.1 M ile fare serpmek.
- Aşağıdaki gibi beyin kaldırın:
- Sadece omurilik üzerinde hayvan başını kesmek.
- Kafatası açığa çıkarmak için kafa derisi üzerinde bir arka-ön kesi yapmak. Yan duvarların birleştiği ve kafatası tabanında iki yan keser ve kemik küçük bir parça kaldırın.
- Sagital sütür boyunca kafatası yoluyla bir kesim olun.
- Beyin maruz bir forseps kullanarak her yarımkürede örten kafatası çıkarın. Kafatası beyin ayırmak ve% 4 PFA çözeltisi içine aktarmak için bir spatula kullanın.
- 4 ° C'de% 4 PFA çözeltisi içinde 3 saat sonrası düzeltme.
- PFA çözeltisi ve incubat kaldırbeyin cryoprotect% 30 sukroz çözeltisi içinde 48 saat boyunca beyin e.
- Sakaroz çözüm çıkarın ve soğuk izopentan (-40 ºC) hızlı beyin dondurma. Mağaza -80 ° C'de dondurulmuş beyin.
- Bir donma mikrotom ile koronal beyin bölümleri (30 mikron) edinin. Bir karyo-koruyucu çözelti içinde on seri kümeleri toplayın. Her seri seti yeterli bregmaya 1.94 ve -2,46 posterior arasındaki fare beyin örnek 300 mikron bir kesit mesafesi etrafında 14-16 koronal dilim oluşmaktadır.
3. Nissl Boyama ve Enfarktüs Hacim Tahmini
- Cresyl menekşe ile Nissl boyama
- Bir SuperFrost mikroskop lamı içine Dağı beyin bölümleri. 7-8 bölümden, yaklaşık olarak toplam, Nissl-boyalı kesitlerde Cavalieri yöntemi ile enfarktüs hacmi belirlenmesi için, 1/20 dilim örnekleme fraksiyonu (adım 2.7 toplanan on seri kümeleri birinin 1/2 bölümleri kullanabilir 600 μ bir içi mesafe ileM) kullanılır. Uygun ön-arka yönünü korumak için dikkatli olun (infarkt alan sağ tarafında yerleştirilir).
- Aşağıdaki gibi geleneksel Nissl boyama gerçekleştirin:
- Slayt monte bölümlerde bazı saat kurumasını bekleyin.
- Slayt monte bölümleri rehidrate ve 5 dakika boyunca% 0.1 kresil menekşe renkli çözelti ile boyanır.
- EtOH kademeli bir dizi kurutmak (% 70,% 90 ve% 100, değişiklik başına 5 dakika). Ksilen ile slayt monte bölümleri temizleyin, distrene-80 plastikleştirici ksilen (DPX) montaj medya eklemek ve bir cam lamel ile kaplayın.
- Içinde Cavalieri yöntemi ile enfarktüs hacmini tahmin etmek stereolojik yazılımı kullanma seri bölümleri Nissl-lekeli
- (Cavalieri yöntemi 14 ve bir kamera, XYZ motorlu bilgisayar aşama ile donatılmış bir mikroskop oluşan bir stereoloji sistemi ve stereolojik yazılım tarafından enfarktüs hacmini ölçmek için ana Tablo 1 'de gösterilen parametreleri kullanarak) Aşağıda verilen tarifi PC'ler ile ilgili ama tarifi diğer işletim sistemleri için farklı olabilir.
- Uygun sırayla PC, mikroskop, sahne denetleyicisi ve kamera açın. Stereolojik yazılımını başlatın.
- Yerine 10X objektif hareket ettirin ve açılan menü objektif açılan 10X seçin.
- İlk Nissl-lekeli bölümünde etrafında Taşı ve uygun bir referans noktası bulmak. Referans noktası oluşturmak için fareyi tıklayın (aktif sevinç serbest düğmeye için gerekli hareket etmek).
- "Bağlı kesit kalınlığı" (büzülme göz önünde bulundurularak mevcut kesit kalınlığı) tahmin edilmesi. "Odak Pozisyon Metre" düğmesine basın ve bölümün üstüne alttan kalınlığı hesaplamak.
- Contralesional ve ipsilesional alanları ve enfarktlı alan için bir kontur aracı oluşturun.
- Menü "Display" üzerine tıklayın ve "Ekran Ayarları" seçin. Bu t açarO Ayarlar Dialog görüntüler.
- "Kontur türü eklemek" "Çevreler" sekmesini seçin ve düğmesine tıklayın.
- Ölçmek ve menüde aşağı kontur onları görünür hale getirmek için her bölge için bir kontur oluşturma. Tamam'a tıklayın.
- Contralesional ve ipsilesional hemisfer ve enfarktlı alan için bir Marker aracı oluşturun.
- Menü "Display" üzerine tıklayın ve Ekran Ayarları iletişim kutusunu açmak için "Ekran Ayarları" seçin.
- "Işaretlerini" sekmesini seçin ve mevcut belirteçler üzerinde çift tıklayarak adını işaretçileri değiştirin. Marker Bar onları görünür hale getirmek. Tamam'a tıklayın.
- Bölüm yöneticisi etkinleştirin.
- Menüsünden "Araçlar / Seri Bölüm Yöneticisi" üzerine tıklayın. "Yeni bölüm" butonu ile yeni bir bölüm ekle. Bu düğme "Seri Bölüm Ayarı iletişim kutusunu" açar.
- 30 mikron olarak "Blok Advance" olarak ayarlayın. SetAdım 3.2.5 tahmini değeri ile "monte kesit kalınlığı".
- 20. Kullanım olarak "Değerlendirme Aralığı" 1/20 dilim örnekleme fraksiyonu ayarlayın.
- 0. tıklayın OK olarak "ilk bölümün üst Z ekseni değeri" Set 1 olarak "başlangıç bölümü numarası" olarak ayarlayın.
- Kontralateral yarımkürede anahat bir kontur çizin.
- Contralesional hemisfer aracını seçin menüsünden aşağı konturundan (daha önce adım 3.2.6 oluşturulan).
- Kontralateral yarımkürede anahat bir kontur çizin.
- Contralesional yarımkürede izleme bitirmek için, farenin sağ tuşunu tıklayın ve "yakın kontur" seçeneğini seçin.
- Cavalieri tarafından contralesional hemisfer konturu tahmin.
- Menüsünden "Problar" üzerine tıklayın ve Cavalieri Tahmincisi seçin. 100 mikron olarak "Izgara Aralığı" olarak ayarlayın. 0. "B Set olarak" Izgara Döndürme "Set30 mikron olarak "Advance kilitleyin. Tamam'a tıklayın.
- İşaretleyiciler Bar "contralesional yarımküre" düğmesini seçin. Sağ hemisfer Contralesional kontur içini tıklatın.
- "Boya Cavalieri İşaretleyiciler Modu" seçin. Sağ tekrar contralesional hemisfer konturu içini tıklatın ve "Kontur içine Boya İşaretçilerini" seçeneğini seçin.
- Prob ve Cavalieri Tahmin tıklayarak Cavalieri Tahmincisi devre dışı bırakın ve işaretleyici bardan contralesional işaretleyici düğmesini devre dışı bırakın.
- Ipsilesional yarımkürede ve infarkt alanı (adımlar 3.2.7 ve 3.2.8) için aynı işlemi tekrarlayın. Her bölümün alanının tahmini sonra verileri kaydetmek.
- Nissl-lekeli bölümün geri kalanında, kontralateral ipsilesional ve enfarktlı alanları hesaplayın.
- Adım 3.2.6 olarak yeni bir bölüm oluşturun. "Seri bölümü, Kur" iletişim kutusunda girilen değerleri değişiklik yapmayın. Ok tıklayın.
- Adımları tekrarlayın 3.2.7-3.2.8 yeni bölümünde.
- Bir elektronik tablo dosyasına miktar sonuçlarını verin.
- Stereo Araştırmacı Menüsünde "Probları" tıklayın. "Ekran Probe Run List" seçeneğini seçin. Bu "Önceki Stereolojik Dialog çalıştırır" açılır.
- Bunların üzerine tıklayarak tüm bölümleri seçin. "Sonuçları Göster" butonuna basın. Bu, her bölge için tahmini alan ve hacim görüntülenir nerede "Cavalieri Tahmin Sonuçlar" açılır.
- Bir elektronik tablo dosyasına sonuçları aktarmak için, her bölgede (Tablo 2) elde edilen ana sonuçlar dosyası bir excel için "Panoya kopyala tüm Sonuçları" ve yapıştır tıklayın.
- Mm 3 veya nerede formül% 15 IH = InfVol / ContrVol * 100 kullanan (% İH) enfarkte olan yarımkürenin% olarak Ekspres enfarktüs hacmi
ContrVol (Contralesional Yarımküre Hacmi) = ΣContrArea i
Optik parçalama tarafından Serebral iskemi sonrasında sızmış Nötrofiller 4. Stereolojik Ölçümü
- Beyin kesitlerinin boyanması:
- Optik kincinin 16 tarafından MCAO sonra sızmış nötrofil sayısını tahmin için, bir dilim 1/10 örnekleme fraksiyonu kullanın. Sıçan anti-Ly6G antikor (1A8) ve serbest yüzen bölümlerde sağ ikincil antikor ile geleneksel İmmunofloresans teknikleri kullanılarak immunostain nötrofiller. Bu nötrofil tanımlanması için gerekli değildir, ancak ek olarak, bir, DAPI veya TOPRO gibi nükleer makinesi ile karşıt, enfarkte alanı tespit etmek daha kolay yapabilir.
- Sağ tarafta yer infarkt alanı ile bir SuperFrost mikroskop lamı içine Dağı beyin bölümleri.
- QuantificOptik kincinin tarafından iskemik beyin sızmış lökositlerin tirme
- Tablo 3'te gösterilen kullanın parametreleri stereoloji sistemi ile optik parçalama yaklaşımla iskemik beyin infiltre lökositler ölçmek için. Bölüm 3 den adımları 3.2.1-3.2.5 tekrarlayın.
- Bu bölüm 3 aşama 3.2.6 tarif edildiği gibi enfarkte alan için bir kontur aracı.
- Bu bölüm 3 aşama 3.2.7 tarif edildiği gibi nötrofil için bir işaret aracı.
- Bölüm yöneticisi etkinleştirin ve adım 3.2.8 gibi yeni bir bölüm oluşturun. Bu durumda, (1/10 dilim örnekleme fraksiyonu nötrofil sayısını tahmin etmek için kullanılır) 10 gibi "Değerlendirme Aralığı" olarak ayarlayın.
- "Enfarktüslü Alanı" kontur aracını seçin menüsünden aşağı konturundan (daha önce adım 4.2.1 oluşturulan). 10X amaca enfarkte alan anahat bir kontur çizin. Neutroph gerçekleştirmek için 100X için objektif değiştirmeil miktar (menü aşağı objektif açılan 100X seçmek unutmayın).
- Menü "Sondalar" üzerine tıklayın ve "Optik parçalama" seçeneğini seçin. X ve Y ızgara boyutu her ikisi için 230 "Çerçeveler sayma XY Yerleştirme" olarak ayarlayın. 30 mikron olarak "Blok Advance" 0 Set olarak "Izgara Döndürme" olarak ayarlayın. Tamam'a tıklayın.
- Marker Bar konumuna "nötrofil" düğmesini seçin. Mark Enfarktüslü alanda nötrofil lekeli. Bitirmek kez, "Sondalar" ve "Optik parçalama" üzerine tıklayarak Optik Parçalama probu devre dışı bırakın. Işaretleyici bardan nötrofil düğmesini devre dışı bırakın.
- Her bölümde (4.2.4-4.2.9) için aynı işlemi tekrarlayın.
- Bir elektronik tablo dosyasına miktar sonuçlarını verin.
- Stereo Araştırmacı Menüsünde "Probları" tıklayın. "Önceki Stereolojik Runs" açmak için "Probe Run Listesini Göster" seçeneğini seçiniletişim.
- Bunların üzerine tıklayarak tüm bölümleri seçin. Nötrofil tahmini sayısı görüntülenir "Optik Parçalama Sonuçlar" açmak için "Sonuçları Göster" butonuna basın.
- Bir elektronik tablo dosyasına "Panoya kopyala tüm Sonuçları" ve yapıştırın tıklayarak elektronik tablo dosyasına sonuçları ihracat.
5. Beyin Ayrılma ve Sitometrisi Analizi
Not: taze beyin dokusu üzerinde akış sitometrisi ile myeloid alt popülasyonu karakterizasyonu sabit ve immunosteyn beyin kesitleri üzerinde gerçekleştirilen, önceki nötrofil karakterizasyonu için bir alternatif olarak kullanılabilir.
- Beyin ayrışma ve tek hücre süspansiyonu hazırlanması
- Yap 10 ml / RPMI (Roswell Park Memorial Institute ortamı) olarak hayvan RPMI 8 ml,% 30 Percoll 1 ml 10x PBS (fosfat tamponlu tuzlu su) ile 1 ml su ihtiva eden çözelti, -Percoll.
- RAdım 2.3 açıklandığı gibi MCAO sonra aldır fare beyin.
- Bir mikroskop altında, beyin beyin iskemik fare ipsilateral korteks (ya da sahte ve naif hayvanlar için benzer bir bölge) çekirdek ve peri-enfarktüs alanları dışında teşrih. Ağırlık beyin dokusu ve buz-soğuk RPMI-Percoll (ağırlık adım Deney grupları arasında normalleştirme için gerçekleştirilebilir), 5 ml içine yerleştirin.
- Teflon havan elleri ile bir Potter-Elvehjem tipi doku öğütücü kullanılarak tek bir hücre süspansiyonu olarak doku ayrıştırmaları.
- 50 ml'lik ultrasantrifüjdeki tüp hücre süspansiyonları aktarın ve örnekleri RPMI-Percoll çözeltisi 5 ml daha ekleyin.
- 25 ° C'de 30 dakika boyunca 7800 x g'de hücre süspansiyonları santrifüjlenir. Santrifüj işleminden sonra, miyelin karşılık gelen beyaz renkli tabaka çözeltisinin üstünde görünmesini sağlamak.
- 40-mikron naylon elek straine yoluyla top haline gelmiş hücreler de dahil olmak üzere, dikkatli bir şekilde, miyelin tabaka alındı ve bütün hücre süspansiyonları filtrer.
- 50 ml tüp çözümü tüm hücreleri süzülür emin ve yerleştirmek için süzgeç üzerine RPMI 10 ml ekleyin. Oda sıcaklığında 10 dakika boyunca 600 x g'de hücre süspansiyonu, 50 ml RPMI 30 ml ilave edilir ve santrifüj.
- Süpernatantı atın ve PBS 1 ml lökosit pelletini. Liziz tamponu (150 mM NH4CI, 10 mM NaHCO3 ve 0.1 mM EDTA) 'nın 4 ml ilave edilir ve hücre süspansiyonu, eritrositleri lizise uğratmak üzere, oda sıcaklığında 2-3 dakika boyunca kuluçkalayın. 4 ° C'de 10 dakika boyunca 600 x g'de çözeltisi santrifüjleyin.
- Hücre boyama ve akış sitometrisi
- PBS-BSA (% 1), 1 200 ul ihtiva eden, akış sitometrisi için bir etiketleme kokteyli elde 100 Fc Block, 01:40, anti-CD45-PerCP sıçan, 01:40, anti-Ly6G APC sıçan, 01:40, anti CD11b-FITC sıçan ve numune başına 01:40 anti-Ly-6C-PE sıçan.
- Etiketleme kokteyl hücrelerin tekrar ve buz 45 dakika örnekleri inkübe.
- Etiketleme kokteyl yıkayın1 soğuk PBS ilave edildi ve santrifüj 4 ° C 'de 10 dakika boyunca 600 x g'de hücreler. FACS Akış 100 ul ile pelet yeniden süspanse edin ve akış sitometrisi ile tüm hücre süspansiyonu elde etmek.
- Hücre popülasyonlarının karakterize ve ölçmek için analiz yazılımı sitometri akışı kullanın.
- CD45 lo CD11b +: şöyle Bu protokol hazırlanan etiketleme kokteyl karşılık gelen ana lökosit alt grupları karakterize edilebilir ikamet mikrogliyal hücreleri; CD45 hi CD11 + Ly-6G +: nötrofiller; CD45 hi CD11 + Ly-6G - Ly-6C hi: pro-inflamatuar monositler.
Sonuçlar
Burada gösterilen serebral iskemi modeli striatum sulama MCA lenticulostriatal kolları (Şekil 1) tıkalı değildir, çünkü striatal doku etkilemeden kortekste sadece görülen infarkt oluşturur. Nissl boyama ile, hasarlı alan bir hipokrom kortikal alanda (Şekil 2) olarak tespit edilebilir. Bu model Nissl-lekeli bölümlerde Cavalieri yöntemi ile tahmin MCAO (% 15.89 ± 0.28 IH) (Şekil 2) 24 saat sonra yüksek tekrarlanabilir enfarktüs hacimleri ile karakterizedir. Cavalieri yöntemi ile infarkt hacmi tahmini contralesional ve ipsilesional hemisferde Gundersen hata (CE) katsayısı hem de infarkt alanı (Tablo 2) yansıyan bir düşük hata ile doğru bir yaklaşımdır. Hasar gören doku hacmi mm 3 hem de bölüm 3.2.13 formül kullanılarak% IH olarak ifade edilebilir. Buna ek olarak, tahminiipsilesional ve contralesional bölgelerin toplam hacminin enfarkte hacim düzeltilmesi için hasarlı dokuya (Tablo 2) olan yüksek değerleri bilmek ödem endeksinin hesaplanmasında sağlar.
Beyin dokusunun seri kesit işleme göz önüne alındığında, bu Optik Parçalama yaklaşımı (Şekil 3 ve Tablo 4) kullanılarak, iskemik alanda, infiltre nötrofil gibi, hücre alt tamsayısının doğru tahmin gerçekleştirmek için bir avantaj alınabilir Tablo 3'te gösterilen parametreler ile. Bu protokol, 24 saat sürdürüldü ve pMCAO (Şekil 3D), sonra farede 82.856 ± 8.143 48'de saatte 23.328 ± 3.623 ve infarkt alanı nötrofillerin (Ly6G-pozitif hücreleri), toplam sayısını belirler. Önceki çalışmalarla uyumlu olarak, nötrofil infiltrasyonu doğrudan infarkt (Şekil 3E) ile ilişkilidir. T TahminiOptik Parçalama yöntemiyle nötrofil o sayı Gundersen (Tablo 4) CE tarafından yansıtılır, düşük hata ile doğru bir yaklaşımdır.
lökosit izolasyonu ve karakterizasyonu protokolü flow sitometri iskemik farelerin ipsilesional yarımkürenin korteks 47.922 ± 23.174 miyeloid hücrelerin izolasyonu sağlar. Bu hücre süspansiyonu içinde bulunan toplam olayların% 10-30 ihtiva etmektedir. Hücresel enkaz (Şekil 4) ilişkili bu protokolü mevcut düşük FSC parametresi kullanılarak çekilen olayların büyük çoğunluğu. CD11 boyama CD11b + hücrelerinin daha önce belirtildiği gibi bu, 200 9'da FSC eşiği ayarı ile analiz dışında olabilir ki, hücre döküntüsü, bu işaretleyici ile etiketlenmiş olmadığını göstermektedir ve (Şekil 4) daha yüksek bir FSC değerine sahip olduğunu göstermektedir. Bu yöntemle elde edilen hücre enkaz değişebilen miktarda örnek süreci o farklılıkları göstermektediring (zamanlama, doku koruma, örnek sıcaklığı, verimli miyelin kaldırma, vb) bunun için hesap edebilirsiniz. Buna ek olarak, hücre süzgeçler kullanımı da örneklerde hücresel kelepçeler yok etmek için gerekli olan; Bu aşama, hücre boyama için yapılması gerekmektedir. CD11b ve CD45 ekspresyonu göre Şekil 5'te gösterilen yolluk strateji kullanarak, iskemik doku içinde yerleşik ve infiltre miyeloid hücrelerin birbirinden ayırabilir. Iskemik hemisferde bu CD11 + popülasyonu artar (Şekil 4, Şekil 5 ve Tablo 5) saf ve bu hücreler, çoğunlukla mikroglia iskemi sonrası çoğalan gösteren CD45 düşük ekspresyonu ile ilişkili olan plasebo grubu ile karşılaştırıldığında . Iskemik beyin bir CD11b + CD45 yüksek hücre alt-popülasyonu ortaya çıkması ile kanıtlandığı gibi bu fark (nedeniyle çevre hücre infiltrasyonuna Şekil 4, büyük olasılıklaŞekil 5 ve naif ve sahte beyinlerinde az sayıda olan Tablo 5). Beyin iskemi CD11b + hücre popülasyonuna infiltratların katkısı çok dinamik bir süreç 4. Bağlanması ile MCAO-modelindeki olarak,% 30 ila lezyonun büyüklüğüne ve karakterizasyonu yapılmıştır zaman bağlı olarak, toplam CD11b + hücrelerinin% 60 arasında değişebilir. Ly-6G + hücreleri gibi, özelliği Nötrofiller, bunlar CD11b + CD45% 70-80 ihtiva gibi, serebral iskemi, bu model kullanılarak iskemik fare beyninde MCAO 24 saat sonra bulunan en çok infiltre hücre popülasyonu hi. Ly-6C hi pro-inflamatuar monositlerin - hücrelerin geri kalanı çoğunlukla CD11 + CD45 hi Ly-6G bir ICSI'nin vardır. Bu modelde, bu nüfus 24 den MCAO sonra 48 saat iskemik beyin bölgelerinde sayısı artacak.
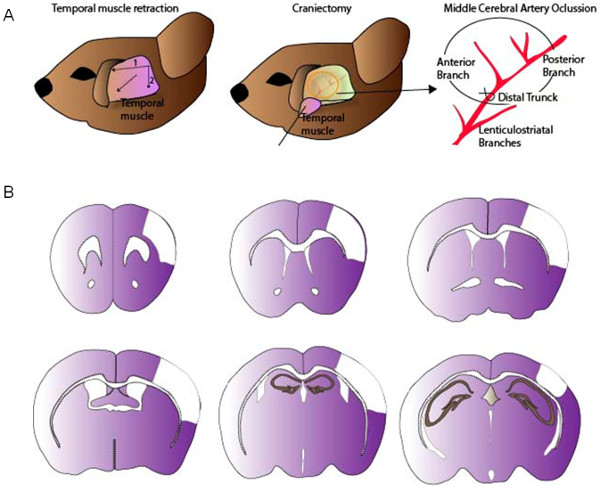
Şekil 1:. MCA ligasyon için cerrahi prosedür, (A) geçici kas retraksiyonu sonra, küçük bir kranyotomi fare kafatası içinde gerçekleştirilir. MCA bir düğüm veya 9/0 sütür kullanarak bir ilmek ile bağlanır. (B) MCAO modeli tarafından üretilen kortikal lezyon Temsilcisi görüntüleri. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
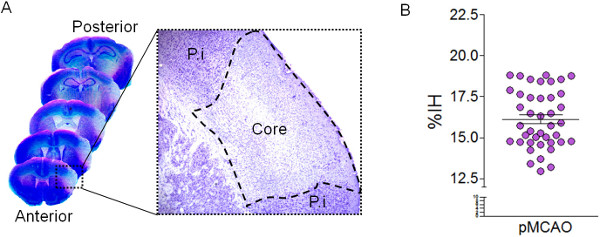
Şekil 2: Cavalieri tarafından infarkt hacmi miktarının belirlenmesi. (A) Nissl-lekeli beyin kesitlerinin Temsilcisi görüntüleri kalıcı MCA bağlanmasından sonra 24 saat. yüksek büyütme Nissl boyama sonra hipocromatic alanı gösterirMCAO'dan sonra hasarlı bölgeyi (çekirdek) tanımlar. Peri-Enfarktüs (PI) bölgesi de gösterilmiştir. (B) (n = MCAO sonra, seri Nissl lekeli bölümlerde 50 fare, 24 saat Cavalieri yöntemi kullanılarak% infarkt Yarımküre (% IH) olarak temsil enfarktüs hacminin sayısallaştırılması ).
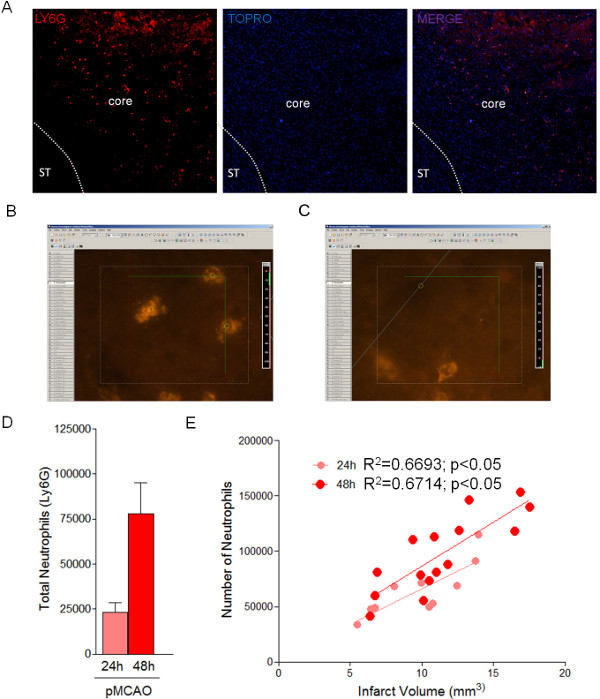
Şekil 3: infarkt alanında 24 nötrofil ve bağlanmasından sonra 48 saat içinde Stereolojik miktar, Optik Parçalama yöntemi kullanılarak. MCAO'dan 24 saat sonra İskemi bölgesinde infiltre edilmiş nötrofil (Ly6G-pozitif hücreleri) (A) Örnek görüntüsü. Sınırlandırılması enfarkte alanı göstermektedir. (B, C) optik parçalama nötrofil ölçümü için bir optik dissektör örnekler. (D) 24 ° C'da enfarkte bölgedeki toplam nötrofil miktar tayini ve 48 saat (n = 4 fare). (E)Enfarktüs 24 boyuta ve MCA bağlanmasından sonra 48 saat ile nötrofil sayısının korelasyonu. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
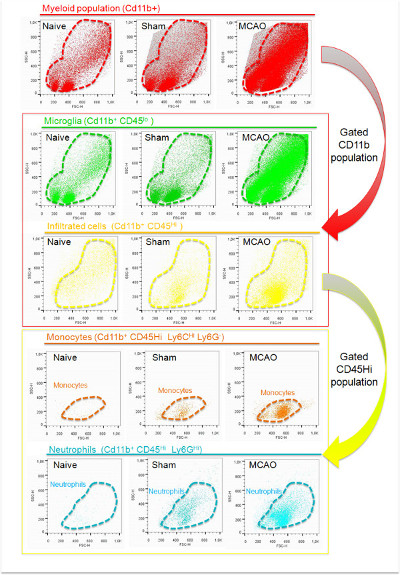
Şekil 4:. Fiziksel parametreler (SSC ve FSC) temelinde naif, sahte ve iskemik (MCAO sonra 24 saat) hemisfer elde edilen beyin lökositlerin Temsilcisi nokta-arsa dağılım analizi CD11b (kırmızı) ifade olaylar bir nüfus tespit edilmiştir Tüm gruplarda. Bu popülasyon CD45 ekspresyonu göre kapı ve karakterize edildi. CD45 (yeşil) düşük seviyelerde ifade hücreler iskemik ve non-iskemik beyin korteksinde bulunan ve mikrogliyal hücrelere karşılık geldi. Bunun aksine, hücre (sarı) CD45 seviyeleri sentezleyen tektiniskemik yarımkürede ve plasebo grubunda daha az ölçüde bulunamadı. CD11 +, CD45 yüksek nüfusun daha fazla analizi, nötrofil (Ly-6G + hücreleri, mavi) ve pro-enflamatuar monositler (Ly-6C yüksek hücreleri, portakal), ana hücre, beyinde bulunan alt-popülasyonları bulunduğunu inme 24 saat sonra sızan olduğunu gösterir. edin Bu rakamın büyük halini görmek için buraya tıklayın.
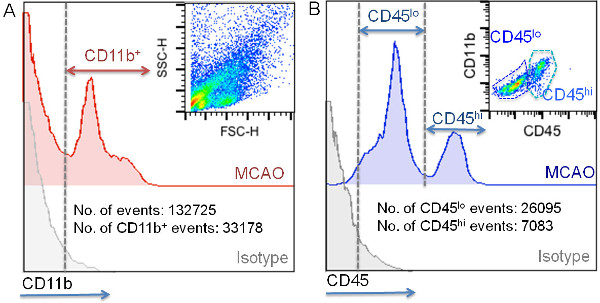
Şekil 5:. Iskemik doku infiltrasyonu miyeloid hücreleri yerleşik ayırt etmek için stratejiler yolluk CD11 + hücresi, ilk izotip floresan yoğunluğu (A) 'ya göre olan kapı edildi. Iskemik beyin hücre süspansiyonları bir temsilcisi nokta arsa panelinin yukarı-sağ köşesinde gösterilir. IçindeAyrıca, bu tekniği kullanarak elde edilen olayların toplam sayısı ve CD11b + olayların sayısı için tipik değerler (gösterilmiştir hayır hücre / iskemik beyin hemisfer;. (A) CD11b + hücrelerinin CD45 Floresan yoğunluğu analizi panelinde gösterilir kapılı CD11 + alt populasyonun CD45 ve CD11 ifade B. temsilcisi nokta arsa analizi panelinin yukarı-sağ köşesinde gösterilir. Buna ek olarak, iskemik beyin yarımkürede başına elde edilen CD45 lo CD45 hi hücrelerin tipik sayısı bu tekniği kullanarak (B) gösterilir.
| Cavalieri yöntem için kullanılan parametreler | |
| Bölüm Kalınlığı (t) | 30 um |
| Nesnel | 10X |
| Dilim örnekleme fraksiyonu (ssf) | 1/ 20 |
| Bölümleri arasındaki mesafe | 600 mikron |
| Izgara Aralığı | 100 um |
Tablo 1: enfarkte doku stereolojik ölçümü için kullanılan parametreler.
| Sonuçlar | Contralesional | Ipsilesional | Enfarktüs |
| Konum (μm²) | 151.460.000 | 155.060.000 | 22.600.000 |
| Hacim (μm³) | 90876000000 | 93036000000 | 13560000000 |
| Cilt için düzeltildi Projeksiyon üzerinde (μm³) | 89957100000 | 92046300000 | 13416600000 |
| Hata Katsayısı (Gundersen), m = 0 | 0.068 | 0.077 | 0.067 |
| Hata Katsayısı (Gundersen), m = 1 ' | 0.015 | 0.017 | 0.015 |
| Hata Katsayısı (Gundersen), a (k) | 0.068 | 0.077 | 0.067 |
| % Enfarktüslü Yarımküre | 14.90 | ||
| Beyin Ödemi (Ips Cilt / Vol Devam) | 1.02 | ||
Tablo 2: Stereo Araştırmacı Yazılımı kullanarak Cavalieri yöntemi ile, contralesional ipsilesional ve enfarktüs hacimleri temsili örnekleri.
| Optik kincinin için kullanılan açıklık = "2"> Parametreler | |
| Bölüm Kalınlığı (TSF) | 30 um |
| Nesnel | 100X |
| Dilim örnekleme fraksiyonu (ssf) | 1/10 |
| Çerçeve Yüksekliği Sayma | 40 um |
| Çerçeve Genişliği Sayma | 40 um |
| X ızgara boyutu | 230 mikron |
| X ızgara boyutu | 230 mikron |
| Güvenli Guard | 2 um |
| Optik Disektör Yükseklik | 14 um |
Tablo 3: Stereo Araştırmacı Yazılımı kullanarak optik parçalama probu ile beyin iskemi sonrasında sızmış nötrofillerin stereolojik ölçümü için kullanılan parametreler.
| Optik parçalama tarafından Nötrofiller Tahmini | |
| Örnekleme Siteleri Sayısı | 430 |
| Şekil Faktörü | 6.24 |
| Toplam belirteçler Sayılan | 166 |
| Optik parçalama Tahmin Nötrofiller | 117,608.03 |
| Hata Katsayısı (Gundersen), m = 0 | 0.22 |
| Hata Katsayısı (Gundersen), m = 1 | 0.09 |
Tablo 4: Stereo Araştırmacı Yazılımı kullanarak Optik Parçalama probu ile beyin iskemi sonrasında tahmin sızmış nötrofillerin Temsilcisi örneği.
| CD11b + | Nötrofiller | Monositler | Mikroglia | |
| Saf | 25.863 ± 4,575.8 | 473 ± 75.8 | 525 ± 191,4 | 19.012 ± 1,523 |
| Sham 24 saat | 24.563 ± 5.263 | 873 ± 192.5 | 1,124 ± 391,5 | 23.734 ± 2.910 |
| pMCAO 24 saat | 47.922 ± 23.174 | 4874 ± 748,7 | 4826 ± 1,345 | 35.395 ± 10.833 |
Tablo 5: yaklaşımla sitometri Akış ile beyin iskemi sonrasında tahmin miyeloid hücrelerin Temsilcisi sonuçları.
Tartışmalar
Burada tanıtılan serebral iskemi modeli son derece tekrarlanabilir enfarktüs hacimleri 24-48 saat ve farklı yaklaşımlar 8,15,17 tarafından MCA bağlanmasından sonra 7 gün tespit verir. Bu MCAO-modelindeki çalışmalarında kullanılan hayvan sayısını en aza indirir kıyasla düşük bir ölüm oranına (% 1'den az) sahiptir. Mortalite bu düşük oran elde etmek için kritik bir adım strok indüksiyon sonrası hayatta kalma bozabilecek enfeksiyonları önlemek için uygun aseptik koşullarda muhafaza etmektir. Bu MCAO model, aynı zamanda, istenen zamanda, bir ilmek ve arka reperfüzyon ile CCA ve MCA geçici ligasyonu ile bir geçiş model olarak, translasyonel araştırma 18 için klinik olarak uygun model olarak kabul edilen bir sürekli MCAO-modelindeki olarak kullanılamaz 19. Bu yöntem, başarılı bir şekilde fareler ve sıçanlar 17,20 kullanılmıştır. Bütün bu deliller ligasyon ile MCAO çoklu uygulamalarla serebral iskemi, yüksek çok yönlü bir model olduğunu gösterir. Bir critiBu tekniğin cal adım, bir stereo mikroskop altında invaziv cerrahi gerektirir; MCA yanı sıra elmacık kemiği zarar değil gibi Kraniyotomi çok dikkatli yapılmalıdır. Ancak, sahte hayvanların kullanımı cerrahi prosedür bağımlı etkilerini ayırt etmek yararlı bir araçtır sağlar (cerrahi prosedür ama CCA ve MCA ligasyonu tabi tutulur gerçekleştirilmez). Bu teknik, aşağıdaki beyin hasarı derecesi, çeşitli yöntemlerle ölçülebilir. Beyin kesit, Nissl boyama ve Cavalieri hacim daha sonra tahmin protokol hasarlı bölgenin tayini için daha kesin sağlar ve seri beyin kesitleri farklı imünohistokimyasal analiz için kullanılabilir çünkü bu tür çalışmalarda kullanılan farelerin sayısını en aza indirir. Bu metodolojinin daha iyi bir performans için, stereoloji yazılımında kullanılan uygun parametreleri seçmek için kritik (Tablo 1) inci tahmin için gerekli olacakformülü ile farklı bölgelerin e hacmi: V = 1 / ssf * Bir f * t * ΣP i (Ssf t bölümlerin ortalama kalınlığı, dilim örnekleme fraksiyonu, bir f ızgara aralığı alanıdır ve ΣP yapıya vurma noktası sayısı).
ligasyon ile uzak MCAO infiltre lökosit ve immün hücre alt-popülasyonunu beyin hasarı 1-4 Aşağıdaki iltihabik sürece katılmaya 8,13 karakterize etmek yararlı olabilir. Burada, beyin, bağışıklık hücre karakterizasyonu, kesin stereolojik yaklaşımla ve daha çok sayıda lökosit subpopülasyonunun karakterize bir akım sitometri analizi için iki farklı metodolojiler öneriyoruz.
Seri beyin kesit yararlanan, nötrofil sayısının ölçümü hücrelerinin örneklenmiş zekâ sayısından hücrelerinin toplam sayısını tahmin optik parçalama yöntemiyle 16, elde edilebilirha yol X tarafsız sanal sayım alanlar arasında düzgün mesafe ile bizim durumumuzda, enfarktüs bölgesini ilgi tüm bölgeyi kapsayan tarafsız sanal sayma alanlarda, Sistematik rastgele Sampled (SRS) seti, Y ve Z Bu yöntem doğru bir araç sağlar bağlanmasından sonra farklı zamanlarda, iskemik beyin total nötrofil sayısını belirlemek. Bu çalışmada gösterilmiş olmasına rağmen, bu protokol de iskemi 21 sonra diğer sızmış lökositlerin gibi iskemik beyin bulunan diğer hücre popülasyonunun doğru ölçümü için farklı nötrofil alt popülasyonlarının tahmini için kullanılabilir (monositler / makrofajlar) ve aynı zamanda hayatta kalan nöronlar tahmin ya da inme sonrası nöron ölçümü için. olanlar İskemi bölgesinde nötrofil ölçümü için, Tablo 3'de gösterildiği gibi, arzu edilen alanda, doğru bir tahmin etmek için en önemli adımı, uygun parametreler seçimidir.Bu parametreler (ΣQ- ile sayılan toplam hücre sayısı, N = ΣQ- x 1 / ssf x 1 / ASF x 1 / tsf denklemi kullanılarak toplam pozitif hücre sayısı (K) hesaplamak için stereoloji yazılımı için kullanılacaktır parçalama, ssf asf örnekleme fraksiyonu alanı, ve TSF örnekleme fraksiyonu kalınlığı) 5 olduğu, bölüm örnekleme bölümüdür. Bu yöntem, diğer ölçüm teknikleri daha düşük olmasına karşın (örneğin, doku, temsili görüntü veya alan başına nötrofil sayısının densitometri mg nötrofil belirteçlerin analizi), bu tarafsız ve kesin sağlayan bir katı madde teknik olma avantajına sahiptir hücre sayıları ölçümü.
Beyin lökosit izolasyon yaklaşım bastırılması için ihtiyacı olan in vivo boyama ya da genetik manipülasyonlar sistem olmadan anında belirlenmesi ve çeşitli immün hücre alt-tiplerinin ölçülmesini sağlar. Karakterize miyeloid p gelen sıralama sonraki hücreopulations veya immünomanyetik ayırma gibi gen veya protein ekspresyonu ile ilgili başka çalışmalar gibi çok sayıda alt baş uygulamalar için kullanılabilir. Bu yöntem ile elde edilen nötrofiller, monositler ve mikroglia doğru karakterizasyon immünohistokimyasal çalışmalar, beyin doğuştan gelen bağışıklık tepkisine aracılık farklı miyeloid hücrelerine özel fonksiyonlar tahsis sağlayan bir avantaj olarak, mevcut yöntemlere göre yüksek spesifisite sağlamaktadır. Buna ek olarak, bundan başka, kanla taşınan makrofajlar (CD11 + CD45 yüksek CD68 +) gibi, uygun bir etiket ile diğer beyin popülasyonları için genişletilebilir ve diğer merkezi sinir sistemi patolojileri ve yaralanma çalışma için uygulanabilir. Bu nedenle bu teknik beyindeki inflamatuvar yanıtın heterojeniteyi keşfetmek için önemli bir araç sağlar. Bu tekniğin bir ana sınırlama değiştirebilir olan taze beyin dokusundan lökosit süspansiyonların hazırlanması bulunduğuhücreler veya bunların antijen değişiklik aktivasyon durumu. Bu teknik, immünohistokimyasal çalışmalara kıyasla daha detaylı bir niteliksel nitelenebilmesine olanak veren, ancak bu hücre izolasyonu göre daha az hassas bir ölçümü içerir. Buna rağmen, hücre izolasyon protokolünün etkinliği diğer yayımlanmış metodolojiler 9 benzer ve etkin bir şekilde kontrol ve MCAO gruplar arasında, hatta farklı tedaviler 8 tabi MCAO grupları arasında beyin bağışıklık hücrelerinin sayısında farklılık tespit etmek için kullanılabilir.
Bu protokolün kritik adımlar doku diseksiyonu, doku bozulması prosedürü ve miyelin kaldırma vardır. Doku toplama ile ilgili olarak, bir normalleşme adımı nedeniyle farklı diseksiyon performansları değişkenlik önlemek için (toplanan doku tartarak) dahil edilebilir. Buna ek olarak, farklı MCAO grupları arasında normalleştirme da enfarktüs hacmi ile oluşabilir (daha önce manyetik R belirleniresonance). Bu sorunu çözmek için başka bir yolu hem iskemik ve kontrol gruplarının tüm ipsilateral yarımküre kullanmak, hatta kullanılan hayvan sayısını en aza indirmek için bir kontrol olarak iskemik fare kontralateral yarımkürede kullanmaktır. Bu yaklaşım, her diseksiyon arasındaki farklılıkları önler iken, bir ana dezavantajı vardır; Bir seyreltme faktörü sadece aynı taraf korteks çekirdek ve peri-enfarktüs alanları bulunan miyeloid hücrelerin sayısını hücrelerinin toplam sayısının artırılması, ancak ilave edilir. Doku bozulması ile ilgili olarak, bu protokol beyin hücrelerinin mekanik bozulması için adımlar, enzimatik tedaviler kaçınarak ve yüzey antijeni değişiklik 9,22, inflamatuar hücre alt daha kalitatif ve kantitatif analiz için önemli bir sorun önlenmesi göstermektedir. Ilgi hücre süspansiyonu hazırlanması yanı sıra, beyin örneklerinden miyelin çıkarma downst müdahaleyi önlemek için bir tavsiye adımdırBöyle immünomanyetik hücre ayırma veya sitometri 23,24 akış gibi delmek uygulamalar. Bu durum, farklı yöntemler, örneğin sukroz veya Percoll gradyenleri, ya da anti-miyelin boncuklar kullanılarak gerçekleştirilebilir. Burada, ve hücre verimini arttırmak için kullanılan miyelin kaldırmak için Percoll kullanımı ile birlikte beyin hücre süspansiyonu izolasyonu, mekanik bozulma için farklı yöntemler karşılaştırın ve 25 Canlılığına önceki çalışmalara dayanmaktadır.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
This work was supported by grants from the Spanish Ministry of Economy and Competitiveness CSD2010-00045 (MAM), SAF2012-33216 (MAM), SAF2011-23354 (IL) and RENEVAS RD06/0026/0005 (IL), and from the Local Government of Madrid S2010/BMD-2336 (MAM) and S2010/BMD-2349 (IL). IB and MIC are fellows of the Spanish Ministry of Economy and Competitiveness.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Photonic Led F1 | WPI | 571329-8 | Equipment |
| Temp Controller | Panlab | HB 101/2 | Equipment |
| Volvere GX | NSK | Ne22L | Equipment |
| Microscope | WPI | PZMIII-BS | Equipment |
| Stainless Steel Burrs | FST | 19007-14 | Surgical material |
| Forceps Dumont #5/45 | FST | 11251-35 | Surgical material |
| Forceps Dumont #5SF | FST | 11252-30 | Surgical material |
| Suture 6/0 | LorcaMarin | 55108 | Surgical material |
| Suture 9/0 | LorcaMarin | 61966 | Surgical material |
| Nikon Eclipse | Nikon | TE300 | Equipment |
| Isoflurane | Esteve | 571329-8 | Chemical |
| Sodium Pentobarbital | Vetoquinol | 570681 | Chemical |
| Freezing microtome | Leica Microsystems GmbH | SM2000R | Equipment |
| Superfrost slides | Thermo Scientific | 2014-07 | Lab material |
| Cresyl violet acetate | Sigma | C5042 | Chemical |
| Microscope | Nikon | Nikon Eclipse TE300 | Equipment |
| XYZ motorized computer stage and controller | Ludl electronics Products | Equipment | |
| Stereo Investigator System | Microbrightfield | Version 7.003 software | Software |
| 5 ml Tissue Grinder, Potter-Elv with teflon pestle | Thomas Scientific | 0913X70 | Lab Material |
| Polypropylene 50 ml Oak Ridge Centrifuge Tube | Nalgene | 3119-0050 | Lab material |
| Percoll | Sigma | p1644-100 | Chemical |
| RPMI 1640 | Lonza | BE12-702F | Chemical |
| Beckman Ultracentrifugue | Beckman Coulter | Equipment | |
| Beckman Coulter ultracentrifuge rotor 45 Ti | Beckman Coulter | Equipment | |
| BD Sterile Cell Strainer, 40 Micron | BD | BD 352340 | Lab Material |
| Bovine Serum Albumin | Sigma | A3733-500G | Reagment |
| FcR Blocking Reagent, mouse | Miltenyi | 130-092-575 | Antibody |
| CD11b-FITC, human and mouse | Miltenyi | 130-098-085 | Antibody |
| CD45-PE, mouse | Miltenyi | 130-102-596 | Antibody |
| Anti-Ly-6G-APC, mouse | Miltenyi | 130-102-936 | Antibody |
| PerCP/Cy5.5 anti-mouse Ly-6C | Biolegend | 128012 | Antibody |
| BD FACS Flow | BD | 342003 | Reagment |
| BD FACSCalibur; 4-color | BD | 342975 | Equipment |
| BD Cell Quest Pro Software | BD | Software | |
| FlowJo software | Treestar inc. | Software |
Referanslar
- Chamorro, A., et al. The immunology of acute stroke. Nature Reviews. Neurology. 8, 401-410 (2012).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nat Med. 17, 796-808 (2011).
- Ramlackhansingh, A. F., et al. Inflammation after trauma: microglial activation and traumatic brain injury. Annals of Neurology. 70, 374-383 (2011).
- Jin, R., Yang, G., Li, G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells. J Leukoc Biol. 87, 779-789 (2010).
- West, M. J., Slomianka, L., Gundersen, H. J. Unbiased stereological estimation of the total number of neurons in thesubdivisions of the rat hippocampus using the optical fractionator. The Anatomical Record. 231, 482-497 (1991).
- Charleston, J. S. Estimating cell number in the central nervous system by stereological methods: the optical disector and fractionator. Current Protocols in Toxicology. 12 (Unit 12.6), (2001).
- Begega, A., et al. Unbiased estimation of the total number of nervous cells and volume of medial mammillary nucleus in humans. Experimental Gerontology. 34, 771-782 (1999).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARgamma Agonist Rosiglitazone. Stroke; a. Journal of Cerebral Circulation. 44 (12), 3498-3508 (2013).
- Campanella, M., Sciorati, C., Tarozzo, G., Beltramo, M. Flow cytometric analysis of inflammatory cells in ischemic rat brain. Stroke. 33, 586-592 (2002).
- Carson, M. J., Reilly, C. R., Sutcliffe, J. G., Lo, D. Mature microglia resemble immature antigen-presenting cells. Glia. 22, 72-85 (1998).
- Perego, C., Fumagalli, S., De Simoni, M. G. Temporal pattern of expression and colocalization of microglia/macrophage phenotype markers following brain ischemic injury in mice. J Neuroinflammation. 8, 174(2011).
- Denker, S. P., et al. Macrophages are comprised of resident brain microglia not infiltrating peripheral monocytes acutely after neonatal stroke. Journal of Neurochemistry. 100, 893-904 (2007).
- Ballesteros, I., et al. Rosiglitazone-induced CD36 up-regulation resolves inflammation by PPARgamma and 5-LO-dependent pathways. Journal of Leukocyte Biology. 95 (4), 587-598 (2013).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. J Microsc. 150, 117-136 (1988).
- Hernández-Jiménez, M., et al. Silent Information Regulator 1 Protects the Brain Against Cerebral Ischemic Damage. Stroke. 44 (8), 2333-2337 (2013).
- Gundersen, H. J., et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS. 96, 857-881 (1988).
- Godino, M. E. C., et al. Amelioration of ischemic brain damage by peritoneal dialysis. J Clin Invest. 123, 4359-4363 (2013).
- Hossmann, K. A. The two pathophysiologies of focal brain ischemia: implications for translational stroke research. J Cereb Blood Flow Metab. 32, 1310-1316 (2012).
- García-Yébenes, I., et al. Iron overload, measured as serum ferritin, increases brain damage induced by focal ischemia and early reperfusion. Neurochem Int. 61, 1364-1369 (2012).
- Sobrado, M., et al. Synthesis of lipoxin A4 by 5-lipoxygenase mediates PPARgamma-dependent, neuroprotective effects of rosiglitazone in experimental stroke. J Neurosci. 29, 3875-3884 (2009).
- Cuartero, M. I., et al. N2 Neutrophils, Novel Players in Brain Inflammation After Stroke: Modulation by the PPARγ Agonist Rosiglitazone. Stroke. 44, 3498-3508 (2013).
- Ford, A. L., Foulcher, E., Goodsall, A. L., Sedgwick, J. D. Tissue digestion with dispase substantially reduces lymphocyte and macrophage cell-surface antigen expression. Journal of Immunological Methods. 194, 71-75 (1996).
- Pfenninger, C. V., et al. CD133 is not present on neurogenic astrocytes in the adult subventricular zone, but on embryonic neural stem cells, ependymal cells, and glioblastoma cells. Cancer Research. 67, 5727-5736 (2007).
- Tham, C. S., Lin, F. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. International Journal of Developmental Neuroscience : the Official Journal of the International Society for Developmental Neuroscience. 21, 431-443 (2003).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9, 147(2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır